小麦抗穗发芽育种大田选种方法研究①
2022-04-20董策肖磊谢淑芹张希太
董策,肖磊,谢淑芹,张希太
邯郸市农业科学院, 河北 邯郸 056001
冬小麦成熟期遭遇连续阴雨天气, 导致麦粒在穗上发芽(穗发芽), 是一种严重的气候灾害. 联合国粮农组织统计, 全世界每年因穗发芽造成的损失约为世界小麦总产量的20%[1]. 我国小麦面积的85%都存在穗发芽隐患, 黄淮麦区、 长江中下游麦区曾多次发生大面积小麦穗发芽灾害, 西南冬麦区及东北春麦区穗发芽灾害也频繁发生[2].
小麦穗发芽后不仅产量降低, 更主要是造成品质严重变劣, 丧失食用、 加工价值. 穗发芽灾害是当前小麦生产的重大隐患之一, 不发则已, 一发则损失惨重. 穗发芽灾害发生的外因是连续阴雨和潮湿的气候, 内因是小麦品种本身的抗性差. 当今科技影响还不能控制气候, 通过抗穗发芽育种来提高小麦品种自身的抗性, 才是从根本上消除穗发芽隐患的有效手段[3].
当前小麦抗穗发芽育种存在两个技术瓶颈: 一是小麦抗穗发芽种质资源匮乏; 另一个是小麦抗穗发芽育种后代材料的大田抗穗发芽定向选择困难, 因为小麦穗发芽气候灾害不是每年都发生的. 这就要求育种工作者创制一种方法在非小麦穗发芽灾害年份有效地淘汰不抗穗发芽(或抗性较差)的育种后代材料, 保留穗发芽抗性好的后代材料, 实现育种圃抗穗发芽性状的定向选择.
小麦抗穗发芽育种后代群体材料最理想的选种鉴定方法是小麦成熟时遇到连续的阴雨天气诱发穗发芽灾害发生, 在大田中进行自然选择鉴定[4], 但我们并不期望这种损失严重的气候灾害发生. 在过去的小麦抗穗发芽育种材料的选择鉴定中, 我国科技工作者发明了多种方法, 总结起来大致有两类: 一种是“离体鉴定法”, 就是在室内建造人工发芽床、 人工气候箱、 湿沙桶等, 将小麦抗穗发芽育种后代群体材料从大田收回放(埋)入其中, 人工模拟连续阴雨的潮湿气候环境, 培养一段时间后, 手工剥去已发芽的籽粒, 留下未发芽的籽粒作为抗穗发芽的后代入选材料[4-7]. 这种鉴定法存在以下缺陷: ①小麦种子的蜡熟后期, 麦穗脱离植株体后影响种子的后成熟, 容易引起穗子霉烂, 籽粒坏死致使选择鉴定结果不够准确; ②室内选择鉴定, 取材量受到限制, 获得抗穗发芽资源的几率降低; ③室内环境和田间环境相比差异大, 不能很好地反映后代材料的田间抗性. 另一种是“大田连体选择鉴定法”, 就是小麦成熟后不收割, 在大田中等待秋季连绵的秋雨, 进行自然选择鉴定[4]. 该方法虽然利用了大田自然环境, 采用连体选择鉴定, 保证了小麦种子的后成熟, 适合大量后代群体材料的选择鉴定但也存在严重的缺陷: ①延长了选择鉴定周期, 影响了下茬秋季作物的种植; ②小麦种子成熟后在大田植株上需要长时间的等待秋雨, 部分抗穗发芽的种子在等待过程中休眠期已过, 选择鉴定结果不准确; ③降秋雨时大田的温湿度和初夏降雨时的温湿度有很大的不同, 造成鉴定结果不够准确, 因此该方法只是设想至今未见应用报道. 亦有人在大田中搭建面积1 m2, 高度为1.5 m的密闭塑料罩室, 配合遮阳板和喷水模拟降雨对育成品种进行大田穗发芽率活体测定[8]. 该方法只适合大田中个别小面积种植材料的鉴定, 不适合大面积种植的抗穗发芽育种后代材料的选种.
随着分子生物学的发展和对小麦穗发芽抗性机制与抗性基因的深入研究, 诞生了一些与小麦穗发芽抗性基因相关的分子标记鉴定技术. 该技术虽然先进, 但就当前的情况应用于抗穗发芽育种选种还是受到了很大的限制. ①目前开发成功的分子标记大多是针对小麦穗发芽抗性这种数量性状的非主效基因的[9]; ②这些非主效基因有显隐性之分[5], 检测到分子标记的其表型不一定有抗性或不一定能稳定遗传; ③大多数分子标记的普遍有效性还需要进一步验证[10-13]; ④分子标记鉴定技术更适合抗穗发芽基因已经纯合的高代品系的鉴定, 而不能应用于基因严重杂合、 性状疯狂分离的低代材料的鉴定, 因为低代材料一个麦穗的不同麦粒之间都存在着抗与不抗穗发芽的基因型与表现型.
在小麦抗穗发芽育种低代材料(F2,F3,F4代)选种时, 如何能够准确、 高效地淘汰掉不抗穗发芽的后代材料, 保留抗穗发芽的后代材料, 促使抗穗发芽基因的纯合, 目前亟需研发一种简单、 实用的穗发芽抗性定向选种新方法. 于是我们在小麦种子的蜡熟后期, 在小麦抗穗发芽育种的F2代选种圃中, 对抗穗发芽育种小麦植株进行了穗部喷水套袋保湿选种方法的研究.
1 材料与方法
1.1 试验材料
试验材料是邯郸市农业科学院小麦分子育种研究室小麦抗穗发芽育种田中的(Ksfy2×邯3992)F2代群体. Ksfy2为该研究室自创的小麦高抗穗发芽种质资源系, 经农业部谷物产品质量安全风险评估实验室(北京)鉴定其穗发芽率为0, 是一个高抗穗发芽的小麦种质资源, 但也有植株较高、 抗倒性较差、 千粒质量低等缺点; 邯3992是该研究室自育的小麦品系, 其除抗穗发芽性较差外, 具有突出的丰产性、 矮秆抗倒性好、 千粒质量高等优点. 将(Ksfy2×邯3992)F1代材料全部混收, F2代群体播种密度为行距20 cm, 株距5 cm, 从F2代开始对抗穗发芽特性进行定向选择. 本研究的各种试验(包括大田试验)所用材料都是(Ksfy2×邯3992)F2代, 需进行3年重复试验的, 第2,3年仍然采用(Ksfy2×邯3992)F1的冷藏种子来播种F2代. 抗穗发芽F5代后基因基本趋于纯合, 性状趋于稳定后再从已稳定抗穗发芽的F5代中选择其他综合农艺性状好的单株定向选择种植进行株系比较.
1.2 麦穗的附着水率测定
1.2.1 麦穗浸水试验
浸水处理Ⅰ~Ⅺ分别对应每升自来水中加入非离子型表面活性剂吐温-80(广东华纳化工有限公司)0 μL,100 μL,200 μL,300 μL,400 μL,500 μL,600 μL,700 μL,800 μL,900 μL,1 000 μL, 共11个处理. 剪取腊熟期的麦穗660穗, 每20个麦穗扎成1把, 共扎成33把. 每浸水处理3把, 分成A,B,C 3个重复组, 每组11把, 分别进行浸水试验. 浸水前先用电子分析天平测定每把麦穗的质量为AmⅠ,AmⅡ,…,AmⅪ;BmⅠ,BmⅡ,…,BmⅪ;CmⅠ,CmⅡ,…,CmⅪ. 然后按每组一个批次将整把麦穗迅速浸入对应的水处理中, 浸泡3 min后将麦穗把迅速从水中提出悬挂控水至无水滴淌下时, 用电子分析天平分别测定各组浸水后麦穗把的质量AMⅠ,AMⅡ,…,AMⅪ;BMⅠ,BMⅡ,…,BMⅪ;CMⅠ,CMⅡ,…,CMⅪ.
1.2.2 麦穗的附着水率计算
A组各处理麦穗的附着水率A/%=(AM-Am)/Am×100, 式中,AM为各处理麦穗浸水后的质量,Am为各处理麦穗浸水前的质量, 同样方法计算B组、 C组各处理麦穗的附着水率.
1.3 选种圃穗部套袋保湿试验
1.3.1 套塑料袋大小规格与套入麦穗个数试验
试验采用的塑料袋(购自邯郸市农业科技贸易城市场)规格分别为10 cm×10 cm,20 cm×20 cm,30 cm×30 cm,40 cm×40 cm,50 cm×50 cm,60 cm×60 cm,70 cm×70 cm,80 cm×80 cm,90 cm×90 cm,100 cm×100 cm. 每袋套入麦穗数量(穗)分别为10,20,30,40,50,60,70,80,90,100,110,120,130,140,150,160,170,180,190,200,250,300,350,400,450,500. 试验时间在小麦扬花后35~40 d, 小麦种子的蜡熟后期. 试验地点在该研究室试验田的小麦抗穗发芽育种选种圃中进行. 因塑料袋规格太小不能装入较多数量麦穗的和因塑料袋规格太大装入麦穗数量多跨行太长不能严密封口的不进行试验以外, 其他各规格大小的塑料袋针对每个能装入又能严密封口的麦穗数量都套装100袋, 至小麦收割前调查各规格大小的塑料袋所套小麦植株的倒伏情况. 连续3年进行重复试验, 计算各规格大小的塑料袋3年所套小麦植株倒伏率数据的平均值进行数据分析.
1.3.2 套塑料袋颜色(白色、 黑色、 银色、 黑色塑料袋外包银色反光膜)对袋内温度影响试验
在小麦扬花后35~40 d, 小麦种子的蜡熟后期, 选择天气晴朗、 阳光明媚的日子, 采用经本文1.3.1部分试验适宜塑料袋规格40 cm×40 cm的白色塑料袋、 黑色塑料袋、 银色塑料袋、 黑色塑料袋外包银色反光膜(购自邯郸市农业科技贸易城市场), 分别套住选种圃中生长的小麦植株的穗部, 每袋套入50个麦穗. 将电子温度计(TPM-10型)的测量探头包藏在麦穗中间封闭在塑料袋的内部, 不要让温度计的测量探头接触塑料袋膜壁或麦穗, 将塑料袋的口封闭严紧. 套好后打开电子温度计开关开始测量, 记录每天8~20时, 每间隔30 min, 同一时刻4种塑料袋内部麦穗处的温度(Tb,Th,Ty,Thy)和塑料袋外部的大田温度(Tw)的值(可将5个电子温度计的液晶显示屏编号, 集中放在一起, 拍照记录同一时刻的温度值). 选3个天气状况相仿的日子重复上述试验, 所测得的温度数据为3次重复, 将3 d同一时间点所测得的温度值算术平均后进行数据分析.
1.3.3 加入不同吸水量的保湿海绵对袋内湿度的影响试验
在大田环境下, 采用经本文1.3.1和1.3.2部分试验筛选出的合适的塑料袋颜色、 规格与每袋套入的麦穗数量, 采用本文1.2部分试验的能使麦穗附着水量最高的水喷透麦穗. 然后在塑料袋内分别按不同的吸水量0 mL,100 mL,200 mL,300 mL,400 mL,500 mL,600 mL,700 mL,800 mL,900 mL,1 000 mL加入吸水海绵块. 将电子温湿度计(西玛AS847型)的测量探头也封闭在塑料袋内部, 不要让电子温湿度计的测量探头接触塑料袋膜壁或麦穗, 保证测量探头的感应点周围为空气, 将塑料袋的口封闭严紧.
电子温湿度计每天所测得的是各海绵吸水量处理袋内的相对湿度, 只有在相同的温度和大气压下所测得的相对湿度值之间才有可比性. 在同一大田环境下塑料袋内的大气压都是相同的, 袋内相对湿度的测定温度统一采用本文1.3.2部分的平均温度(Thy=28.3 ℃), 连续7 d, 每天8~20时, 在大田中观察并记录各海绵吸水量处理袋内温度达到28.3 ℃时的相对湿度值并进行比较.
1.4 小麦“大田穗部喷水套袋保湿抗穗发芽选种法”及选种试验
1.4.1 小麦“大田穗部喷水套袋保湿抗穗发芽选种法”技术内容
在非小麦穗发芽灾害年份, 在抗穗发芽育种田选种圃中: ①于小麦扬花后35~40 d, 小麦种子的蜡熟后期, 用0.04%(体积分数)的吐温-80水溶液(1.2部分试验结果)将活体小麦植株穗部喷湿喷透; ②利用外包银色反光膜的40 cm×40 cm规格的黑色塑料袋(1.3.1和1.3.2部分试验结果), 每袋罩入50穗喷透水的麦穗; ③在塑料袋中加入300 mL吸水量保湿海绵块(1.3.3部分试验结果)后将塑料袋口扎紧, 使塑料袋罩室内处于密封高湿度状态, 保湿5~7 d(保湿期的长短可根据对材料选择压的大小酌情掌握); ④打开并去除塑料袋, 让经过保湿处理的麦穗在大田小麦植株上风晒干燥; ⑤将经过风晒干燥后的麦穗脱粒保存种子, 留作下一代播种. 不抗穗发芽的小麦种子, 在经过田间套塑料袋保湿过程中已经穗发芽, 去掉塑料袋风晒干燥后不能再次发芽而自动淘汰; 抗穗发芽的小麦种子在经过田间套塑料袋保湿过程中未发芽, 去掉塑料袋风晒干燥保存至休眠期过后仍能正常发芽出苗而自动保留(一捂一晒, 自然淘汰).
1.4.2 “大田穗部喷水套袋保湿法”选种效果验证及与传统方法的比较
小麦扬花后35~40 d, 小麦种子的蜡熟后期, 在该研究室小麦抗穗发芽育种试验田(Ksfy2×邯3992)F2代群体选种圃中, 采用1.4.1部分小麦“大田穗部喷水套袋保湿抗穗发芽选种法”进行选种; 另将育种田(Ksfy2×邯3992)F2代群体的部分麦穗割下, 利用文献[4]的3.1部分所述的“人工简易发芽床法”进行鉴定选种. 7d后分别取样剥粒并统计经两种方法处理后材料已发芽的麦粒数(种胚膨大胀破种皮的麦粒统计为已发芽)和未发芽的麦粒数; 将已发芽和未发芽的麦粒尽快晒(烘)干, 然后立即取部分已发芽和未发芽的麦粒分别在培养皿中进行第1次发芽试验, 统计发芽率. 主要验证选出的未穗发芽的麦粒是否真抗穗发芽和已穗发芽的麦粒是否还能二次发芽; 将剩余的已穗发芽和未穗发芽的麦粒分别保存到当年10月初, 在小麦大田播种前, 在培养皿中进行第2次发芽试验并分别统计其发芽率. 主要验证未穗发芽的麦粒休眠期过后能否正常发芽和已穗发芽的麦粒经过长期保存后是否能二次发芽.
2 试验结果与分析
2.1 麦穗附着水率测定结果
通过对表1中3个重复麦穗附着水率的统计分析, 3个重复间F值为0.19, 远小于理论F0.01=5.85, 因此重复间麦穗的附着水率差异无统计学意义; 11个吐温-80处理间F值为100.09, 远大于理论F0.01=3.37, 因此吐温-80处理间的麦穗附着水率差异有统计学意义. 11个吐温-80处理间麦穗附着水率的最小显著差数LSD0.05=2.45,t0.05=2.086和LSD0.01=3.34,t0.01=2.845. 经比较分析各吐温-80处理麦穗附着水率的平均值, 处理Ⅰ, Ⅱ, Ⅲ, Ⅳ, Ⅴ间差异有统计学意义, 处理Ⅴ, Ⅵ, Ⅶ, Ⅷ, Ⅸ, Ⅹ, Ⅺ间差异无统计学意义.

表1 不同吐温-80浸水处理麦穗的附着水率
小麦腊熟期的麦穗浸水试验数据表明, 在水中加入微量的非离子型表面活性剂吐温-80后, 水分子间的表面张力大大降低, 可使水膜均匀附着在麦穗的表面, 能够显著提高麦穗的附着水率. 当用含0.04%吐温-80(每升水中加入400 μL吐温-80)的水浸麦穗时, 麦穗的附着水率能够达到48.98%, 当继续增加吐温-80的量时, 所浸麦穗的附着水率没有显著变化. 因此在喷湿麦穗时宜采用0.04%的吐温-80水溶液, 效果最佳又节约成本.
2.2 保湿塑料袋规格大小与套入麦穗数量对小麦植株倒伏率的影响
由表2中不同规格大小的保湿塑料袋在套入不同数量的麦穗后, 小麦植株(簇)3年的大田平均倒伏率试验数据可知: 在大田利用套袋保湿时, 对塑料袋的大小规格以及每袋套入麦穗的数量是有一定要求的. 塑料袋太大时, 每袋能套入的麦穗数量多但跨行较长, 塑料袋口难以封严, 保湿效果差; 同时由于塑料袋太大, 在大田中的风阻也大, 遇风容易造成小麦植株(簇)倒伏, 影响小麦种子的后熟而失去大田活体选种的意义. 塑料袋尺寸太小时, 每袋套入麦穗的数量太少, 虽然植株(簇)不易倒伏但工作效率低下. 分析表2我们连续3年的大田试验数据可知, 在大田利用穗部套袋保湿时, 采用40 cm×40 cm规格的塑料袋, 每袋套入50穗为宜, 这样保湿塑料袋既容易封口严密又不容易造成小麦植株(簇)倒伏, 工作效率高.

表2 不同大小规格的塑料袋套入不同麦穗个数后植株的大田倒伏率
2.3 保湿塑料袋颜色对袋内温度影响试验结果
表3数据可知, 套塑料袋颜色(白色、 黑色、 银色、 黑色塑料袋外包银色反光膜)对袋内的温度变化有较大的影响. 白色塑料袋透光率好, 因此袋内的温室效应强, 在阳光照射下的不同时间节点, 袋内的温度都远远高于外界温度. 黑色塑料袋能遮挡住大部分阳光, 有效降低了塑料袋内的温室效应, 在大田阳光照射下黑色塑料袋内的温度虽然高于外界温度但却低于白色塑料袋内的温度. 银色塑料袋反射了大部分阳光, 只有微量的阳光透入银色塑料袋, 但仍然有一定的温室效应, 在大田阳光照射下银色塑料袋内的温度仍高于外界温度但较白色、 黑色塑料袋内的温度低. 外包银色反光膜的黑色塑料袋, 由于银色反光膜反射了大部分太阳光, 透过的小部分太阳光又被黑色塑料袋所遮挡, 其袋内的温室效应更低. 14时前, 外界温度逐渐升高时其袋内温度也随之而升高, 但一直略低于外界温度; 14时以后, 外界温度逐渐降低时其袋内的温度随着外界温度而降低, 但一直略高于外界温度. 一天内外包银色反光膜黑色塑料袋内的积温更接近于外界积温, 因此, 在利用穗部喷水套袋保湿法进行大田抗穗发芽选种时宜采用外包银色反光膜的黑色塑料袋.
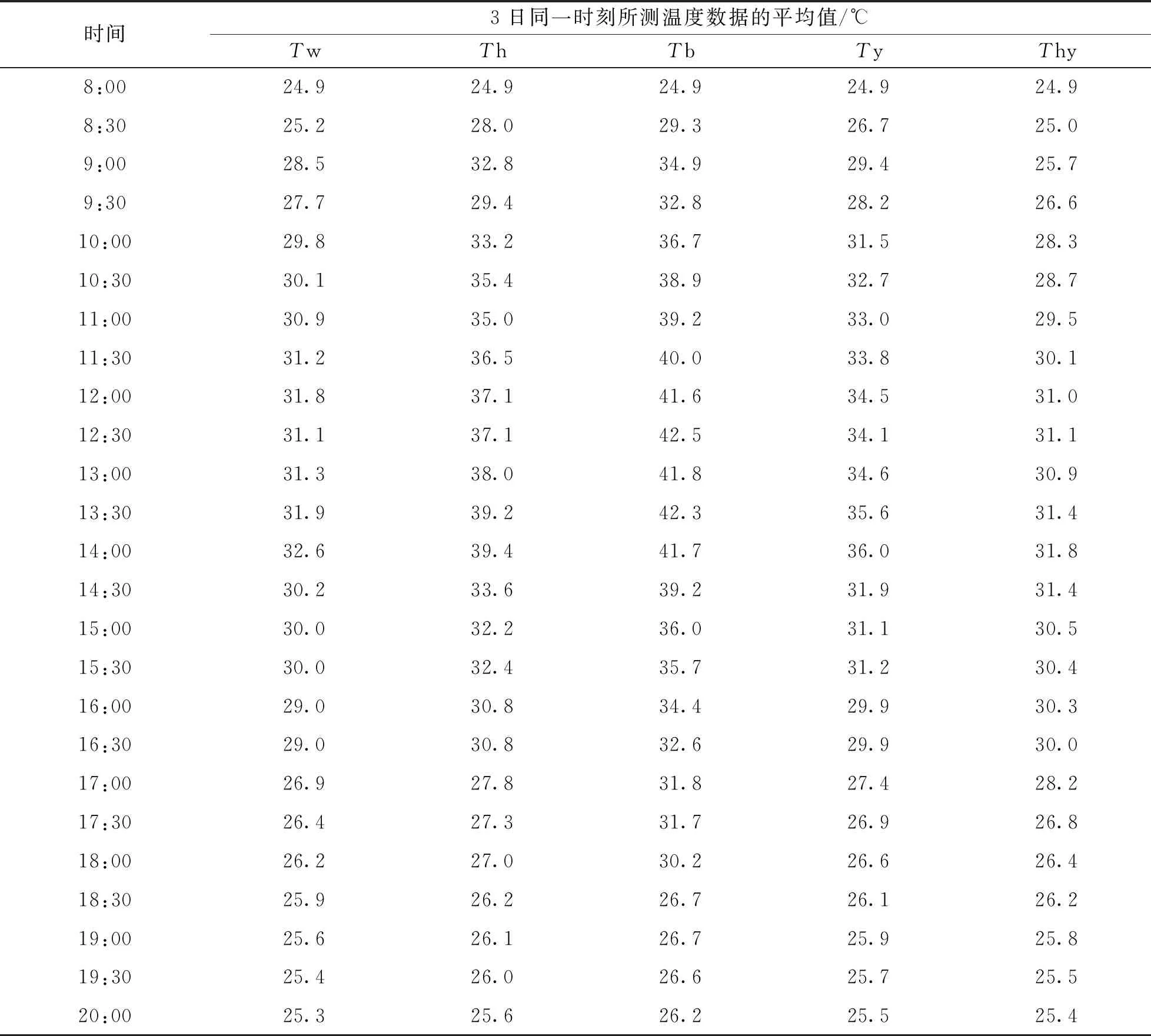
表3 3日同一时刻不同颜色塑料袋中所测温度数据的平均值
2.4 加入不同吸水量的保湿海绵对袋内湿度的影响试验结果
表4数据为在大田相同的大气压强环境下, 每天在28.3 ℃的温度下测得的不同吸水量保湿海绵处理塑料袋内的相对湿度值. 通过比较分析表4中1~7 d的测量数据可知, 在保湿塑料袋中加入不同吸水量的保湿海绵后大大提高了保湿效果. 不加保湿海绵仅用水喷湿透麦穗的处理, 第1 d保湿塑料袋内的相对湿度能保持在90%以上, 从第2 d开始塑料袋内相对湿度迅速降低; 当加入吸水保湿海绵后, 保湿塑料袋内的保湿效果明显改善. 随着加入保湿海绵吸水量的增加, 塑料袋内保湿时间越长. 当加入海绵块的吸水量低于300 mL时, 保湿时间较短, 不能满足连续7 d保持塑料袋内90%以上相对湿度的要求; 当加入海绵块的吸水量高于300 mL时, 虽然保湿效果好, 但增加了塑料袋内的质量, 在大田中遇风容易造成小麦植株的倒伏; 加入300 mL吸水量的保湿海绵处理既能使塑料袋内保持1~7 d, 90%以上的相对湿度, 又不至于过分增加塑料袋内的质量而造成小麦植株倒伏. 因此, 在利用穗部喷水套袋保湿法进行大田抗穗发芽选种时, 加入吸水300 mL的保湿海绵块为宜.
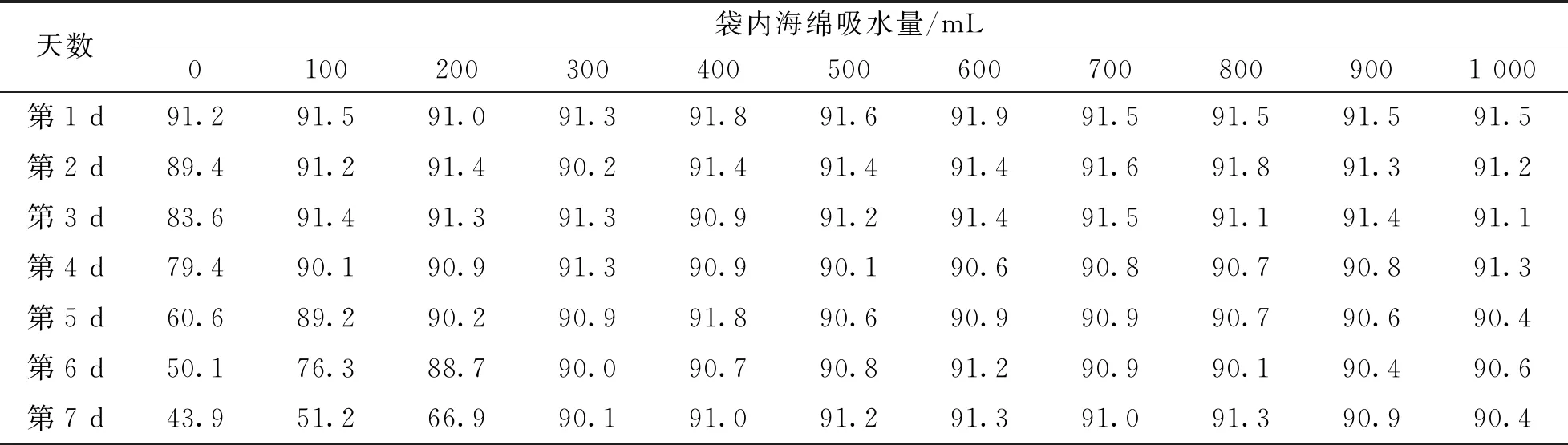
表4 在28.3 ℃温度下1~7 d各吸水量的保湿海绵处理袋内的相对湿度 /%
2.5 “大田穗部喷水套袋保湿法”和“人工简易发芽床法”选种验证与比较
对采用“大田穗部喷水套袋保湿法”和“人工简易发芽床法”两种方法连续进行7 d抗穗发芽定向选择, 对获得的抗穗发芽材料进行穗发芽率和霉烂粒率测定, 所得的数据见表5. 对表5两种方法选出材料的穗发芽率进行方差分析与t检验, 标准差SD=1.254,t0.01=9.925>t0.05=4.303>t=3.473, 说明这两种选择方法对相同世代育种材料进行抗穗发芽选择, 选出的抗穗发芽材料的穗发芽率差异无统计学意义; 对表5中两种方法选出材料的霉烂粒率数据进行方差分析与t检验, 标准差SD=0.834,t0.01=9.925>t0.05=4.303>t=-11.92, 说明这两种选择方法对相同世代育种材料进行抗穗发芽选择, 选出的抗穗发芽材料的霉烂粒率, “大田穗部喷水套袋保湿法”极显著低于“人工简易发芽床法”.

表5 两种方法选择鉴定7 d后选种材料的穗发芽率与霉烂粒率
经“大田穗部喷水套袋保湿法”和“人工简易发芽床法”抗穗发芽育种后代材料选种鉴定后, 已穗发芽的种子和未穗发芽的种子烘(晒)干后进行的两次培养皿发芽试验数据见表6. 由第1次发芽试验数据可知, 已穗发芽的种子干燥后在培养皿中的发芽率都为0, 说明穗发芽的小麦种子干燥后不能再二次发芽; “大田穗部喷水套袋保湿法” 和“人工简易发芽床法”选种鉴定后未穗发芽的种子干燥后在培养皿中的发芽率仅为1.7%和1.8%, 说明这两种方法选种鉴定后未穗发芽种子基本上都仍然处在休眠期不能发芽.
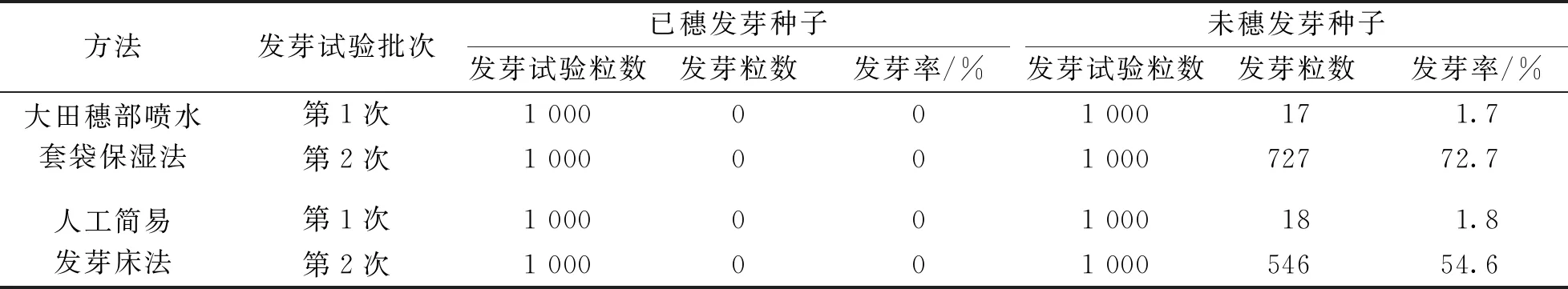
表6 经穗部喷水套袋保湿7 d后的小麦干种子不同时期的发芽率
由第2次发芽试验数据可知: 经两种方法选种鉴定干燥后, 保存3个多月的已穗发芽种子二次发芽率仍为0, 说明已穗发芽的种子干燥后, 无论保存多长时间都不能再进行二次发芽; “大田穗部喷水套袋保湿法” 和“人工简易发芽床法”选种鉴定后未穗发芽的种子干燥后保存3个多月, 在培养皿中的发芽率为72.7%和54.6%, 说明大部分未穗发芽的种子休眠期过后仍能发芽; 另有27.3%和45.4%的未穗发芽种子, 经3个多月保存后仍未能发芽, 原因可能是这部分种子经选种鉴定后从外观上看似完好, 没有发芽, 但在保湿选种鉴定过程中其发芽生理生化过程已经启动, 只是种胚尚未撑破种皮, 烘(晒)干燥时其发芽生理生化过程被迫停止而造成不能二次发芽.
经“人工简易发芽床法”选择的抗穗发芽种子, 播种前的发芽率54.6%明显低于“大田穗部喷水套袋保湿法” 的发芽率72.7%. 分析可能存在以下几方面的原因: ①“人工简易发芽床法”是离体选种法, 选种时种子的后熟不足; ②“人工简易发芽床法”离体选种时材料的霉烂加重, 对选种材料的伤害严重.
3 技术总结与讨论
3.1 技术总结
研发了一种非穗发芽灾害发生年份, 小麦抗穗发芽育种杂交后代材料的大田选种方法, 其技术特征总结如下: ①非小麦穗发芽灾害年份, 在抗穗发芽育种大田选种圃中; ②于小麦扬花后35~40 d的小麦种子蜡熟后期, 对活体小麦植株的穗部用每升加入400 μL吐温-80的水喷透; ③利用40 cm×40 cm大小规格的黑色塑料袋, 将喷水湿透后的麦穗罩住, 每袋罩入50穗, 并在塑料袋中加入吸水300 mL的海绵块, 然后将塑料袋口扎紧使罩室内保存密封湿润状态并外包裹银色反光膜; ④连续保持麦穗处于湿润状态5~7 d后去掉塑料袋, 让麦穗在大田中风晒干燥, 使不抗穗发芽的已发芽种子干枯死亡而淘汰; ⑤小麦成熟后将经“大田穗部喷水套袋保湿法”选种鉴定的抗穗发芽育种后代材料脱粒, 充分晾晒干燥后保存种子; ⑥小麦抗穗发芽育种下一代材料播种前, 从保存的上一代种子中取样做发芽试验, 根据发芽率确定播种量, 保证下一代选种圃群体的密度.
3.2 讨论
1) 本技术方法与文献[4-7]所述的“离体鉴定法”相比, 实现了抗穗发芽育种在大田活体小麦植株上的选种, 不影响小麦植株后期生长, 保证了抗穗发芽种子的成熟度, 减轻了霉变, 更贴近于自然环境, 选种准确, 简单易行, 提高了田间抗穗发芽材料的选择效率, 节约了育种成本, 缩减了工作量, 实现了小麦抗穗发芽种质资源的高效筛选.
2) 与文献[4]所述的3种“活体鉴定法”相比, 本技术方法实现了在大田中对大量活体材料穗发芽抗性的实时鉴定与选种, 选择准确且不影响下茬作物的种植. 因为文献[4]的3.3部分所述“①推迟收获期在大田中等待秋雨的选种法”延长了鉴定周期, 影响了下茬秋季作物的种植; 小麦种子成熟后在植株上需要长时间的等待秋雨, 部分抗穗发芽的种子在等待过程中休眠期已过, 未能实时鉴定选种, 使部分原来抗穗发芽的种子漏选, 结果不准确; 降秋雨时大田的温湿度和初夏季节小麦蜡熟后期有很大的不同, 鉴定结果不够准确. 文献[4]所述的“②采用盆栽, 成熟期移入人工发芽床”及文献[4]所述的“③将材料直接种入人工发芽床”, 这两种方法受人工发芽床面积的限制, 都不适合大量抗穗发芽育种后代材料的鉴定与选择.
3) 与文献[8]所述“在田间建小塑料棚并喷水模拟降雨”的方法相比, 本技术方法用塑料袋内的小空间湿润环境代替了文献[8]所述的塑料棚, 解决了文献[8]所述方法不便于在大田中大面积应用的技术问题; 而且节约了用料、 用工成本, 节约了大量的水资源和喷水消耗的电能源, 更适合小麦抗穗发芽育种田中大面积育种材料活体选种的应用, 提高了工作效率.
4) 与文献[4]所述的手工剥粒淘汰已穗发芽麦粒相比, 本技术方法利用了大田中风干和阳光自然晒干轻松淘汰掉了不抗穗发芽种子而留下了抗穗发芽种子, 更适合在大田中对大量的育种材料进行活体选择; 同时缩减了工作量, 提高了选种效率, 节约了成本, 是一个准确性高且简便易行的选育方法.
5) 与分子标记鉴定法[9-13]相比, 本技术方法更适用于小麦抗穗发芽育种性状分离严重的低代材料选种鉴定; 适用于各种类型的抗穗发芽基因型及表现型的选种鉴定, 不像分子标记那样只针对特定的基因.
6) 本技术方法实现了小麦抗穗发芽育种在大田活体小麦植株上的选种, 快速有效地淘汰了不抗穗发芽种子, 准确地保留了抗穗发芽种子, 适合非穗发芽灾害年份在育种圃对大量小麦抗穗发芽育种低代材料的选种, 加速了抗穗发芽基因的纯合, 降低了育种成本, 实现了小麦抗穗发芽育种大田材料的高效定向选择.
