中晚期恶性肿瘤患者应用PD-1抑制剂多周期治疗对外周血淋巴细胞亚群影响的动态变化研究
2022-04-19黄玉斌徐翠香黄晓燕王建华西安医学院研究生处西安710021陕西省人民医院普外二科陕西省感染与免疫疾病重点实验室西安710068
黄玉斌,刘 霄,徐翠香,黄晓燕,王建华(1.西安医学院研究生处,西安 710021;2.陕西省人民医院,a.普外二科;b.陕西省感染与免疫疾病重点实验室,西安 710068)
近年来恶性肿瘤的发病率趋于年轻化和逐渐增高趋势[1],对于中晚期恶性肿瘤患者的根治方法主要以手术联合放、化疗为主,然而并未给中晚期实体瘤患者带来长期的生存获益[2-3]。肿瘤复发的原因较多,近年来免疫微环境改变导致的肿瘤免疫逃逸被认为是主要危险因素之一,成为了目前肿瘤免疫领域研究的热点与重点内容[4]。肿瘤复发转移与机体自身免疫密切相关,正常机体处于免疫动态平衡状态,而恶性肿瘤患者免疫负向调节通路活化,导致免疫失衡、肿瘤微环境改变[5]。其中程序性死亡分子1(programmed death-1,PD-1)/程序性死亡配体1(programmed death ligand-1,PD-L1)信号通路是启动这一系列过程的主要机制之一[6]。近年来 PD-1抑制剂在中晚期恶性肿瘤的治疗中已经取得了突破性进展,尤其在黑色素瘤、肺癌、膀胱癌及霍奇金淋巴瘤等的治疗中取得了较好的疗效[7-8]。大量研究表明,PD-1抑制剂能改变恶性肿瘤患者外周血淋巴细胞的功能和比例,如 CD3+T,CD4+T,CD8+T,CD4+/CD8+细胞等,从而改善恶性肿瘤患者预后[9]。但在临床研究中,很少涉及在治疗过程中对淋巴细胞亚群动态变化的探究,故本研究旨在通过分析中晚期恶性肿瘤患者应用 PD-1抑制剂治疗外周血淋巴细胞亚群数量的动态变化,探讨 PD-1抑制剂对机体的免疫功能及近期疗效的影响,为临床恶性肿瘤患者制定个体化治疗方案提供参考和依据。
1 材料与方法
1.1 研究对象 收集2019年1月~2021年1月陕西省人民医院肿瘤内科恶性肿瘤患者144 例。纳入标准:①经术后病理或组织活检确诊为中、晚期肿瘤患者,既往未行免疫抑制药物治疗或诊断病毒性疾病;②行为状态良好,卡氏功能状态(Karnofsky performancestatus,KPS)评分≥70分,生存时间>3 个月;③具有计算机断层扫描(CT)或核磁共振(MRI)等可评估的肿瘤病灶。排除标准:①并发严重心、肺、肝等器官功能障碍疾病;②伴有免疫系统性疾病;③未完成4 个周期治疗或因疾病进展更换治疗方案。根据纳入、排除标准,共入组中、晚期恶性肿瘤患者144 例,其中男性70 例,女性74 例;年龄28~78 岁,中位年龄59 岁;美国癌症联合委员会(American Joint Committee on Cancer,AJCC)肿瘤分期为III期和IV 期(III期:45 例,IV 期:99 例);肿瘤类型包括肺癌40 例,胃癌25 例,结直肠癌22 例,乳腺癌16 例,宫颈癌7 例,肾癌6 例,胰腺癌5 例,肝癌、卵巢癌各4例,食管癌、子宫内膜癌、小肠癌、前列腺癌各2例,神经外胚瘤、膀胱癌、黑色素瘤、胸腺瘤、牙龈癌、鼻咽癌、甲状腺癌各1 例。随机分为三组:①联合治疗组(PD-1 单抗+化疗)患者54 例;②PD-1单抗组患者38 例;③单纯化疗组患者52 例。三组患者性别、年龄、肿瘤类型及治疗前淋巴细胞亚群数量比较差异均无统计学意义(P>0.05)。以上患者均知情同意并经陕西省人民医院伦理委员会批准。
1.2 仪器与试剂 BD FACSanto 流式细胞仪及其抗体(抗CD3 FITC,抗 CD4 PE,抗 CD8 PE,抗CD19 PE,CD16 CD56 PE,红细胞裂解液),均由美国 Becton Dickinson 公司提供。CT和磁共振成像(MRI)系统由德国Siemens 公司提供。所有操作严格按照操作说明书进行。
1.3 方法
1.3.1 治疗方法:①联合治疗方案:紫杉醇 +pembrolizumab 单抗方案(第1 天紫杉醇200mg/m2,第1 天pembrolizumab 单抗2mg/kg);紫杉醇 +nivolumab 单抗方案(第1 天紫杉醇200mg/m2,第1 天nivolumab 单抗3mg/kg)。 ②PD-1 单抗治疗方案:nivolumab 单抗(第1 天3mg/kg)或pembrolizumab 单抗(第1 天2mg/kg)。③化疗方案:紫杉醇+卡铂方案(第1 天紫杉醇260mg/m2,卡铂200mg/m2)或紫杉醇+顺铂方案(第1 天紫杉醇200mg/m2,第1,2 天顺铂50mg/m2)。三种治疗方案均以每3 周为1 个周期。
1.3.2 检测及观察指标:治疗前及每周期治疗结束后第21 天,空腹抽取肘静脉血5ml,加入10 ml 抗体,室温下避光孵育20 min,加入红细胞裂解液,避光静置10 min,1 500 r/min 离心20 min,弃上清,洗涤3 次加入磷酸盐缓冲液(phosphate buffered saline,PBS)上机检测外周血淋巴细胞亚群 CD3+T,CD4+T,CD8+T,CD4+/CD8+,B 细胞(CD19+)及 NK细胞(CD16+CD56+)数量水平。观察指标:①比较三种方案治疗前后淋巴细胞亚群数量变化趋势。②比较三种方案之间淋巴细胞亚群数量变化差异。③比较三种方案之间疗效差异。
1.3.3 疗效评价标准:所有患者治疗前及第4 周期治疗后3 周行 CT 或 MRI 检查评价疗效。采用WHO 可测量实体瘤疗效统一标准[10]:完全缓解(complete response,CR):临床检查肿瘤完全消失;部分缓解(partial response,PR):肿瘤最大直径与其最大垂直径的乘积减少>50%以上;疾病稳定(stable response,SD):肿瘤最大直径与其最大垂直径的乘积减少 < 50% 或增加 < 25%;疾病进展(progressive response,PD):肿瘤最大直径与其最大垂直径的乘积增加 > 25%及其他转移征象。有效组包括 CR和 PR;无效组包括 SD和 PD。
1.4 统计学分析 采用统计学软件SPSS 26.0 对数据进行统计分析,计量资料以均数±标准差(±s)表示,重复测量数据多组比较采用单因素及两因素重复测量方差分析(统计量为F);计数资料以率(%)表示,采用χ2检验(统计量为χ2)。P<0.05为差异有统计学意义。
2 结果
2.1 不同治疗方案淋巴细胞亚群数量变化趋势对比见表1。与治疗前比较,经过连续4 个周期治疗,54 例联合治疗组患者外周血CD3+T,CD4+T,CD4+/CD8+及 NK 细胞数量显著升高,差异具有统计学意义(F=44.978~448.929,均P<0.05),CD8+T 细胞数量显著降低,差异具有统计学意义(F=636.362,P<0.05),B 细胞数量无明显变化,差异无统计学意义(F=0.941,P>0.05);38 例 PD-1 单抗组患者外周血 CD3+T,CD4+T,CD4+/CD8+细胞数量显著升高,差异具有统计学意义(F=15.174~87.558,,均P<0.05),CD8+T 细胞数量明显降低,差异具有统计学意义(F=189.966,P<0.05),B 细胞及 NK 细胞数量无明显变化,差异无统计学意义(F=0.328,2.065,均P>0.05);52 例化疗患者外周血CD3+T,CD4+T,CD4+/CD8+细胞数量显著升高,差异具有统计学意义(F=7.312~130.232,,均P<0.05),CD8+T 细胞、B 细胞及NK 细胞数量无明显变化,差异无统计学意义(F=0.084~2.592,均P>0.05)。
表1 三种治疗方案淋巴细胞亚群数量变化对比(±s)
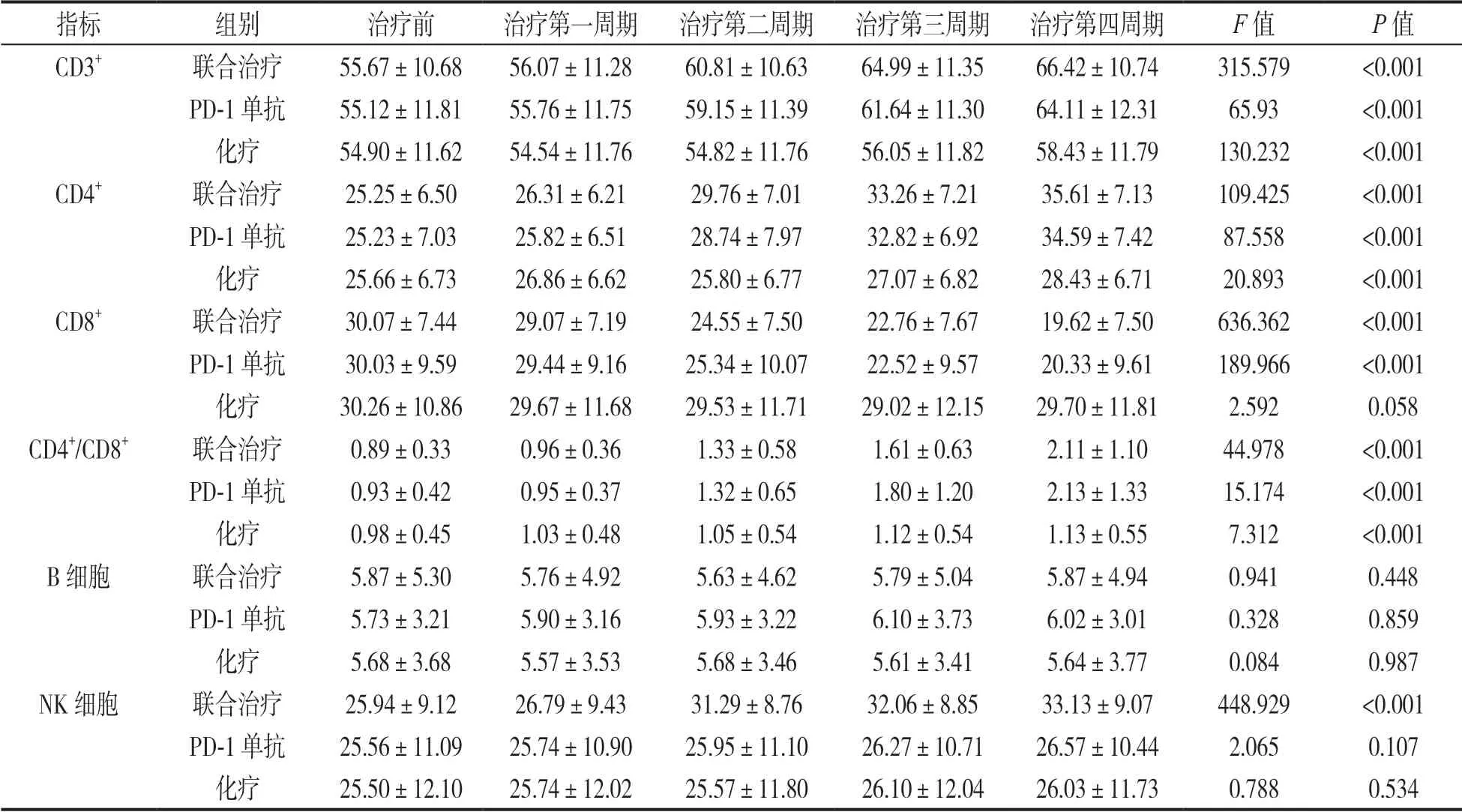
表1 三种治疗方案淋巴细胞亚群数量变化对比(±s)
指标组别治疗前治疗第一周期治疗第二周期治疗第三周期治疗第四周期F 值P 值CD3+联合治疗55.67±10.6856.07±11.2860.81±10.6364.99±11.3566.42±10.74315.579<0.001 PD-1 单抗55.12±11.8155.76±11.7559.15±11.3961.64±11.3064.11±12.3165.93<0.001化疗54.90±11.6254.54±11.7654.82±11.7656.05±11.8258.43±11.79130.232<0.001 CD4+联合治疗25.25±6.5026.31±6.2129.76±7.0133.26±7.2135.61±7.13109.425<0.001 PD-1 单抗25.23±7.0325.82±6.5128.74±7.9732.82±6.9234.59±7.4287.558<0.001化疗25.66±6.7326.86±6.6225.80±6.7727.07±6.8228.43±6.7120.893<0.001 CD8+联合治疗30.07±7.4429.07±7.1924.55±7.5022.76±7.6719.62±7.50636.362<0.001 PD-1 单抗30.03±9.5929.44±9.1625.34±10.0722.52±9.5720.33±9.61189.966<0.001化疗30.26±10.8629.67±11.6829.53±11.7129.02±12.1529.70±11.812.5920.058 CD4+/CD8+联合治疗0.89±0.330.96±0.361.33±0.581.61±0.632.11±1.1044.978<0.001 PD-1 单抗0.93±0.420.95±0.371.32±0.651.80±1.202.13±1.3315.174<0.001化疗0.98±0.451.03±0.481.05±0.541.12±0.541.13±0.557.312<0.001 B 细胞联合治疗5.87±5.305.76±4.925.63±4.625.79±5.045.87±4.940.9410.448 PD-1 单抗5.73±3.215.90±3.165.93±3.226.10±3.736.02±3.010.3280.859化疗5.68±3.685.57±3.535.68±3.465.61±3.415.64±3.770.0840.987 NK 细胞联合治疗25.94±9.1226.79±9.4331.29±8.7632.06±8.8533.13±9.07448.929<0.001 PD-1 单抗25.56±11.0925.74±10.9025.95±11.1026.27±10.7126.57±10.442.0650.107化疗25.50±12.1025.74±12.0225.57±11.8026.10±12.0426.03±11.730.7880.534
2.2 不同治疗方案及周期淋巴细胞亚群数量变化 根据三组治疗方案的不同,采用统计学两因素重复测量方差分析比较不同组别、不同治疗周期淋巴细胞亚群数量变化,Mauchly 球形检验结果均显示P<0.05,证明实验数据不对称,以“多变量检验结果”为此次研究最终结果。结果显示:经过连续4 个周期治疗,三种治疗方案 CD3+T,CD4+T和CD4+/CD8+细胞数量随治疗周期数增加均显著升高,差异具有统计学意义(F=423.589,202.709,56.095,均P<0.05),CD8+T 细胞数量随治疗周期数增加均显著降低,差异具有统计学意义(F=328.596,P<0.05)。与化疗组比较,联合治疗组及 PD-1 单抗组 CD4+T,CD4+/CD8+细胞数量随治疗周期数增加均显著增加(F=4.192,5.362,均P<0.05),CD8+T细胞数量随治疗周期数增加均显著降低,差异具有统计学意义(F=3.365,P<0.05);CD3+T 细胞数量在不同治疗方案及周期间比较,差异无统计学意义(F=2.764,P>0.05)。三种治疗方案 B 细胞数量在不同治疗方案及周期间比较,差异无统计学意义(F=0.434,P>0.05)。联合治疗组 NK 细胞数量随治疗周期数增加显著升高,差异具有统计学意义(F=18.062,P<0.05)。与化疗组比较,联合治疗组 NK 细胞数量随治疗周期数增加显著增加,差异具有统计学意义(F=4.032,P<0.05),PD-1 单抗组与化疗组比较,差异无统计学意义(F=0.009,P>0.05)。
2.3 不同治疗方案多周期治疗后疗效比较 54 例联合治疗患者有效组 44 例(CR 14 例,PR 30 例),无效组 10 例(SD 7 例,PD 3 例),治疗有效率为81.48 % ;38 例 PD-1单抗治疗患者有效组32例(CR 4 例,PR 28 例),无效组6 例(SD 4 例,PD 2 例),治疗有效率为84.21%;52 例化疗治疗患者有效组33 例(CR 8 例,PR 25 例),无效组19 例(SD 14例,PD 5 例),治疗有效率为63.46 % ;三种不同治疗方案疗效比较,差异有统计学意义(χ2=6.710,P=0.035)。
3 讨论
随着肿瘤疫苗、CAR-T 细胞疗法及免疫检查点阻断等治疗手段的出现,免疫疗法再次成为肿瘤治疗研究的前沿和热点,其中免疫检查点 PD-1/PD-L1 通路引起了国内外学者越来越多的关注。作为目前肿瘤治疗领域中最具前景的研究方向之一,PD-1 于 1992年被日本学者发现并命名。研究证实,PD-1/PD-L1 在正常机体免疫系统中发挥保护作用,防止机体 T 淋巴细胞过度激活从而导致自身免疫损害;而肿瘤发生时,肿瘤细胞则可利用此免疫检查点逃脱机体免疫系统的监视与杀伤[11]。PD-1 在活化的 T,B 细胞等多种免疫细胞上表达,其胞质结构域中有两个酪氨酸残基:膜近端的一个构成免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motif,ITIM),另一个构成免疫受体酪氨酸转换基序(immunoreceptor tyrosine-based switch motif,ITSM)。当 PD-1/PD-L1 结合后,位于 PD-1 ITSM 内的酪氨酸残基被磷酸化,并可招募蛋白酪氨酸磷酸酶,该蛋白酶可诱导多种关键信号激酶去磷酸化,促使肿瘤微环境中T 细胞耗竭[12]。PD-L1则表达于包括肿瘤细胞在内的多种细胞类型,其在正常组织中表达是生理性免疫耐受检查点,在机体受损后控制自身免疫反应。然而肿瘤细胞也可以利用 PD-L1 来减弱 T 细胞介导的细胞毒性[13]。恶性肿瘤在发生发展过程中高表达 PD-L1,与招募在肿瘤微环境周围免疫细胞表达的 PD-1 结合,激活PD-1/PD-L1 通路,使整个肿瘤微环境呈免疫抑制状态,最终导致肿瘤细胞发生免疫逃逸。近年来,PD-1抑制剂临床研究取得重大进展,为部分中晚期实体瘤患者的治疗带来了新的希望。
研究表明,肿瘤的发生发展与宿主的免疫状态相关,在免疫防御中起决定作用的是细胞免疫。免疫系统中各群淋巴细胞相互作用,维持机体免疫动态平衡。然而研究发现恶性肿瘤患者外周血淋巴细胞亚群比例会出现异常,如抑制性 CD8+T 细胞比例升高,辅助性 CD4+T 细胞比例下降,CD4+/CD8+比例降低。而当肿瘤负荷降低或解除时,淋巴细胞亚群则逐渐恢复平衡。目前 PD-1抑制剂在临床应用过程中,部分患者对其响应率增高,因此,选择T,B 淋巴细胞亚群及 NK 细胞数量水平的动态变化作为监测 PD-1抑制剂治疗肿瘤患者的疗效及预后指标是有参考价值的。本研究证实所有纳入患者在连续4 个周期治疗过程中 CD3+T,CD4+T和CD4+/CD8+细胞比例均显著增加,其机制与肿瘤患者细胞免疫功能紊乱及受抑制有关[14-15],经过有效地治疗后肿瘤负荷降低,细胞免疫功能逐渐恢复。同时研究显示,联合治疗组及 PD-1 单抗治疗组从第 2周期开始 CD4+T,CD4+/CD8+细胞数量显著升高,CD8+T 细胞数量显著降低,化疗组淋巴细胞数量则恢复较慢。进一步分析发现,与化疗组比较,联合治疗组与 PD-1 单抗治疗组 CD4+T,CD4+/CD8+细胞比例显著升高,CD8+T 细胞比例显著降低。与此同时,临床疗效观察发现,联合治疗组与 PD-1 单抗治疗组治疗有效率显著高于化疗组;其涉及机制可能与免疫治疗激活了机体的免疫系统密切相关,PD-1抑制剂的使用解除了 T 细胞受抑制状态,使其正常活化增殖,细胞毒性T 淋巴细胞比例升高。此外,国内外学者研究发现化疗引起的骨髓抑制能够刺激机体免疫系统,这种反馈稳态性增生能够增强机体抗肿瘤免疫应答[16],杀伤肿瘤细胞。研究已证实 PD-1抑制剂可阻断 PD-1 在 T 细胞与抗原呈递细胞相互作用阶段的抑制信号传导,同时在效应阶段阻断 PD-1与肿瘤细胞上的 PD-L1 结合,恢复细胞毒性 T 淋巴细胞的功能[17]。化疗是治疗肿瘤的经典有效手段之一,研究发现其可增强肿瘤细胞的抗原性,增加免疫细胞对肿瘤细胞的敏感性[18],直接影响细胞毒性 T 淋巴细胞发挥抗肿瘤效应。因此,由于 PD-1抑制剂和化疗药物作用机制的不同,二者联合治疗可发挥更强的抗肿瘤作用。
本研究着重分析了外周血淋巴细胞亚群数量的动态变化及近期疗效,但各种免疫细胞、细胞因子及肿瘤细胞之间存在着错综复杂的网络关系,因此需要更多的检测肿瘤微环境中免疫细胞及相关细胞因子的变化趋势,才可能对免疫治疗疗效起到更好的预测作用。此外,本研究的样本量较小,观察治疗周期数短,作为一个初步探索性的研究,尚需大样本前瞻性的临床研究进一步探索,为实现肿瘤患者个体化精准治疗提供参考,在减少不良反应的同时实现抗肿瘤效应最大化。
