黑果枸杞组培快繁技术研究
2022-04-19刁玄章周玉丽
刁玄章 周玉丽



摘要 [目的]优化黑果枸杞组培快繁条件。[方法]以黑果枸杞的种子为材料,在种子无菌萌发后,取带腋芽的嫩茎段作外植体,以不同基本培养基与不同种类的植物生长调节剂以及不同浓度配比,研究不同种类植物生长调节剂对黑果枸杞组培苗增殖和生根的影响。[结果]以MS为基本培养基,添加不同浓度的6-BA与IBA、IAA组合处理均能提高组培苗的增值倍数,其中0.5 mg/L 6-BA+0.5 mg/L IAA增殖效果明显,增殖倍数达到9.33;5种不同基本培养基中,MS对黑果枸杞组培苗的增殖效果最好,芽多,生长状况良好;生根培养中,添加生长素可抑制黑果枸杞组培苗生根,不添加任何生长素的WPM培养基的生根效果最好,生根率最高,达到97.5%。 [结论]该研究可为建立黑果枸杞快繁体系提供科学依据。
关键词 黑果枸杞;组织培养;增殖;生根
中图分类号 S567.1+9 文献标识码 A 文章编号 0517-6611(2022)07-0099-04
doi:10.3969/j.issn.0517-6611.2022.07.023
开放科学(资源服务)标识码(OSID):
Study on Tissue Culture and Rapid Propagation of Lycium ruthenicum
DIAO Xuan-zhang1,ZHOU Yu-li2
(1.Agriculture and Rural Affairs Bureau of Liuhe District,Nanjing,Jiangsu 211599; 2.College of Agronomy,Anhui University of Science and Technology,Fengyang,Anhui 233100)
Abstract [Objective]To optimize the conditions of Lycium ruthenicum seed rapid propagation system.[Method]With Lycium ruthenicum seeds as the material,after the sterile seed germination,take tender stem segment with axillary bud as explant,with different basic culture medium with different kinds of plant growth regulator and concentration ratio,the effects of different kinds of plant growth regulator on Lycium ruthenicum somaclone proliferation and rooting were studied.[Result]With MS as the basic culture medium,adding different concentrations of 6-BA and IBA,IAA combination treatment all can improve the value of the somaclone multiples,6-BA and IAA on proliferation effect was obvious,and proliferation ratio was 9.33;among the five different basic media, MS had the best proliferation effect on the tissue culture seedlings of Lycium ruthenicum, with many buds and good growth; in rooting culture, adding auxin can inhibit the rooting of tissue culture seedlings of Lycium ruthenicum. The rooting effect of WPM medium without auxin was the best, and the rooting rate was the highest, up to 97.5%. [Conclusion]This study can provide a scientific basis for establishing the rapid propagation system of Lycium ruthenicum.
Key words Lycium ruthenicum;Tissue culture;Propagation;Rooting
黑果枸杞(Lycium ruthenicum Murr.)為茄科(Solanceae)枸杞属(Lycium L.)多年生落叶灌木,主要分布于西北及内蒙古等地,在中亚、高加索和欧洲也有分布[1]。在盐渍化土壤大量生长,常构成盐爪爪(Kalidium foliatum)-黑果枸杞盐生植物群落[2],是一种较为典型的储盐植物,也是荒漠化地区尤其是盐碱化土地恢复植被的备选植物之一[3]。野生黑果枸杞的适应能力很强,耐38.5 ℃高温,且在-25.6 ℃下无冻害[4];为较耐旱植物,土壤水合补偿点为3.81%[5];果实富含枸杞多糖、蛋白质以及微量元素等多种营养成分,其提取物还具有降血糖、降血脂、抗氧化、延缓衰老及预防并治疗动脉硬化、心血管疾病、肿瘤等中老年常见疾病的功效,保健和药用价值远远超过普通红枸杞,被誉为“软黄金”[6-12]。近年来,随着人们保健意识的增强,具有滋补养生、强身健体、美容养颜的黑果枸杞备受消费者的青睐。由于黑果枸杞市场需求量逐年增大,对野生资源的过度采摘,造成严重的生态影响,因此研究黑果枸杞组培快繁技术显得尤为重要。植物组织培养起源于20世纪,对植物学的发展起到了重要的推动作用[13]。采用植物组织离体培养的方式对黑果枸杞进行研究,改变传统育苗模式,既可以保障黑果枸杞的品质,又能满足市场需求,但目前有关黑果枸杞组培快繁技术的研究较少,仅仅局限于简单的培养条件探索。该研究以黑果枸杞种子为材料,以MS培养基为基本培养基,用组织离体培养技术培育黑果枸杞试管苗,研究不同激素组合和不同培养基对无菌苗外植体不定芽增殖和生根的影响,旨在为黑果枸杞建立系统组培快繁体系提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试材料。供试种子为采自甘肃省敦煌市的野生黑果枸杞种子,供试苗为黑果枸杞种子繁殖的无菌苗。
1.1.2 培养条件。培养基中均加入蔗糖30 g/L,琼脂5.5 g/L,调节pH 6.0~6.5,培养温度(25±1) ℃,光照在2 000~4 000 lx,光照时间12 h/d,相对湿度60%左右。
1.2 方法
1.2.1 无菌苗的获得。
选择适宜大小的黑果枸杞果实→用洗洁精水清洗干净表面→自来水冲洗30 min→蒸馏水冲洗3~4次→在超净工作臺上用75%乙醇浸泡30~45 s→无菌水冲洗2~3次→5 %次氯酸钠溶液处理 8~10 min→无菌水冲洗 4~5次→用无菌滤纸吸干多余水分→在超净工作台上无菌条件下剥取种子接种到不添加植物生长调节剂的MS培养基上培养,7 d后种子逐渐萌发,45 d左右苗高6~8 cm时备用(图1a)。
1.2.2 增殖培养。将无菌苗剪切成带2~3个腋芽的茎段,接种到添加不同浓度6-BA与IBA、IAA、NAA组合的MS培养基上诱导丛生芽(图1b),每处理10瓶,每瓶接3~4个茎段,接种30 d后观察生长情况并进行数据分析。
将上述筛选的最适植物生长调节剂浓度组合分别添加到1/2MS、MS、B5、N6和WPM的基本培养基中,分别将无菌苗茎段接种到以上5种基本培养基中,每处理10瓶,每瓶接3~4个茎段,接种30 d后观察生长情况并统计分析数据。
增殖倍数=芽的增殖总数/接种单茎芽总数
1.2.3 生根培养。将增殖培养的组培苗剪切成带2~3个腋芽茎段,接种到5种基本培养基上诱导生根,每处理10瓶,每瓶接4个茎段,接种20 d后观察生长情况并进行数据分析。
由上述试验筛选出最适宜诱导黑果枸杞组培苗生根的基本培养基,在该基本培养基中分别添加不同浓度的IBA、IAA和NAA,将无菌苗茎段接种到添加生长素的最适基本培养基中,每处理10瓶,每瓶接3个茎段,接种20 d后观察生长情况并进行数据分析。
生根率=生长出根系的植株数/接种单茎芽的总数×100%
平均根数=生长出的根系总数/生长出根系的植株数×100%
2 结果与分析
2.1 不同植物生长调节剂组合对黑果枸杞组培苗增殖的影响
将组培苗茎段接种到不同植物生长调节剂组合的MS培养基上,探究添加不同浓度6-BA与IBA、IAA、NAA组合对黑果枸杞组培苗增殖的影响。由表1可知,6-BA与NAA组合只促进黑果枸杞组培苗愈伤组织的形成,愈伤大,致密,淡绿色;而6-BA与IBA组合不同程度地促进了黑果枸杞组培苗的增殖,其中增殖倍数最高的组合为0.2 mg/L 6-BA+0.2 mg/L IBA,增值倍数为4.93,且芽少,枝粗,叶片肥厚,第2组0.5 mg/L 6-BA+0.1 mg/L IBA处理还出现了玻璃化,甚至畸形的现象;在添加相同浓度的6-BA时,IAA对黑果枸杞组培苗增殖的影响要优于IBA,以第8组(0.5 mg/L 6-BA+0.5 mg/L IAA)的增殖效果最好,增殖倍数最大,达到9.33,且苗生长状况良好(图1c)。
2.2 不同基本培养基对黑果枸杞组培苗增殖的影响
将组培苗茎段接种到0.5 mg/L 6-BA+0.5 mg/L IAA基本培养基上,探究不同基本培养基对黑果枸杞组培苗增殖的影响。由表2可知,基本培养基对黑果枸杞组培苗增殖均有不同程度的影响,1/2MS、N6和WPM培养基对黑果枸杞组培苗增殖影响较小,芽少,增殖倍数低;B5培养基对黑果枸杞组培苗增殖的影响最小,增殖倍数仅1.00,且生长一般;MS培养基对黑果枸杞组培苗的增殖效果最好,增值倍数达到8.83倍,且生长状况良好。
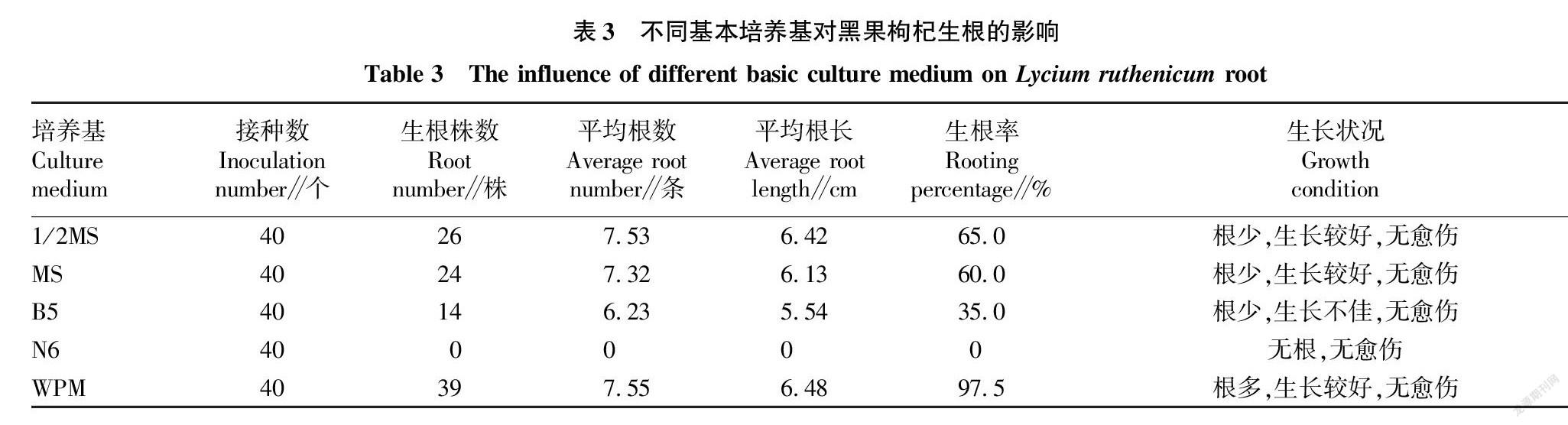
2.3 不同基本培养基对黑果枸杞组培苗生根的影响
将组培苗茎段接种到不含激素的不同基本培养基上,研究不同基本培养基对黑果枸杞组培苗生根的影响。由表3可知,N6培养基上接种的组培苗生根率为0,对黑果枸杞组培苗生根不仅没有促进作用,还抑制黑果枸杞组培苗的生根;1/2MS和MS培养基上的组培苗虽然生根株数少,但是生长较好,无愈伤;B5培养基上的组培苗不仅生根率低,且生长不佳;WPM培养基上生长的组培苗生根率最高,达到97.5%,有利于黑果枸杞组培苗的生根。
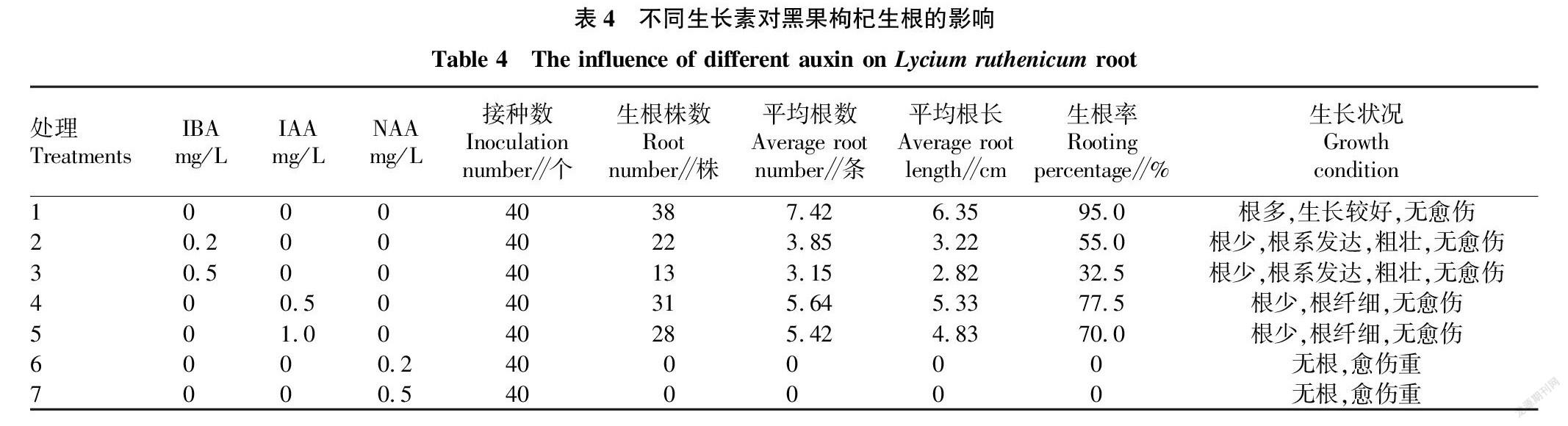
2.4 不同生长素对黑果枸杞组培苗生根的影响
将组培苗茎段接种到添加不同生长素的WPM培养基上,研究不同浓度IAA、IBA、NAA对黑果枸杞组培苗生根的影响。由表4可知,NAA只促进黑果枸杞组培苗愈伤组织的形成,对生根没有帮助,IBA和IAA不同程度地抑制了黑果枸杞组培苗生根,其中,IBA对组培苗的生根抑制程度较大,但根系发达粗壮,适合壮苗,IAA对组培苗的生根抑制程度较小,根纤细。以第1组(不添加生长素的WPM培养基)生根效果最好(图1d),生根率达95.0%,平均生根条数最多,达到了7.42条,生长状况较好。可见,在培养基中添加生长素反而不利于其生根。
3 讨论
降低黑果枸杞外植体污染率是研究黑果枸杞快繁技术要解决的重要问题,通常选用的外植体都比较幼嫩,经过消毒灭菌会对植物组织造成不同程度的损伤,但取自田间的外植体又存在带菌较多的问题,较难彻底消毒灭菌。该试验通过直接对黑果枸杞种子进行消毒灭菌处理,将灭过菌的种子直接接入基本培养基即可生长出无菌的幼嫩植株,再由无菌植株得到无菌茎段直接进行腋芽的诱导,避免了对幼嫩茎段的损伤,有效解决了无菌系建立所面临的污染率较高的问题。
同一试验材料,若外植体的取材时间和来源不同,所需要的培养条件也会对增殖倍数产生不同影响。马彦军等[14]对甘肃省永靖县黑果枸杞嫩枝进行组织培养研究,通过试验得出,诱导黑果枸杞增殖的最适培养基配方为MS+6-BA 0.1 mg/L+NAA 0.2 mg/L,增值倍数达到3.58。而该试验结果表明,诱导黑果枸杞增殖的最佳培养基配方为MS+6-BA 0.5 mg/L+IAA 0.5 mg/L,且NAA只促进黑果枸杞组培苗愈伤组织的形成,难以促进其增殖。马彦军等[14]研究所用的外植体是7月份直接取自田间的黑果枸杞嫩枝,而笔者选用的茎段取自无菌种子长出的45 d组培苗。由此可知,筛选黑果枸杞增殖的最适培养基配方需要严格考察外植体的多方面因素,并且该试验对种子进行消毒灭菌,利用无菌茎段直接进行快繁技术研究,极大地降低了污染率。
提高生根率对于黑果枸杞快繁体系的建立意义重大。杨宁等[15]对甘肃省民勤县黑果枸杞种子进行组织培养研究,通过试验得出诱导黑果枸杞生根的最适培养基配方为MS+IBA 0.1 mg/L+蔗糖5 g/L,生根率为95%。而该试验结果表明,诱导黑果枸杞增殖的最佳培养基为不添加任何生长素的WPM,黑果枸杞组培苗的生根率高达97.5%,平均根数为7.55条,平均根长为6.48 cm,且根系多,生长较好,无愈伤。杨宁等[15]研究了不同浓度IBA对黑果枸杞组培苗生根的影响,而该试验选择3种生长素及5种基本培养基作比较,结果表明,生长素会抑制黑果枸杞组培苗的生根,而NAA可促进愈伤组织的形成。
在诱导黑果枸杞增殖培养时,0.5 mg/L 6-BA+0.1 mg/L IBA出现玻璃化现象,甚至出现畸形苗,这与其他相关研究有较大差异[14-16]。该研究中,各种植物生长调节剂的组合均对黑果枸杞增殖产生一定作用,而各种生长素会抑制黑果枸杞组培苗的生根,不添加任何激素WPM为促进黑果枸杞组培苗生根的最适培养基配方,可见今后需对优化黑果枸杞组培快繁技术进行进一步研究。
4 结论
该研究结果表明,诱导黑果枸杞增殖的最适培养基配方为MS+6-BA 0.5 mg/L+IAA 0.5 mg/L,诱导黑果枸杞生根的最适培养基配方为不添加任何激素的WPM,不管是生根试验还是增殖试验,添加NAA都会促进愈伤组织的形成,但不利于生根或增殖;IAA与6-BA的组合有利于黑果枸杞的增殖。该研究通过对增殖速度和生根时间进行调控,实现了优质、高效快繁黑果枸杞种苗的目的。但是该试验仅筛选了部分植物生长调节剂的组合进行研究,因此对黑果枸杞组培快繁技术仍有很大的研究空间。
参考文献
[1]
中国科学院中国植物志编辑委员会.中国植物志:第67卷 第1册[M].北京:中国科学出版社,1999.
[2] 常兆丰,安富博,樊宝丽.荒漠生态观测研究方法[M].兰州:甘肃科学技术出版社,2009.
[3] 章英才,张晋宁.两种盐浓度环境中的黑果枸杞叶的形态结构特征研究[J].宁夏大学学报(自然科学版),2004,25(4):365-367.
[4] 李世忠.永靖县黑果枸杞育苗技术[J].林业实用技术,2011(7):48-49.
[5] 耿生莲.不同土壤水分下黑果枸杞生理特点分析[J].西北林学院学报,2012,27(1):6-10.
[6] LV X P,WANG C J,CHENG Y,et al.Isolation and structural characterization of a polysaccharide LRP4-A from Lycium ruthenicum Murr.[J].Carbohydrate polymers,2013,365:20-25.
[7] PENG Q,XU Q S,YIN H,et al.Characterization of an immunologically active pectin from the fruits of Lycium ruthenicum[J].International journal of biological macromolecules,2014,64:69-75.
[8] 甘青梅,骆桂法,李普衍,等.藏药黑果枸杞开发利用的研究[J].青海科技,1997,4(1):17-19.
[9] 陈海魁,蒲凌奎,曹君迈,等.黑果枸杞的研究现状及其开发利用[J].黑龙江农业科学,2008(5):155-157.
[10] 陈红军,侯旭杰,白红进,等.黑果枸杞中的几种营养成分的分析[J].中国野生植物资源,2002,21(2):55.
[11] 阿力同·其米克,王青锋,杨春锋,等.新疆产药用植物黑果枸杞遗传多样性的ISSR分析[J].植物科学学报,2013,31(5):517-524.
[12] 林丽,张裴斯,晋玲,等.黑果枸杞的研究进展[J].中国药房,2013,24(47):4493-4497.
[13] HABERLANDT G.Experiments on the culture of isolated plant cells[J].Botanical review,1969,35(1):68-88.
[14] 马彦军,程艷青,张荣梅.黑果枸杞组织培养快繁技术研究[J].林业科技通讯,2015(6):26-28.
[15] 杨宁,李宜珅,陈霞,等.黑果枸杞的组织培养和快速繁殖[J].西北师范大学学报(自然科学版),2016,52(2):84-88.
[16] 胡相伟,马彦军,李毅,等.黑果枸杞的组织培养和植株再生[J].农业科技与信息,2015(7):48-49.
