萝卜对铀及其伴生金属镉的富集特征与光合生理响应
2022-04-18陈兴帮肖丕显杨秀林
陈兴帮,陈 熹,吴 国*,肖丕显,李 熠,杨秀林,何 兵
(1 四川职业技术学院,四川遂宁 629000;2 四川师范大学 生命科学学院,成都 610101)
核能和国防工业促发了铀(U)矿的开采,导致大量尾矿释放到土壤和水环境中,造成严重的核污染[1]。铀尾矿中还含有低剂量的镉(Cd)、铅(Pb)、锰(Mn)等多种伴生金属,其中Cd被联合国环境规划署列为全球性危害化学物质之首[2]。U、Cd容易通过食物链进入人体,引发肾脏中毒和骨痛病等,严重威胁人类健康,因此修复铀尾矿污染环境势在必行[3]。相较于物理和化学等手段,植物修复技术具有成本低、绿色环保等特点,具有广阔的应用前景。然而,U、Cd是植物的非必需元素,过量积累会抑制植物生长,使植物修复效率降低[4-5]。
研究表明,U、Cd胁迫会通过破坏植物根系微观结构[6-8]、干扰矿质元素代谢(Fe和Mn等)[9-11]、打破细胞的氧化还原水平等[12-13]对植株造成严重毒害。在光合作用方面,U胁迫对不同植物的影响不尽相同。例如,在U胁迫下,蚕豆(Viciafaba)和黑麦草(Loliumperenne)的净光合速率(Pn)显著降低[14-15],黄秋葵(Abelmoschusesculentus)的光系统Ⅱ(PSⅡ)结构和功能受损,最大光量子产额(Fv/Fm)显著降低[16];而大叶菠菜(Spinaciaoleracea)和红圆叶苋(Iresineherbstii)的Pn有所升高,拟南芥(Arabidopsisthaliana)的实际光量子产额(ΦPSⅡ)等荧光参数呈上升趋势,光合作用能力加强[17-18]。目前,Cd胁迫对植物光合作用的影响机理已经比较清楚,主要通过抑制叶绿体的增殖[19]、阻碍光合电子传递[20]、与Ca2+竞争而抑制光激活[21]以及破坏叶绿体结构[22]等抑制光合作用。
迄今,相关研究大多限于U或Cd单一胁迫,关于二者共存时的生物学效应研究较少。Vandenhove[23]和姚天月[24]等研究表明,U、Cd对拟南芥的鲜重以及水芹(Oenanthejavanica)株高和根长等的抑制表现为协同作用;而李仕友等研究表明U、Cd对万年青(Rohdeajaponica)抗氧化酶的抑制表现为拮抗作用[25]。Lai等[4-5]发现,甘薯(Ipomoeabatatas)主要通过改善能量代谢和增加初级代谢产物以响应U和U+Cd胁迫,主要以抗氧化系统的改变响应Cd胁迫;不同品种的甘薯对U、Cd的响应机制也不同。因此,U、Cd复合污染在不同植物中的生物学效应有待进一步研究。
十字花科植物对重金属的耐受性普遍较强[26],且萝卜对U的耐受性强于甘蓝(Brassicaoleraceavar.capitata)等十字花科其他植物[27]。白萝卜(Raphanussativus)是十字花科萝卜属的植物,生长快、易收获。朱业安等[28]用白萝卜修复U污染土壤,使土壤残留U浓度从140~560 mg·kg-1降低为57.9~198.4 mg·kg-1,去除率达到57.7%~72.2%;Li等[29]对比不同萝卜品种后发现,白萝卜的Cd富集能力更强。可见,用白萝卜修复铀尾矿污染的应用潜力较大,但目前对U、Cd伴生条件下萝卜生长和光合特性的研究鲜见报道。因此,本研究以白萝卜为试材,在溶液培养条件下探究U、Cd单一和复合处理时其在萝卜幼苗中的富集特征及对萝卜幼苗生长和光合特性的影响,为铀尾矿污染环境的生态修复提供实验依据。
1 材料和方法
1.1 供试材料及植物培养
萝卜种子购于成都市种子市场,硝酸铀酰[UO2(NO3)2·6H2O]、氯化镉(CdCl2·5H2O)和其他试剂均为分析纯,购于成都市苌钲化玻仪器有限公司。随机选择饱满种子,用70%酒精消毒,蒸馏水冲洗3次,浸种24 h后转移至垫有1层滤纸的培养皿(直径9 cm)中,并放入发芽箱中28 ℃萌发。种子根长约0.5 cm时转移至定植篮(直径5 cm),并置于含改良Hoagland营养液(pH 5.5,无磷)的组培瓶中培养,每3 d换1次营养液。UO22+易与磷酸盐结合而沉淀,生物有效性降低,因此将营养液配方中的磷酸盐稀释为0.1 mmol·L-1,每天定时叶面施肥,避免植株缺磷[10]。培养室温度20~25 ℃,光照强度60~65 μmol·m-2·s- 1。
1.2 实验设计
据景称心等[2]调查结果,某铀尾矿库周围0~50 cm深度土壤中U含量约6.63~92.2 mg·kg-1,Cd含量约0.23~6.63 mg·kg-1。折算为摩尔浓度可知,铀尾矿中Cd浓度仅为U浓度的10%~20%。此外,无磷(或低磷)条件下,重金属的生物有效性显著增大,U浓度为25~50 μmol·L-1时植物生长受到显著抑制[4,6,12]。萝卜对铀的耐受浓度较高,结合预实验结果,本研究选择U浓度为50 μmol·L-1,Cd浓度为10 μmol·L-1,设置单一U、单一Cd和U+Cd复合处理3个处理组,以无磷Hoagland营养液为空白对照(CK)。待萝卜幼苗第二片真叶变绿(约3周),用处理液培养2周,每3 d换1次处理液,保持每天喷施磷酸盐。
1.3 测定指标及方法
1.3.1 U、Cd元素含量和富集系数、转移系数U、Cd胁迫处理结束后,用20 mmol·L-1的Na2-EDTA浸泡根部30 min,去除根系表面吸附的元素。将幼苗分为根部和地上部,采用湿法消解法消解后,用电感耦合等离子质谱仪(ICP-MS)测定幼苗根部和地上部U、Cd含量。
萝卜对U、Cd的生物富集系数(BCF)和转移系数(TF)计算公式分别为:
BCF=C整株/C溶液,TF=C地上/C根
其中,C整株、C地上和C根分别表示萝卜幼苗整株、地上部和根部U、Cd含量,C溶液表示溶液中添加的U、Cd浓度。
1.3.2 生物量和根系活力将采集的萝卜幼苗用超纯水(ddH2O)冲洗3次后分为地下部和地上部,在120 ℃杀青15 min,转至80 ℃下烘至恒重,测定生物量并计算根冠比。剪取约0.5 cm根尖,用二乙酸荧光素(FDA)和碘化丙啶(PI)双重染色法[12]染色,置于荧光显微镜下观察根系活力,活细胞被FDA染色后在488 nm激发光下发出绿色荧光,死细胞被PI染色后在543 nm激发光下发出红色荧光。
1.3.3 叶绿素和可溶性糖含量采用暗室震荡提取法[30]测定叶绿素含量:称取约0.5 g叶片,加入10 mL混合浸提液(丙酮∶乙醇= 1∶1,V/V),暗室震荡浸提约12 h,至叶片全部变为白色为止,分别在663、645、470 nm下测定光吸收值。参照Zhang等[14]的方法测定可溶性糖含量:称取0.25 g叶片,加入15 mL ddH2O研磨至匀浆,沸水浴提取30 min,冷却后定容至250 mL,滤纸过滤后得到样品提取液。将0.5 mL样品提取液与1 mL苯酚(1%)和5 mL浓硫酸混合,静置10 min后30 ℃下反应20 min,测定480 nm处的光吸收值,并根据标曲计算可溶性糖含量。
1.3.4 光合特性选择晴朗天气,于上午9:00-11:00用便携式光合测定系统(GFS-3000,德国,WALZ)测定叶片的基本光合参数:净光合速率(Pn)、蒸腾系数(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)。分别在不同光照强度下(0、50、100、200、300、400、600、800、1 000、1 200、1 400 μmol·m-2·s- 1)测定不同处理的光-光合响应曲线,采用直角双曲线修正模型拟合光响应曲线,并计算出相关特征参数[31]。将各组幼苗置于暗室暗处理一晚,次日黎明使用便携式叶绿素荧光仪(FMS-2,英国,汉莎)测定叶绿素荧光参数实际光量子产额(ΦPSⅡ)、光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)和电子传递速率(ETR)[32]。
1.4 数据处理
采用Excel、SPSS 20处理数据,进行单因素方差(ANOVA)分析,LSD法多重比较,用Origin 2018绘图。
2 结果与分析
2.1 萝卜幼苗对U和Cd的富集特征
在单一U或U+Cd复合胁迫处理下,萝卜幼苗U含量均表现为根部远高于地上部,与单一U胁迫相比,U+Cd复合胁迫处理组的U含量和对U的生物富集系数(BCF)均明显升高,而对U的转运系数(TF)无明显变化(图1,Ⅰ)。萝卜幼苗根部Cd含量也均远高于地上部,但与单一Cd胁迫相比,U+Cd复合胁迫处理组的根部或地上部Cd含量均显著降低;同时,萝卜幼苗对Cd 的BCF和TF也明显低于单一Cd胁迫处理(图1,Ⅱ)。其中,与单一处理相比,复合处理的萝卜幼苗根部和地上部U含量分别显著升高118.6%和155.4%,Cd含量却分别显著降低57.5%和91.5%(P<0.05)。结果表明,萝卜根部U、Cd含量远高于地上部,在单一胁迫处理下其对Cd的富集能力强于U,而在复合胁迫处理下,对U的富集和转移能力增强,对Cd富集和转移能力减弱。

相同部位内不同大写和小写字母表示处理之间在0.05水平差异显著(P<0.05)
2.2 U、Cd胁迫对萝卜幼苗生长的影响
U、Cd胁迫下萝卜幼苗生长均受到抑制,地上部和根部生物量、根冠比明显降低,抑制程度表现为:U+Cd复合处理>单一U处理>单一Cd处理(图2,Ⅰ-Ⅲ)。与CK相比,萝卜幼苗根部生物量、地上部生物量和根冠比在单一U胁迫处理下分别显著降低41.5%、21.3%和25.5%(P<0.05),在单一Cd胁迫处理下分别降低16.9%、12.5%和5.0%,在复合胁迫处理下分别显著降低76.9%、58.3%和45.5%;与单一胁迫处理相比,复合处理组幼苗根部和地上部生物量也显著降低。同时,FDA-PI染色结果显示(图2,Ⅳ),与CK相比,处理组萝卜幼苗根部绿色荧光减弱而红色荧光增强,表明其根系活力减弱,并表现为CK>单一Cd处理>单一U处理>U+Cd复合处理。
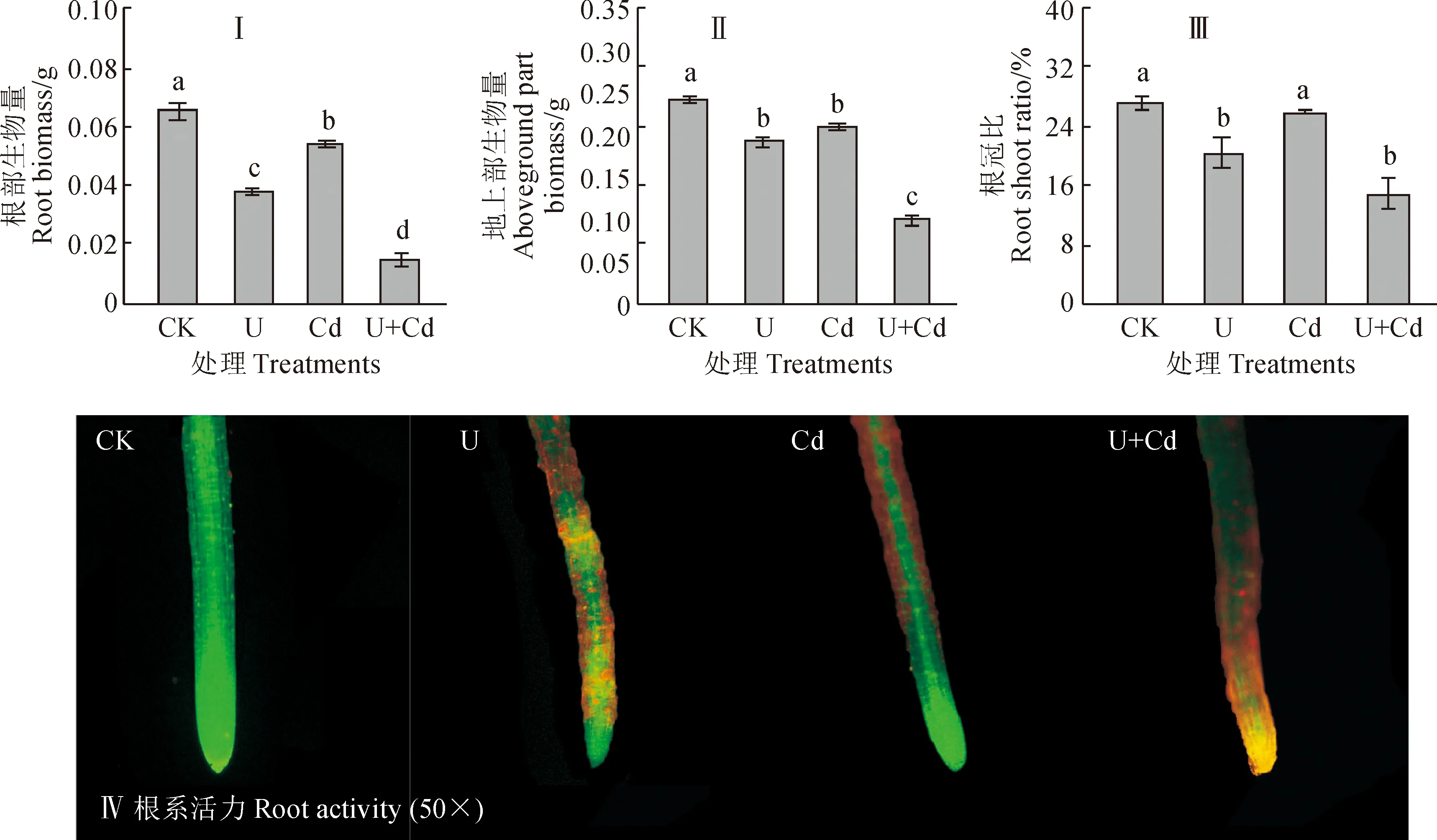
不同小写字母表示不同处理间的差异显著(P<0.05),下同;图Ⅳ中50×表示放大50倍的观察结果
2.3 U、Cd胁迫对萝卜幼苗叶片光合特性的影响
2.3.1 光合色素和可溶性糖含量图3显示,萝卜幼苗叶片叶绿素b含量在U、Cd单一或者复合胁迫下均与CK无显著差异(P>0.05);叶绿素a、类胡萝卜素和可溶性糖含量在单一Cd胁迫处理下也均与CK无显著差异,但在单一U胁迫处理下分别比CK显著降低16.7%、20.9%和17.6%,在U+Cd复合胁迫处理下分别比CK显著降低24.6%、31.2%和53.7%。同时,U+Cd复合胁迫处理下,叶绿素a和可溶性糖含量显著低于单一Cd胁迫处理组,而叶绿素b和类胡萝卜素含量则与U或Cd单一处理相比均无显著差异。

图3 U和Cd胁迫下萝卜幼苗叶片光合色素和可溶性糖含量的变化
2.3.2 光合气体交换参数由图4可知,U、Cd单一及复合处理均对萝卜幼苗光合作用造成显著抑制。各处理组净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)分别比CK显著降低43.9%~68.6%、27.6%~55.1%和33.8%~59.5%(P<0.05),而其胞间CO2浓度(Ci)比CK显著升高17.7%~25.9%。

图4 U和Cd胁迫下萝卜叶片光合气体交换参数的变化
同时,U+Cd复合处理萝卜幼苗叶片Pn、Tr和Gs均显著低于U、Cd单一处理,Ci却显著高于单一处理。说明U、Cd复合胁迫对萝卜幼苗光合作用的抑制强于单一处理。
2.3.3 光响应曲线及其特征参数随着光合有效辐射(PAR)的增加,各处理组萝卜幼苗叶片Pn均逐渐升高至最高值,而后保持平缓变化,且在同一PAR水平下叶片Pn基本表现为CK>单一Cd处理> 单一U处理 >U+Cd复合处理;在U、Cd单一及复合胁迫处理下,曲线的最低值、斜率和最高值均低于CK,表明暗呼吸速率(Rd)增大,表观量子效率(AQY)和最大净光合速率(Pnmax)降低(图5,Ⅰ)。进一步用直角双曲线修正模型拟合发现,各处理组叶片的Rd比CK显著升高61.9%~353.1%,而其Pnmax和AQY则分别比CK显著降低46.6%~56.3%和13.9%~38.6%(图5,Ⅱ-Ⅳ)。以上结果表明,U、Cd胁迫下萝卜幼苗叶片呼吸作用加强,光合作用减弱,且复合处理影响显著大于单一处理。

图5 U和Cd胁迫下萝卜叶片光合-光响应曲线及其相关参数的变化
2.3.4 叶绿素a荧光参数图6显示,萝卜幼苗叶片叶绿素a荧光参数在单一Cd处理下与CK相比无显著差异(P>0.05),而在单一U和U+Cd复合处理下均受到显著影响(P<0.05),且复合胁迫处理受到的影响更大。在单一U胁迫处理下,叶片实际光量子产额(ΦPSⅡ)、光化学淬灭系数(qP)和电子传递速率(ETR)分别比CK显著降低19.9%、49.3%和37.0%,而非光化学淬灭系数(NPQ)则升高为CK的2.1倍;在U+Cd复合胁迫处理下,叶片ΦPSⅡ、qP和ETR分别比CK显著降低57.1%、42.4%和70.3%,同时也比单一U胁迫处理显著降低, NPQ则比CK显著升高2.4倍,但与单一U胁迫处理无显著差异。

图6 U和Cd胁迫下萝卜幼苗叶片叶绿素a荧光参数的变化
3 讨 论
U在植物中的富集与其伴生金属及植物种类密切相关。Lai等[5]研究发现,Cd能影响甘薯转运蛋白基因表达,促进甘薯对U的吸收;而李宇林[33]研究表明,泽泻(Alismaplantago-aquatica)和鱼腥草(Houttuyniacordata)体内U含量与外界Cd浓度呈显著负相关。本研究中,Cd伴生也促进了萝卜对U的富集、转运。总体而言,铀尾矿中伴生的低剂量Cd能增强萝卜对U的富集,或可提高萝卜对U污染土壤的修复效率,但实际应用时还需考虑生物量受到抑制对修复效率的负效应。
U、Cd均为植物的非必需元素,容易对植物造成毒害,主要表现为生物量减少、根系活力下降[6,12]及光合能力减弱等[14,16]。本研究显示,各胁迫处理组均显著抑制萝卜幼苗生物量和根系活力,根系活力的降低不利于植株对水分和矿质元素等的吸收。而且U+Cd复合处理对萝卜生长的影响强于单一处理,这与赖金龙等[4]的研究结果一致。主要原因是复合处理下U含量的增幅大于Cd含量的降幅,植株体内的金属总含量增加,同时U和Cd对植株的毒理机制不同,共存时造成双重毒害[34-35]。
叶绿素是进行光合作用的重要色素,其含量可反映光合作用的效能。本研究中在单一U胁迫和U+Cd复合胁迫下萝卜幼苗叶片叶绿素a和类胡萝卜素含量显著降低,这将明显影响到叶片的光能利用效率,与前人对水芹[24]和蚕豆[36]的研究结果相似。同时,本研究中U、Cd胁迫处理萝卜叶片Pn、Tr和Gs均显著降低,光合作用受到显著抑制,可溶性糖积累显著减少,这与前人报道的U对黑麦草和黄秋葵光合作用的影响相似[14,16]。影响植物Pn的因素众多,若Ci伴随气孔的关闭而降低,则Pn的限制因素为气孔因素,否则为光能吸收、能量转化和电子传递等非气孔因素[37]。本研究结果显示,萝卜幼苗叶片Gs降低的同时Ci呈升高趋势,表明U、Cd胁迫下萝卜Pn的主要限制因素均为非气孔因素[38]。
叶绿素荧光参数可进一步反映叶片PSⅡ受损程度。在受到逆境胁迫时,植物叶片气孔关闭会导致CO2供应不足,植物通过加强交替氧化酶呼吸途径耗散过剩光能,从而保护光合器官[39]。在本研究中U胁迫处理后,萝卜叶片光化学淬灭减弱而非光化学淬灭加强,说明萝卜幼苗通过调整光能分配(增强热耗散)以保护光合系统,这与Rd升高的结果相吻合。同时,本研究中U胁迫处理组萝卜叶片ΦPSⅡ和AQY显著下降,表明叶绿素a含量的降低影响了叶片的光能利用效率。热耗散的增加和光能利用效率的降低最终导致PSⅡ的电子传递速率下降,用于暗反应的能量减少,这可能是U胁迫引起萝卜光合作用减弱的主要原因,与贾文甫等[16]对黄秋葵的研究结果相似。另外,本研究中单一Cd胁迫处理对萝卜叶片叶绿素荧光无显著影响,说明该浓度Cd处理下PSⅡ受损程度较小,推测主要原因是分布于叶绿体中的Cd含量未超出PSⅡ的耐受限度[40]。
综上所述,在单一和复合胁迫下,U、Cd均主要分布在萝卜根部,对幼苗生长和根系活力造成显著抑制。Cd伴生时萝卜对U的吸收增强,而对Cd的吸收减弱,植株受到的毒害更大。因此,对萝卜的毒害作用表现为U+Cd复合处理>单一U处理>单一Cd处理。U、Cd胁迫下萝卜光合作用的主要限制因素均为非气孔因素;在U胁迫下,萝卜通过增强热耗散来保护光合结构,但叶绿素a含量减少,叶片的光能利用效率降低,最终导致光合作用受阻;Cd对PSⅡ的影响较小,但Cd伴生加剧了U对光合作用的抑制。总之,U是影响萝卜幼苗生长和光合作用的主要因素,Cd的伴生会提高植物对U的吸收效率,但植株受到的毒害更大。
