全局转录机器工程调控微生物代谢的应用进展
2022-04-18田鑫戴健欣田园王光强艾连中熊智强
田鑫,戴健欣,田园,王光强,艾连中,熊智强
(上海理工大学 健康科学与工程学院,上海食品微生物工程研究中心,上海,200093)
微生物精细调节自身转录翻译和复杂代谢网络,而在全局水平扰动其转录调控,可有效引起多基因协同调控效应。σ因子和全局转录因子作为微生物改造中极其重要的工程靶标,与多个协同因子共同维持细胞碳氮代谢和抗逆性等生理功能,突变后将显著影响下游众多基因的表达。因此,全局转录机器工程(global transcription machinery engineering,gTME)通过对全局转录因子改造,建立转录因子基因突变文库,精准筛选以获得满足需要的超能细胞株,有效提高细胞代谢活力[1]。但高效特异性进化手段与灵敏快速的高通量方法是gTME主要限制环节。本文主要从gTME分子机制和应用方向展开综述,介绍与gTME相配合的改造技术和筛选策略,以期为微生物代谢改造提供参考。
1 gTME作用机制
原核生物RNA聚合酶(RNA polymerase,RNAP)由α2ββ’ω核心酶和σ亚基构成,σ亚基识别启动子-35和-10区开启转录,负责所有基因转录起始延伸和终止。gTME通过改造σ亚基引起大量调控基因转录水平波动,进而全局水平上影响细胞蛋白表达[2]。其中σ70家族指导参与应激反应和细胞生长的基因转录,RpoD、RpoS、RpoE、RpoN、RpoH、RpoF和FecI等σ70因子协同全局转录因子(如CRP、ArcAB、H-NS、FNR、FIS、LRP和IHF)构成gTME主调控网络,有激活和抑制转录的双重调节作用[3](图1)。RpoD和RpoS调节1 000多个基因,具有控制转录开关、协同调控多个分类功能转录因子的能力,结合gTME改良细胞生长和稳定期压力等表型[4]。CRP、ArcAB和H-NS分别负责不同功能群基因表达,参与稳定期生长和应答反应的基因转录。CRP调控分解代谢,由环磷酸腺苷(cyclic adenosine monophosphate,cAMP)形成复合体激活启动子区域间蛋白质-蛋白质和蛋白质-DNA之间相互作用,影响95%受体蛋白表达,被广泛用于gTME改良微生物渗透压和氧化应激等方面。BASAK等[5]采用gTME改造大肠杆菌CRP,通过2.0 mmol/L H2O2富集筛选得出高耐受菌株OM3,相比野生型(不生长)生长速率提高到0.6/h,氧化耐受性提高36.84%。提高机理是CRP突变体与启动子结合作用发生变化,使其转录水平增加8.9倍,同时RpoS和OxyR(氧化还原敏感调节因子)转录水平提高至7.76倍和3.48倍,共同加强OM3菌株氧化应激能力。H-NS是一种15.5 kDa的类核相关蛋白,生成的Hha-H-NS复合物调节操纵子特定序列和162个基因。GAO等[6]采用过表达和敲除建立大肠杆菌H-NS与耐酸性相关性,再利用gTME改造H-NS,耐酸性提高100倍。其中谷氨酸和谷氨酰胺依赖的耐酸系统中ybaS、ybaT和gadA显著上调,证实H-NS可激活和调控多个耐酸系统提高耐酸性。ArcAB调节厌氧呼吸蛋白,控制氧化还原相关基因表达。CABEZAS等[7]依靠gTME改造ArcA,得到突变株Arc-D54,相比野生菌株在NaClO氧化应激下耐受性提高7倍,使ArcA下游基因(acrB,tdcB,fadB和cyoE)激活,但arcA敲除菌株不生长,表明ArcA显著提高沙门氏菌抵抗NaClO氧化应激的能力。
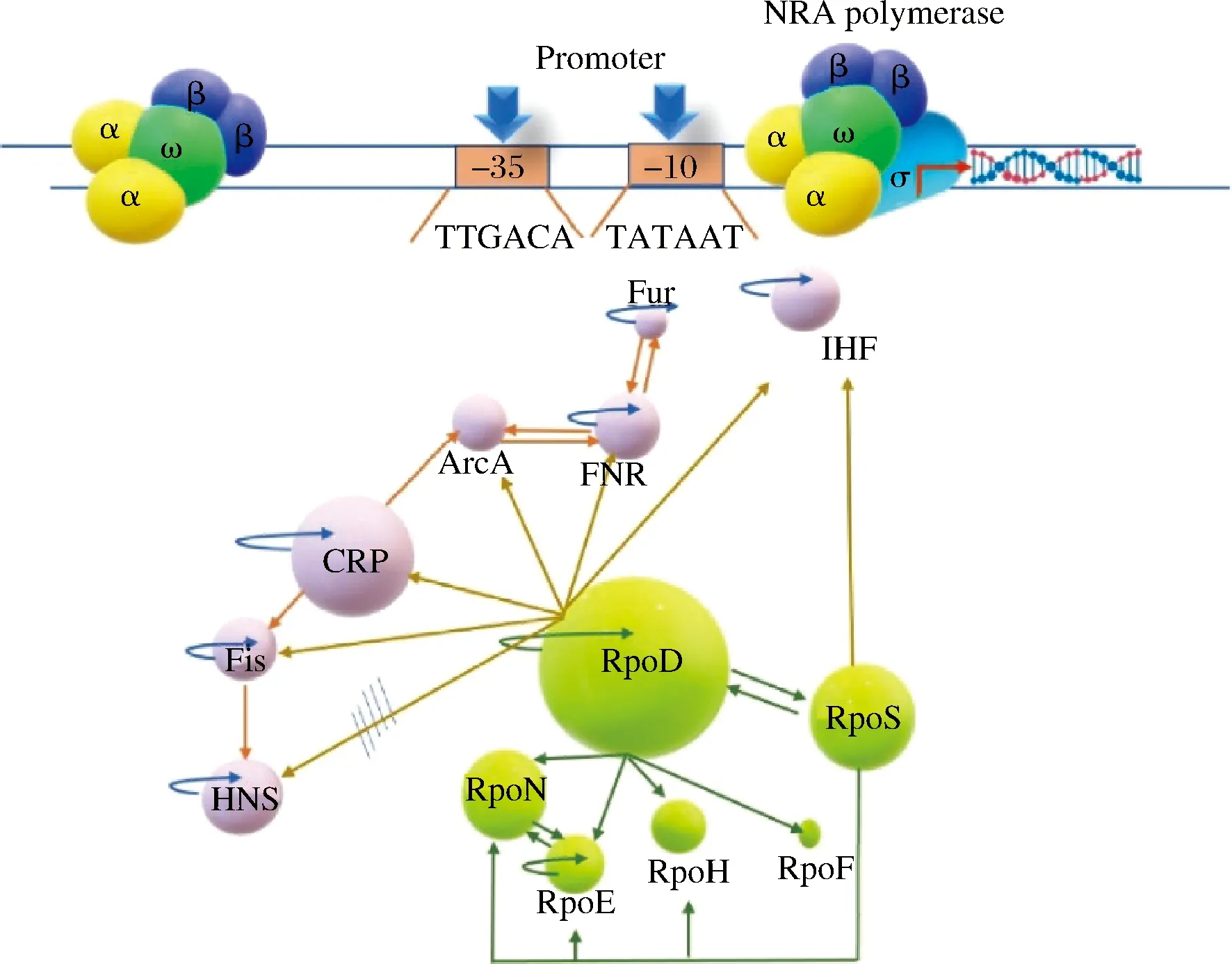
图1 RNA聚合酶与主调控网络(全局转录因子和sigma因子)Fig.1 RNA polymerase and master regulatory network(global transcription factor and sigma factor)注:圆大小与调控基因数量相关,箭头反应表达方向
真核生物中Spt蛋白是转录起始辅助因子Spt-Ada-Gcn5-乙酰转移酶复合体(Spt-Ada-Gcn5-acetyltransferase,SAGA)的组成部分,调节染色质TATA结合蛋白(TATA binding protein,TBP)启动子结合,与RNA聚合酶Ⅱ及十几种转录因子完成基因组mRNA转录。Spt15是TFIID(转录起始因子)的亚基,是RNA聚合酶Ⅱ和Ⅲ的组成成分,结合TBP激活转录。通过gTME构建Spt15文库操纵酵母TFIID组分引起转录子多基因重排,使RNAⅡ转录谱偏好变化,得到一株实现葡萄糖和木糖共发酵的酿酒酵母,木糖利用率达98.9%,而出发菌株不能利用木糖,此研究丰富了gTME在真核细胞中适用性[8]。人工转录因子(artifical transcription factor,ATF)通常由一种转录调控因子DNA结合域和另一种转录调控因子效应域融合形成的调控蛋白。gTME采用随机组装不同类型的锌指蛋白(zinc finger proteins,ZFs)与CRP效应域构建ATF文库,展现高度特异性和特征性,筛选得到的大肠杆菌MG1655突变株耐热性增加并可耐受1.5%丁醇。总之,σ因子、全局转录因子和人工转录因子都在gTME中展现出强序列特异性和作用效果[9]。
2 gTME在应变工程中的应用
提高微生物抗逆性是gTME的重要应用,转录因子促进或抑制RNAP,差异化调节编码蛋白质表达,在应变过程能显著提高抵抗有机溶剂、高糖、高温和强渗透压等极端环境(表1)的能力。以大肠杆菌为例,RpoD和RpoS分别调控细胞对数期和稳定期与压力响应相关基因的转录,全局转录因子CRP通过调节RpoS表达,间接调控细胞应激能力。ALPER等[10]采用gTME对大肠杆菌RpoD进行三轮突变,分离出突变株对乙醇有强耐受性,在70 g/L乙醇中能保持6 h倍增时间(对照不生长)。rpoD突变造成groEL和htpG等乙醇胁迫相关基因显著上调。CHONG等[11]揭示全局转录因子CRP对提高大肠杆菌乙酸和甲苯耐受性有显著功效,采取gTME获得最优菌株A2的CRP氨基酸序列第138位点天冬氨酸替换成酪氨酸,影响CRP的DNA结合亲和力,A2乙酸耐受性提高5倍,微阵列分析耐酸相关基因yfid、pflb和gadA表达水平上升,从而抑制细胞内酸化。另外,利用gTME构建CRP突变文库调控有机溶剂耐受性,得到的大肠杆菌在0.23%甲苯中比生长速度达到0.51/h(对照无生长),对突变株测序分析CRP第136位苯丙氨酸替换为异亮氨酸导致β发夹结构改变,影响CRP调控基因转录水平,导致耐有机溶剂相关基因arcAB和rpoS转录水平提高,促进甲苯排出细胞[12]。
相比细胞展示技术、单基因敲除等传统方法,gTME提高酵母抗逆性的优势在于无需将融合蛋白定位宿主表面,改造表型广泛且效率更高[13]。gTME诱导真核细胞强化抗逆性方法主要包括:(1)构建Spt或Taf突变库,Spt亚基和Taf蛋白与编码乙醇脱氢酶Ⅱ复合物功能相关。ALPER等[14]构建Spt15和Taf25的gTME文库改良酿酒酵母乙醇耐受性和产量,筛选出突变株spt15p-100可耐受20%乙醇,乙醇产率增加到2 g/(L·h),而对照组仅为1.2 g/(L·h)。突变株在转录水平上数百基因差异表达,对高表达的12个基因进行单独过表达和敲除,均未能达到gTME作用效果,表明细胞耐受性提高为多基因共同调控的结果。(2)通过下游基因结构性刺激提高有机溶剂耐受性。如酵母中Pdr1p(多药耐药转运蛋白基因)不参与有机溶剂胁迫的反应,但由gTME修饰Pdr1p,使其在821位点由丝氨酸突变为精氨酸,下游编码ABC转运蛋白基因pdr10、pdr15、snq2和yor1等6个编码细胞壁蛋白的基因显著上调,正壬烷耐受性提高23%,gTME改造效果明显优于单独过量表达ABC转运蛋白。因此,gTME通过修饰转录因子调控多个基因是提高酵母抗逆性的有效策略[15]。
3 gTME在代谢调控中的应用
gTME有强定向性,能高效生产各种代谢产物和缩短改造周期(表1)。MCKENNA等[16]利用gTME技术构建RpoD文库筛选高效表达抗体的大肠杆菌,改造后RpoD仅包含第4区567-613氨基酸组成的截短体。在突变株基础上过表达促进蛋白质折叠和组装基因DsbA、DsbC和FkpA,得到最高抗体滴度达130.7 mg/L,效价比出发菌株提高13倍。gTME应用在改善微生物糖酸转化率,如YU等[17]构建大肠杆菌RpoD和RpoS的随机突变库,其中rpoD突变株D72透明质酸产量最高,相比对照组提高35%。而单独rpoD和rpoS过表达菌株产量增长不明显,证明gTME技术可促进透明质酸积累。周筱飞等[18]通过gTME改造sigA,筛选出高产L-异亮氨酸的黄色短杆菌ART-1,产量达24.1 g/L,比出发菌株提高33.9%。目前gTME积累有益突变是非线性函数优化最快速基因改造方式之一,已成为提高底物消耗或积累能力、激活合成目标产物的高效方法。
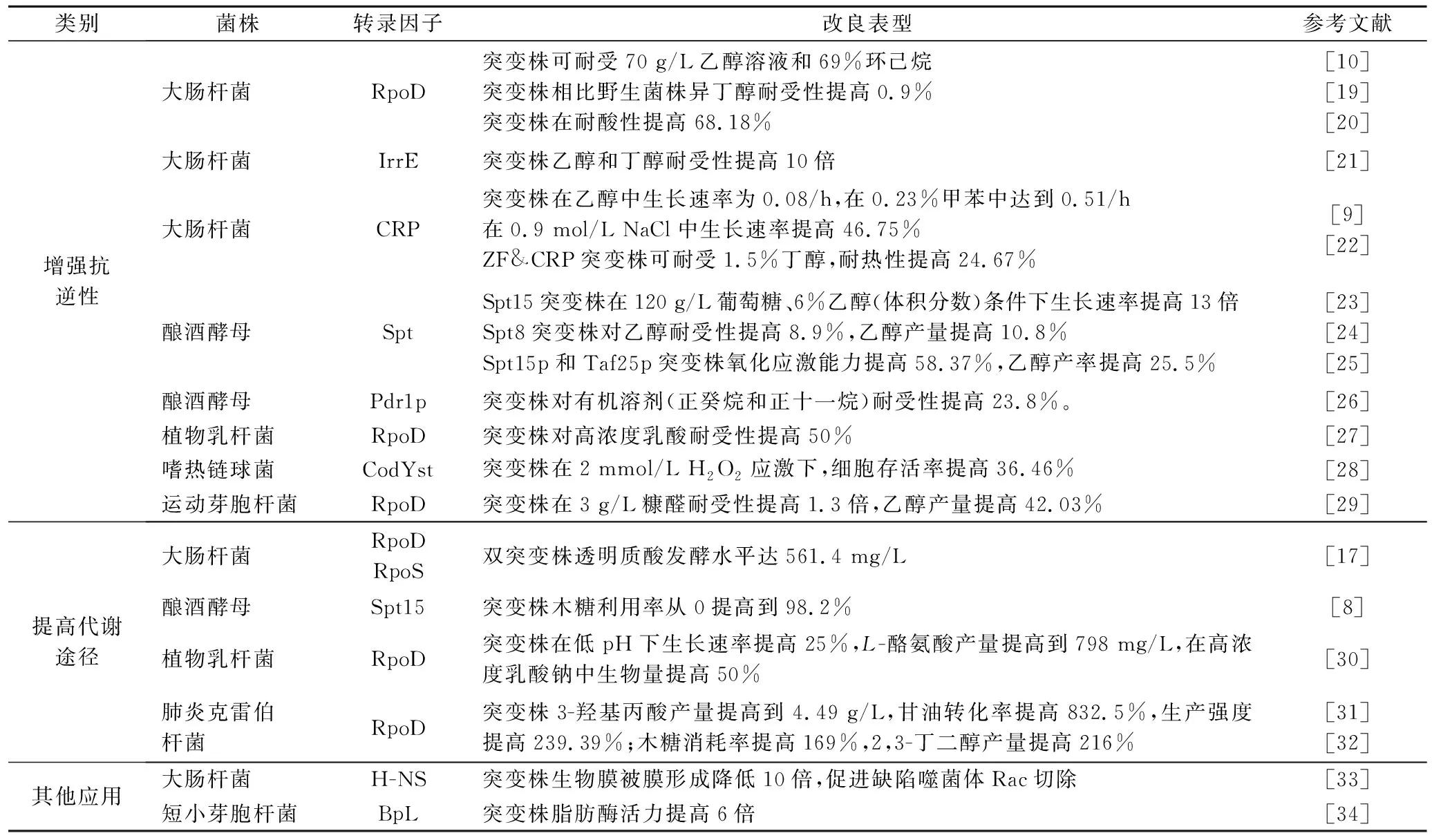
表1 gTME提高工业微生物代谢的应用Table 1 Application of gTME in improving industrial microbial metabolism
4 gTME中定向进化和高通量筛选的应用
gTME可通过体外随机突变技术引入遗传多样性,改进目标性能(表2)。例如,易错PCR和DNA改组对σ因子和全局转录因子进行碱基突变或DNA片段重组,操作简单且不需要深入了解序列和结构。随机片段交换法(random insertional strand exchange mutagenesis,RAISE)将目标基因破碎、添加随机短序列和重新组装,可汇集多种突变形式,丰富gTME文库种类。GAO等[20]利用RAISE技术对大肠杆菌rpoD随机突变,将末端脱氧核苷酸转移酶随机添加到rpoD的3’末端,进行重新组装生成突变文库。采用低pH值脉冲对104液体突变库进行表型筛选,最强耐酸菌株在pH=4条件下生长速率可提高2.8倍。可调基因间隔区(tunable intergenic regions,TIGRs)是指基因与基因间的一段非编码序列,通过在全局因子σ70后插入TIGRs实现gTME改造,改变转录终止、mRNA稳定性和翻译起始过程,增强甲羟戊酸代谢途径上游atoB、hMGS和tHMGR等多个基因的表达转录,使甲羟戊酸产量增加了7倍[35]。随着CRISPR/Cas介导的EvlovR、CRISPR-X和CasPER等新型进化技术出现,gTME改造可以同时靶向多个sgRNA诱发基因组位点突变,实现多重基因组工程,完成高效定向进化。HALPERIN等[36]使用EvolvR靶向进化rspE和rspL(核糖体蛋白亚基),与野生型相比全局突变率提高223倍,在20 mg/mL 壮观霉素抗性下菌株数量提高16 000倍,显著提高大肠杆菌耐药性。因此,gTME可通过多种策略扩大目标突变范围,提高微生物的定向进化能力。

表2 gTME改造方法Table 2 gTME modification methods
gTME应用局限主要为筛选难度和分析成本,实现gTME高通量筛选可以在满足遗传多样性的同时,实现高效大规模筛选(图2)。gTME的高通量筛选分为三类:(1)gTME改造可标记表型,根据琼脂平板水解圈、抑制圈的大小及菌落形态等表型对乙醇和乳酸等耐受程度进行快速筛选。YIN等[37]利用gTME改造黄色短杆菌中σ因子编码基因sigA,将突变文库涂布营养缺陷平板,根据菌落生长圈直径大小推断异亮氨酸产量高低,筛选出突变株BF3的L-异亮氨酸产量达4.5 g/L,比出发菌株提高60%。(2)gTME改造代谢产量,通过测定可见光谱或荧光光谱吸光值对代谢产物实现快速检测。HUANG等[38]利用gTME改造大肠杆菌CRP,用酶标仪测定472 nm处吸光值定量番茄红素产量,24 h完成105文库筛选,获得的高产菌株MT-1番茄红素产量达到18.49 mg/g DCW。CHOI等[39]利用gTME改造σ70因子筛选高产3-羟基丁酸脂(poly-3-hydroxybutyrate,PHB)菌株,采用尼罗红作为亲脂荧光染料与PHB结合产生荧光,通过荧光强度反映细胞PHB产量,对5×105文库高效率筛选得到最优菌株M54,PHB产量比出发菌株提高2.5倍。(3)gTME使用荧光生物传感器将生物表型信号转化为荧光信号,实现基因型和表型关联。ZHANG等[40]采用改造NCgl0581(L-丝氨酸特异性转录因子)和黄色荧光蛋白相融合,构建生物传感器质粒导入大肠杆菌生成gTME文库,采用流式细胞仪进行荧光分选,以每秒数千次分辨速度完成1.2×105文库筛选,筛选到的A36-pDser菌株可积累34.78 g/L丝氨酸,比出发菌株提高66.7%。此外,分子克隆和微生物筛选自动化平台和工作站等高新技术设备使高通量筛选更加快捷高效,进一步拓展gTME工业应用。

图2 gTME筛选流程Fig.2 Screening process of gTME
5 结论
gTME在微生物改造中具有广阔的应用前景,可显著扩大遗传和性状多样性。本文主要介绍gTME全局调控机制,结合定向进化和高通量筛选实现在应变工程和代谢途径中应用。在传统基因工程技术中,受到载体构建和转化效率等条件的限制,无法同时在多个基因位点进行改造,且对多基因控制表型的作用有限,而gTME在多基因控制生物合成和菌株育种等方面显示出强大潜力。随着gTME调控机制的深入研究及定向进化和高通量筛选的快速发展,未来gTME研究方向可以(1)着眼于各项转录因子的具体功能,进一步丰富全局转录调控元件,为利用gTME改善特定表型提供理论基础;(2)深入探索RNAP其他亚基进行gTME研究的可行性,对转录关键环节突变产生更加宽泛的全局扰动;(3)拓展多策略组合的改造方式,精准高效筛选出各种理想表型和生理特性的菌株;(4)结合生物信息学、计算生物学和蛋白质功能结构等方法,完善gTME技术体系,提高目标产物的生产效率;(5)完善基因编辑定向改造工具和高通量技术,快速优化特定表型。在此基础上,进一步阐明细胞代谢网络的分子机制、稳定性和相互作用关系,为gTME在食品与发酵工业应用提供新思路。