超高效液相色谱-串联质谱法测定牛奶中氮氨菲啶残留量不确定度评定
2022-04-18张艳芳吕耀龙李照白荣国
张艳芳,吕耀龙*,李照,白荣国
1(内蒙古农业大学 职业技术学院,内蒙古 包头,014109)2(内蒙古蒙牛乳业(集团)股份有限公司,内蒙古 呼和浩特,011517)
氮氨菲啶(isometamidium,ISM)是由一组复合的异构体构成[1-2],是一种长效抗锥虫药,通过抑制锥虫DNA和RNA聚合酶,阻碍核酸的合成[3],作为预防和治疗化学药物被广泛应用于牛羊等动物寄生虫病的防治,同时也可对动物睡眠病进行预防和治疗[4-6]。然而,氮氨菲啶作为牛羊动物寄生虫防治药物的同时,也伴随着有致癌、致畸形和致突变等副作用[7]。滥用防治药物对动物本身造成影响的同时,残留物在动物性食品中对人类健康造成潜在的危害。
测量结果的不确定度可以保证检测结果更加准确,同时,不确定度评价也可以判定测量结果质量的高低,与检验结果的合格判定相关[8-10]。目前牛奶中氮氨菲啶含量的测定大多采用高效液相色谱法、高效液相色谱-串联质谱法等,而采用超高效液相色谱-串联质谱法测定结果的不确定度评定较少。本实验参照JJF 1059.1—2012《测量不确定度评定与表示》和JJF 1135—2005《化学分析测量不确定度评定》,按照GB 31660.8—2019《牛可食性组织及牛奶中氮氨菲啶残留量的测定 液相色谱-串联质谱法》中规定的检测方法,评定牛奶中氮氨菲啶药物的残留检测结果不确定度,为实验室检测质量控制提供科学依据的同时,也为测量其他兽药残留量不确定度提供参考。
1 材料与方法
1.1 材料、仪器
1.1.1 材料
牛奶,市售;氮氨菲啶,纯度98%,坛默质检标准物质中心;甲醇(色谱纯),正己烷(色谱纯),福晨(天津)化学试剂有限公司。
1.1.2 仪器设备
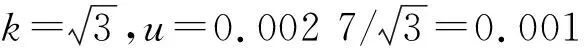
1.2 实验方法
1.2.1 样品制备
准确称取5 g牛奶试样(精确到0.01 g)于50 mL的离心管中,加入20 mL提取液盖好混匀,放于振荡器上300 r/min振荡10 min,以10 000 r/min离心5 min,将上层溶液用滤纸过滤于鸡心瓶,残渣再用20 mL提取液超声提取10 min,以10 000 r/min离心5 min,将上层溶液用滤纸过滤,合并2次滤液,于<40 ℃条件下旋转蒸发至近干(约剩余2 mL以下),剩余液转移至10 mL具塞刻度离心管中,用甲醇洗涤鸡心瓶,合并溶液用甲醇定容至5.00 mL,漩涡混匀1 min,然后加入5 mL饱和了80%甲醇水的正己烷溶液,旋涡混匀1 min,以3 000 r/min离心3 min,弃去上层正己烷,再加入5 mL饱和了80%甲醇水的正己烷溶液,漩涡混匀1 min,以3 000 r/min离心3 min,取下层溶液过0.2 μm滤膜,供液相色谱-串联质谱测定。
1.2.2 液相色谱条件
A相:甲醇;B相:0.1%甲酸水;流速0.4 mL/min;柱温35 ℃,其他参数见表1。
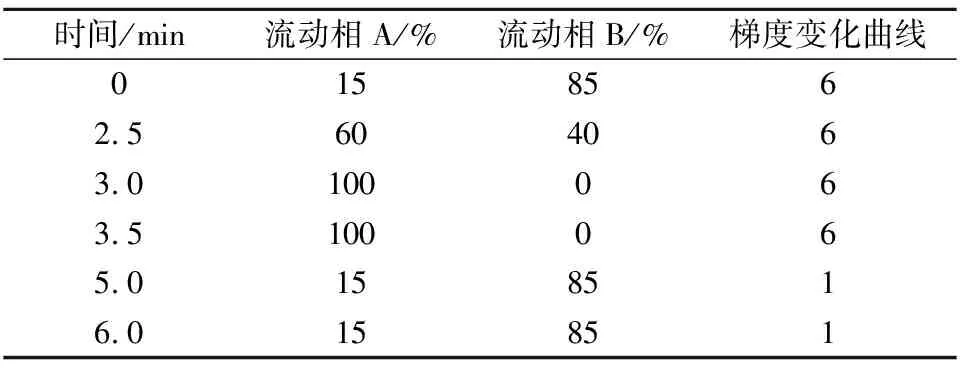
表1 梯度洗脱参考条件Table 1 Reference conditions of gradient elution
1.2.3 质谱条件
选择ESI离子源正离子扫描模式,离子源温度110 ℃,电源电压2.8 kV,雾化温度350 ℃,锥孔气流速50 L/h,雾化气流速550 L/h,驻留时间0.3 s,多反应检测(multiple reaction monitoring,MRM)采集参数见表2。

表2 氮氨菲啶的质谱采集参数Table 2 Acquisition parameters of isometamidium for UPLC-MS/MS
1.2.4 测量样品
样品经过净化浓缩后用甲醇定容至5.00 mL,经0.22 μm有机相滤膜过滤于测样瓶,将样品导入检测器中,其峰面积与氮氨菲啶浓度成正比。
1.2.5 标样制备
用1 mL刻度吸管吸取1 mL氮氨菲啶标准储备液,置于100 mL A级容量瓶中,用甲醇定容至刻度,制成1 μg/mL氮氨菲啶标准工作溶液。再用100 μL移液器准确吸取100 μL氮氨菲啶标准工作液,置于10 mL A级容量瓶中,用阴性样品基质定容至刻度,制成10 ng/mL氮氨菲啶基质标准工作溶液。
1.2.6 试样分析
校准曲线取7个点,每个浓度点进样2次,以响应值的峰面积对样品浓度绘制工作曲线,外标法定量。2次空白对照试验,并计算均值。
1.2.7 实验条件、引用数据
室温下进行本实验,氮氨菲啶加标回收率(83.2%~100%)。
1.2.8 数学模型的建立
(1)
式中:X,试样中被测组分残留量,mg/kg;ρ,被测组分的溶液质量浓度,μg/mL;V,样品溶液定容体积,mL;m,样品溶液所代表试样质量,g;F,换算系数,牛奶F=1;计算结果扣除空白值。
1.2.9 样品的标准不确定度(uncertainty,u)来源
根据试验检测的步骤和建立的数学模型,超高效液相色谱-串联质谱法测定牛奶中氮氨菲啶残留量标准不确定度主要有以下几个方面:(1)氮氨菲啶进样浓度标准不确定度u0;(2)测量重复性的标准不确定度u1;(3)V(样品定容体积)的标准不确定度u2;(4)质量的标准不确定度u3;(5)氮氨菲啶标准储备液的标准不确定度u4;(6)超高效液相色谱-串联质谱的不确定度u5;(7)取样引入的标准不确定度u6;(8)实验回收率引入的标准不确定度u7。
2 结果与分析
2.1 不确定度的评定
2.1.1 氮氨菲啶进样浓度标准不确定度u0
制备7个不同质量浓度氮氨菲啶标准溶液,每个浓度测定1次,得到相应的峰面积A,用最小二乘法拟合,得到拟合曲线方程A=a+b×ρ=621 026.2×ρ-140.9;r=0.999,如表3所示。
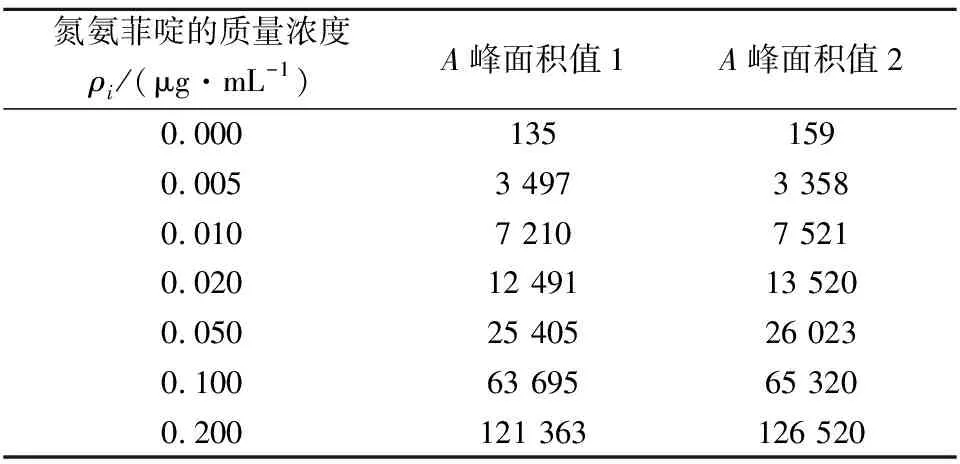
表3 不同浓度测得峰面积Table 3 Peak areas under different concentration of ISM
平行取2份样品测定,所得的峰面积为11 133和10 633。利用拟合曲线校准的测定液氮氨菲啶含量分别为0.018 2和0.017 4 μg/mL,平均值为0.017 8 μg/mL。
(2)
平行测定的测定液浓度确定时的不确定度包含3个分量:定容的刻度离心管引入的标准不确定度、校准直线引入的不确定度、标准溶液在20 ℃的环境条件下引入的不确定度。
2.1.1.1 刻度离心管引入的标准不确定度
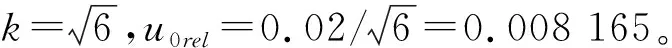
2.1.1.2 校准直线引入的不确定度
由于拟合曲线本身具有一定的不确定性,用拟合直线计算测定液的浓度所引入的标准不确定度按公式(3)计算:
(3)
式中残余标准偏差按公式(4)计算:
(4)
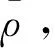

2.1.1.3 温度的变动引起标准溶液的不确定度
给出氮氨菲啶标准溶液在20 ℃时的浓度,实验室温度变化±5 ℃之间不需要温度修正。甲醇体积膨胀系数1.1×10-3/℃,假设均匀分布,由温度变化引起的标准溶液浓度相对不确定度按公式(5)计算:
(5)
显然,氮氨菲啶进样浓度标准不确定度应由以上3个分量合成计算,按公式(6)所示:
(6)
2.1.2 测量重复性的标准不确定度u1
重复性条件下,对样品进行10次测量,测量结果如表4,其平均值为0.017 7。

表4 重复性条件下10次加标样品测量数据 单位:mg/kg

2.1.3 样品定容体积(V)标准不确定度u2
定容体积引入不确定度分量有:所用定容体积的量器、定容溶液随温度变化的影响。
2.1.3.1 所用定容体积不确定度
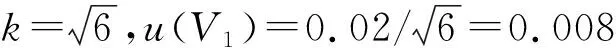
2.1.3.2 温度的影响
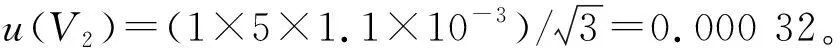
2.1.4 质量的标准不确定度u3
2.1.5 氮氨菲啶标准储备液标准不确定度u4
氮氨菲啶标准储备液扩展不确定度是0.5%,k=3,u4=0.005/3=0.001 67,那么u4rel=0.001 6/100=0.000 016。
2.1.6 超高效液相色谱-串联质谱仪不确定度u5
由超高效液相色谱—串联质谱仪引起的分量不确定度u5=4.8%,k=3,那么u5rel=0.048/3=0.016。
2.1.7 取样引入的标准不确定度u6
GB/T 22974—2008牛奶和奶粉中氮氨菲啶残留量的测定,将牛奶随机取样,可认为样品均匀,取样的不确定度可忽略。
2.1.8 回收率引入的标准不确定度u7
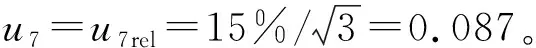
2.2 合成标准不确定度uc(y)
氮氨菲啶的相对不确定度分量表如表5,假如不考虑各不确定度相关性,其合成不确定度按式(7)计算,结果为0.003 9 mg/kg。
uc(y)=0.017 8×0.218=0.003 9 mg/kg
(7)
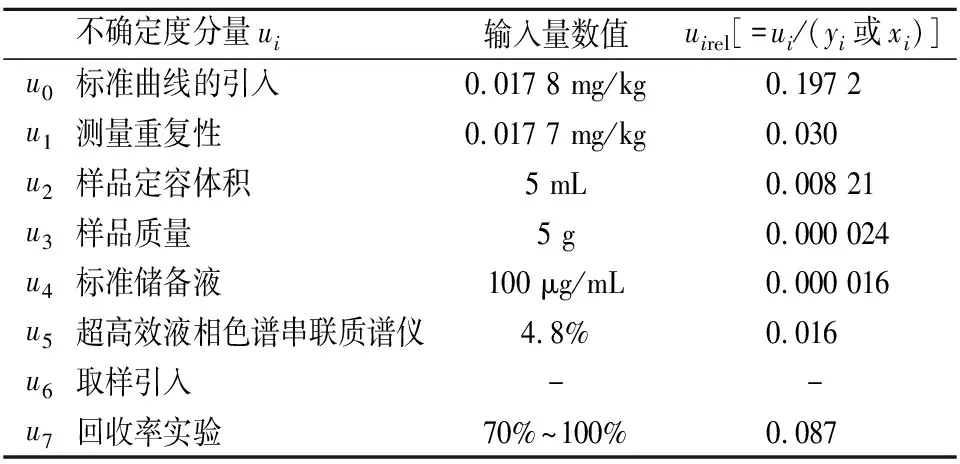
表5 各不确定度分量值Table 5 Values of each uncertainty component
2.3 扩展不确定度(U)及结果表示
根据CNAS-GL006:2018《化学分析中不确定度的评估指南》,取k=2时,扩展不确定度U=k×uc(y)=2×0.003 9=0.007 8 mg/kg。测量结果为:y=0.017 8 mg/kg,U=0.007 8 mg/kg,k=2。
3 结论
在市售牛奶样品氮氨菲啶残留量检测过程中,校准曲线的拟合、标准溶液的配制、超高效液相色谱串联质谱、实验回收率引入等各过程都会引入测量的不确定度。本实验综合各因素考虑,发现在测定牛奶中氮氨菲啶残留量检测过程中,标准曲线引入的不确定度最大,其次是回收率实验,标准储备液引入的不确定度最小,取样引入的不确定度可忽略不计。因此,在实验过程中,需要实验操作人员适当增加试验的平行次数以及准确加标回收率试验,定期维护检测仪器的性能,使其有较高的灵敏度和精密度,做好仪器期间核查和校准检定,减少因仪器引入的不确定度,提高检测结果的准确度。