秦岭中蜂蜂蜜酚类提取物的鉴定及其抑菌活性研究
2022-04-18王银刘彩玲苟心怡岳田利曹炜
王银,刘彩玲,苟心怡,岳田利,曹炜
(西北大学 食品科学与工程学院,陕西 西安,710069)
中蜂蜂蜜(Apisceranahoney)为我国蜜蜂品种“中华蜜蜂”所酿花蜜,较单花意蜂蜂蜜具有更高的药用价值及生物活性,被广泛地应用于我国传统中医药中。酚类化合物是蜂蜜中最主要抑菌成分之一,其物质组成主要受地理位置、蜜源植物影响[1]。陕西省秦岭沿麓具有丰富的药用植被资源,整体花期较长,为中蜂养殖及蜂蜜品质提供了独特的资源条件[2]。虽然国内外对植物酚类提取物抑菌作用做了大量研究,但对秦岭中蜂蜂蜜中酚类物质解析及抑菌作用研究较少。
大肠杆菌(Escherichiacoli)及金黄色葡萄球菌(Staphylococcusaureus)会引起人类肠道及皮肤感染,且极易获得耐药性,我国每年约有40%~65%的食源性疾病爆发由其引起[3]。由于抗生素在畜牧养殖、临床治疗上的过度使用,部分抗生素向食品原料发生迁移,大肠杆菌及金黄色葡萄球菌多重耐药率在20年间提高了近2.5倍,对食品安全、人类临床治疗及畜牧养殖带来巨大的威胁与挑战。
前期研究发现秦岭沿麓中蜂蜂蜜中酚类物质种类较多,但同一地区酚类指纹图谱接近,具有明显的地域代表性[2]。本文拟对秦岭中蜂蜂蜜理化性质,酚类提取物组分及抑菌作用进行进一步分析,为秦岭中蜂蜂蜜酚类物质抑菌机制研究提供理论基础,同时为高品质中蜂蜂蜜的资源开发及药理研究提供科学理论依据。
1 材料与方法
1.1 材料和试剂
秦岭中蜂蜂蜜,陕西省略阳县森林人家养殖农民专业合作社;枣花蜜,老蜂农;标准质控菌S.aureusATCC 29213、E.coliATCC 25922,均为本实验室保存;甲醇(HPLC级),默克公司;甲醇、乙腈、乙酸铵、氨水,LC-MS级,CNW Technologies公司。
1.2 仪器与设备
Vanquish超高效液相色谱仪、Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm)液相色谱柱、Thermo Q Exactive HFX质谱仪,Thermo Fisher Scientific公司;Infinite M200Pro酶标仪,瑞士TECAN;Carl Zeiss冷场发射扫描电镜,美国SIGMA。
1.3 实验方法
1.3.1 中蜂蜂蜜的理化指标
理化指标:pH、水分含量、葡萄糖含量、果糖含量、蔗糖含量、淀粉酶活性测定参考《进出口蜂蜜检验规程》(SN/T 0852—2012)。
总酚酸及总黄酮提取测定参照WANG等[4]的方法。
1.3.2 提取物超高效液相色谱串联四极杆串联轨道离子阱质谱(UHPLC-QE-MS)组分测定
色谱条件:采用Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm)液相色谱柱。液相色谱A相为5 mmol/L乙酸铵水溶液,B相为乙腈。采用梯度洗脱:0 min,1% B;1 min,1% B;7~8 min,99% B;8~9 min,99% B;9~9.1 min,40%~95% B;9.1~12 min,1% B。流动相流速:0.5 mL/min,柱温30 ℃,样品盘温度4 ℃,进样体积3 μL。
原始数据采用R程序包(内核为XCMS)进行峰识别、峰提取、峰对齐和积分等处理,与BiotreeDB(V2.1)自建二级质谱数据库匹配进行物质注释。
1.3.3 牛津杯抑菌试验
将-80 ℃冻存菌株划线接种于LB平板,37 ℃培养18 h后,挑取单克隆接种于20 mL LB肉汤中,37 ℃培养16 h。稀释后取200 μL金黄色葡萄球菌或大肠杆菌菌悬液(106CFU/L)分别涂布于MHA平板,分别取20 μL秦岭中蜂蜂蜜(2.5 mg/mL)及枣花蜜(2.5 mg/mL)酚类提取物加入牛津杯中,并以链霉素为对照,37 ℃培养14 h,用游标卡尺测量抑菌圈直径,每组3次平行,数据以平均值±标准差表示。
1.3.4 最低抑菌浓度(minimum inhibitory concentration,MIC)测定
在无菌96孔板中,分别加入10 μL大肠杆菌或金黄色葡萄球菌菌悬液(105CFU/mL)及酚类提取物,用MHB定容至终质量浓度分别25、12.5、5、2.5、1、0.5 mg/mL,每组3个平行,37 ℃培养18 h。肉眼未见细菌生长的最低浓度即为MIC。
1.3.5 生长曲线
无菌96孔板中,分别加入10 μL大肠杆菌、金黄色葡萄球菌悬浮液(105CFU/mL)。加入酚类提取物,调整终浓度分别为1、1/2、1/4、1/8、1/16 MIC,每组3个平行,37 ℃培养。采用酶标仪每隔1 h测定一次OD600,连续测定12 h。以测定值减去各浓度下0 h的吸光度扣除背景值绘制生长曲线。
1.3.6 细胞形态
用无菌MHB将提取物浓度分别调整至0、1/2、1和2 MIC。取200 μL 108CFU/mL金黄色葡萄球菌或大肠杆菌菌悬液,5 000 r/min离心10 min,去上清液后分别加入500 μL 0、1/2、1、2 MIC提取物,37 ℃培养4 h。5 000 r/min离心10 min,PBS洗涤2次,将细胞重悬于2.5%戊二醛溶液中,-4 ℃固定12 h,离心后分别用30%、50%、70%、80%、90%和100%的乙醇溶液梯度脱水、干燥。真空下喷金,在冷场发射扫描电子显微镜下成像。
2 结果与分析
2.1 中蜂蜂蜜理化指标
秦岭中蜂蜂蜜水分含量为(17.86±0.06)%,远低于马来西亚Kelulut蜂蜜(29.8±0.9)%~(30.42±0.68)%、Tualang蜂蜜(22.96±0.89)%~(24.8±0.36)%[5]及海南无刺蜂蜂蜜(26.3±0.1)%[6],与塞尔维亚的多种单花蜂蜜(15.7%~17.3%)[7]及巴西意蜂蜂蜜(16.2%~20.87%)接近[8]。水分含量与蜂蜜稳定性与储存特性密切相关,不同地区品种蜂蜜含水量差异主要受产区当地气候条件与地理环境影响[7]。秦岭中蜂蜂蜜总糖质量分数为69.78%,其中葡萄糖含量为32.04%,果糖含量36.33%,蔗糖含量1.41%。其葡萄糖及果糖含量明显高于婆罗洲无刺蜂蜂蜜[葡萄糖(14.9±0.7)%~(21.0±1.7)%,果糖(12.01±1.1)%~(19.5±1.3)%][9]。与巴西圣卡塔琳娜州意蜂蜂蜜[8]接近。蜂蜜中糖含量主要与蜜源植物有关,气候条件、来源以及加工和储存条件对其影响较小。淀粉酶是评估蜂蜜新鲜度的重要指标,秦岭中蜂蜂蜜淀粉酶活性值为26.4°Gothe,高于行业标准中优级蜜(8°Gothe)指标。
中蜂蜂蜜总酚酸含量为(377.85±1.33) mg GA/kg。与ZHAO等[2]报道的中蜂蜂蜜平均TPC(408.9 mg GA/kg)及巴西无刺蜂蜂蜜[10](375 mg GA/kg)接近,高于土耳其蜂蜜[11],莫桑比克蜂蜜(106 mg GA/kg)及Tualang蜂蜜[(139.42±13.7)~(183.93±24.1)mg GA/kg][8]。不同地区的总酚酸含量存在明显差异,这与植被分布及气候条件显著相关,日照及植被丰富地区花蜜总酚酸含量明显高于其他地区[10]。
秦岭中蜂蜂蜜总黄酮含量为(109.38±0.05) mg RUE/kg,低于巴西蜂蜜(152.2~304.5 mg RUE/kg)[12]。高于Kelulut蜂蜜[(97.88±10.1)~(101.5±11.4)mg RUE/kg]、Tualang蜂蜜[(64.72±11.4)~(66.98±7.32)mg RUE/kg][5]和巴西无刺蜂蜜[(1.9±0.1)~(4.2±0.6)mg RUE/kg][10]。不同纬度地区总黄酮含量主要受蜜源植物分布影响,同一纬度总黄酮含量则与光照水分,湿度及当地环境有关。本文中总酚酸及总黄酮含量与ZHAO等[2]前期对中蜂蜂蜜相关研究略有差异,可能与样品来自秦岭沿麓不同区县,地理环境与植被分布不同有关。不同地理环境与蜜源植物种类直接决定蜂蜜中酚类物质的种类与含量,而蜂蜜抑菌作用与总酚酸及总黄酮含量呈正相关,二者主要可通过破坏细胞质膜结构,抑制酶活力,降低能量代谢,抑制基因合成等作用抑制细菌生长。同时还会进一步影响细菌黏附、毒力基因、生物膜形成等耐药相关基因表达[13]。
2.2 中蜂蜂蜜酚类提取物的UHPLC-QE-MS分析
UHPLC-QE-MS在正、负离子模式下共表征出40种酚类化合物(表1、表2),其中有3种分别在2种离子模式下均有检出,整体结果负离子模式响应较好。正离子模式下共检出18种酚类化合物,其中酚酸类3种(7、16、17),黄酮类15种(图1、表1)。负离子模式下共检出25种酚类化合物,其中酚酸类9种(2、5、7、9、11、12、15、18、21),黄酮类16种(表2)。本样品中山奈素及山奈酚(表2)相对含量高于前期研究中其他秦岭中蜂蜂蜜提取物。山奈素与山奈酚均广泛的存在于植物中,是蜂胶及蜂蜜中较常见的黄酮醇类化合物,具有良好的抗炎、抗菌、抗氧化、抗肿瘤、降血糖、降血脂、酶抑制活性等功能,被广泛应用于临床治疗及功能性食品开发中[9]。黄酮类物质抑菌主要通过破坏细胞膜及细胞壁结构,使蛋白、核酸及内容物溢出,抑制核酸生物合成、抑制细胞质膜功能、抑制能量代谢[14]。黄酮类化合物可促使细菌抗性基因表达上调,生物合成及能量代谢相关基因下调。虽然山奈素及山奈酚对多种细菌具有抑制作用,但其对革兰氏阳性菌,尤其是金黄色葡萄球菌抑菌作用显著优于革兰氏阴性菌。此类甲基化黄酮类物质可靶向作用于细菌细胞膜,改变其通透性,降低ATP合成能力和膜运输能力,有研究表明其可通过下调RNAIII及Hla蛋白转录抑制金黄色葡萄球菌生长。同时可协同其他黄酮类组分加速细胞裂解,破坏细菌细胞膜通透性抑制细菌生长[15]。实验室在前期对中蜂蜂蜜提取物抑菌作用筛选研究中发现,虽然本样品总酚酸及总黄酮含量略低,但其对金黄色葡萄球菌抑制作用显著优于其他样品。因此推测其良好的革兰氏阳性菌抑制作用可能与高含量的山奈素与山奈酚有关,但此推测仍需进一步实验确定。

续表1
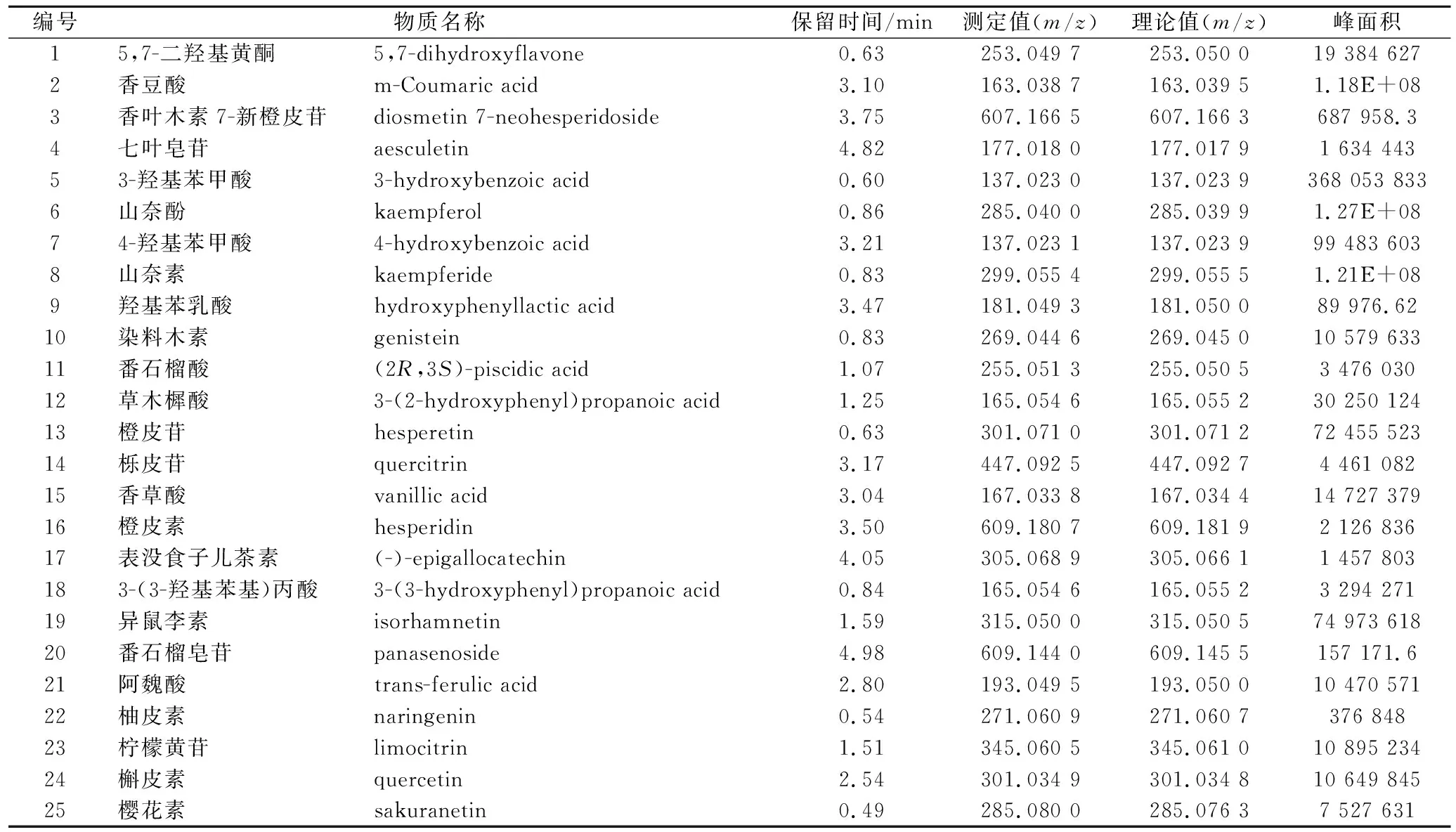
表2 UHPLC-QE-MS负离子模式下秦岭中蜂蜂蜜酚类提取物Table 2 Bioactive components in Qinling A.cerana honey extracts by UHPLC-QE-MS on negative ion mode
2.3 中蜂蜂蜜酚类提取物的抑菌效果
酚类提取物对金黄色葡萄球菌和大肠杆菌的抑菌圈直径大小为链霉素﹥中蜂蜂蜜酚类提取物﹥枣花蜜酚类提取物(表3)。提取物对金黄色葡萄球菌抑菌活性最强,抑菌直径达(14.08±0.14)mm,显著优于枣花蜜提取物(P<0.05)。秦岭中蜂蜂蜜中总黄酮含量(109.38±0.05)mg RUE/kg远高于陕西地区枣花蜜(30.75±10.50)mg RUE/kg,枣花蜜提取物含量较高的代表物质为原儿茶酸、绿原酸及咖啡酸,但黄酮类物质较少[16],而黄酮类物质对革兰氏阳性菌具有显著的抑制作用。因此推测秦岭中蜂蜂蜜提取物中高总黄酮含量可能是其对金黄色葡萄球菌的抑菌作用显著优于枣花蜜提取物的主要影响因素。另一方面,中蜂蜂蜜酚类提取物对革兰氏阳性菌(金黄色葡萄球菌)抑菌效果显著优于革兰氏阴性菌(大肠杆菌)(表3),这与马来西亚无刺蜂蜂蜜[9]和巴西单花蜂蜜[10]研究结果一致。

表3 酚类提取物对金黄色葡萄球菌及大肠杆菌抑菌圈直径 单位:mm
由于酚类物质可通过改变细胞膜通透性、抑制DNA解旋酶活性、螯合金属离子钝化酶活性等方式抑制细菌生长,而革兰氏阴性菌细胞壁外壁层的外膜系统具有渗透屏障作用,可有效抑制酚类物质与细胞作用靶位点的结合,降低其抑菌效果。
2.4 中蜂蜂蜜酚类提取物对金黄色葡萄球菌和大肠杆菌的生长曲线及MIC测定
中蜂蜂蜜酚类提取物对金黄色葡萄球菌及大肠杆菌的MIC分别为2.5、5 mg/mL。其生长曲线如图2所示,抑菌作用随着酚类提取物浓度增高而增强。
当酚类提取物浓度为1/8 MIC时,金黄色葡萄球菌生长对数期出现延缓,但抑制作用不明显,当达到1/2 MIC时,金黄色葡萄球菌对数期延缓1 h,且对数期细菌增长速率显著减缓,当浓度达到1 MIC时,其生长被完全抑制(图2-a)。大肠杆菌在提取物浓度<1/2 MIC时,随着提取物浓度增加其生长曲线均在6 h进入对数期,虽然细菌增长速度放缓,但整体变化不大,当提取物浓度达1 MIC时其生长在12 h内被完全抑制(图2-b)。酚类提取物对金黄色葡萄球菌的生长抑制作用优于大肠杆菌,这可能与金黄色葡萄球菌对渗透效应的敏感性及革兰氏阳性和阴性菌间细胞壁结构差异有关,受脂多糖外膜保护的革兰氏阴性菌更耐受[17]。
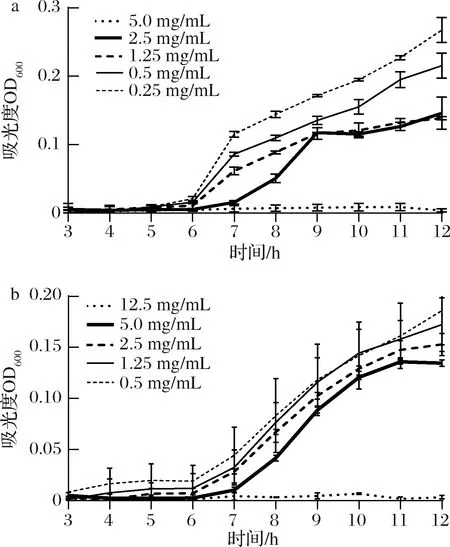
a-金黄色葡萄球菌;b-大肠杆菌图2 秦岭中蜂蜂蜜酚类提取物对金黄色葡萄球菌和大肠杆菌生长曲线抑制作用Fig.2 Growth curves of Qinling A.cerana honey extracts against S.aureus and E.coli
2.5 细胞形态变化
如图3所示,正常的金黄色葡萄球菌形态圆润饱满,在1/2 MIC提取物作用下,细胞表面发生部分破裂及脱落,但仍具有正常细胞形态,在1 MIC作用下,细胞发生破裂,细胞内容物溢出,当浓度达2 MIC时,大部分细胞表面完全坍塌破裂(图3-a)。
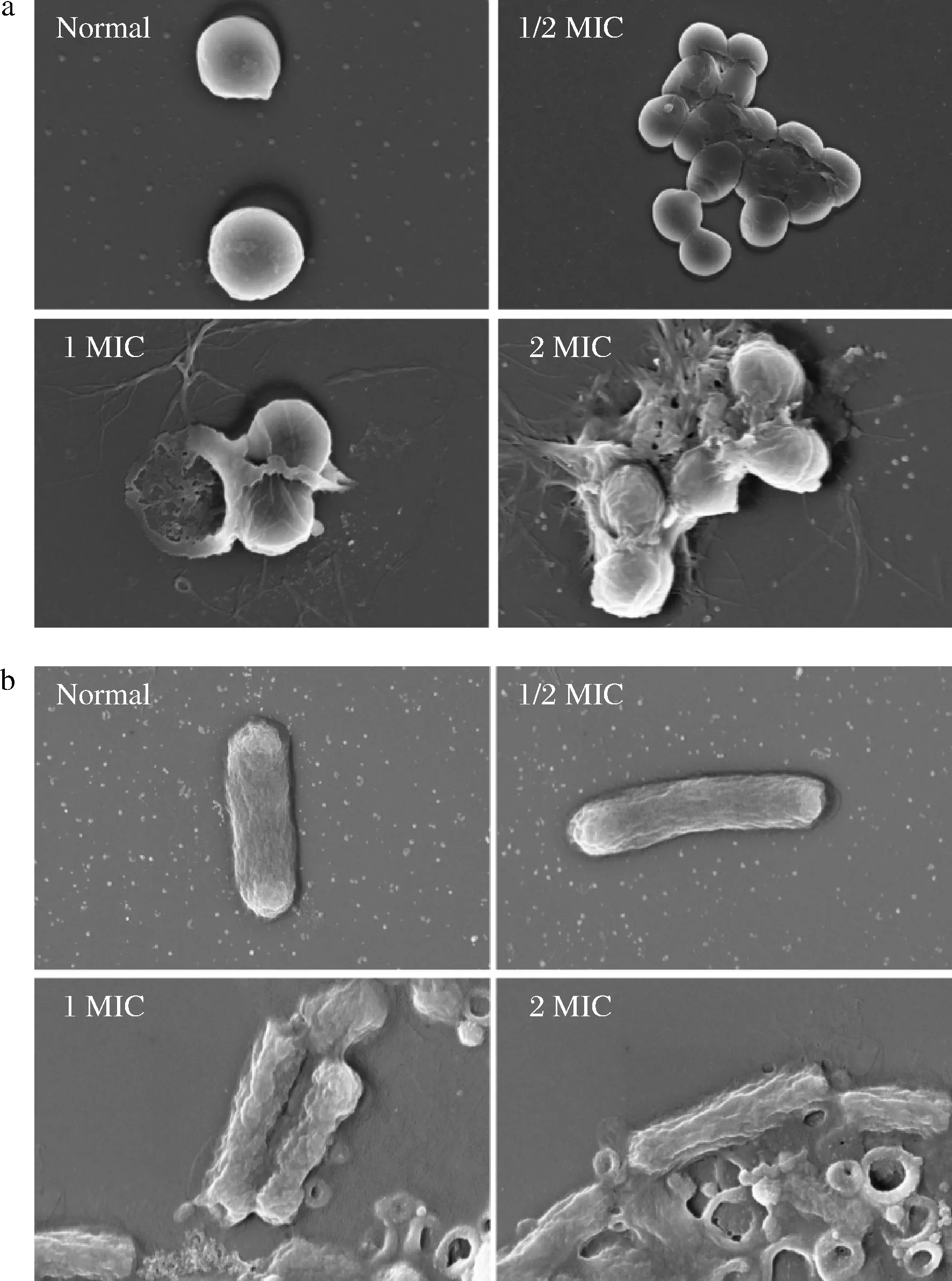
a-金黄色葡萄球菌;b-大肠杆菌图3 酚类提取物对金黄色葡萄球菌及大肠杆菌形态的影响Fig.3 Effects of phenolic extracts against S.aureus and E.coli on cell morphology
大肠杆菌在1 MIC提取物作用下细胞表面发生明显皱缩,部分细胞裂解,当浓度达2 MIC时,细胞表面严重皱缩(图3-b)。秦岭中蜂蜂蜜酚类提取物对裂解细胞壁膜作用明显,具有显著的抑菌效果,且革兰氏阳性菌对其的耐受程度远小于革兰氏阴性菌。
3 结论
研究结果显示,秦岭中蜂蜂蜜pH为5.61,水分含量(17.86±0.06)%,果糖36.33%,葡萄糖32.04%、蔗糖1.41%、淀粉酶活性26.4°Gothe、总酚酸含量(377.85±1.33)mg GAE/kg,总黄酮含量为(109.38±0.05)mg RUE/kg。相比西方意蜂蜂蜜及单花蜂蜜具有水分含量低,糖度高,淀粉酶活性高、总酚含量高等特点。UHPLC-QE-MS分析共鉴定出40种酚类组分,其中酚酸类11种,黄酮类29种,山奈素及山奈酚为代表性组分。秦岭中蜂蜂蜜酚类提取物对金黄色葡萄球菌及大肠杆菌的MIC分别为2.5、5.0 mg/mL。提取物能够显著抑制2种食源性致病菌的生长,破坏细胞壁细胞膜结构,引起细菌死亡。相比意蜂枣花蜜,中蜂蜂蜜提取物抑菌效果更强,且对革兰氏阳性菌(金黄色葡萄球菌)的抑制作用大于革兰氏阴性菌(大肠杆菌)。研究结果为秦岭中蜂蜂蜜抑菌机理探索及资源开发提供一定的理论依据。