纤维素微球色谱介质制备、孔结构调控及聚合物改性
2022-04-15王珊珊廖雨昕乔亮智杜开峰
王珊珊,廖雨昕,乔亮智,杜开峰
(四川大学 化学工程学院,四川 成都 610065)
随着基因工程等生物技术的不断发展,生物产品的生产水平大幅提升,使得胰岛素、酶、生长因子、抗体等生物产品的广泛使用成为可能[1-4]。作为生物产品生产的重要环节,分离过程占据总生产成本的60%~90%[5-7]。色谱技术由于具有分离精度高、分离条件温和、操作简单且重复性高等特点,已成为大规模生物产品生产过程中使用频率最高的一项分离纯化手段[8-9]。生物分离工程的根本任务是设计和优化分离过程,提高分离效率,降低分离成本。因此,作为色谱技术的核心,高性能色谱介质的开发一直是生物分离工程领域研究的重点[10]。
纤维素是最早应用于生物分离的色谱介质之一[11]。这主要是因为纤维素的基本结构为多糖化合物,表面含有大量羟基[12],易于修饰功能配基[13],且非特异性吸附弱,特别适合不稳定生物大分子的分离纯化[14]。目前,已有系列化的纤维素色谱介质产品的上市与应用,包括纤维素微球、纤维素膜和纤维素整体柱等,其中,纤维素微球由于出色的流体动力学特性,且具有可操作性强、易于填充、吸附容量大等优势,是目前生物分离纯化领域使用最多的一类色谱介质[15]。因此,本文综述近年来纤维素微球色谱介质的研究新进展,首先简述了几种典型的纤维素微球制备方法及其特点,再着重介绍了孔结构和聚合物配基两种策略对纤维素微球介质色谱性能的强化作用和机制,以期为进一步设计构建高性能纤维素微球色谱介质提供有价值的参考和指导。
1 纤维素微球的制备
目前,纤维素微球的制备方法多种多样,依据成形手段的区别,可分为滴定法[16-20]、喷雾法[21-24]、乳化法[25-32]、微流通道法[33-36]等以及部分特殊制备工艺,如笔者所在课题组开发的竹纤维一步生成法[37]、Higashi等[38]开发的微生物发酵法等。不同的方法所制备得到的微球粒径、均一性存在很大的区别(表1),也影响着纤维素微球介质的应用领域和范围。
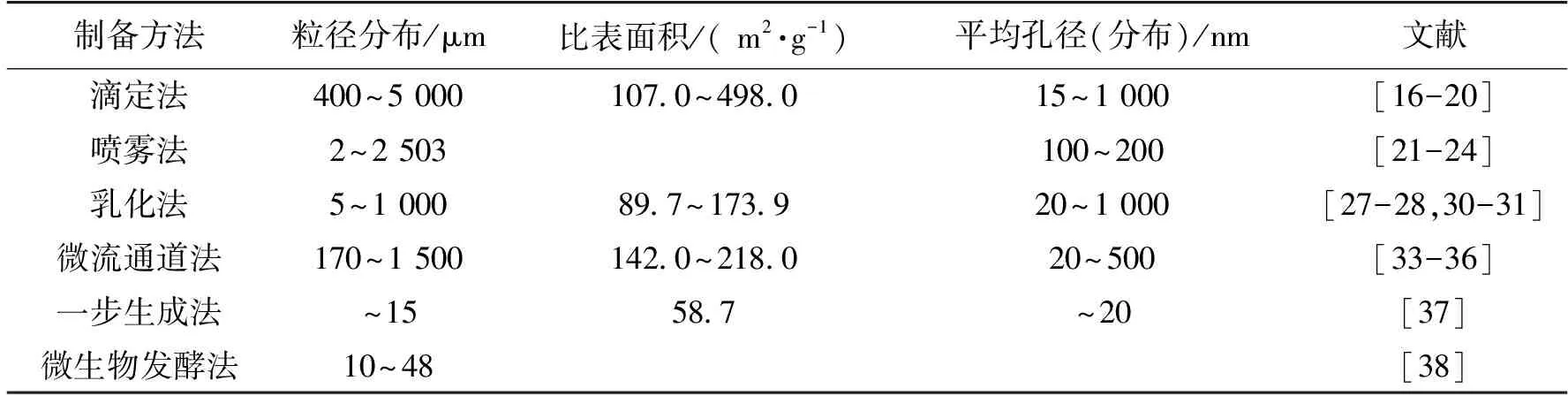
表1 不同制备方法所制得纤维素微球的主要参数对比
1.1 滴定法
滴定法是最简单也是最早报道的纤维素微球制备方法之一。早在1951年,O’Neill等[39]首次报道了采用喷射法以纤维素黄原酸酯为原料制备纤维素微球,整个过程仅需利用注射器或滴管等简单滴定器具,将纤维素溶液滴入凝固浴中再生便可获得微球。滴定法所制备出的纤维素微球粒径大多处于毫米级(表1),因此其在微球装填、回收与重复利用方面具有显著的优势。Kamal Mohamed等[18]以NaOH/尿素/ZnO的水溶液作为溶剂,在-10 ℃的低温下溶解纤维素,利用尖端出口直径约2 mm的细玻璃滴管将纤维素溶液滴入2 mol/L盐酸凝固浴中,制备出了2.0~2.5 mm的纤维素凝胶球。滴定法可以通过对滴定距离、纤维素溶液的浓度等参数进行调整,从而实现对纤维素微球形貌、孔径等参数的调节。Sescousse等[17]将纤维素溶于NaOH溶液,通过改变滴定过程中的多种参数,利用多通道微量移液器制备纤维素液滴并凝固于水浴中,制备出了各种形状的纤维素凝胶球,能实现从圆盘到球形之间的形状调控。然而,由于纤维素溶液普遍较高的黏弹性,在滴定过程中与凝固浴液面的撞击易造成微球拖尾和扁平化现象,球形度较差。此外,在应用过程中,微球较大的尺寸也常常导致较低的柱效与分离效率[28]。
1.2 喷雾法
喷雾法本质上是一种特殊的滴定法。但相比于滴定法,喷雾法所制备的微球尺寸更小、更均一、更适合批量化生产。谷军等[23]利用高压静电喷雾法,使用微量注射泵推进注射器,分别改变纤维素溶液浓度、电压、推进速度和电极间距等参数,在Na2SO4/H2SO4/H2O凝固浴中再生形成纤维素微球,粒径可在微米至毫米级之间进行可控的调节,平均孔径为100~200 nm。吴伟兵等[24]研究了在不同电压下的静电喷雾模式及其对应的纤维素微球粒径分布,结果发现,当电压在10 kV时,喷射出的液滴状态呈现出稳定的“Cone-jet”模式,形成的纤维素微球粒径均一,平均粒径为111 μm。
1.3 乳化法
乳化法是利用表面活性剂使得纤维素溶液(水相)在油相中被高速剪切力分散成为稳定小液滴,再通过再生或交联破坏纤维素溶解体系,使纤维素固化得到纤维素微球,是目前使用最为广泛、工业化程度最高的纤维素微球制备方法。Liu等[27]以纤维素-离子液体溶液为原料,采用W/O乳化和热再生相结合的方法制备出了平均直径为38 μm多孔纤维素微球。Xiong等[31]利用碱脲体系溶解纤维素和魔芋葡萄多糖并混合均匀,再经乳化和盐酸固化以及一系列后处理之后,最终得粒径为30~100 μm的再生纤维素微球,所获纤维素微球粒径小、耐碱性好、色谱柱效高。Luo等[30]以碱脲体系溶解的纤维素溶液为原料,通过改变表面活性剂的用量、水相与油相的比例以及搅拌速度,控制纤维素微球的平均直径在5 μm到1 mm之间。然而,由于搅拌分散不能制备尺寸均一的乳液,固化后得到的微球粒径不均一,在用作色谱介质之前,需经过反复筛分,得到粒径相对均一的微球,这不仅需要额外的分离设备和加工时间,也导致了原料浪费和大量溶剂的使用[37]。
1.4 微流通道法
微流通道法是一种具有新兴的纤维素微球制备技术[40]。微流通道法由于其较小的时空分辨率,可以实现在微纳尺度范围内对液滴的控制,所获得的纤维素微球粒径高度均一。童芳丽等[36]以添加Span-85的葵花籽油为油相,以纤维素-离子液体溶液为水相,通过十字形微通道将纤维素溶液剪切分散成粒径均一的微液滴,滴入水中再生固化成形,所制备的纤维素微球粒径在100 μm左右。但是该方法产量较低,仅适用于实验室制备。
1.5 其他方法
上述的制备工艺,无论是滴定法还是乳化法,均需要经过溶解、成形和再生3个必不可少的步骤,制备工艺较为繁琐,且需要大量的试剂和能量消耗。针对这一问题,笔者课题组Du等[37]开发了一种绿色简便的制备纤维素微球的新方法(图1)。利用廉价的木浆竹纤维为基本原料,通过一段时间高碘酸盐的强氧化作用,直接在高结晶度的竹纤维表面上自组装形成多孔纤维素微球。在氧化过程中,高结晶度的纤维素区逐渐转化为无定形的纤维素链,并且伴随着双醛的生成。随着“腌制”程度的逐渐加深,被氧化的纤维素链由于氢键作用逐渐聚集并且溶胀,经过层层组装形成微球。该工艺简单,无需有机溶剂以及搅拌,是一种有实际应用潜力的纤维素微球制备方法。
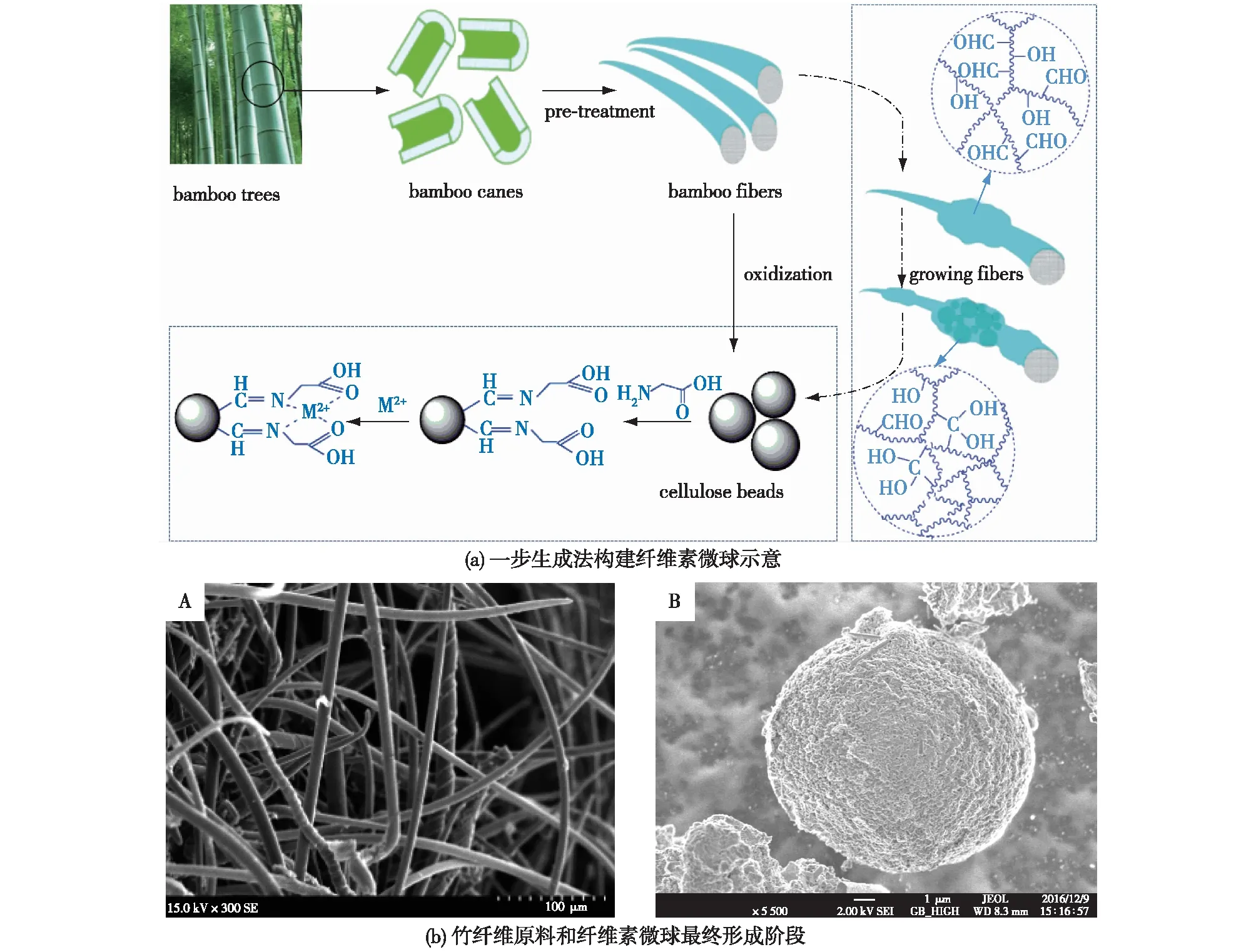
图1 一步生成法构建纤维素微球示意及其扫描电子显微镜图像[37]
此外,Higashi等[38]研制了一种微生物发酵法用于制备细菌纤维素微球,将木糖驹形氏杆菌(Komagataeibacterxylinus,NBRC 13693)与明胶在低温下混合,利用微流通道法制备细菌/明胶微球,然后促使细菌微球内部发酵合成细菌纤维素,最终可获得最小球径约为10 μm的细菌纤维素微球。
2 纤维素微球的孔结构调控
纤维素微球孔结构对其色谱分离性能有着决定性的影响。因此,为了提高纤维素微球的色谱性能,开发出有效的纤维素微球结构调控策略、加快传质速率、同时提高吸附容量成为目前纤维素微球色谱介质研究的重点与热点。笔者所在课题组在纤维素微球的结构调控方面也进行了大量的研究与探索,基于传统的乳化法,开发了多种孔调控策略,如预交联法[28-29]、模板法[26]、双乳化法[25]和表面活性剂胶团溶胀法[41]等,显著提升了纤维素微球色谱性能。
2.1 预交联法
比表面积大意味着微球可以接枝更多数量的配基,具有更高的吸附容量。Qiao等[28]通过预交联法(PCC)成功制备了一种具有比表面积大的多孔纤维素微球(DEAE-Cb/PCC)(图2)。该方法的关键在于将纤维素溶液与交联剂预混合,使交联剂均匀地分散在纤维素液滴内,促进交联反应在整个微球中均匀发生,从而有效提高微球强度并降低结晶度。交联反应的发生破坏了纤维素晶体的正常生长,产生了更多的非晶区,从而有效增大了微球的比表面积,比表面积达到约142.96 m2/g,约为传统纤维素微球的3倍。此外,这种PCC策略也有效地提升了微球的力学强度。进一步采用二乙基氯乙烷盐酸盐(DEAE)改性后,获得的吸附剂对牛血清白蛋白(BSA)和对牛血红蛋白(BHb)的吸附容量分别达到204.58和144.78 mg/g,远高于过去文献所报道的以及商业琼脂糖微球(DEAE-FF)吸附剂(表2)。
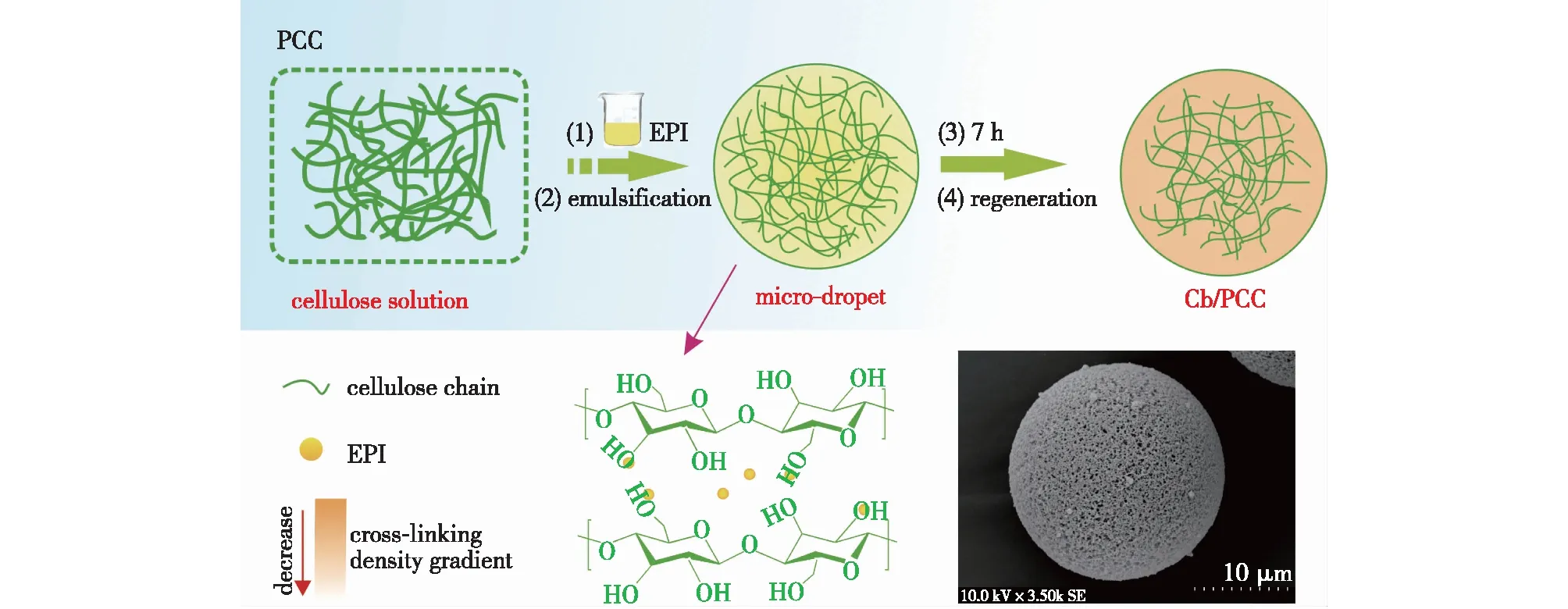
图2 预交联策略构建纤维素微球示意及其形貌[28]
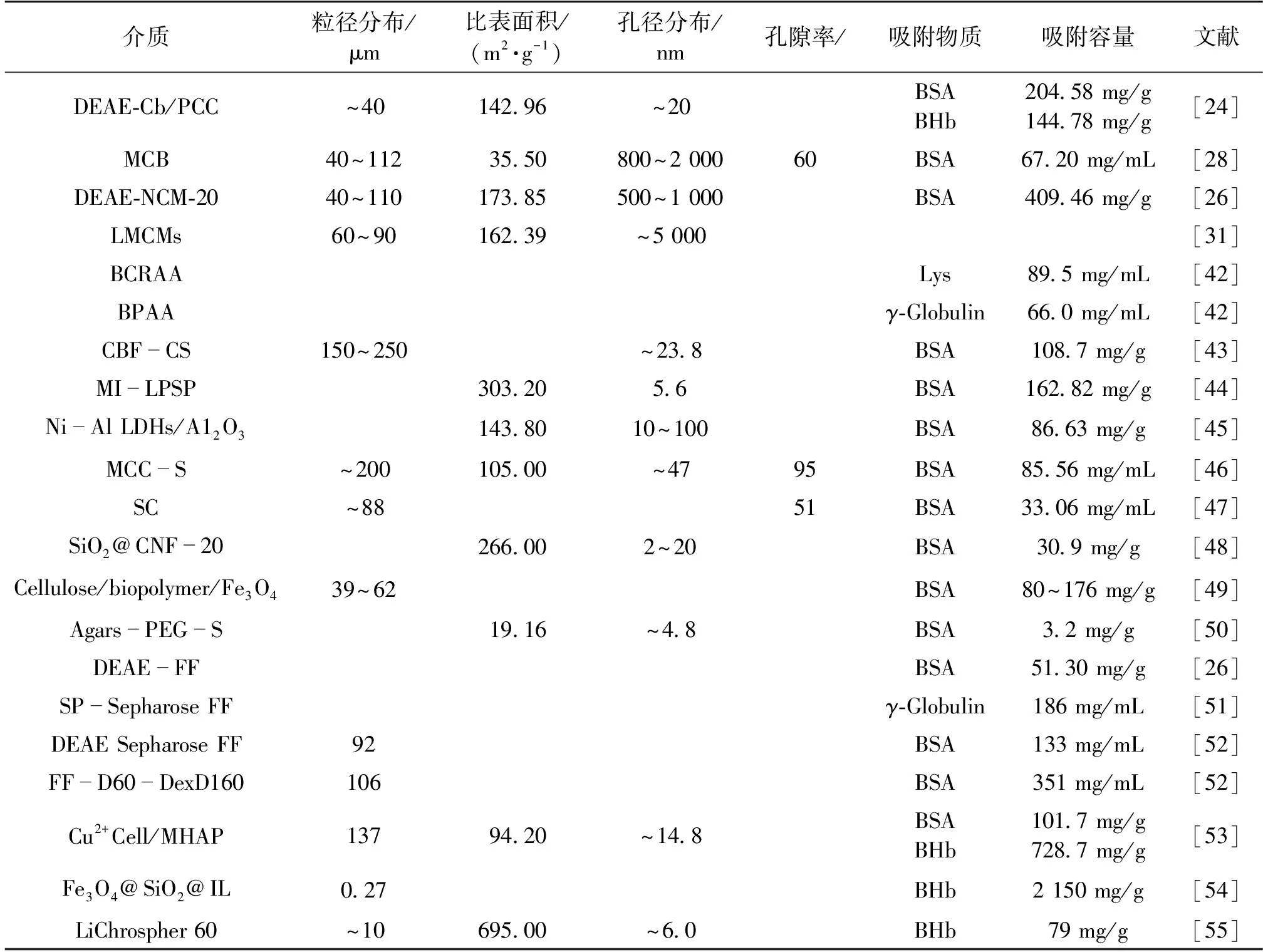
表2 不同纤维素微球的主要参数及吸附性能对比
2.2 模板法
模板法通过简单的模板混合与去除即可得到相应的孔道。通过选择或合成相应的模板,可以实现微纳孔道结构,包括孔形、孔径及孔分布的准确控制。Qiao等[26]研究以琼脂糖为介/微孔模板,采用乳化法制备了一种比表面积大的大孔纤维素纳米纤维微球DEAE-NCM-20(图3)。制孔机制为①琼脂糖和纤维素都可以溶于碱/脲溶液,使两者可以充分地混合;②利用琼脂糖热溶性质,通过沸水浴将琼脂糖模板去除。微球比表面积最大达到173.85 m2/g,孔径达到0.5~1.0 μm。进一步经DEAE改性后,对BSA的最大吸附量达到409.46 mg/g。因为相互连通的大孔结构显著降低了吸附阻力,提升了吸附速率,最终效果远远超过商用DEAE-FF介质(51.30 mg/g)(表2)。
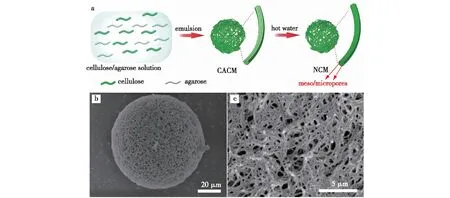
图3 DEAE-NCM-20的制备示意及其形貌[26]
2.3 双乳化法
除比表面积外,微球的孔径也对其色谱分离效率有着非常重要的影响。特别是对于生物大分子这类分子尺寸较大的物质,较小的孔径易造成孔道堵塞,导致吸附容量过小,微球吸附位点利用率降低等问题。而且生物大分子不稳定,长时间操作易导致产物失活,所以扩展微球孔径成为解决该问题的一条有效途径。这主要是由于大尺寸孔道有利于生物大分子在孔内的传质,提高了微/介孔的可及性,不仅可提升传质能力,也可增大吸附容量。Du等[25]采用双乳化法成功制备出一种具有双孔结构的球形纤维素吸附剂(MCB),具有10~20 nm的扩散孔和800~2 000 nm的大孔。通过调节有机相、表面活性剂的组成和比例,促使表面活性剂与纤维素溶液形成互相穿透的双连续相,进一步再生,得到具有双孔结构的纤维素微球。将微球进行交联并利用DEAE改性获得阴离子色谱介质。经测试发现,相比于微孔纤维素微球(HCB),MCB微球具有更低的柱压,吸附容量也超过HCB和商业琼脂糖微球(CSFF),实现了对蛋白质的高容量和快速分离。
2.4 表面活性剂胶束溶胀法
当表面活性剂在溶液中的浓度超过其临界胶束浓度时,表面活性剂会形成胶束或反胶束。利用这一特点,Qiao等[41]采用表面活性剂胶束溶胀制备大孔纤维素/碳纳米管微球(LMCMs)(图4),将高浓度表面活性剂加入纤维素/碳纳米管水溶液形成表面活性剂胶束,再进行乳化。在乳化过程中,表面活性剂的疏水内核将外部油相吸收到液滴中形成油相通道,再生凝固后,这些油相通道转化为大孔,孔径约达到5 μm,比表面积162.39 m2/g。以此对胆红素进行吸附,该吸附剂在2 h内的吸附量(314.14 mg/g)即达到最大吸附量(338.14 mg/g)的92.9%,远超过未制孔纤维素/碳纳米管微球(LCMs)的194.23 mg/g。

图4 大孔纤维素/碳纳米管微球制备示意及其形貌[41]
3 聚合物接枝改性
配基接枝是制备纤维素基吸附剂的重要后处理步骤[56],通过对纤维素基材表面进行化学改性,连接新的化学功能基团,赋予其对生物大分子特异性吸附的能力。近年来,聚合物接枝修饰得到了产学界的广泛关注。相较于传统的短链配基,聚合物接枝配基通常拥有更高的吸附容量和吸附速率。高吸附容量归功于聚合物配基提供的三维吸附空间,可以更加灵活地与生物大分子结合;快吸附速率则是因为聚合物配基可以促进生物大分子的表面扩散。Yao等[57]通过原子转移自由基聚合将间二甲苯二磷酸盐固定在多孔纤维素整体柱表面(图5),结果发现,这种触须状配基对溶菌酶的最大静态和动态吸附容量分别达到169.6 mg/mL和102.6 mg/mL。此外,He等[58]以乙烯基膦酸(VPA)为单体,通过自由基聚合方法成功合成了一种聚合物接枝型的磷酸基棉纤维基材料CF-NH2-AZO-p(VPA-x),经钛离子进一步固定化后得到一种金属亲和层析介质,该介质可以从大鼠脑溶解液中分离出8 107个独特的磷酸肽和9 381个磷酸酯。Wang等[42]在大孔再生纤维素膜上利用光引发的多相接枝共聚法制备了聚(丙烯酸-亚甲基双丙烯酰胺)接枝的纤维素吸附剂,对溶菌酶和γ-球蛋白的最大静态吸附量分别达到89.5和66.0 mg/mL,表现出比短链配基更高的吸附容量(表2)。
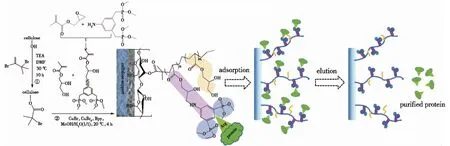
图5 触手状聚合物接枝示意[57]
4 结语
通过对纤维素微球的制备方法、孔结构调控和聚合物配基接枝的系统介绍,阐述了不同方法对纤维素微球形貌及色谱性能的影响及作用机制。这些也为今后高性能色谱介质的制备提供了可参考的研究思路和方向。例如,针对不同应用领域对微球粒径尺寸的要求不同,可以选用合适的制备方法来生产所需微球;比表面积大益于吸附容量的提升,而大孔结构有利于提升生物分子在孔内的传质,提高吸附速率;此外,聚合物配基也为生物大分子吸附容量和速率提升提供了一条有效途径。尽管纤维素微球色谱介质高能化研究已经取得了长足的进展,但在面向应用过程中仍有两个重要科学问题需深入研究:一是大规模制备尺寸均一的微球。目前常用手段仍是分级筛分,不仅效率低,而且过程繁琐,微球和溶剂浪费严重;二是纤维素微球的孔结构化学性质对其生物分离性能的影响机制。这里孔的结构化学性质包括两层含义:一是孔的物理性质,包括孔尺寸、形貌和分布;二是孔表面化学性质,主要受表面配基影响。由于生物分子较大的尺寸和复杂的表面性质,相比于小分子吸附分离,生物分子的吸附过程十分复杂,相关研究结果可为纤维素微球色谱介质的构建和应用提供有价值的思路和指导。
