纳米晶递药体系在肿瘤诊疗领域研究进展
2022-04-15凌祥李尚飞龙威杨宇涵蔡挺
凌祥,李尚飞,龙威,杨宇涵,蔡挺
(中国药科大学药学院药剂系,江苏 南京 210009)
1 纳米晶概述
纳米晶多为单相或多相多晶体,其尺寸在至少一个维度上为几个纳米到几百纳米的数量级。纳米晶的晶体形貌极细,晶界可占整个材料的50%以上,三维原子结构存在偏离原本对应的周期性排列的特点,因此所构成纳米晶的性能也不同于相同成分的晶体或非晶体。通常情况下,粒子尺寸减小至微纳尺寸,会引起材料宏观物理、化学等性能变化,即小尺寸效应。纳米晶主要包括药物纳米晶、无机纳米晶和量子点(quantum dot,QD)、纳米晶金刚石(nanodiamonds,NDs)、纤维素纳米晶(cellulose nanocrystals,CNCs)和其他纳米晶等(见图1)。纳米晶具有众多优势,如药物纳米晶的溶出速率和饱和溶解度较大。根据Noyes-Whitney和Freundlich-Ostwald方程,当药物的粒径减少到纳米级别时,由于其表面积的增大,其溶出速率和饱和溶解度也随之增大[1]。纳米晶还具备与体内肠壁接触面积大、黏附性强的特点,因此其生物利用度也随之显著提高。随着对纳米晶研究的不断深入,其在生物医学领域的应用前景也正逐步展现。如药物纳米晶同时将纳米技术和晶型研究进行有机结合,提供了一种安全、稳定和高效的新型给药策略,能够提高难溶性药物的溶出,增强药物的缓释和靶向作用,丰富药物的给药途径等,对于提高药物成药性和新药开发具有良好的促进作用[2]。
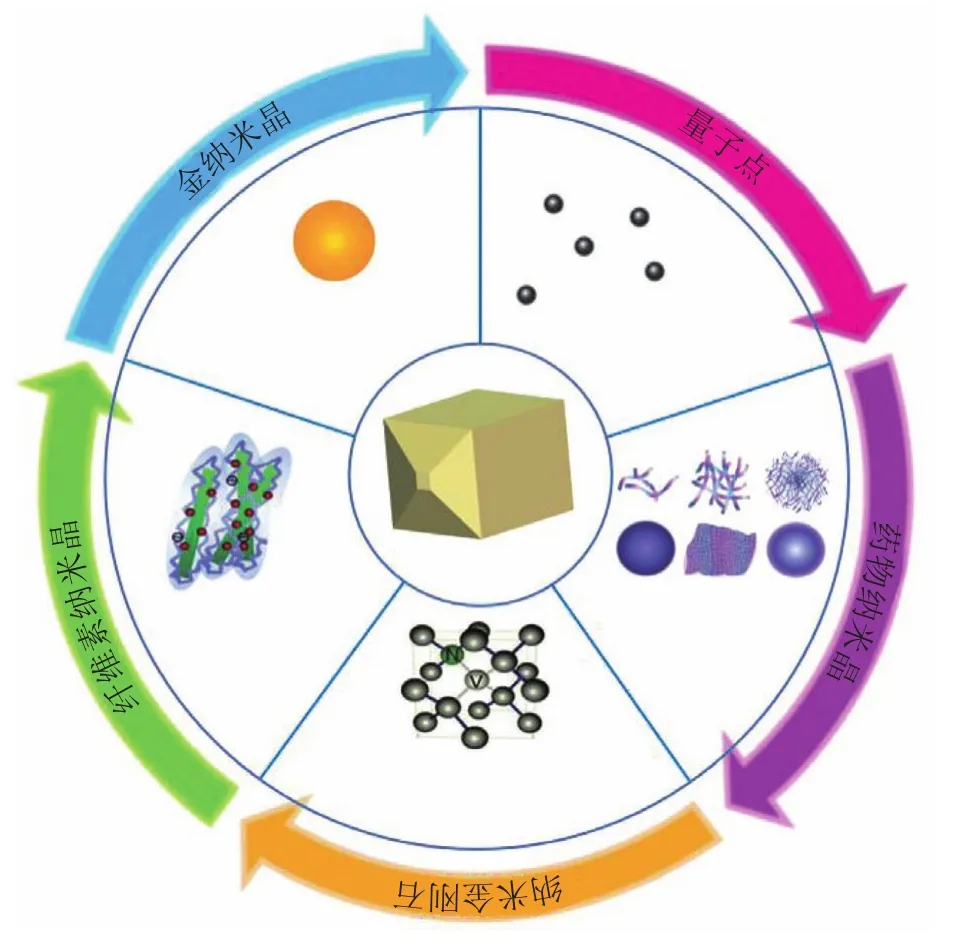
图1 纳米晶主要分类Figure 1 Main categories of nanocrystals
随着肿瘤学研究的进展,纳米晶材料在肿瘤诊疗领域的应用价值得到进一步拓展,具有极大的应用前景。譬如一些纳米晶体系装载并递送药物时可以提供一个相对封闭的包药环境,能够有效减少或避免药物的毒副作用。肿瘤高渗透长滞留效应的发现使纳米级别尺寸的颗粒物在生物体内转运时能够趋向性地在肿瘤附近聚集,从而为纳米晶靶向治疗提供了理论依据。此外,纳米晶材料在进一步表面修饰后可以赋予其特定的生物学功能,进而改善其体内效应[3]。一些纳米晶材料如金纳米晶(Au nanocrystals,Au NCs)、氧化铪纳 米 晶 (HfO2nanocrystals,HfO2NCs)不仅能作为药物递送载体,其自身还具有放疗增敏、光热转换等效果,使得这些材料在肿瘤诊疗领域展现出巨大的医学应用价值。虽然纳米晶体系在肿瘤诊疗领域的应用充满机遇,但真正应用于临床或进入临床前研究的仍然屈指可数,纳米晶的生物相容性,尤其是无机纳米晶的体内代谢和生物安全性仍然存在风险,需要进一步深入研究。
2 纳米晶的制备与修饰
2.1 纳米晶的制备技术
药物纳米晶是指无载体、含少量稳定剂的纳米胶态颗粒,可显著改善药物的可润湿性和溶解性。药物纳米晶可以由“自上而下”(top-down)法、“自下而上”(bottom-up)法以及2种方法的组合技术来制备,其中top-down和bottom-up的制备过程如图2所示。Top-down法主要通过介质研磨或高压均质等方法将大粒径药物晶体粉碎至纳米级尺寸。通过该方法制备的药物纳米晶通常具有较窄的粒径分布和可控的粒径大小,且制备过程中不需要有机溶剂,操作较为简单。Hao等[4]采用微射流法成功制备了粒径小且均匀的阿霉酮B(amoitone B)纳米晶并对其形态学进行了表征,证实了纳米晶在尺寸减小的过程中没有出现晶型的改变。用这种阿霉酮B纳米晶配制溶液,其饱和溶解度增加,体外溶出速度加快,可通过静脉注射给药。Top-down法容易实现工业化,目前已有数十种上市产品,然而这种制备方法能耗较高,且长时间的研磨和均质可能会对药物造成一定的污染和降解[5]。Bottom-up法将药物溶液与药物溶解性较差的反溶剂混合,降低药物溶解度,从而促进成核及生长过程来获得药物纳米晶,这种方法又被称为反溶剂沉淀法[6]。Gao等[7]采用蒸发沉淀法制备了紫杉醇纳米晶,其平均粒径约135.4 nm。该研究结果显示,紫杉醇纳米晶的半数致死量(median lethal dose,LD50)是市售注射剂的2倍,可显著提高小鼠的耐受剂量,并表现出与注射液不同的药代动力学特性。但是bottom-up法在制备的过程中需要使用有机溶剂,残留溶剂可能会产生毒性,并且该方法在进行大规模生产时存在挑战,目前在生产中应用较少。组合技术通常首先使用bottom-up法进行预处理,随后再应用topdown法,用于缩短制备时间,同时获得粒径分布范围较窄的药物纳米晶。Yang等[8]用一种不含稳定剂和有机溶剂的组合方法制备了10-羟基喜树碱(10-Hydroxycamptothecin,10-HCPT)纳米晶体。与10-HCPT注射剂相比,10-HCPT药物纳米晶在细胞和动物水平均呈现出更好的药效学效果。然而组合技术的操作相对较为复杂,通常只有在能够显著改善药物纳米晶成药性时才有较大应用价值。
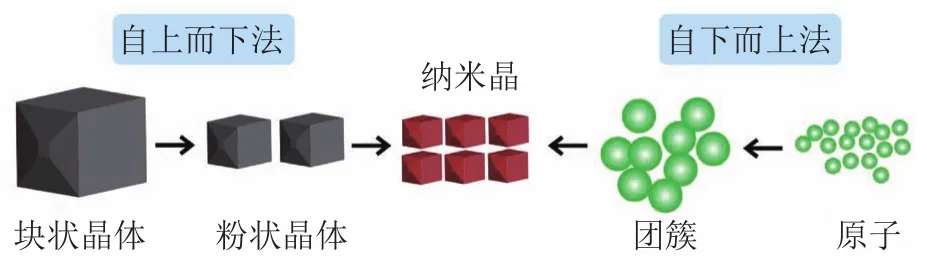
图2 “自上而下法”和“自下而上法”制备过程示意图Figure 2 Schematic diagram of "top-down" and"bottom-up" preparation process
无机纳米晶主要包括金属及其氧化物的纳米颗粒,其制备方法也可分为top-down法和bottom-up法,基于这2种方法又可细分为化学法、物理法和生物法。化学法是合成金属纳米晶的主要方法,通常还需加入稳定剂控制粒径大小和分布,如银纳米晶(Ag NCs)主要是在表面活性剂存在的情况下由乙醇还原硝酸银所得。金属纳米晶广泛使用的稳定剂有聚乙烯醇、聚乙烯吡咯烷酮、柠檬酸盐和纤维素等,主要用于减少颗粒的聚集,提高其分散性。物理法通常需要借助紫外照射、微波辅助、热分解、乳化等方式,具有一定的优势,如微波辅助与传统加热相比可显著提高反应速率以改善均质性[9]。生物法主要是采用如羟胺、抗坏血酸等还原剂进行生物还原,也可以使用生物制剂、植物提取物、微生物等还原剂进行绿色合成[10]。
QD是指尺寸在2 ~ 10 nm之间的半导体纳米晶体颗粒,其以半导体晶体为基础,每一个粒子均是单晶。QD的命名来源于半导体纳米晶的量子限域效应或量子尺寸效应。当半导体晶体小至纳米尺度(1 nm大约等于头发丝宽度的1/10 000),不同的尺寸发出不同颜色的光,其发光颜色可以覆盖从蓝光到红光的整个可见区,而且色纯度高、连续可调。由于QD是具有独特光学和化学性质的纳米粒,已在生物医学领域显示出巨大应用潜力。制备QD的常用方法有外延生长法和胶体法。前者可以使QD有序生长,合成过程通过液相外延、金属有机化学气相沉积和分子束外延进行;后者通过液相缩合,使前体过饱和,进而导致QD成核。此外,微流控技术可以为疾病标志物的诊断提供一个有效的平台,通过这种方法制备QD,使其在纳米医学领域具备一定的应用前景。微流控技术制备方法主要包括连续流、分段流和液滴微流控技术[11]。
NDs作为另一种碳基纳米材料,由于具有良好的理化特性和生物相容性,也得到广泛研究。NDs的制备分为大规模工业生产方法和小量实验室制备法,前者包括静态合成、爆轰技术的动态合成、激光烧蚀、化学气相沉积法(chemical vapor deposition,CVD)等,后者包括等离子体辅助CVD、高压釜合成、石墨离子辐照、真空加热和超声空化等[12]。此外,CNCs可采用化学方法从植物纤维素中分离得到。改进后的CNCs制备方法主要通过进一步酸水解微晶纤维素来破坏糖苷键以去除纤维素的无序部分,其形貌为棒状或针状纳米晶体,其宽度可小至5 ~ 20 nm,长度通常在100 ~ 200 nm之间,并且能够在血液循环中保持其粒径和杆状。除了纤维素材料优异的生物相容性和可再生性外,CNCs还因优异的高纵横比、高强度、丰富的表面羟基和良好的生物相容性引起广泛关注[13]。
2.2 纳米晶的修饰
纳米晶的表面修饰方法与普通的纳米粒的修饰方法类似,一般采用物理、化学等深加工处理方法对纳米粒的表面进行特定修饰,从而控制其内应力,增加纳米晶间的斥力,降低引力,使晶粒的表面物理、化学性质(形貌、晶体结构、应力状态、官能团表面能、表面疏水性、表面润湿性、表面电势、表面吸附和反应特性等)发生变化,有目的地改变纳米晶的形态、电荷、分布等理化性质,从而赋予纳米晶新的分散性、相容性和靶向性等特点。
另一方面,纳米晶在制备和储存过程中容易发生聚集,造成粒径增大、稳定性降低。考虑到纳米晶具有巨大的比表面积且表面常存在各种可修饰的官能团,通过表面修饰无疑是改善其稳定性的有效手段。纳米晶的表面修饰方法通常分为物理吸附和化学键合2种,如表面活性剂、高分子聚合物通过物理相互作用吸附在纳米晶表面,抑制纳米晶聚集,从而实现对纳米晶稳定性的控制。Katsuhiko等[14]将聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)/十二烷基硫酸钠(sodium dodecyl sulfate,SDS)作为稳定剂吸附于格列苯脲(glibenclamide,GLB)表面,优化GLB/PVP/SDS三元热挤出物制备稳定的格列本脲纳米晶。该研究表明,将PVP和SDS作为稳定剂可有效控制纳米晶的结晶度,使其形成稳定的药物晶体。此外,通过物理吸附在纳米晶表面覆盖一层涂层可赋予其肿瘤靶向等附加功能。例如Talekar等[15]以泊洛沙姆188/叶酸偶联物作为稳定剂,采用高压均质法制备了磷脂酰肌醇3-激酶(phosphatidylin-ositol-3-kinase,PI3K)抑制剂——PIK-75纳米晶。研究表明,这种靶向PIK-75的药物纳米晶可显著增强药物在肿瘤部位的吸收,进而改善治疗效果。
化学键合是指通过化学反应在纳米晶表面引入基团或配体,赋予其更多活性和功能。如NDs、CNCs表面具有多种活性官能团,易于进行化学修饰。Yu等[16]发现全氟辛酸功能化的NDs能够自发转化为分散良好且生物相容性好的超粒子纳米团簇。研究表明,基于ND的超粒子(superparticle,SP)ND-SPs具有细胞膜的高穿透性,因此可用作传统纳米药物的载体,ND-SPs在体外和体内均具有消灭癌细胞的功效。不同制备工艺的纳米晶药物如表1所示。

表1 不同制备工艺制备的纳米晶药物Table 1 Nanocrystalline drugs prepared by different preparation processes
3 纳米晶在肿瘤诊疗中的应用
3.1 药物纳米晶
相比于传统制剂,药物纳米晶因比表面积剧增而通常具有更好的溶解度和生物利用度,这有助于改善难溶性分子的成药性,即水溶性差的候选药物可以使用纳米晶体技术或固体非晶态分散技术来改善其溶解性并配制成上市药物[27]。然而,由于开发技术难度高和成本投入大,纳米晶仍存在一定的转化技术壁垒,不过目前已有一些产品处于临床前、临床开发和上市阶段。市场上早期推出的纳米晶技术产品是2000年惠氏公司的西罗莫司片(商品名:雷帕鸣)。雷帕鸣作为一种片剂配方,将1~2 mg的药物纳米晶掺入360 mg的片剂中以达到缓释效果,主要用于器官移植后免疫抑制[28]。随后帕尔制药公司推出了醋酸甲地孕酮纳米晶(商品名:Megace ES),用于癌症和厌食症治疗。受益于纳米化,Megace ES的体内生物利用度不受食物效应的影响且相比普通制剂显著提高[29]。真正将纳米晶技术应用于临床肿瘤治疗的是Angiotech 制药公司开发的紫杉醇纳米晶制剂Paxceed,解决了抗肿瘤药物溶解性难题[30]。Paxceed最大限度减少了聚氧乙烯蓖麻油引起的过敏性超敏反应。此外,Paxceed的治疗剂量也远低于常规制剂的使用剂量。纳米晶技术在解决难溶性药物溶解度问题上具有一定的优势,很多制药企业也逐渐意识到药物纳米晶潜在的商业开发价值,并将其作为重要的制剂技术。但是药物纳米晶作为新兴研究方向,仍然有大量工作亟待展开,譬如药物纳米晶体系的稳定性、缓控释和靶向研究等。尽管目前针对上述问题的基础研究已经有了一定成果,如制备方法逐渐完善、影响稳定性的因素逐渐明晰,但如何提高制备效率和拓宽纳米晶的应用领域等方面仍需不断深入研究。
工业上,通常将制备的纳米晶体悬浮液转化为固态,然后将固体粉末转化为其他剂型,例如注射用无菌粉末、口服片剂和胶囊等,以增加稳定性。除了上述制药工业在药物纳米晶技术上的探索外,一些专利报道在多柔比星、喜树碱、紫杉醇的纳米晶中加入靶向肿瘤的配体或抗体,甚至是放射性核素或造影剂,可以达到肿瘤靶向诊疗的目的[31]。另一项研究中,药物纳米晶与客体分子(如荧光分子)进行物理整合,从而对其进行功能化,Hollis等[32]研究了将紫杉醇与生物响应的MMPSense 750 FAST荧光分子和近红外的FPR-648荧光分子进行主客体整合获得杂化纳米晶。该纳米晶中释放的MMPSense 750 FAST分子受到体内基质金属蛋白酶的刺激而活化发光,从而达到在体监测肿瘤进展的目的,另一种MMPSense 750 FAST荧光分子可以实时监测纳米晶在体内的分布。总体而言,药物纳米晶在缓控释、生物成像、生物传感器等医学领域具有重要研究意义,是新药开发的一种有效策略。
3.2 无机纳米晶
无机纳米晶的尺寸、形状、电荷和表面修饰可精确控制,同时大部分无机纳米晶又具有独特的光电学性质,可用于结合免疫疗法介导肿瘤消融[33]。作为一类金属及其氧化物的纳米颗粒,无机纳米晶在肿瘤诊断医学领域已有初步应用,但在肿瘤治疗领域仍处于临床前研究阶段,很少能有无机纳米晶成功进入临床试验[34]。基于贵金属的新型纳米结构材料因其独特的光学、电学和催化性能,近年来备受科研人员关注,其中Au、Ag元素构建的纳米晶具有成熟的制备工艺、特殊的理化特性、良好的稳定性和较低的生物毒性,在生物医学领域获得了突破性应用。Conde等[35]构建了基于Au NCs的局部三联疗法,在水凝胶贴片中,球形Au NCs递送针对Kirsten鼠肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)的小干扰RNA(siRNA),用于基因治疗;棒状Au NCs介导近红外辐射的热转化,导致化疗药物释放和热致细胞损伤。这种局部三联疗法能够完全缓解原发性肿瘤的恶性进展,同时有效预防术后肿瘤复发。与性能稳定的Au NCs不同,Ag NCs虽然具有良好的自然丰度和较低的成本优势,但因其易氧化而极大地限制了Ag纳米材料的发展。Porto等[36]开发了三原子的Ag原子量子簇用于靶向染色质,在原位肺癌模型中与顺铂共同给药取得了良好的疗效,因而可作为一种化疗强化的潜在手段。Chakraborty等[37]证实Ag NCs还能通过降低肿瘤微环境中的白细胞介素-1β(IL-1β)信号传导以减少促肿瘤细胞因子分泌,从而对纤维肉瘤具有一定的疗效。
与金属纳米颗粒相比,金属氧化物纳米颗粒极大地丰富了无机纳米晶的性能。新型疫苗的开发对免疫佐剂提出了更高的要求。作为经典可靠的疫苗佐剂,铝盐除了通过储存库效应和免疫刺激效应增强免疫应答外,还可促进抗原递呈细胞的活化和成熟以提高其对抗原摄取的同时,活化炎性小体参与免疫反应。Moyer等[38]发现工程化的抗原结合铝质纳米晶可增强体液免疫。与传统明矾吸附免疫原相比,经过聚磷酸丝氨酸修饰的免疫原引发了明显的生发中心,这些纳米粒被运输至淋巴结并通过多价和定向递呈抗原触发B细胞活化。
作为一种电离辐射,放疗是用于癌症治疗的非手术常规治疗手段。Nanobiotix公司开发的NBTXR3在欧洲获得了Hensify®商标的上市许可,用于治疗软组织肉瘤,另外其正在开展8项针对多种类型癌症的临床试验。基于HfO2NCs的NBTXR3是一款创新放疗增强剂,瘤内注射给药后通过放疗激活自由基生成,直接破坏肿瘤细胞并激活适应性免疫应答,可作为局部晚期肢端或躯干软组织肉瘤的新型治疗选择[39]。作为氧化还原酶(如过氧化氢酶、超氧化物歧化酶等)的人工底物,Zeng等[40]发现透明质酸介导的氧化铈纳米晶(CeO2nanocrystals,CeO2NCs)对活性氧诱导的机体损伤表现出有效的保护作用,可用于调控光动力治疗过程中产生的过量活性氧。CeO2NCs的辐射防护和光防护特性有助于其在肿瘤放疗和光动力治疗领域内发挥重要应用。
恶性肿瘤转移会增加对机体的损害作用,进而影响转归。半导体QD纳米晶作为一类独特的光学成像荧光探针,具有可调的光学特性、高稳定性以及表面功能化特性,与美国食品和药品管理局(FDA)批准的癌症成像的荧光分子相比,具有独特的优势[41]。Liu等[42]通过使用近红外QD和阳离子供体膜不渗透腐蚀剂,后者通过阳离子交换快速猝灭QD,促进QD释放出的金属离子在肾脏的清除;通过使用肿瘤穿透肽将QD静脉注入小鼠原位乳腺和胰腺肿瘤;随后淬灭多余的QD,在血管外肿瘤细胞和成纤维细胞中留下完整QD提供的高度肿瘤特异性信号。半导体QD纳米晶提供了体内高分辨追踪细胞的潜力。
3.3 其他纳米晶
除了上述药物纳米晶和无机纳米晶外,NDs、CNCs等在肿瘤诊疗领域内也具有重要应用。
作为一种新型碳基材料,NDs具有化学稳定性高、生物相容性好、价格低廉等优点,是目前已知毒性最低的纳米材料之一。经爆轰法制备的NDs粒径可达2 ~ 10 nm,具有巨大的比表面积和丰富的表面官能团(如羟基、烯基、酮基、羰基等),为其进一步修饰提供了便利[43]。例如表面功能化的NDs通过与药物、核酸、蛋白质等分子物理吸附或共价结合,应用于药物/基因递送和蛋白分离。表面功能化的NDs显示出良好的药物负载性能,在肿瘤诊疗领域具有良好的应用前景。研究发现,将阿霉素(doxorubicin,DOX)负载在聚乙二醇修饰的碲化镉量子点(PEG-CdTe QDs)上;PEG-CdTe-DOX通过聚乙烯的组织相容性促进细胞内药物积累,并以pH控制的方式将DOX释放到微环境中,从而提高骨髓瘤细胞的治疗效果和凋亡率[44]。
碳量子点(carbon quantum dots,CQD)是CD纳米晶中的代表,其由分散的类球状碳颗粒组成,尺寸极小(在10 nm 以下),是具有荧光性质的新型碳材料。与传统的半导体量子点相比,CQD不仅具有传统QD的发光性能,还具有水溶性好、生物毒性低和导电性好的优势,因此在生物成像、生物标记、传感、催化等领域受到了极大的关注[45]。采用CQD荧光进行体内追踪的研究已相当广泛,近期研究表明CQD在肿瘤诊疗领域也具有良好的应用前景[46]。Hua等[47]通过间苯二胺和L-半胱氨酸的一锅水热反应合成了一类新型多功能化CQD,具有良好的水分散性、丰富的表面基团、可靠的光稳定性、优异的生物相容性以及简单便捷的染色程序。与SYTO RNASelect(一种常用的商业核仁成像染料)只能对固定细胞中的核仁成像不同,这种CQD可对固定细胞和活细胞中核仁进行高质量成像,从而实时跟踪核仁相关的生物学行为。体内实验表明,这种修饰后的CQD静脉注射后能快速、特异性地靶向肿瘤部位,并且在激光照射后能够有效地消融肿瘤。Li等[48]开发了一种在结构上模拟大型氨基酸的CQD,静脉注射后能够与肿瘤内广泛表达的大型中性氨基酸转运蛋白1(large neutral amino acid transporter 1,LAT1)结合,从而选择性地蓄积在肿瘤组织,同时CQD可通过π-π堆积相互作用装载芳香族药物,实现肿瘤组织的近红外成像和光声成像。
作为纤维素材料中的代表,CNCs具有优异的物理化学和生物性能,如高强度、高结晶度、高弹性模量、大比表面积、高反应活性、优异的生物相容性等,已成为纤维素科学技术领域内最有前途的候选材料之一[49]。通过酸水解法制备的CNCs形貌多呈棒状或针状,宽度5 ~ 20 nm,长度50 ~ 200 nm,表面有大量羟基活性官能团,易于进行表面修饰[50]。Wang等[51]通过开环聚合合成了聚磷酸乙酯(poly ethyl ethylene phosphate,PEEP) 修饰的CNCs纳米粒 (CNCs-g-PEEP)。这种带负电荷的CNCs-g-PEEP通过静电作用负载DOX,并发挥出良好的抗肿瘤作用。近年来报道了羟磷灰石(hydroxyapatite,HA)与各种生物分子和治疗剂结合,可作为药物递送载体。HA纳米晶比二氧化硅纳米粒、QD、碳纳米管或磁性粒子具有更低的毒性与pH依赖的溶解性优势[52]。Lelli等[53]研究了顺式-1,4-二氨基环己烷和1,1-环丁烷二羧酸的2种铂衍生物在仿生HA上的吸附和释放行为。体内研究显示,HA在肿瘤部位的溶解导致铂类药物和高浓度的钙离子与磷酸根离子进行靶向释放,从而诱导炎性细胞因子产生,抑制肿瘤增殖。纳米晶在肿瘤诊疗中的应用情况如表2所示。

表2 纳米晶在肿瘤诊疗中的应用Table 2 Application of nanocrystals in tumor diagnosis and treatment
4 纳米晶的体内过程
纳米晶在体内的行为较复杂,关于纳米晶的体内过程,如纳米晶与细胞的相互作用、跨膜吸收机制和吸收动力学等仍知之甚少,目前缺乏可靠的分析方法来识别和量化生物环境中的纳米晶体。但纳米晶在体内的行为直接影响其安全性和有效性,近年来的研究通过多种成像方法检测到纳米晶的体内行为,有助于了解纳米晶的体内过程,加深了对于不同纳米晶在不同给药方式下,与生物组织的相互作用和时空转运行为的理解。
4.1 药物纳米晶
不同给药途径会影响纳米晶的体内转运和确定其对疗效的贡献,对于纳米晶的设计和优化均具有重要意义。例如,快速溶解是胃肠道给药制剂首先遇到的问题。一些难溶性药物可通过微纳加工改善溶解度,使药物在胃肠道内的吸收增加,生物利用度提高。此外,在胃肠道观察到纳米晶被上皮细胞(如M细胞或肠细胞)吸收,这取决于药物纳米晶的大小和黏液渗透[61]。Imono等[62]发现纳米晶表面修饰后,其黏膜黏附和胃滞留特性发生改变,例如使用疏水蛋白包被后最多能在胃中保留3 h。
对于眼部给药而言,受限于眼部屏障和泪液清除作用,通常情况下药物生物利用度不到5%[63]。纳米晶提高了难溶性药物在眼部的溶解速率和表观溶解度,升高药物初始浓度,这种高浓度梯度差进而促进药物分子通过角膜和结膜上皮细胞进行渗透。此外,纳米晶比表面积大、黏附力强,显著延长了药物局部滞留时间。
对于静脉给药而言,纳米晶的体内行为取决于其在血液中的溶解速率。Shen等[64]对大鼠静脉注射槲皮素杂化纳米晶(QT-HNCs),荧光成像表明QT-HNCs具有长循环能力,QT-HNCs能够以完整的纳米晶形式存在体内长达48 h,且QT-HNCs在肝和肺聚集程度最高。值得注意的是小粒径的QTHCNs更容易被肝细胞摄取,但在体内溶解更快,导致QT的体内分布更高。Zhang等[65]通过以四-(4-羟基苯)乙烯(THPE)纳米晶为模型,经激光共聚焦成像和流式细胞荧光分析发现,纳米晶体可以完整地跨KB细胞膜转运或以溶解分子的形式被细胞摄取,且纳米晶的摄取具有浓度依赖性,表明KB细胞对纳米晶的吸收可能与主动转运有关。研究中用染料分子进行的观察表明,药物化合物的纳米晶可以被细胞内化,被内吞的纳米晶溶解并释放药物分子,然后进一步扩散到细胞外。Pi等[66]合成了一种基于姜黄素的纳米晶分子探针,在小鼠尾静脉注射后取主要器官分析发现该分子探针在肿瘤中的分布比在其他器官中高得多,提示此纳米晶分子探针具有良好的肿瘤靶向能力,这为新型探针用于癌症早期检测的设计提供了一个新思路。
对于肌肉注射给药而言,纳米晶通过控制粒径大小可以达到缓控释效果。帕潘立酮棕榈酸酯长效纳米晶通过肌肉注射可维持1个月至数个月的疗效,这类长效注射剂经皮下或肌肉注射后,药物从注射部位缓慢溶解进入血液,再逐步进入血液循环发挥疗效,其释放周期取决于药物的晶型、粒径及溶解度等因素。药物在体内的吸收释放过程主要由制剂中小粒径的药物晶体溶解提供初期血药浓度,随后药物晶体缓慢溶解释放药物入血,该过程中药物溶解速度是限速步骤,后期注射部位创伤逐渐形成炎性肉芽肿包埋药物颗粒,通过微晶溶解和肉芽肿部位药物扩散控制药物释放。
4.2 无机纳米晶
相比于药物纳米晶,无机纳米晶大多由重金属元素构成,其体内行为与毒性密切相关,需要额外关注其生物安全性问题。基于HfO2的纳米晶已经完成部分肿瘤放射增敏临床试验。为了预防HfO2NCs在血液中聚集,Li等[67]开发了一种静脉注射安全的HfO2NCs以增强放疗效果,IR780标记用于其体内示踪,与游离IR780相比,纳米晶组在肿瘤区域明显具有更强的荧光信号,验证了其肿瘤聚集特性。计算机断层扫描(computed tomography,CT)成像也验证了纳米晶的肿瘤富集效果。此外,透射电子显微镜观察肿瘤组织切片确认了纳米晶通过内化作用进入肿瘤细胞。组织分布实验表明,大部分HfO2NCs在3个月内完成体内代谢清除过程。Li等[68]提出了一种同步热疗与热响应性局部释药的方法,研究发现采用抗人表皮生长因子受体2抗体的外壳包裹磁铁矿纳米晶和5-氟尿嘧啶具有癌细胞特异性靶向能力。静脉注射荷瘤小鼠后,主要脏器未见明显病理变化,且药物浓度在肿瘤内的积累在注射后48 h明显高于注射后24 h,这能够在降低全身毒性的同时,显著提高治疗效果。Lv等[69]通过水热法合成了锑掺杂氧化锡纳米晶用于肿瘤光热治疗,并采用CT成像监测瘤内注射纳米晶的体内行为。注射后,肿瘤部位与其他组织对比具有显著的信号,且具有长期驻留肿瘤特性。此外,无机纳米晶的体内行为还与表面修饰有关。Liu等[70]在研究中发现,在纳米晶中通过增加D-生育酚聚乙二醇1000琥珀酸酯(TPGS)的用量,可使癌细胞具有更高的细胞摄取率,纳米晶能够更多地蓄积在肿瘤组织。此外,纳米晶的尺寸大小也会影响其体内行为,例如Gu等[71]发现氧化铁纳米晶尺寸越小,在血液中的循环时间越长,同时纳米晶表面的PEG层也能明显延长它们的体循环;同时小尺寸的纳米晶表现出更快的降解率与清除率,这表明纳米晶的大小与结晶度是决定生物降解率和生物清除率的重要因素。无机纳米晶在成药性方面具有极大的挑战,尤其涉及重金属元素的体内代谢,由此产生的毒副作用需要额外关注,此外,大部分重金属元素在体内具有长期蓄积特性,代谢排泄困难,由此造成的潜在风险大大提高。因此,未来很长一段时间内,在开发新型无机纳米晶的同时,需要重点关注其毒副作用。
4.3 其他纳米晶
虽然CNCs、CQD等在肿瘤诊疗领域内也具有较大的开发价值,然而,与无机纳米晶类似,其体内行为仍需要额外关注。Imlimthan等[72]开发了基于CNCs的分子成像探针,显示出良好的生物相容性;组织分布实验表明,CNCs探针主要被单核吞噬细胞系统(MPS)器官摄取,通过对其化学修饰的优化,可以减少MPS的清除、增加肿瘤组织的蓄积。Tian等[73]系统地研究了CQD对机体的潜在毒性,细胞和动物水平证实CQD与阴性对照之间无显著差异,与生物体内蛋白无较强的生物相互作用,可用作有效的光学纳米探针。纳米晶与体内蛋白的相互作用也会影响其体内行为,De France等[74]发现掺杂CNCs的纳米复合水凝胶具有非特异性蛋白吸附的特性,可以支持较弱的细胞黏附和局部细胞增殖,且可以随着CNCs负载增多而增强。此外,CNCs大部分固定在注射部位并且几乎不在任何器官中积累。虽然这类新型纳米晶材料具有优异的性能,在生物医学的基础研究中获得了一系列有前景的研究成果,然而,在临床前和临床研究过程中,需要注意这类纳米晶材料由于体内吸收、分布、代谢和排泄过程,可能造成潜在的蓄积毒性,进而影响其生物学效应。此外,这些新型材料具有巨大的比表面积,其高吸附性能与生物体内蛋白之间的相互作用尚缺乏深入研究。
5 结语
纳米晶技术的出现有望解决许多生物医学领域内的现有问题,对于肿瘤诊疗甚至整个创新药物研究均具有良好的促进作用,如从微纳水平改善难溶性分子后续开发问题,设计具有更高灵敏度和更好生物相容性的体系用于生物成像和传感,开发增强肿瘤放疗敏感度和提高肿瘤靶向性的药物递送体系等。显然,纳米晶在医药领域中的应用前景是广阔和光明的,但就目前发展而言,纳米晶相关产品的临床转化尚需进一步细化和完善。当前药物纳米晶的临床前研究应当主要聚焦改善成晶技术、提高制备工艺效率和改善晶体稳定性为主。相比之下,无机和其他纳米晶的制备工艺日趋成熟且功能丰富,但由于其体内过程复杂,部分新型纳米晶的毒理问题仍然存疑等原因,其临床转化前景仍然不明,需要加大针对其体内安全性的基础科学研究,而非继续丰富其复杂的功能。因此,纳米晶在肿瘤诊疗中的应用研究还有很长的道路要走,关于该领域的科学研究仍是当下热点。随着纳米晶研究的不断发展和对纳米晶与生物界面交互理解的不断深入,纳米晶在生物医学领域中的应用将迎来崭新的突破。
