滨海沙地8种观赏竹叶片、小枝和细根的化学计量特征
2022-04-15郑俊鸣荣俊冬洪小龙陈礼光何天友陈凌艳郑郁善
张 盟, 郑俊鸣, 李 磊, 荣俊冬, 洪小龙, 陈礼光, 何天友, 陈凌艳, 郑郁善
(1.福建农林大学林学院,福建 福州 350002;2.福建农林大学园林学院,福建 福州 350002; 3.福建省东山赤山国有防护林场,福建 漳州 363400)
化学计量特征指有机体的元素组成,主要研究植物体内化学元素的平衡关系[1].C、N、P是植物生长发育的基本元素,能较好地指示植物的养分分配状况和利用效率[2-3].植物体内的C、N、P含量与植物生长发育、生命活动密切相关,对维系森林生态系统养分循环和能量流动等方面发挥着重要作用[3].C是植物体内干物质的主要元素,是植物生命活动过程的底物和能量来源;N、P是蛋白质和遗传物质的重要组成元素[4].C∶N、C∶P反映了植物对土壤营养吸收效率及碳同化的能力[5];N∶P能反映植株的养分限制情况[6-8].通过化学计量特征研究,能揭示植物养分的分配格局、养分利用效率及对环境的适应方式.毛竹(Phyllostachysedulis)及其变种不同器官的养分分配格局存在差异,通过多种元素相互作用以适应环境[9].滨海沙地木麻黄(Casuarinaequisetifolia)等5种人工林树种主要受到P的限制,进一步证明滨海沙地土壤中的P严重缺乏[10-11].目前,化学计量特征的研究区域主要在亚热带森林[5]、草地[12]、沙漠[13]和滨海沙地[1]等.滨海沙地植被主要是人工林,竹种相对较少,研究对象主要集中在木麻黄、湿地松(Pinuselliottii)和潺槁木姜子(Litseaglutinosa)等常见的树种,而有关滨海沙地竹类植物C、N、P含量的研究相对较少.植物不同器官间的C、N、P含量及化学计量比会受到植物基本生理需求、器官组织结构和功能分化的影响[1,14].植物不同器官和生活型的养分利用效率存在差异[15],但滨海沙地上的适生观赏竹是否也遵循该规律有待揭示.鉴于此,本研究对8种观赏竹不同方位、不同器官(叶片、小枝、细根)以及不同生活型的化学计量特征开展研究,旨在揭示滨海沙地观赏竹的养分利用效率、限制元素和适应方式,为沿海防护林景观建设提供参考.
1 研究区概况
研究区位于福建省漳州市东山县东山岛(北纬23°40′,东经118°18′),属于亚热带海洋性季风气候,干湿季节明显,湿季集中在5—9月,旱季集中在11月至翌年2月.东山岛10月至翌年3月有大风98 d,占大风天数的80%;风速6~8 m·s-1,年均风速7.1 m·s-1;年降水量1 113.9 mm,蒸发量2 013.2 mm;年均气温20.8 ℃,极高气温36.6 ℃,极低气温3.8 ℃;平均径流量481 mm[16].台风和干旱是当地主要的自然灾害,台风多发于7—8月.
2 研究对象与方法
2.1 研究对象
选取木麻黄林下的‘绿竹’(Bambusaoldhamii)、‘鼓节竹’(Bambusatuldoides‘Swolleninternode’)、‘青丝黄竹’(Bambusaeutuldoidesvar.viridivittata)、‘花吊丝竹’(Dendrocalamusminorvar.amoenus)、‘福建茶秆竹’(Pseudosasaamabilisvar.convexa)、‘矢竹’(Pseudosasajaponica)、‘实肚竹’(Phyllostachysnidulariaf.farcata)和‘四季竹’(Oligostachyumlubricum)为研究对象.8个竹种均以600株·hm-2的初始密度种植在木麻黄林下的空地上,与木麻黄进行不规则混交.8个竹种的引种时间均在5 a以上,自引种以来均为自然生长,未采取人工抚育措施,适应能力相对较强,生长情况良好.8个竹种和木麻黄的混交林距海岸的垂直距离为500~800 m.于2019年10月对试验竹林的基本情况进行调查,结果如表1所示.
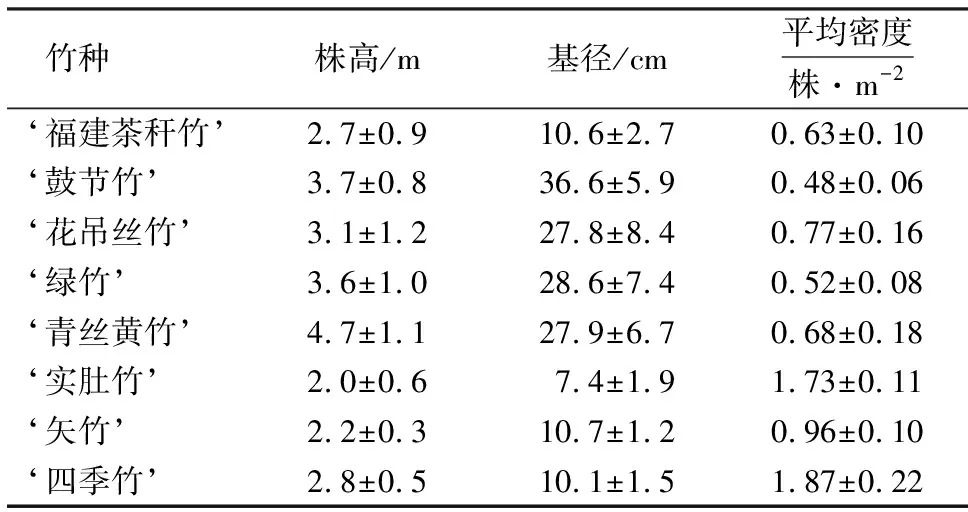
表1 试验竹林的基本情况1)Table 1 Basic information of bamboo forest
2.2 样品采集与测定
2019年8—10月于东山赤山防护林场内对8种观赏竹的叶片、小枝和细根进行采集.每种植物选取5~10株,在每株植物上摘取东、南、西、北4个方位的完全展开且未遮荫的当年新生的叶片,移去叶柄;在每株上选取不同方位末端的无分枝、无花、无果且已展叶完成的当年生小枝各8~10根;在每种植物上选取4个方位的细根,先去除土壤表面的腐殖质层,再挖取完整根系带回实验室,并将直径>2 mm的根系及其他物种的根系去除.每竹种设置3个重复.将叶片、小枝和细根放在烘箱中于105 ℃杀青0.5 h,后放置于80 ℃烘箱中干燥72 h至恒重,研磨成粉末状,过100目(0.149 mm)筛后放置于干燥器内备用.叶片、小枝和细根的全C含量采用重铬酸钾—外加热法测定,全N含量采用半微量凯氏定氮法测定,全P含量采用钼锑抗比色法测定[17].
2.3 数据处理
数据为平均值±标准差.运用Excel 2013软件进行数据汇总和统计,运用SPSS 19.0软件对指标进行单因素方差分析,运用成对比较检验(Tukey法)多重比较不同竹种和方位之间的差异性.灌木竹和乔木竹的C、N、P含量及化学计量比的差异性采用独立t检验.竹种和方位对指标的影响采用双因素方差进行分析.数据分析运用SPSS 19.0软件和R语言(version 3.6.1)完成.
3 结果与分析
3.1 观赏竹不同品种的C、N、P含量及化学计量比
表2显示:8种观赏竹叶片的C含量为448.40~494.19 g·kg-1,N含量为17.32~24.27 g·kg-1,P含量为0.87~1.76 g·kg-1;小枝的C含量为394.92~511.63 g·kg-1.‘矢竹’叶片的N含量最低,‘实肚竹’和‘福建茶秆竹’叶片的P含量最低,显著低于其他竹种(P<0.05).‘绿竹’细根的N含量最低,仅为6.74 g·kg-1,‘矢竹’细根的N含量最高,达15.22 g·kg-1;‘福建茶秆竹’、‘实肚竹’和‘绿竹’细根的P含量最低,显著低于其他竹种(P<0.05).
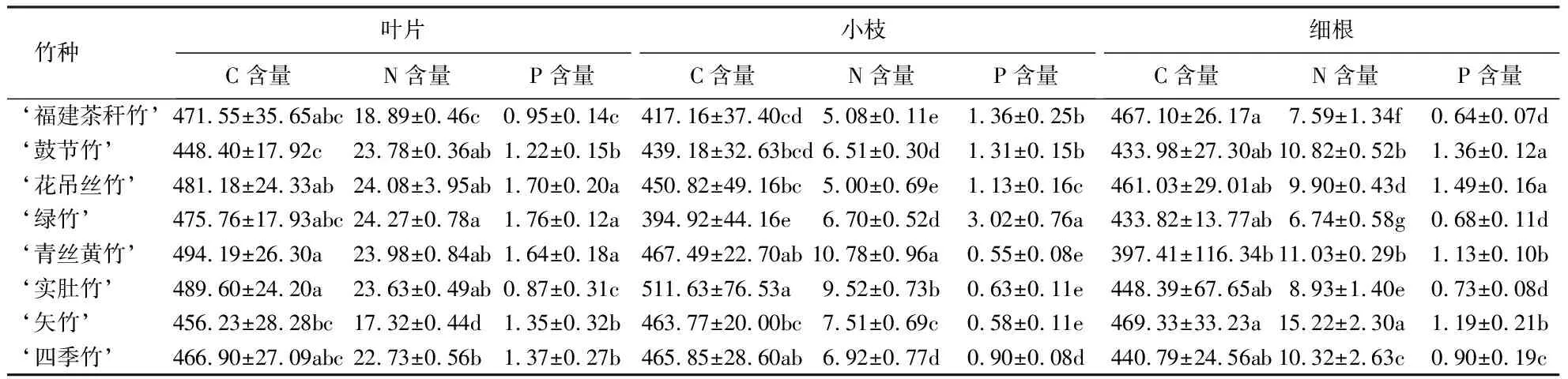
表2 8种观赏竹3个器官的C、N、P含量1)Table 2 C, N and P contents in 3 organs of 8 ornamental bamboos g·kg-1
表3显示:‘福建茶秆竹’和‘矢竹’叶片的C∶N最高,分别为24.98、26.33,二者无显著差异(P>0.05);‘实肚竹’叶片的N∶P最高,为30.71;‘花吊丝竹’小枝的C∶N最高,为92.12;‘福建茶秆竹’和‘绿竹’细根的C∶N最高,分别为63.22、64.69,二者无显著差异(P>0.05).

表3 8种观赏竹3个器官的C、N、P化学计量比1)Table 3 C, N and P stoichiometry ratios in 3 organs of 8 ornamental bamboos
3.2 观赏竹不同方位的C、N、P含量及化学计量比
表4显示:‘绿竹’西面叶片的C含量显著高于南面叶片(P<0.05);‘四季竹’南面叶片的C含量显著高于东面和西面叶片(P<0.05);‘青丝黄竹’南面叶片的N含量最高,为25.33 g·kg-1,显著高于其他方位的叶片(P<0.05);‘绿竹’南面叶片的N含量最低,为23.17 g·kg-1;‘四季竹’南面叶片的N含量显著高于东面和北面叶片(P<0.05).‘实肚竹’西面小枝的N含量显著高于其他方位的小枝(P<0.05);‘福建茶秆竹’西面小枝的P含量显著高于其他方位的小枝(P<0.05).‘福建茶秆竹’东面细根的N含量显著高于其他方位的细根(P<0.05);‘花吊丝竹’东面和南面细根的N含量高于其他方位的细根(P<0.05).
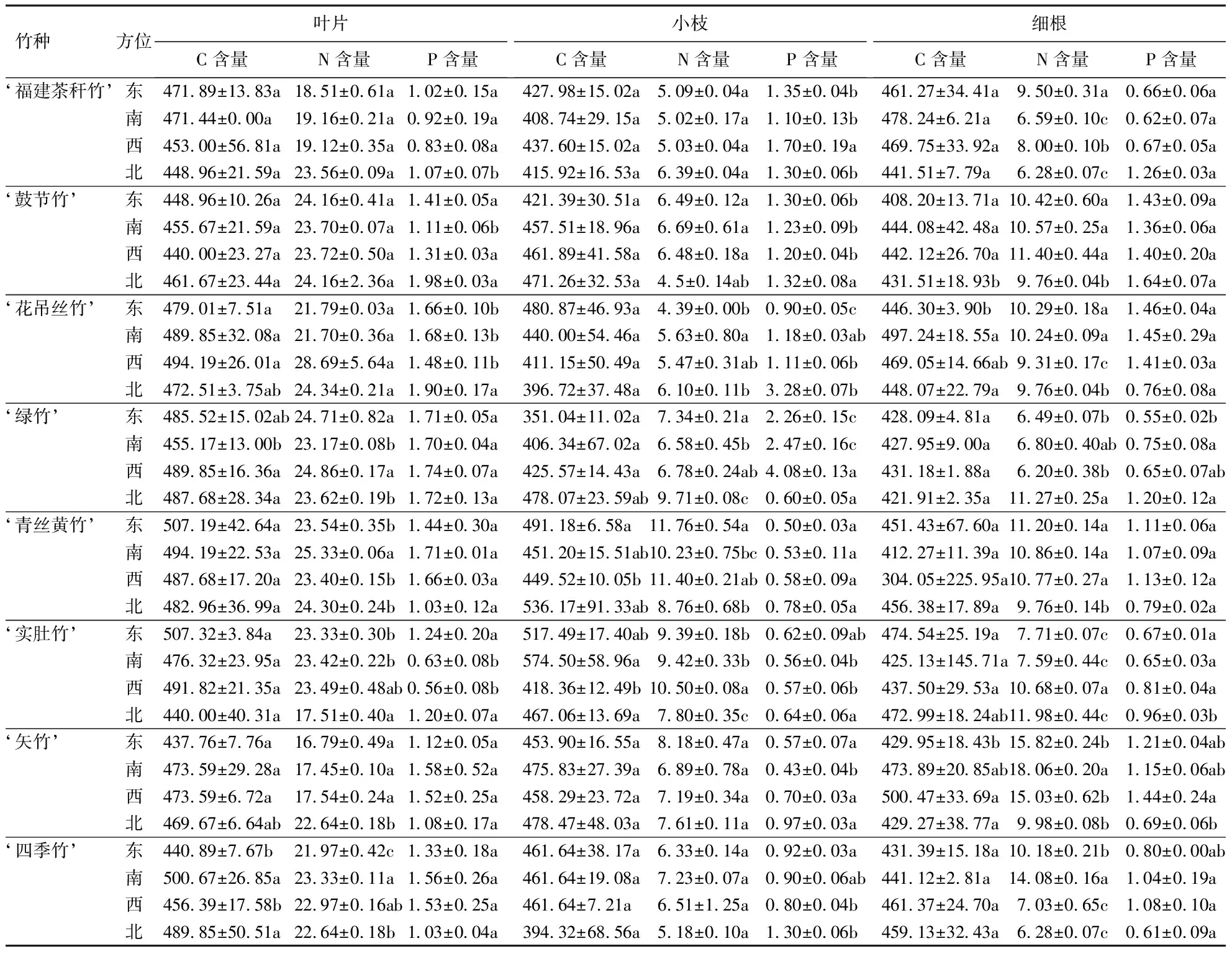
表4 8种观赏竹3个器官不同方位的C、N、P含量1)Table 4 C, N and P contents of bamboo organs grown in different directions g·kg-1
表5显示,8种观赏竹叶片在4个方位的C∶N差异不显著(P>0.05).‘实肚竹’西面小枝的C∶N最低,仅为39.84;‘福建茶秆竹’东面细根的C∶N最低,仅为48.57,最高的为北面和南面,分别为73.08、72.54;‘绿竹’东面细根的C∶P为785.50,显著高于南面和北面细根(P<0.05).

表5 8种观赏竹3个器官不同方位的C、N、P化学计量比1)Table 5 C, N and P stoichiometry ratios in bamboo organs grown in different directions

续表5
3.3 观赏竹不同器官和生活型的C、N、P含量及化学计量比
表6显示:观赏竹叶片的C、N、P含量和N∶P显著高于小枝和细根(P<0.05),叶片的C∶N显著低于小枝和细根(P<0.05);小枝的N含量最低,仅为7.25 g·kg-1;细根的P含量最低,仅为1.01 g·kg-1;小枝和细根的C含量、N∶P、C∶P无显著差异(P>0.05).灌木竹和乔木竹的N含量、C∶N无显著差异(P>0.05);灌木竹的C含量、N∶P、C∶P显著高于乔木竹(P<0.05),而灌木竹的P含量显著低于乔木竹(P<0.05).
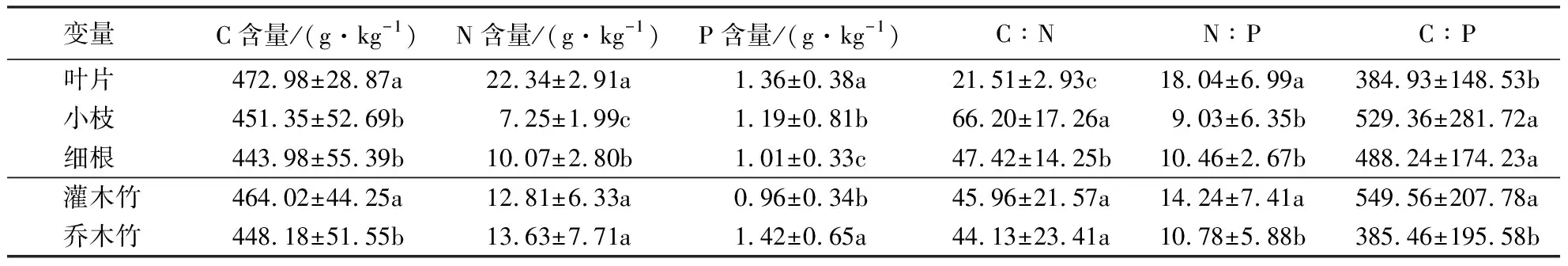
表6 观赏竹不同器官和生活型的C、N、P含量及化学计量比1)Table 6 C, N and P contents and stoichiometry ratios in various organs of ornamental bamboos with different morphological features
3.4 观赏竹不同品种和方位对C、N、P含量及化学计量比的影响
表7显示:竹种对C、N、P含量及化学计量比均有显著影响(P<0.05);方位对叶片的N含量,小枝的N、P含量,细根的N、P含量,叶片、小枝和细根的N∶P、C∶P有显著影响(P<0.05).竹种和方位具有交互作用,仅对叶片、细根的C含量和叶片的C∶N无显著影响(P>0.05).
4 讨论
4.1 观赏竹不同品种叶片的C、N、P含量及化学计量比
C、N、P与植物生长、发育、生命活动密切相关,在维系森林生态系统养分循环和能量流动等方面发挥着重要作用[3].全球陆生植物叶片C、N、P的平均含量分别为464.00、20.60、1.99 g·kg-1[4],中国陆生植物叶片N、P的平均含量分别为20.20、1.46 g·kg-1[2].本研究中,8种观赏竹叶片C、N、P的含量分别为472.98、22.34、1.36 g·kg-1,大于全球陆生植物叶片的C、N平均含量,而P含量低于全球和中国陆生植物叶片的平均P含量.8种观赏竹叶片的C含量较高,表明其碳储存能力较强.大气氮沉降有助于增强竹类植物,如毛竹的碳固定能力[18].观赏竹与木麻黄林组成的混交林群落,群落中木麻黄的根瘤存在弗兰克氏菌,能固定空气中的N,并转化为有效N,提高土壤N含量[19].而竹类植物的无性繁殖能帮助其迅速吸收土壤中的N,使竹叶中的C、N含量相对较高.滨海沙地土壤的P含量相对较低,树种生长主要受到P的限制[10-11],加上沙地养分流失相对较快,导致竹叶的P含量相对较低.
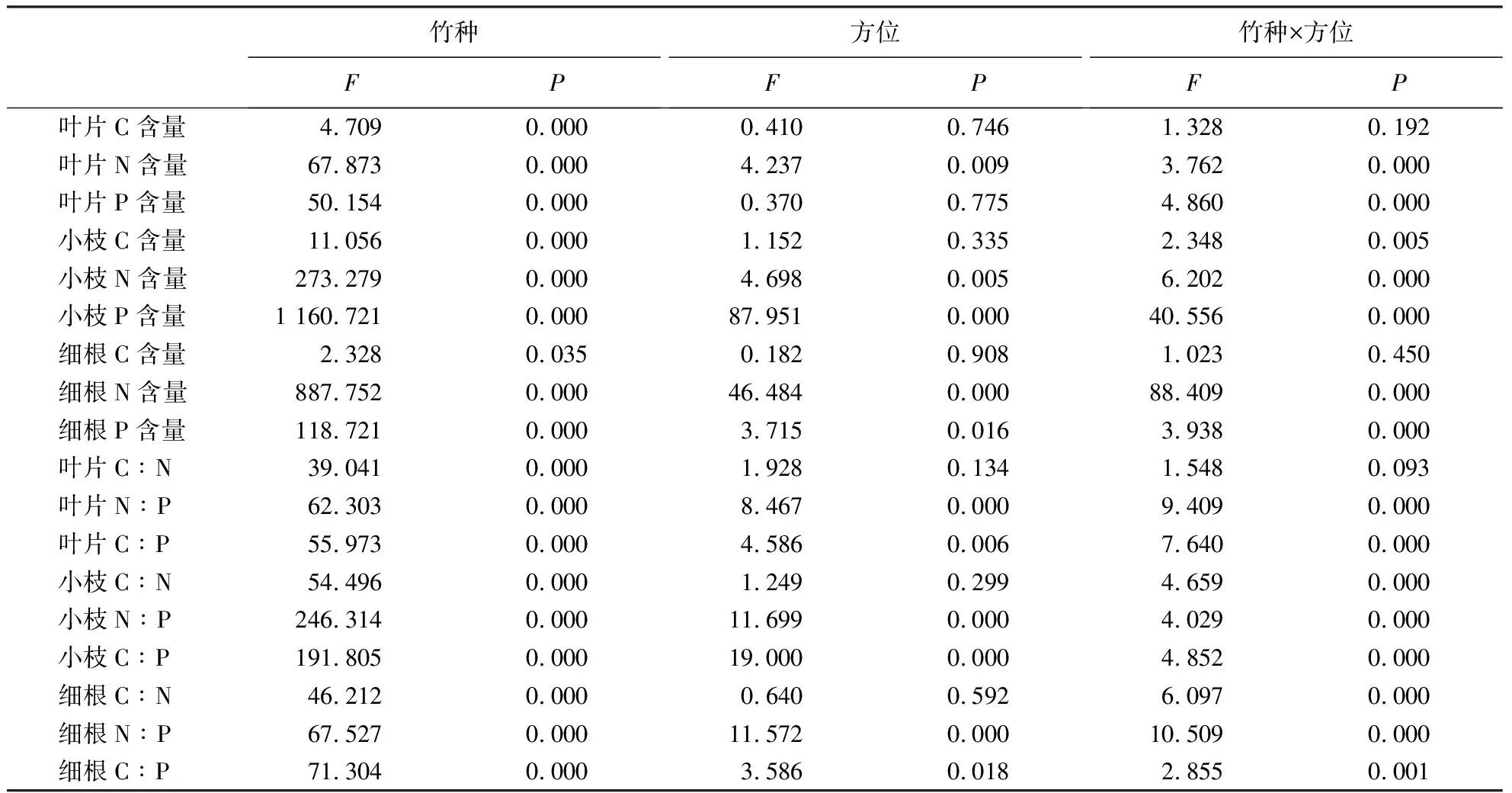
表7 观赏竹不同品种和方位对C、N、P含量及化学计量比的影响Table 7 Effects of species and directions on C, N and P contents and stoichiometry of ornamental bamboos
C∶N、C∶P反映了植物在进行碳同化的时候,对土壤养分的吸收效率[5].叶片的C∶N、C∶P越低,表明植物的生长速率越快,对N、P的吸收效率就越高[2].植物组织、凋落物和土壤中的C、N含量及C∶N在干旱环境下均下降[20].全球陆生植物叶片C∶N、C∶P的平均值分别为22.5、232[4].本研究中,8种观赏竹叶片的C∶N为21.51,比全球陆生植物叶片更低;叶片的C∶P为384.93,比全球陆生植物叶片更高.竹叶碳同化能力强,但受干旱环境的影响,C∶N相对较低.沙地土壤的P含量较低[10],使C∶P相对较高.与滨海沙地的木麻黄和湿地松的C∶N、C∶P相比[1],8种观赏竹的C∶N、C∶P相对较低,表明观赏竹对土壤N、P的利用效率较低.N∶P反映了群落水平上叶片的养分限制情况.叶片的N∶P为14~16时受N、P的共同限制,N∶P高于16时受P的限制,N∶P低于14时则受N的限制[6-8].滨海沙地木麻黄等5个树种较大程度受到了P的限制,可能是这5个树种具有较高的固氮能力,使得N∶P大于16[11].本研究中,8个竹种的限制元素并不完全相同,‘绿竹’和‘矢竹’的生长受到N限制,‘福建茶秆竹’、‘鼓节竹’、‘实肚竹’和‘四季竹’的生长受到P限制,而‘花吊丝竹’和‘青丝黄竹’的生长受到N、P的共同限制,由此表明不同竹种对养分的吸收利用具有差异性.土壤是植物体内营养元素的主要来源,土壤养分含量与植物体内营养元素含量息息相关[21],沙地土壤养分较低[16],滨海沙地土壤中的P严重缺乏已被证实[10].由此说明,植物的养分限制情况并不完全取决于土壤情况,竹种本身的差异也是一大因素.研究表明,‘四季竹’的生长主要受到土壤N的影响[22];而本研究中的‘四季竹’主要受P的影响.造成这种差异一方面可能受调查样地的环境条件差异导致,沙地营养元素容易流失,P由于淋溶作用逐渐减少;另一方面可能是竹种本身对养分需求的差异造成的,这一因素有待在将来的研究中进一步证实.
4.2 观赏竹不同品种细根的C、N、P含量及化学计量比
中国陆生植物细根C、N、P的平均含量分别为473.9、9.2、1.0 g·kg-1,C∶N、C∶P、N∶P的平均值分别为59.15、522.10、14.27[23];全球陆生植物细根C、N、P的平均含量分别为447、9.8、0.78 g·kg-1,C∶N、C∶P、N∶P的平均值分别为65.8、1415、16.0[24];本研究中,8种观赏竹细根C、N、P的含量分别为443.98、10.07、1.01 g·kg-1,C∶N、C∶P、N∶P分别为47.42、488.24、10.46.表明观赏竹细根的N含量高于中国和全球陆生植物细根的平均N含量;观赏竹细根的P含量与中国陆生植物细根的平均P含量相差不多,但高于全球陆生植物细根的平均P含量.禾本科植物的体内和根际有内生和根际固氮菌[25],观赏竹细根的N含量相对较高,可能与其体内或根际有固氮菌有关.观赏竹细根的C含量及C∶N、C∶P、N∶P均低于中国和全球陆生植物的平均水平.由N∶P可知,中国和全球陆生植物的生长主要受到N、P的共同制约,而滨海沙地观赏竹细根的生长主要受N的限制(N∶P=10.46<14.0),表明细根的生长需要大量的N以加快生长速率和代谢活动.植物在组织快速生长阶段需要富含P的rRNA以合成蛋白质,使得植物组织内的P含量升高[26],细根的P含量越高,根系生长越快[27].对比滨海沙地木麻黄等5个树种细根的P含量[10],8种观赏竹细根的P含量相对更高,表明观赏竹的细根在滨海沙地生长迅速,根系的生长具有较强的优势.
4.3 观赏竹不同器官和生活型的C、N、P含量及化学计量比
植物基本生理需求的差异、器官的组织结构和功能分化导致不同器官的化学计量特征存在差异[1,14].本研究中,观赏竹叶片的C、N、P含量和N∶P显著高于小枝和细根(P<0.05).植物不同器官的C、N、P含量随着环境养分的限制而呈现差异,表明植物为了适应环境中的养分限制状况而对不同器官的养分含量及化学计量比进行了调整与分配[12].叶片是碳同化和代谢的主要器官,植物将大量的营养运输至叶片以满足生长需要[28].小枝和细根作为吸收和运输养分的器官,缺少贮存养分的功能[29],使小枝和细根的N、P含量显著低于叶片(P<0.05).本研究中,观赏竹叶片的N含量约为细根的两倍,叶片的P含量与细根相当,该现象与徐冰等[30]的研究结果相符.在养分贫瘠的环境中,根系吸收养分供应地上部分,以维持叶片的N、P含量处于较高水平,保证植株的生活史能正常完成[31].本研究中,8种观赏竹小枝和细根的C含量差异不显著(P>0.05);小枝的C∶N最大;小枝和细根的C∶P最大,二者之间的差异不显著(P>0.05):表明小枝和细根的N、P含量对C∶N、C∶P存在显著影响.影响C∶N、C∶P最主要的因素是N、P的含量[32].8种观赏竹小枝的N含量和细根的P含量最低,小枝和细根的N∶P小于14,主要与器官的养分吸收、运输、分配规律有关[29].
不同生活型的植物在生态系统功能上存在差异,这种差异是植物系统发育或植物对环境适应的结果[13].不同生活型的植物对养分利用的方式不同[15].不同生活型的植物,其生长速率具有差异,灌木竹叶片的C含量显著高于乔木竹,而灌木竹叶片的P含量显著低于乔木竹(P<0.05),表明灌木竹同化积累C的能力显著高于乔木竹,灌木竹对P的吸收能力显著低于乔木竹,进一步证明了生活型的差异导致了植物碳同化能力和养分吸收能力的差异.
5 结论
滨海沙地不同竹种和器官的养分吸收利用效率和适应方式存在差异.8个竹种的生长限制元素不完全相同,‘绿竹’和‘矢竹’受N限制,‘福建茶秆竹’、‘鼓节竹’、‘实肚竹’和‘四季竹’受P限制,而‘花吊丝竹’和‘青丝黄竹’受N、P的共同限制.叶片是吸收和贮存养分的重要器官,其养分含量显著高于小枝和细根.生活型差异使植物碳同化和养分吸收能力产生分化,灌木竹碳同化能力显著高于乔木竹,而对P的吸收能力显著低于乔木竹.因此,在今后对其他植物进行化学计量特征的相关研究时,需要充分考虑竹种和生活型的差异,减少此类差异给研究结果带来影响.此外,可以进一步结合试验林所在地的土壤和凋落物的化学计量特征开展耦合研究,以更加全面、深入地探究竹类植物养分循环情况和利用效率,从而更加科学地开展防护林景观建设,维护滨海沙地森林可持续经营.
