甜菜组蛋白去乙酰化酶(HDACs)基因家族鉴定及功能预测
2022-04-15王琳玉蒋依辰于清洋吴则东
王琳玉,蒋依辰,于清洋,吴则东,邳 植
(1黑龙江大学现代农业与生态环境学院,哈尔滨 150080;2黑龙江省普通高校甜菜遗传育种重点实验室/黑龙江大学,哈尔滨 150080)
0 引言
组蛋白乙酰化修饰作为表现遗传调控的重要机制之一,参与了植物生长、发育和胁迫响应等过程[1]。组蛋白乙酰转移酶(Histone acetyltransferase,HATs)和组蛋白去乙酰化酶(Histone deacetylase,HDACs)可通过改变组蛋白电荷属性促进或抑制基因表达[2],从而催化可逆的组蛋白乙酰化修饰。在植物研究中,组蛋白乙酰化修饰与植物成花转变密切相关。在拟南芥中,AtMSI1介导的H3K9ac能够调控开花整合基因AtSOC1的表达,从而决定开花抽薹[3]。AtMSI1能够与组蛋白去乙酰化酶AtHDAC6相互作用,参与H3K9的去乙酰修饰[4]。AtMSI4(又称AtFVE1)参与CORs和CBFs等基因对低温的应答[5]。同时,能够识别AtFLC组蛋白H4,通过去乙酰化修饰调控AtFLC转录,参与调控春化途径[6]。fve突变体内组蛋白乙酰化修饰水平显著升高,具有明显的晚花表型。相反,在拟南芥aldh3f1突变体组蛋白H3乙酰化修饰水平显著降低,低水平的H3K9Ac显著抑制AtFLC基因表达,导致突变体表现出明显的早花现象[7]。
真核生物HDAC家族包含RPD3/HDA1、SIR2、HD2三个亚家族[8]。RPD3/HDA1亚家族是一类Zn+依赖型HDAC,催化中心由2个Asp、2个His和1个Tyr组成。该亚家族成员数目最多且保守性较高。SIR2亚家族成员是一类NAD+依赖型HDAC,具有一个保守的SIR2domain,但在N-和C-末端序列差异较大[9]。在生物和细菌中一般含有1-2个SIR2基因,在真核生物中通常具有多个SIR2基因,例如人类中包含7个SIR基因、拟南芥中包含2个SIR基因。HD2亚家族是植物特有的一类HDAC,该家族成员在N-末端通常具有一个保守的MEFW序列和100个氨基酸左右的催化domain,该区域蛋白序列与the nucleoplasmin-like domain(NPL)具有较高的相似度。对拟南芥HDTs进行基因敲除发现,HD2亚家族成员广泛参与成花转变和种子发育等形态建成[10]。
甜菜(Beta vulgarisL.)苋科二年生草本植物,作为主要糖料作物提供全球20% ~30%的糖产量[11]。低温引起的春化作用是决定甜菜生长期的重要因素,影响甜菜块根的产量和含糖率[12]。前人研究已经成功从甜菜基因组中克隆了BvBTC1、BvFT1、BvFT2等多个春化相关基因,初步解析了一年生和二年生甜菜春化的分子机制[13]。目前,拟南芥和冬小麦等作物中的研究表明,组蛋白乙酰化修饰等表观遗传调控是植物记忆冬季低温和剂量春化时间的重要方式[14]。那么甜菜基因组中有哪些HDACs成员?其中哪些成员可能参与调控甜菜的春化作用?因此,研究BvHDACs基因家族成员在甜菜春化中的作用是非常有必要的。
本研究以HDAC特征domain和拟南芥HDAC蛋白序列为起始,通过HMMsearch和BLAST在甜菜基因组中对HDAC家族成员进行分析[15]。利用HMMER、iqtree、TBtools等 生 物 信 息 学 工 具 对BvHDACs基因家族成员基因结构、进化关系、染色体分布、春化过程表达模式进行分析,为解析BvHDACs基因家族成员在甜菜春化作用中的功能提供必要信息。
1 材料与方法
1.1 BvHDACs基因家族的鉴定
首先,分别从NCBI、Phytozome和甜菜数据库(http://bvseq.molgen.mpg.de)下载人类、小鼠、果蝇、拟南芥、水稻、大豆、甜菜蛋白质组数据。以E-value<1E-10和score>50为阈值,利用HMMsearch程序在人类、小鼠、果蝇、拟南芥、水稻、大豆、甜菜蛋白质组中检索含有Hist_deacetyl(PF00850)或SIR2(PF02146)功能结构域的蛋白质,分别鉴定为RPD3/HDA1和SIR2亚家族成员。由于目前没有HD2亚家族的HMM模型,采用Blastp和HMMscan相结合的方式筛选HD2亚家族成员。以拟南芥AtHDT1-4蛋白序列检索各物种中E-value<1E-5且 score>50的同源序列。随后,通过HMMscan筛选N-末端仅含有NPL domain(PF17800)的蛋白质,鉴定可能是HD2亚家族成员。
1.2 HDAC基因家族系统进化树的构建
利用Cluster Omega对筛选出的RPD3/HDA1、SIR2和HD2亚家族成员进行序列比对,所有参数采用默认值[16]。选择乙酰氨基葡萄糖脱乙酰化酶(AtLPXCA1)作为外类群,利用iqtree采用最大似然树法构建进化树。根据ModelFinder计算结果,选择VT+I+G4为最优模型,Bootstrap设置为1000。最后,使用EvolView工具对HDAC家族成员进化树进行可视化[17]。
1.3 BvHDACs家族成员基因特征的分析
利用TBtools软件从甜菜基因组gff文件中提取HDAC基因家族成员基因组定位、外显子和内含子位置信息,并绘制的染色体定位图谱。通过Expasy计算HDAC基因家族成员编码蛋白分子量和等电点,蛋白功能结构域信息通过HMMscan进行检索。
1.4 转录组分析BvHDACs家族成员表达模式
将KWS9147甜菜种子播种在方形花盆(12 cm×12 cm×10 cm),在温度24±2℃,光照强度200 μmol/(m2·s)和16 h/8 h光周期的温室中进行培养。待播种后24天,将甜菜幼苗转移到4±2℃,200 μmol/(m2·s)光强和16 h/8 h光周期的冷窖中进行春化处理。在春化0、2、6、10、14周后将不同程度春化幼苗移入温室继续进行培养,测定各处理甜菜幼苗抽薹率。同时,剪取甜菜幼叶,提取RNA建库并进行转录组测序,分析春化过程中甜菜HDAC基因家族成员表达模式。
1.5 BvHDACs家族成员蛋白互作网络分析
运用STRING(https://string-db.org/)数据库在线分析BvHDACs家族蛋白互作关系,分别筛选出与蛋白界面两个表面结构相似的蛋白对,通过SEARCH得到蛋白互作网络,再从STRING中导出蛋白互作关系结果(参数为物理互作类型且score>0.4)。最后,使用cytoscape绘制网络图[18]。
2 结果与分析
2.1 BvHDACs家族成员蛋白理化性质
16个BvHDACs家族成员的氨基酸长度、分子量大小和等电点都存在较大差异。表1可知,RPD3/HDA1亚家族成员通常氨基酸长度在350 aa ~500 aa,蛋白分子量在40 kDa ~70 kDa,蛋白质等电点在5.0 ~6.5之间。BvHDAC3与其他成员理化性质差异较大,该基因编码蛋白氨基酸序列较短,仅124 aa,分子量13.5 kDa,等电点为8.49。3个HD2亚家族成员蛋白质长度均为290 aa左右,分子量在31k ~32 kDa,蛋白质等电点在4.6 ~4.7之间。SIR2亚家族成员中BvSIRT1-3具有相似的理化性质,氨基酸长度在43k ~56 kDa,分子量在43k ~55 kDa,等电点均大于7。BvSIRT4蛋白长度和分子量均小于其他SIR2成员,等电点为6.04。根据亚细胞定位预测,16个BvHDACs中有8个基因编码蛋白具有明确的核定位信号。在人类HDACs中,II和IV类HDAC可能同时位于细胞质和细胞核中,与BvHDAC2、BvHDAC5、BvHDAC7、BvHDAC8被预测定位于细胞质中相符。此外,这些HDAC可能与其他蛋白形成复合体从而进入细胞核。
2.2 HDAC基因家族的系统进化树分析
通过HMMsearch和Blastp方法在甜菜基因组内共检索HDAC家族成员16个。图1可知其中,9个基因属于RPD3/HDA1亚家族,SIR2亚家族共有4个甜菜基因,HD2亚家族成员共有3个。为了进一步了解甜菜HDAC家族成员的分类及系统发育关系,分别从挑取不同动物(人类、小鼠)、昆虫(果蝇)、植物(拟南芥、水稻、大豆)HDAC家族成员构建系统进化树。结果显示,部分BvHDACs与HsHDACs具有较近的亲缘关系(BvHDAC3、BvSIRT4),但是大部分甜菜HDACs与植物HDACs构成单独分枝,暗示HDACs在动植物中独立进化参与不同的生物学过程。RPD3/HDA1亚家族成员最多,根据Milazzo等研究结果,该亚家族包括3个组(Class I ~III)。BvHDAC1、BvHDAC3、BvHDAC6、BvHDAC8-9与HsHDAC1-3、HsHDAC8共同归属于Class I。其中,BvHDAC3与HsHDAC3亲缘关系较近,BvHDAC1和BvHDAC6则与其他植物HDACs组成单独一支。Class II包含多个独立分枝且动植物基因成员之间具有较大差异,BvHDAC4、BvHDAC5、BvHDAC7则分别位于植物特有的亚枝。Class III基因数目最少,仅有BvHDAC2归属于该组。SIR2亚家族中包括3个大枝,其中BvSIRT1和BvSIRT3与HsSIRT1、AtSRT1具有较高相似性。BvSIRT2、BvSIRT4则与HsSIRT4、HsSIRT5、AtSIRT2位于同一分枝。HD2为植物特有的HDAC亚家族,BvHDT1和BvHDT2与AtHDT1、AtHDT2和AtHDT4亲缘关系较近。而BvHDT3与单子叶植物HDTs位于同一分枝。
2.3 BvHDACs染色体定位分析
利用TBtools软件预测了候选的HDACs基因在染色体上的分布情况。在甜菜中,BvHDACs基因家族成员它们不均匀的分布在染色体上的见图2。其中,BvHDAC9位于Chr-2,但并没有明确挂载染色体中的具体位置。在Chr-4染色体上分布2个基因,分别为BvSIRT2和BvSIRT1定位到染色体的中上端的下末端。在Chr-5染色体上分布有3个基因,其中BvHDAC7和BvHDAC5并未定位到染色体的具体位置。BvHDAC6则定位到了染色体Chr-5的下端。在Chr-6染色体上端分布有1个基因(BvHDAC4)。在Chr-7染色体上分布有2个基因BvHDT3和BvHDAC8,分别定位染色体的上端与下端。在Chr-9染色体上分布有3个基因,其中BvHDT1和BvHDT2在染色体中距离较近,可能由于串联重复事件产生。
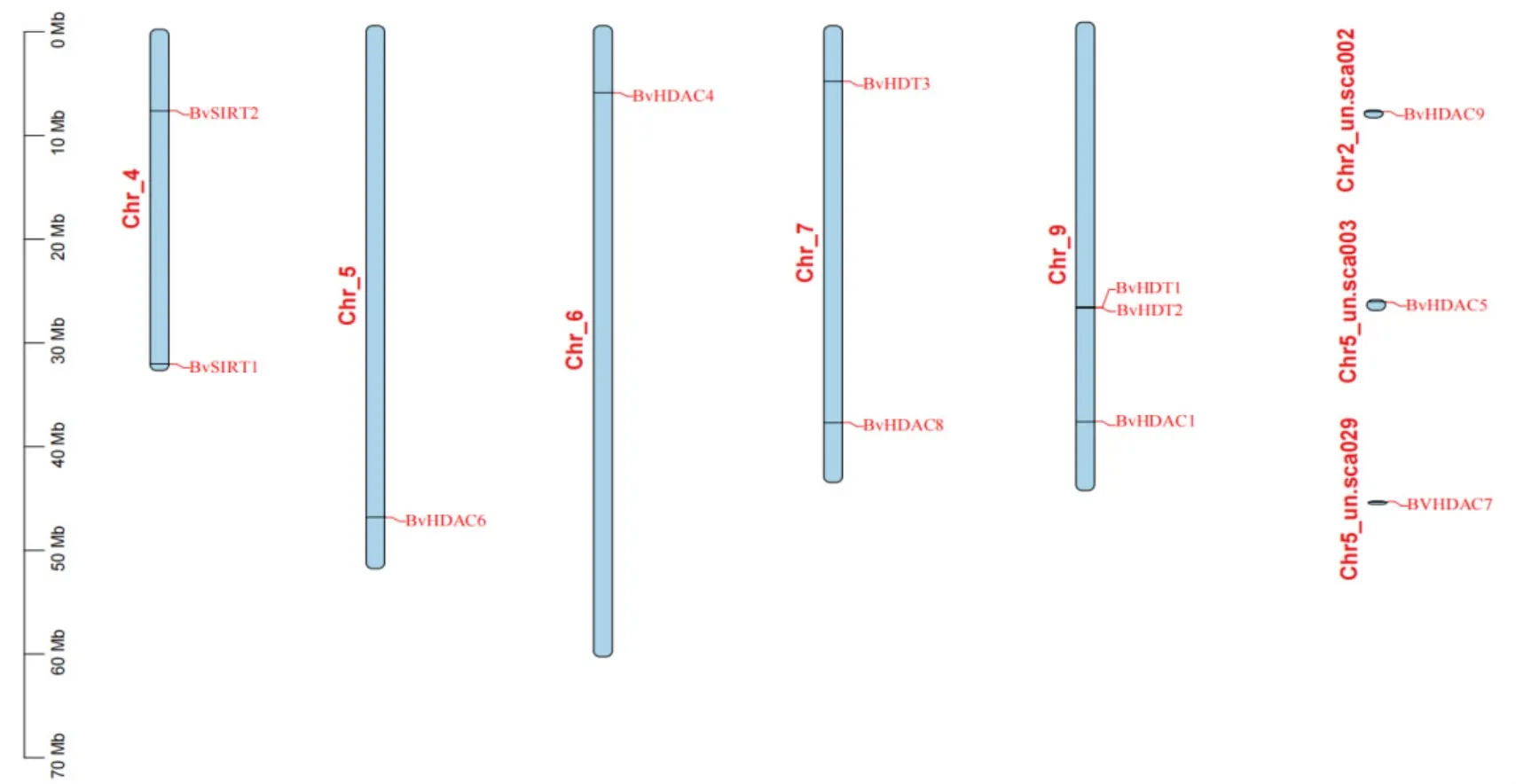
图2 BvHDACs基因染色体定位
2.4 BvHDACs家族成员基因结构分析
为了更加详细的了解甜菜HDAC家族成员特征,对BvHDACs外显子和内含子分布情况及蛋白质功能结构域进行分析见图3。结构表明,甜菜HDAC家族成员通常含有7 ~16个外显子。BvHDAC3、BvHDAC8和BvSIRT4含有较少的外显子,分别为4个、3个和1个。其中,BvHDT1和BvHDT2不仅在染色体中的位置相邻,同时外显子和内含子分布相同,说明这2个基因为串联重复基因。蛋白结构域方面,各HDAC亚家族内成员间domain分布具有较高的相似性。RPD3/HDA1和SIR2亚家族成员分别仅含有hist_deacetyl和SIR2功能结构域。HD2家族成员均在N末端含有一个NPL domain。

图3 BvHDACs家族成员进化关系、基因结构和保守基序分析
2.5 BvHDACs家族成员在春化过程中的表达模式
春化处理后甜菜生长受到明显抑制,但不会导致甜菜幼苗死亡。春化处理2周和6周后甜菜春化时间不充足,在后续长日照室温条件下培养并不发生抽薹开花现象。约有67%的甜菜幼苗在春化10周后能够抽薹开花。春化14周后,几乎所有幼苗(96%)在后续长日照室温培养中抽薹开花。通过检测不同春化时间甜菜转录组数据发现(图4),RPD3/HDA1亚家族成员在低温处理后均出现上调变化。其中,BvHDAC1、BvHDAC2、BvHDAC5、BvHDAC6变化程度达到显著水平。SIR2亚家族成员中仅有BvSIRT1在春化过程中显著上调。值得注意的是,BvHDT1和BvHDT2在春化6 ~10周后显著下调,基因表达量与春化后抽薹率的spearman相关系数分别为-0.824和-0.813。这暗示BvHDT1和BvHDT2可能与甜菜剂量春化时间相关。
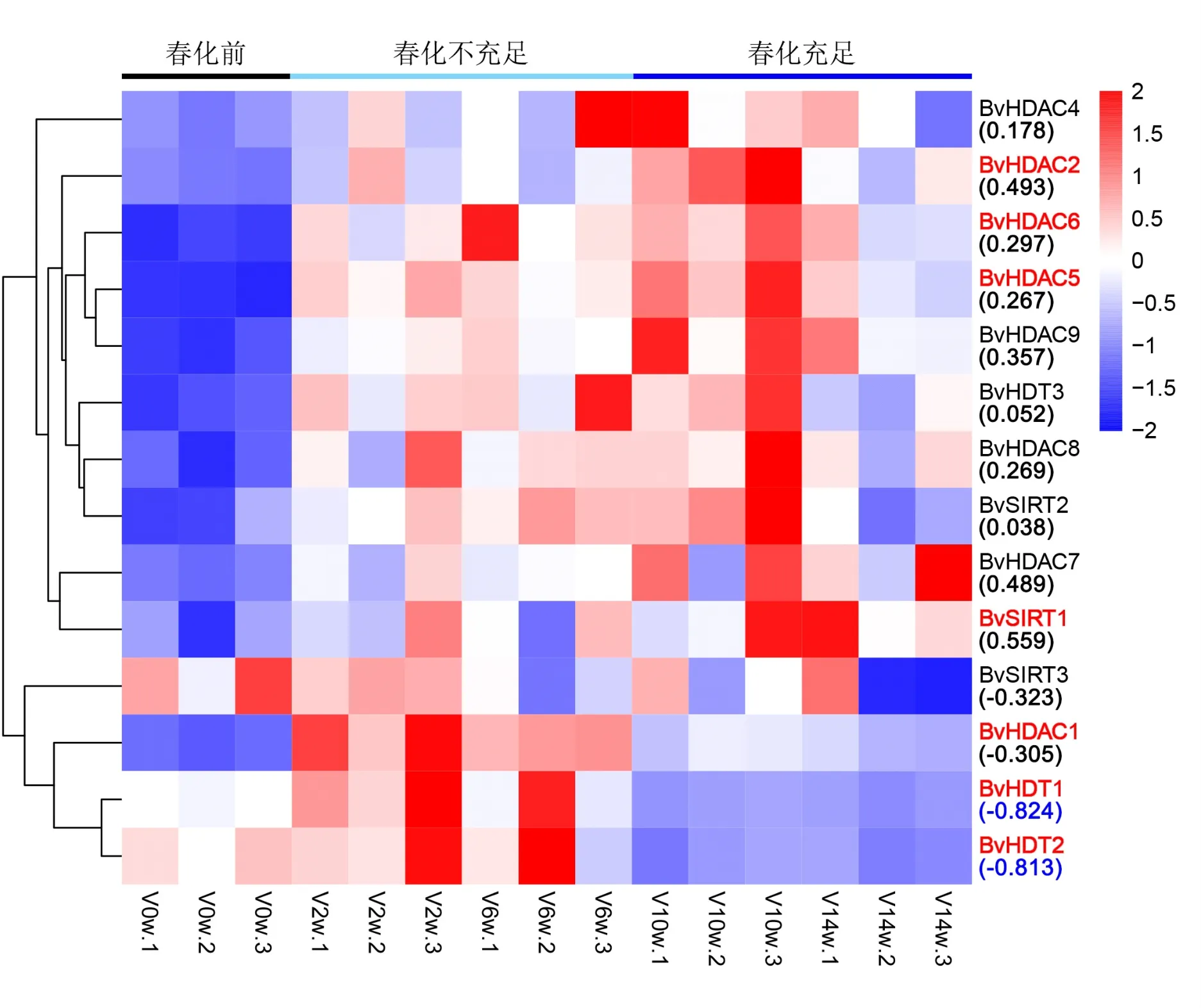
图4 BvHDACs基因家族在不同低温胁迫下的基因表达
2.6 BvHDACs基因家族蛋白互作分析
通过检索STRING数据库,共发现10个蛋白主要与RPD3/HAD亚家族成员具有蛋白互作关系(图5)。这些蛋白包括5个组蛋白结合蛋白(BvSYD、BvHMGB15、BvSIN3A、BvNCOR1和BvRB)、4个组蛋白修饰酶(BvJMJ11、BvJMJ12、BvHDAT3和BvFLD)和1个DNA甲基化酶(BvDMT)。其中,BvFLD、BvJMJ11和BvJMJ12在拟南芥中的同源基因参与春化和成花转变过程[19-20]。BvJMJ11和BvJMJ12与BvHDAC1-9、BvSIN3A、BvNCOR1、BvRB具有构成蛋白复合体的潜力。BvFLD则与BvHDAC5和BvHDAC6具有蛋白互作关系。此外,HD2家族成员可能与BvHDAC6具有蛋白互作关系,而SIR2亚家族成员与哪些蛋白存在互作关系仍未可知。

图5 BvHDACs家族蛋白互作网络
3 讨论与结论
组蛋白去乙酰化酶(HDACs)是调节染色质结构和基因表达的关键表观遗传因子,在植物生长、发育和对冬性植物的春化机制反应中发挥重要作用[21]。截至目前为止,前人已对拟南芥[4]、玉米[22]和水稻[23]等植物HDAC基因家族进行了功能分析。本研究通过生物信息学手段从甜菜基因组中共鉴定16个BvHDACs成员,利用进化树分析BvHDAC与其他物种HDACs的亲缘关系,基于春化过程表达模式和互作蛋白关系分析哪些BvHDACs可能参与甜菜春化作用。
系统发育树将16个BvHDACs分为3个亚家族,即RPD3/HDA1、SIR2、HD2。甜菜RPD3/HDA1家族Class I和IV、SIR2家族成员与人类HDACs具有一定的同源性。推测,丙戊酸、苯甲酰胺类等人类Class I和Class IV HDAC抑制剂可能在植物中同样具有抑制作用[24]。此外,烟酰胺也同样对植物SIRT家族成员产生酶活性抑制作用[25]。植物Class II成员与其他成员分别位于不同亚枝,暗示其植物与动物Class II成员蛋白特性和功能可能存在一定差异。同时,HD2家族是植物特有的HDAC,BvHDT1和BvHDT2与AtHDT4、AtHDT1和AtHDT2亲缘关系较近,BvHDT3则与单子叶植物HDT具有较高的同源性。甜菜BvHDACs与人类、拟南芥HDACs的亲缘关系将有助于判断组蛋白抑制剂可能对哪些BvHDACs具有抑制作用,为今后挑选特定组蛋白抑制剂开展甜菜春化作用机制研究提供基础信息。
AtHDACs能够与AtMSI1和AtMSI4形成复合体,调控组蛋白乙酰化修饰从而影响AtSOC1和AtFLC的转录,实现对拟南芥成花转变的调控[26]。通过对拟南芥RPD3/HDA1亚家族成员进行沉默可以导致拟南芥晚花表型[27]。与拟南芥不同,笔者发现HD2家族成员BvHDT1和BvHDT2在春化过程中表达模式变化与抽薹率变化显著相关,暗示其与参与甜菜春化时间剂量。此外,STRING分析表明BvHDT1和BvHDT2与BvHDAC6相互作用,可能与BvFLD、BvJMJ11和BvJMJ12形成蛋白复合体。在拟南芥中,AtJMJ11(又称AtELF6)和AtJMJ12(又称AtREF6)与植物抽薹开花密切相关,分别参与H3K4和H3K27甲基化修饰,调控开花整合基因AtFT和AtSOC1的表达[20]。AtFLD能够调节H3K4的甲基化水平,参与AtFLC的表达[19]。这些结果表明BvHDT1和BvHDT2催化蛋白乙酰化修饰可能与甲基化修饰协同或拮抗决定甜菜抽薹开花。
综上,本研究通过分析BvHDACs春化过程中的表达模式与蛋白互作关系发现甜菜HD2家族成员BvHDT1和BvHDT2可能与甜菜春化作用密切相关。根据染色体位置和系统进化分析发现BvHDT1和BvHDT2可能由单一基因串联复制产生并与AtHDT1和AtHDT2直系同源。目前,暂未有HD2家族组蛋白抑制剂的相关报道。但是,有研究表明甜菜孢囊线虫的32E03效应蛋白可以抑制AtHDT1的活性[28]。今后可通过外源注射或转化32E03效应蛋白进一步验证或分析BvHDT1和BvHDT2如何参与甜菜春化作用。
