CRISPR 技术应用于山羊和绵羊育种的研究进展
2022-04-15史玉洁李芳王昕
史玉洁,李芳,王昕
(西北农林科技大学动物科技学院,陕西杨凌 712100)
基因编辑技术是对靶基因进行特异编辑,如突变、敲除或基因的定点整合等,最终达到改变或修饰基因功能的目的,进而影响细胞、器官甚至个体生理性状的一种基因工程技术。基因编辑技术操作简单且通用性强,主要经历了锌指核酸酶 (Zinc-Finger Nucleases,ZFN) 技术、转录激活样效应因子核酸酶(Transcription Activator-Like Effector Nucleases,TALEN)技术和规律成簇间隔短回文重复序列(Clustered Regularly Interspersed Short Palindromic Repeat,CRISPR)及其相关蛋白(Cas)技术等几代的发展历程,它们的出现使得对任意物种和细胞基因的精准编辑成为可能。其中CRISPR 技术的操作方式和编辑效率明显优于其他早些传统的基因编辑技术,一经出现便被广泛应用于多个领域,尤其在动植物基因编辑以及改良动物生产性能方面得到成功应用。
羊作为重要的经济动物之一,提供奶、毛、绒、肉、皮等多种动物产品,同时也是重要的实验动物。利用基因编辑技术提高羊的绒、毛、肉产量、“人源化”羊乳以及作为生物反应器生产药用蛋白等具有重要意义。本文概述了CRISPR/Cas 系统的发展历程、组成及分类、作用方式和原理,总结了CRISPR/Cas 系统近年来在提升山羊和绵羊生产性能方面的应用,并对该技术的发展前景作了简要阐述,为我国畜禽种业的快速、健康和持续发展提供参考。
1 CRISPR 系统的发现与分类
CRISPR 系统是原核生物的一种抵抗外源基因入侵的获得性免疫系统,也是继ZFN 和TALEN 后第三代被广泛应用于基因组精准编辑的人工核酸酶技术。
1.1 CRISPR 系统的研究历史 1987 年,日本学家Ishino等首次在大肠杆菌的基因中发现特殊的串联间隔重复序列。之后对原核生物的基因组进行生物信息学分析发现,这种重复序列存在于50% 的细菌和95% 的古细菌中。直至2002 年,该基因家族被正式命名为CRISPR,并提出用Cas 来命名相关核酸酶。2008 年,Marraffini 等研究发现对应的Cas 蛋白主要作用于DNA 序列,CRISPR 可以破坏转染的外源质粒。2010 年,Garneau 等研究发现Cas9 是Cas 蛋白中独特的基因簇,可以由酶介导对目标DNA 进行精准切割。2013年,Le 等优化了CRISPR/Cas9 系统,建立了一个由CRISPR,tracrRNA 和Cas9 组成的基因调控系统,并和Mali 等首次利用CRISPR/Cas 系统介导小鼠和人类的细胞进行基因编辑,成功定点修饰了哺乳动物基因组。这对CRISPR 系统来说具有里程碑式意义,为该技术在基因编辑领域的应用奠定了基础。此后,CRISPR/Cas9 系统逐渐成为国内外研究人员青睐的工具,在生命科学各个领域的相关研究迅速增加。
1.2 CRISPR 系统的结构与类型 CRISPR/Cas 系统是细菌为抵抗噬菌体而形成的一种免疫机制,它可以特异识别入侵的病毒序列并对外源入侵DNA 进行切割和降解。CRISPR 是一种特殊的DNA 重复序列,主要包括前导序列、CRISPR 序列和Cas 相关蛋白(图1)。

图1 CRISPR/Cas9 位点特征[12]
CRISPR 序列由重复序列(Repeats)和间隔序列(Spacer)相互交替排列组成,重复序列-间隔序列的单元个数多变,在不同物种甚至同一物种中都可能不同。重复序列高度保守,间隔区间的回文序列可以形成发卡结构。间隔序列是被细菌俘获的外源DNA 序列,主要来自质粒和病毒。相邻的地方有一段保守序列,被称作原间隔序列临近基序(Protospacer Adjacent Motif,PAM),该序列一般由NGG 3个碱基组成(N代表任意碱基),在CRISPR/Cas 系统中起到识别外源DNA 的重要作用。
Cas 基因家族的种类繁多,编码的蛋白质具有与核苷酸结合的功能以及与核酸酶、聚合酶、解旋酶等多种酶类结合的活性,其编码的蛋白都可以与CRISPR序列区域共同发生作用。
根据CRISPR RNA(crRNA)成熟的方式及Cas蛋白的种类和功能的差异,可将CRISPR 系统分为两大类,进而分为6 种亚型(图2)。第一类为多种效应蛋白复合物组成的干扰靶基因的系统,包含I、III 和IV 型;第二类为单一效应蛋白组成的干扰靶基因的系统,包括II、V 和VI 型。II 型是最为典型、研究最为广泛的含有Cas9 基因的系统类型。其中Cas9 蛋白具有核酸酶活性,并且在基因附近有一段帮助crRNAs 成熟的反式激活RNA(Trans-activating crRNA,tracrRNA)。Cas9 与crRNA 和tracrRNA 结合,通过构象的变化暴露其核酸酶结构域,结合并切割靶序列,因此产生的双链断裂通常由同源导向修复(HDR)和非同源末端连接(NHEJ)进行修复。此外还有V 型CRISPR/Cas12a(Cpf1)和VI 型靶向RNA 的CRISPR/Cas13等其他种类的Cas 蛋白也逐渐被发现,进一步丰富了CRISPR/Cas 系统。
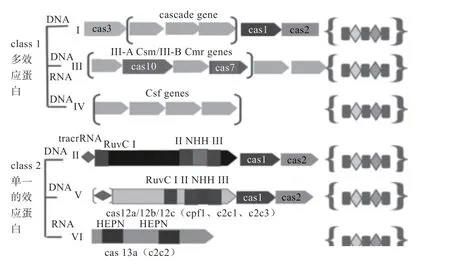
图2 CRISPR/Cas 系统分类[24-25]
2 CRISPR/Cas9 技术在羊育种研究中的应用
CRISPR/Cas 系统自发现以来,在基因治疗、制作抗体药物、构建模式动物等方面得到广泛应用,同时在提升羊的生产性能方面也展开了大量研究,为羊的精准育种提供基础。
2.1 CRISPR/Cas9 技术在提升羊肉品质研究中的应用已有研究表明肌肉生长抑制素(Myostatin,)是一类能够对骨骼肌的生长起负调控作用的基因,抑制哺乳动物中的基因可有效促进骨骼肌的生长分化,引起双肌表型。
2014 年,有研究将CRISPR/Cas9 系统应用于编辑和共4个羊成纤维细胞基因,并利用体细胞核移植(Somatic Cell Nuclear Transp lantation,SCNT)方法成功产生了3 只基因敲除山 羊。2015 年,Crispo 等利 用CRISPR/Cas9 技术和受精卵显微注射技术高效生产了基因敲除绵羊,新生22 只羔羊中有10 只羊的基因突变,并表现出双肌表型和体重显著增加的现象。这些研究为进一步在小反刍动物上应用CRISPR/Cas9 技术提供了有效参考。2016 年,Wang 等通过注射单个sgRNA 至单个细胞阶段的羊胚胎中,精确靶向敲除了、-()和()基因,且未检测到脱靶效应,证明了CRISPR/Cas9介导基因组编辑的多重性,以及改善绵羊不同基因决定不同性状的可能性。直至2019 年,Zhang 等利用CRISPR/Cas9 技术研究了乙酰CoA 酰基转移酶2(ACCAA2)在绵羊前体脂肪细胞分化过程中的重要作用,为阐述羊肉品质的形成机制奠定基础。2020 年,Ding 等利用CRISPR/Cas9 技术精确删除了滩羊的基因的长基因组片段,得到的MSTN 敲除羊体重较野生型羊显著增加,这为接下来动物模型的构建和基因大片段的删除或插入的功能研究提供了重要参考。同时,他们还发现了双sgRNA 定向CRISPR/Cas9 系统可以高效敲除哺乳动物基因组。
2.2 CRISPR/Cas9 技术在改良羊毛品质研究中的应用羊毛纤维长度和平均纤维直径是绵羊的重要经济性状,它与羊毛的产量和质量密切相关。
成纤维细胞生长因子FGFs 家族成员基因被证明在毛发生长过程中对毛发生长期有抑制作用,突变基因可以促进毛发生长并延长毛囊的生长期,进而改善羊毛品质。Wang 等利用CRISPR/Cas9系统将和基因的Cas9 mRNA 和sgRNA显微注射至山羊胚胎中,成功获得和FGF5 双基因修饰的山羊,所得羊只的羊绒产量和生长速度均显著提高。Li 等利用CRISPR/Cas9 系统编辑中国美利奴细毛羊的基因,获得了16 只目标位点突变的细毛羊,12 只1 岁基因编辑羊的毛丛自然长度和拉伸长度均显著长于野生型对照。Zhang 等通过CRISPR/Cas9 干扰基因的表达,出生的6 只美利奴羔羊中有5 只羊的基因位点缺失,羔羊表现出多种毛色图案,进一步研究发现,修饰发生在1个或2个以上的基因拷贝中,在靶向修饰位点前第2 外显子的9 bp 和5 bp 缺失的额外自发突变可能涉及被毛颜色的形成。Hao 等设计了2个相反的sgRNA 在绒山羊中成功定位了外膜异常酶受体()基因,并与编码Cas9 的质粒共转染羊成纤维细胞,测序结果显示变异率达69.7%。胸腺素4(T4)是一个小分子蛋白,包含43个氨基酸残基,可用于激活毛囊干细胞的迁移和分化。Li 等利用CRISPR/Cas9 系统并结合SCNT技术,以肌源性卫星细胞作为核供体获得了绒山羊基因在CCR5(趋化因子受体5)上的作用轨迹,敲入T4 基因的山羊产绒量增加74.5%。
2.3 CRISPR/Cas9 技术在改造羊乳研究中的应用 羊乳与人乳成分接近,是重要的牛乳补充替代品,尤其适合对牛乳过敏体质的人群,但羊乳含有-乳球蛋白(-lactoglobulin,BLG)等致敏原,能引起人体过敏反应,因此在保证羊乳营养成分的同时去除其中的致敏成分成为提升羊乳品质的重要研究内容。
Zhou 等成功利用CRISPR/Cas9 系统生产了基因敲除的山羊,在靶向敲除基因的山羊乳腺组织中发现BLG 表达量显著降低,相关乳蛋白编码基因也显著降低,羊奶中BLG 蛋白也不表达。周文君等首次使用CRISPR/Cas9 系统在山羊的基因位点定点敲入人乳铁蛋白(hLF)的cDNA 序列,在保证羊乳营养价值的同时又减少了羊乳的过敏原性,还发现10 μmol/L 的RAD51 蛋白激活剂(RS-1)可以显著提升Cas9 引导的敲入效率。此外,Teng 等利用CRISPR/Cas9 系统结合显微注射技术成功开发了一种可以生产富含褪黑素羊奶的绵羊生物反应器,这些基因编辑羊可能成为褪黑激素的良好来源。Huang 等成功使用CRISPR/Cas9 系统获得miR-145 敲除的山羊乳腺上皮细胞,miR-145 敲除降低了TAG(Total Cellular Triacylglycerol)和胆固醇含量,并通过降低与脂肪酸合成相关的几个关键基因的表达进而影响脂肪酸组成。
3 CRISPR/Cas9 技术在其他动物育种研究中的应用
CRISPR/Cas 系统已经成功在猪上实现了多基因编辑、相关性状的遗传改良等,主要是作为模式动物进行相关研究并为人类疾病的研究提供了试验依据。Wang 等利用CRISPR/Cas9 和SCNT 有机结合获得了SIX1-/-和SIX1-/-/SIX4-/-的猪胚胎,其中SIX1-/-/SIX4-/-型猪胚胎表现严重的肾脏发育迟缓。Xie 等利用CRISPR/Cas9 介导敲入靶向pRSAD2 基因质粒,成功获得猪的pRSAD2-KI 细胞;体外病毒激发试验显示,pRSAD2-KI 细胞能够有效地降低猪瘟病毒和伪狂犬病病毒的感染;此外还利用SCNT 技术成功生产了1只pRSAD2-KI 猪。
牛的基因编辑技术较其他物种发展较晚,迄今已开始在基础疾病相关基因功能研究、改善遗传特性、提升肉品质及生产药物蛋白等领域得到广泛应用。Zhou 等利用截短的CRISPR/Cas9 gRNAs(1、2、3和5 bp)对牛胎儿成纤维细胞的基因进行敲除,发现截短3 bp 的gRNA 的CRISPR/Cas9-17 质粒能有效降低脱靶效率且不降低牛基因打靶效率,丰富了CRISPR/Cas9 技术的编辑策略。Jeong 等利用CRISPR/Cas9 和SCNT 技术结合将基因导入牛成纤维细胞-基因的内含子并获得了转(Human Fibroblast Growth Factor 2)基因的囊胚,在细胞水平及胚胎水平成功检测到了基因的表达。
禽类由于受精卵结构特殊,无法像哺乳动物那样直接通过核移植获得基因编辑个体,所以基因编辑技术在禽类上发展较为缓慢。Lee 等使用CRISPR/Cas9 系统和杂交技术成功获得了Z 染色体敲除鸡,Z染色体编辑的鸡可以在胚胎发育过程中通过检测荧光进行性别鉴定。
4 存在问题及发展前景
CRISPR/Cas9 作为当下最有效、最便捷的基因组编辑技术,已被应用于不同细胞及物种基因组的高精度改造和修饰,在建立动物模型和生物医学等方面有巨大潜力。但目前CRISPR/Cas9 系统的脱靶效应和PAM 序列的局限性仍然是主要缺陷,所以未来的主要发展方向仍然是降低脱靶效率,提升其特异性、精准性和稳定性。
此前有研究发现,缩短sgRNA 互补区域长度和增加PAM 序列的长度均可以在保证目标基因组的编辑效率下显著降低脱靶率。此外,Kim 等发现给sgRNA5' 端添加2个鸟嘌呤也可显著增加其识别特异性并降低脱靶率。还有研究将腺相关病毒(Adeno-Associated Virus,AAV) 应用于CRISPR/Cas9系统,可显著促进其靶向能力并提高编辑效率。Timin 等研究报道了由可降解聚合物微粒并经硅壳修饰的微载体可用于CRISPR/Cas9 系统的传递,其转染效率还明显高于脂质体。如今的基因编辑技术已经进入精准编辑时代,脱靶效应和外源基因的定点插入效率等问题仍需要深入探索。此外,人们也在不断的优化和开发新的基因编辑技术以期应用于家畜育种、构建动物疾病模型和疾病治疗等各个领域。
综上所述,CRISPR/Cas 系统具有巨大的发展空间和优化潜能,它的编辑效率高、构建简单、特异性强等的优势将有助于解决畜禽种业的瓶颈问题,使我国的种业得到快速、健康和持续发展。随着研究的逐步深入,CRISPR/Cas 系统仍将不断完善和优化,争取在更多的领域获得成果。
