新西兰白兔毛囊体外培养条件优化及其增殖能力的研究
2022-04-15孙少宁陈秋燃李佳丽张琛靳荣帅白少成姚凡陈阳吴信生
孙少宁,陈秋燃,李佳丽,张琛,靳荣帅,白少成,姚凡,陈阳,2,吴信生,2*
(1.扬州大学动物科学技术学院,江苏扬州 225009;2.农业与农产品安全国际合作联合实验室,江苏扬州 225009)
新西兰兔原产于美国,其早期生长快,毛皮质地好,具有较高的饲养经济价值,并在医药学和生物学实验中被广泛应用。构建新西兰白兔的毛囊体外培养模型对畜牧学、医学和生物学研究都具有重要意义,也可为探究家兔毛囊发育机制提供研究素材。
毛品质是衡量毛兔经济价值的主要性状,毛囊决定背毛质量,探究毛囊生长因子调控及生长条件显得尤为重要。随着生物学技术的不断发展,离体培养组织器官的可能性大大提高。麦跃等曾在血浆凝块中尝试种植胚胎鼠皮肤,进行悬滴培养,顺利获得和普通毛囊相仿的毛囊构造,拓展毛囊重建培养研究领域。1990年Kaufman 等研究发现,在William’s E 培养基中毛囊生长速度与体内生长速度相近,成功建立人头皮游离毛囊培养模型,但由于实验所用人头皮毛囊组织来源狭窄,实验很难重复。范卫新等将猪毛囊代替人毛囊展开无血清成分培养研究。如今,多数实验以人、鼠、猪、羊等动物毛囊为模型,但兔作为常见的实验动物,与之有关研究报道较少。本实验通过体外分离毛囊,分析不同培养基对新西兰白兔触须毛囊生长、形态和增殖能力的影响,为研究毛囊生物学特征、生长调节机制提供重要参考。
1 材料与方法
1.1 试剂与仪器
1.1.1 主要试剂 William’s E、DMEM、MEM 培养基来自Gibco 公司;胰岛素、氢化可的松、转铁蛋白、亚硒酸盐购于北京索莱宝科技有限公司;双抗购自华北制药有限公司;PCNA 增殖细胞核抗原(GB13010-1)购自赛维尔公司。其中,配制3 种培养基时,均添加10 μg/mL胰岛素、10 ng/mL 氢化可的松、10 μg/mL 转铁蛋白、10 ng/mL 亚硒酸盐和100×双抗。
1.1.2 主要仪器 解剖显微镜(OLYMPUS);荧光倒置显微镜(OLYMPUS);CO培养箱(BINDER);DK-600 恒温水槽;SW-CJ-1F 型无菌超净工作台。
1.2 兔触须毛囊的分离与培养 选择2 月龄健康的新西兰白兔,准备75%酒精的容器,将其完全浸泡,处理10 s,置于已消毒完成托盘中。准备好6个消毒容器,3个分别加酒精(75%),另3个分别加含双抗的生理盐水,将剪下的兔触须部皮肤依次放入,浸泡。准备灭菌处理好的烧杯,加入4℃生理盐水,将浸泡处理好的触须部皮肤置入,备用,烧杯下放冰袋。把触须部组织顺毛囊平行方向分割成细条形状,将细条状毛囊用显微器械进行分散处理,获得独立处于毛囊生长期的组织,去除大部分周围组织,尽量避免兔毛囊损伤。挑选结构完整的毛囊进行体外培养实验。
取3个培养皿,依次加入William’s E 无血清培养液、DMEM 和MEM,将已处理兔触须毛囊随机分成3组置入。得到3 组兔触须毛囊,各用3 种培养液洗涤2 遍,分为3 组置入 24 孔培养板中,标记好,再每孔分别加入无血清培养液1 mL,置入细胞培养箱进行培养,温度保持37℃,2 d 更换培养液,持续6 d,注意控制温度。
1.3 组织HE 染色收集已由William’s E、DMEM 和MEM 培养基处理4 d 后的毛囊,4% 多聚甲醛固定。50%-70%-80%-90%梯度浸泡,乙醇处理冲洗包埋。乙醇、二甲苯透明处理,浸蜡,制作厚度约5 μm 切片。用二甲苯、乙醇和不同浓度酒精脱蜡,苏木素和伊红染色。经透明脱水处理后,用中性树胶封片,显微镜记录毛囊形态。
1.4 增殖细胞核抗原(PCNA)免疫荧光染色 切片顺次置入二甲苯I、二甲苯II,经无水乙醇、75%和85%酒精蒸馏洗涤,置于修复盒中,中低火间断加热,降温后摇晃洗涤。微干,在组织外围画圈,由圈内自发荧光淬灭剂等待处理5 min,BSA 孵育30 min。加一抗、二抗室温避光孵育,加PBS 缓冲液洗涤5 min,DAPI 染色。取出微干,抗荧光淬灭封片剂封片,荧光显微镜观察采集。
1.5 统计分析 倒置显微镜下观察,采用目镜测微尺方式,每2 d 测量毛囊,观察形态变化,记录毛囊生长数据。软件SPSS 20.0 开展单因子ANOVA 方差分析,结果以平均数± 标准差表示,<0.05 为差异显著,<0.01 为差异极显著。
2 结果
2.1 毛囊的体外培养 如图1 所示,显微镜下毛囊未发生破损,且毛干正常生长,说明毛囊体外分离成功。在6 d的体外毛囊培养周期中,3 组毛囊均可长出毛干,不同组毛囊会随着培养时间延长的毛干增长下降,4 d 后部分毛囊发生不同程度的弯曲甚至停止生长。

图1 体外分离毛囊0~6d 的生长形态
2.2 不同培养基对毛囊毛干体外生长速度的影响 由表1可以看出,William’s E、DMEM、MEM 中毛囊毛干生长速度在不同时间均有不同,DMEM 组在2 d 和4 d 毛干生长速度高于6 d(<0.05),William’s E 组和MEM组在2 d 和4 d 的毛干生长速度也高于6 d(<0.01)。对比3 组毛囊毛干平均生长速度,William’s E 组的平均生长速度大于MEM 组(<0.05),DMEM 组与其他2 组没有显著差异。4 d 后各组毛干生长缓慢,MEM 组毛干生长基本停滞。
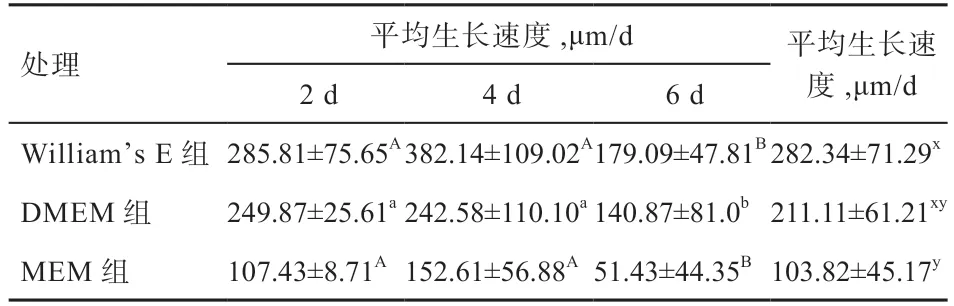
表1 培养基类型对毛囊毛干生长速度的影响
2.3 不同培养基对毛囊形态的影响 如图2 所示,HE 染色表明3 组毛囊结构有所不同。培养4 d 时,Williams’E组毛囊结构完好,毛乳头清晰,DMEM 和MEM 组毛乳头消失。DMEM 组毛囊开始出现萎缩与结缔组织开始分离,MEM 组毛囊结构明显萎缩,外根鞘底部变圆,毛囊变形。

图2 HE 染色组织学分析(×40)
2.4 体外培条件对毛囊基质细胞增殖能力影响 PCNA染色荧光在毛囊底部出现,其中,Williams’E 组PCNA阳性表达在毛乳头清晰可见,DMEM 和MEM 组毛囊表达仅表达在外根鞘,说明Williams’E 组毛囊增殖能力比其他2 组强(图3)。

图3 免疫荧光染色分析(×100)
3 讨 论
毛发生长受许多因素控制,呈现周期变化,兔的年龄、毛囊大小、操作温度等均可能成为影响因素。1 月龄以下兔的毛囊结构发育不完全或较嫩小,而2 月龄的兔毛囊形态大小理想、活性强,更适用于毛囊的分离。因此,本实验选择2 月龄兔触须毛囊作为研究对象。苗勇研究表明毛囊在裸露分离时,如果完全暴露会影响其活性,其生长状态会变差。本实验在分离毛囊时也注意保持毛囊的完整性,防止影响毛囊活性,在不影响观察的情况下,可以留一些组织保护毛囊。
前人通过毛囊体外保存实验发现William’s E 培养液优于DMEM 培养液,且未添加血清的William’s E 培养液优于添加血清的William’s E 培养液。有研究显示毛囊更适合在无血清培养基中生长,因此血清在毛囊培养中成为无关紧要成分,所以试验条件均未添加血清。本实验发现,在William’s E 中培养的毛囊可以生长6 d 以上,通过比较培养基成分发现,William’s E较DMEM 培养基含有更丰富的维生素、氨基酸及微量元素,有助于毛囊生长,William’s E 营养成分比另外两个培养基更加丰足,更加接近体外触须毛囊生长营养环境。总体来说,无血清William’s E 较其他培养基更贴近毛囊在新西兰兔体内生长的环境。Philpott 等研究发现 William’s E 培养液中有NaSeO及氢化可的松,可以适当保持毛囊形态。DMEM 和William’s E、MEM 组的毛囊生长与时间成反比,与体内生长相比差距很大,此现象可能与毛囊细胞的分裂能力下降有关。毛囊脱离内环境后,虽然体外模拟出毛囊的生长环境,但缺乏在体内存在的各种细胞因子,微环境异常,毛囊生长会受到不同程度的阻碍。本实验发现毛囊在William’s E 培养基生长最佳,这和在人、绒山羊、蒙古绵羊、北京鸭、小鼠上的研究结论相同。通过石蜡切片结果可以得出William’s E 培养基能维持毛囊处在生长期,而另外2 种培养基不能。用 PCNA免疫荧光染色观察发现DMEM 和MEM 组毛囊表达仅表达在外根鞘,William’s E 组在毛乳头PCNA 阳性表达清楚透彻,说明 Williams’E 组更适合的囊增长,更好促进毛发生长。
4 结 论
本实验结果显示,在William’E 中培养的毛囊毛干的生长、形态以及增殖能力最佳。因此,William’s E培养基最适宜培养新西兰白兔的触须毛囊,可为开展动物毛囊生长发育的研究提供参考依据。
