CsBLH7与CsKNAT4蛋白互作调节下胚轴细胞的伸长
2022-04-15张利国
摘要:CsBLH7与CsKNAT4分别属于BELL类蛋白与KNOX类蛋白,可能与植物器官形态建成密切相关,但目前几乎没有关于CsBLH7与CsKNAT4蛋白互作的深入研究报道。采用酵母双杂交初步确定CsBLH7与CsKNAT4能够在细胞体内互作,形成BLH7-KNAT4蛋白复合物。双分子荧光互补(BiFC)进一步确定了这种互作关系。原生质体瞬时转染试验结果表明,CsBLH7与CsKNAT4分别为转录抑制因子与转录激活因子。同时,针对35S:CsBLH7、35S:CsKNAT4材料的形态分析结果表明,下胚轴细胞长度分别缩短与伸长,这与它们的转录活性相适应。再者,35S:CsBLH7、35S:CsKNAT4遗传材料的赤霉素合成酶基因分别下调与上调。研究结果表明,BLH7-KNAT4可能是通过调节赤霉素合成来调控下胚轴细胞长度,对揭示CsBLH7和CsKNAT4调控植物形态建成分子机理具有重要意义。
关键词:CsBLH7;CsKNAT4;蛋白互作;BiFC;下胚轴细胞;转录活性;植物形态建成
中图分类号: S563.301 文献标志码: A
文章编号:1002-1302(2022)06-0041-04
收稿日期:2021-06-11
基金项目:黑龙江省自然科学基金(编号:LH2020C097);黑龙江省农业科学院国自然培育项目(编号:2019JJPY003);黑龙江省麻类科技创新基金(编号:MLCX-20);特色经济作物绿色种植技术示范推广项目(编号:KYBG-05WDL-2020001)。
作者简介:张利国(1978—),男,黑龙江哈尔滨人,博士,助理研究员,主要从事麻类分子育种研究。E-mail:zlg86@aliyun.com。
BELL类蛋白几乎存在于所有植物当中[1],大麻中目前发现有13个BELL蛋白[2]。现有研究揭示,BLH1能够调节植株花基形态,在生殖生长与营养生长的转换节点可能发挥重要负调控功能;在拟南芥中BLH3和BLH6的转录活性相反,同时还可能参与调节植株叶片的形态与花期[3]。
KNOX家族作为TALE蛋白的一个亚类,也能够从多方面参与对植物形态建成的调控。不同物种的同源BELL和KNOX蛋白可能存在不同的蛋白互作关系[4-5]。研究的前期工作基础初步表明,CsBLH7可能与CsKNOXs家族部分成员之间存在蛋白互作关系。对比大麻的全基因组测序数据,在大麻中发现6个KNOX蛋白和13个BELL蛋白,因此确定它们之间的互作关系、调节方式,对解析大麻器官形态发生的机制是十分必要的,将是揭示CsBLH7调控基因表达分子机理的基础与关键。
1 材料与方法
1.1 试验材料
本研究中植物材料为工业大麻新品种龙大麻4号,由黑龙江省农业科学院经济作物研究所选育。龙大麻4号的THC (四氢大麻酚)含量低于千分之一,为高产高纤型工业大麻品种。
1.2 酵母双杂交相关质粒构建与测试蛋白-蛋白互作
采用PCR方法通过对大麻cDNA进行克隆获取BLH7和KNAT4的开放读码框片段。在酵母细胞中,转入BLH7的同源异型结构域蛋白片段与 Bell-like 片段,在pvgDT3中插入BLH7与BLH10的cDNA。在缺乏Trp及缺乏Leu的培养基中筛选酵母细胞,以测试其蛋白互作关系,在缺少Ade与Leu,以及无Trp、无His的培养基中培养筛选后的株系。使用阴性对照Pgatd7SV(40)和Pgbkt (7)Lam,阳性对照是Pgatd7SV (40)与Pgbkt (7)p53。
1.3 采用双分子荧光互补技术(BiFC)测试蛋白-蛋白互作
通过35S启动子的调控,黄色荧光蛋白的两端[4]分别连接BLH蛋白与KNOX蛋白形成融合蛋白,即C-KNAT4 与N-BLH7。扩增完成后,在pSAT6-nEYFP-N1中亚克隆KNAT4-YFPC、KNAT3-YFPC,在pSAT6-cEYFPN1中亚克隆BLH7-YFPN、BLH10-YFPN,参考Yoo等聚乙二醇转染拟南芥原生质体的试验方法[4]展开试验,于Leica 2PS SSC 激光共聚焦显微镜下观察荧光成像情况。
1.4 原生质体瞬时转染试验
在pUC19质粒中构建35S:GD-OIPs,用于质粒提取和扩增。反式强激活作用因子Ld-Vp16,以及报告基因2 LexA-2 Gal4:Gus和2Gal4:Gus也在本试验中应用。本试验采用无内毒素转染级质粒试剂盒(Abcam)进行报告质粒和效应因子的分析,至少重复进行3次生物学试验和设置2次技术性重复,数据分析处理采用t检验。研究采用Gal4 DNA-binding domain和LexA DNA-binding domain,对应GD-OIPs与VP16,其可靠性已被反复证实,例如AUX/IAA蛋白[6]、OFP4蛋白[7]。
2 结果与分析
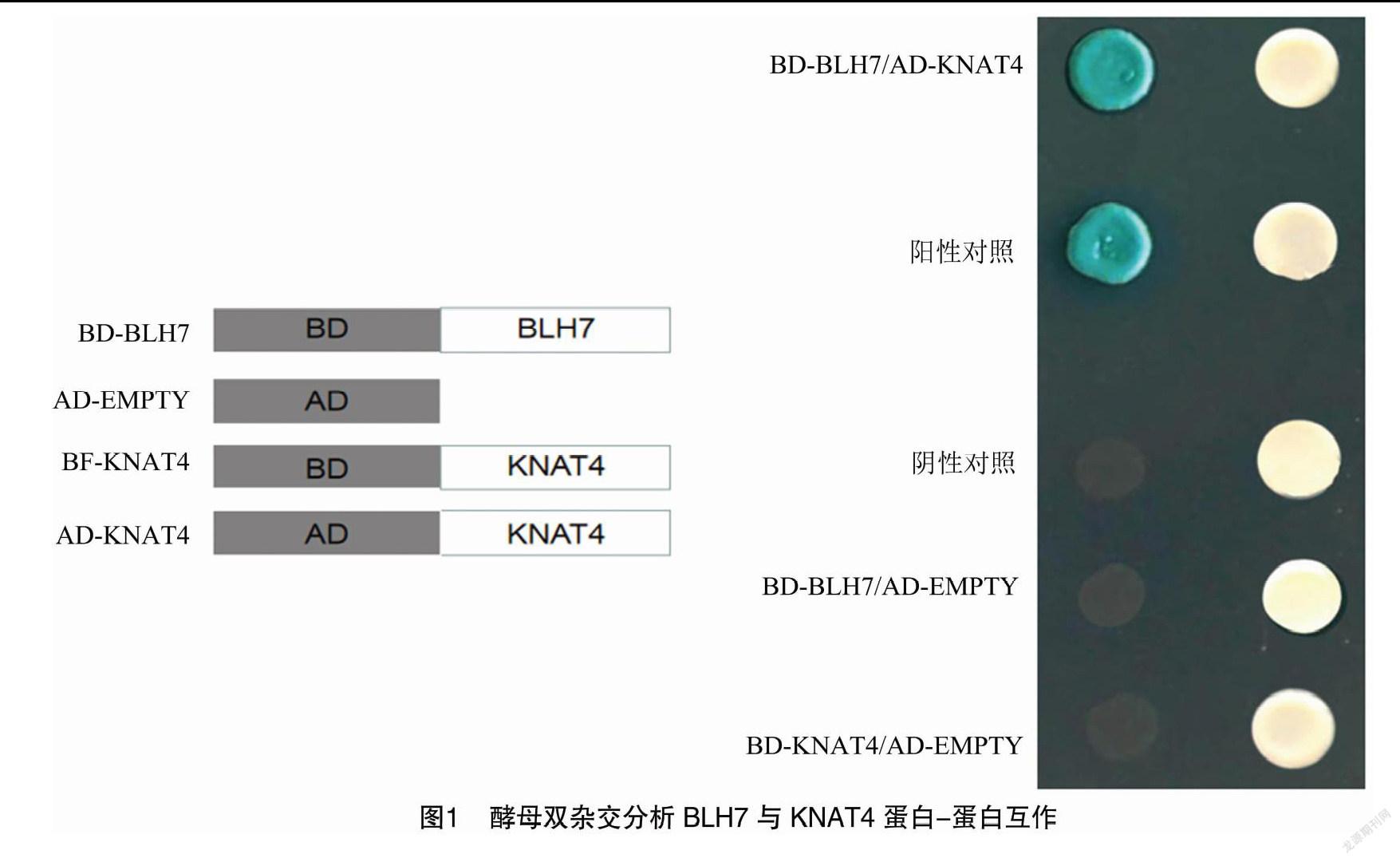
2.1 酵母双杂交测试CsBLH7与CsKNAT4之间的蛋白互作
通过酵母双杂交试验测试CsBLH7与KNAT4在体内的相互作用,CsBLH7与转录蛋白因子的结合域连接组成融合蛋白,KNAT4与转录激活域形成融合蛋白。为排除目标蛋白可能的自激活活性,测试结合域蛋白-Oips与激活域蛋白-Empty蛋白互作。试验结果表明,CsBLH7、KNAT4均无自激活活性,CsBLH7与CsKNAT4在体内存在蛋白互作关系,形成BLH7-KNAT4蛋白復合物。CsBLH7与CsKNAT4酵母双杂交(图1)。在缺乏Leu与缺乏Trp的培养基质中,Yeast-cell首先被选择,在缺Leu、缺Trp、无His与无Ade的培养基质中培养5~6 d,完成BLH-KNOX蛋白-蛋白互作测试。
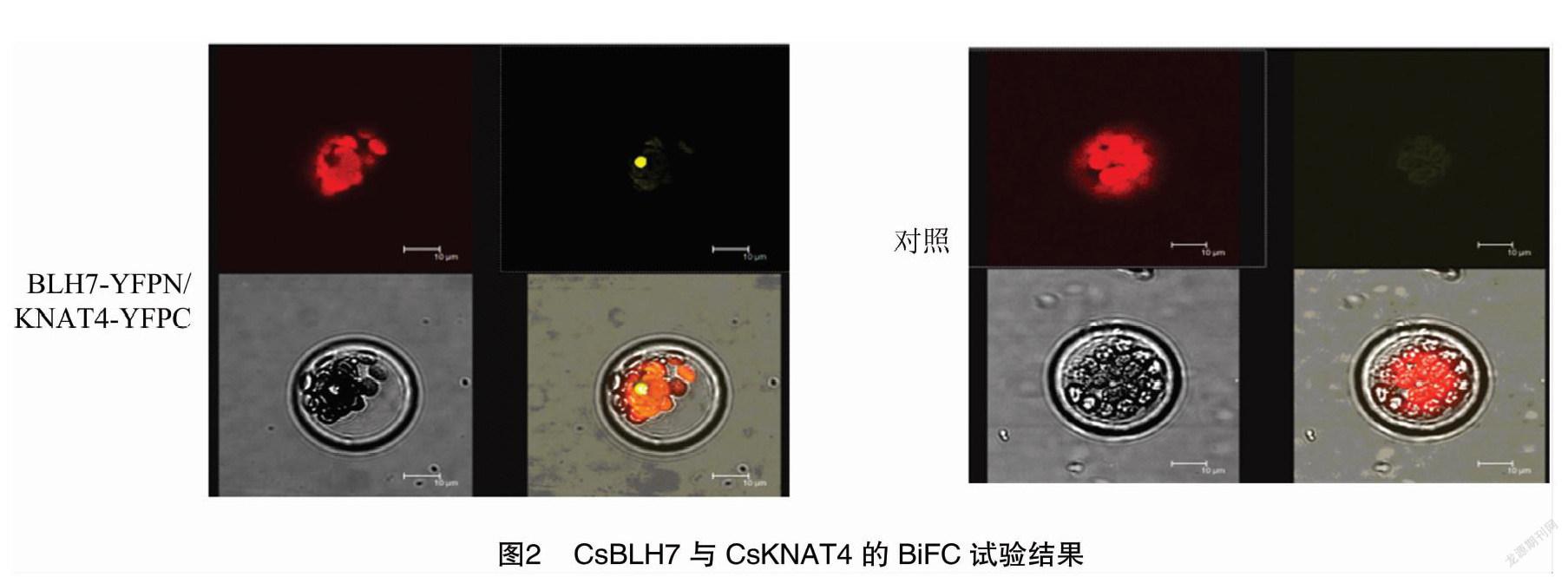
2.2 雙分子荧光互补(BtFC)研究BLH7与KNAT4蛋白互作
由于酵母双杂交技术上的局限性,为进一步证实BLH7与KNAT4在细胞体内的蛋白互作,采用双分子荧光互补方法进行测试。试验采用拟南芥叶肉原生质体,共转染YFPC-CsKNAT4与YFPN-CsBLH7,试验体系采用RACK1-C-EYFP作为阴性对照。BiFC试验结果显示,BLH7与KNAT4蛋白互作发生在细胞核中(图2)。
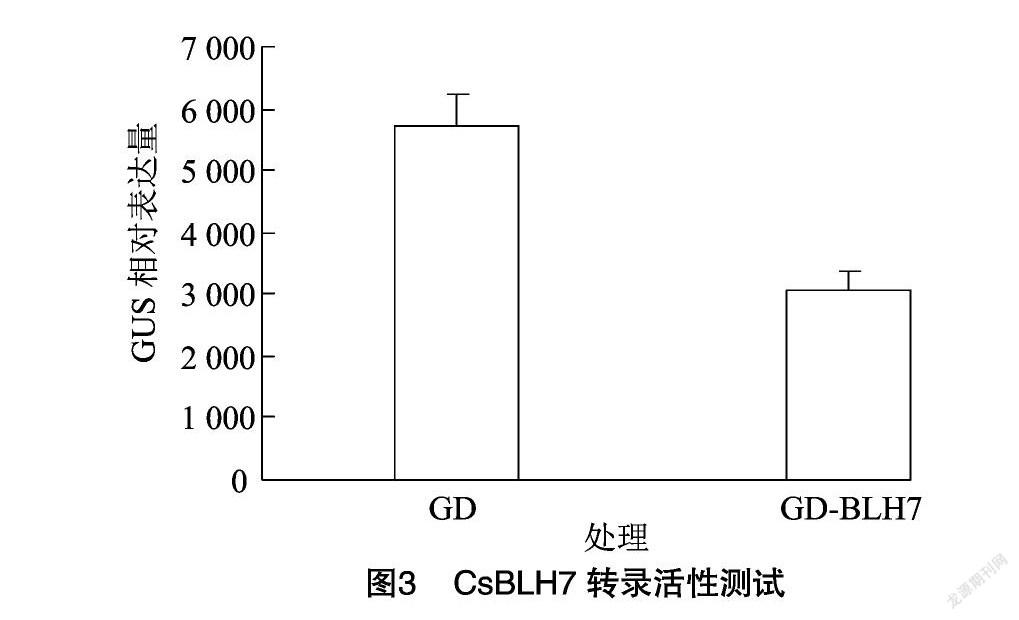
2.3 BLH7与KNAT4转录活性测试
从原生质体瞬时转染效应因子相对表达量可知,图中GD-BLH7的GUS相对表达量明显降低(图3),GD-KNAT4的GUS相对表达量明显上调(图3、图4),由此可知CsBLH7为转录抑制因子,CsKNAT4为激活因子,且CsBLH7能够与CsKNAT4互作,并能够抑制CsKNAT4的转录激活活性(图5)。
2.4 CsBLH7-CsKNAT4调节下胚轴细胞的伸长
在过去针对BELL与KNOX类蛋白研究的结果表明,二者能够调节植株的形态发育,包括叶片的形状、茎的长度、花基发育等。对比野生型(Col),35S:CsBLH7下胚轴长度与下胚轴细胞长度明显缩短,35S:CsKNAT4下胚轴长度明显伸长(图6、图7)。
在水稻、拟南芥等植物中过去关于BELL与 KNOX蛋白的研究曾报道,BELL-KNOX通过调控赤霉素合成酶基因来调节茎与细胞的伸长。为进一步探究CsBLH7-CsKNAT4调节胚轴与茎细胞长度的机制,对不同遗传背景材料的赤霉素合成酶基因做荧光定量分析。结果表明,35S:CsBLH7中CsGA20ox1表达量均降低,35S:CsKNAT4中CsGA20ox1表达量上升(图8)。
3 讨论
研究采用酵母双杂交初步确定,CsBLH7与
CsKNAT4能够在细胞体内互作,形成BLH7-KNAT4蛋白复合物,双分子荧光互补(BiFC)进一步证实了这种蛋白互作。以拟南芥原生质体为材料,为确定转录蛋白的作用开展瞬时转染,通过酶标仪以GUS基因相对表达量,确定CsBLH7为转录抑制因子,35S:CsKNAT4为转录激活因子。材料35S:CsBLH7下胚轴与细胞长度降低,材料35S:CsKNAT4下胚轴与细胞长度增加。BLH7与KNAT4互作形成BLH7-KNAT4蛋白复合物,BLH7能够抑制茎与胚轴细胞的伸长,KNAT4能够促进茎与胚轴细胞的发育,这与BLH7作为一个转录抑制因子,KNAT4作为一个转录激活因子的遗传特性相适应。结合不同材料CsGA20ox1的表达量,在BLH7与KNAT4蛋白互作基础上,暗示BLH7-KNAT4可能是通过调节赤霉素合成来调控下胚轴与茎细胞长度,从而影响下胚轴的发育。
同时,在过去的报道中,OFP等其他转录蛋白可能与BELL-KNOX蛋白复合物发生互作来发挥调控作用,形成OFP-BELL-KNOX复合蛋白[8-9],本研究中KNAT4与BLH7的蛋白-蛋白互作,也可能并不是直接形成的,并不能排除是通过其他蛋白间接形成的互作,这需要通过体外蛋白互作试验进一步来确定。
参考文献:
[1]Arnaud N,Pautot V. Ring the BELL and tie the KNOX:roles for TALEs in gynoecium development[J]. Frontiers in Plant Science,2014,5:93.
[2]Kumar R,Kushalappa K,Godt D,et al. The Arabidopsis BEL1-LIKE HOMEODOMAIN proteins SAW1 and SAW2 act redundantly to regulate KNOX expression spatially in leaf margins[J]. Plant Cell,2007,19(9):2719-2735.
[3]Gomez-Mena C,Sablowski R. ARABIDOPSIS THALIANA HOMEOBOX GENE1 establishes the basal boundaries of shoot organs and controls stem growth[J]. Plant Cell,2008,20(8):2059-2072.
[4]Yoo S D,Cho Y H,Sheen J. Arabidopsis mesophyll protoplasts:a versatile cell system for transient gene expression analysis[J]. Nature Protocols,2007,2(7):1565-1572.
[5]Furumizu C,Alvarez J P,Sakakibara K,et al. Antagonistic roles for KNOX1 and KNOX2 genes in patterning the land plant body plan following an ancient gene duplication[J]. PLoS Genetics,2015,11(2):e1004980.
[6]Oh E,Zhu J Y,Bai M Y,et al. Cell elongation is regulated through a central circuit of interacting transcription factors in the Arabidopsis hypocotyl[J]. eLife,2014,3:e03031.
[7]Giacomo E D,Sestili F,Iannelli M A,et al. Characterization of KNOX genes in Medicago truncatula[J]. Plant Molecular Biology,2008,67(1/2):135-150.
[8]Zhou H B,Liu B,Weeks D P,et al. Large chromosomal deletions and heritable small genetic changes induced by CRISPR/Cas9 in rice[J]. Nucleic Acids Research,2014,42(17):10903-10914.
[9]Tzfira T,Tian G W,Lacroix B,et al. pSAT vectors:a modular series of plasmids for autofluorescent protein tagging and expression of multiple genes in plants[J]. Plant Molecular Biology,2005,57(4):503-516.
