怀玉山三叶青烟草病毒增殖蛋白3基因克隆和功能分析
2022-04-15尹明华陈佳雯陈瑞樊凡辜婷婷何思捷陈荣华蔡红
尹明华 陈佳雯 陈瑞 樊凡 辜婷婷 何思捷 陈荣华 蔡红


摘要:通过怀玉山三叶青试管苗转录组数据库筛选到怀玉山三叶青烟草病毒增殖蛋白3基因的核心片段,利用RT-PCR 技术克隆该病毒增殖蛋白3基因,并进行序列分析、亚细胞定位、器官表达分析和功能分析。结果表明:怀玉山三叶青烟草病毒增殖蛋白3基因cDNA总长度为873 bp,G+C 含量为44.22%;怀玉山三叶青烟草病毒增殖蛋白3由290个氨基酸组成,分子量33 374.79 u,等电点9.72,为疏水性蛋白;二级结构由α-螺旋(57.24%)、β-片层(10.69%)、无规则卷曲(32.07%) 构成;三级结构为单体;预测怀玉山三叶青烟草病毒增殖蛋白3主要存在质膜、液泡膜、内质网中;怀玉山三叶青烟草病毒增殖蛋白3与葡萄烟草病毒增殖蛋白3 (GenBank:XP_002275179.1、GenBank:XP_034684444.1)的同源性最高,同源性达到94.83%。通过烟草叶片亚细胞定位分析表明,烟草病毒增殖蛋白3定位于细胞质(可能包括细胞膜)和细胞核膜中。实时定量PCR结果显示,烟草病毒增殖蛋白3基因在怀玉山三叶青2个栽培种中的表达存在器官特异性,怀玉2号和怀玉1号均在叶中表达量最高;烟草病毒增殖蛋白3转基因阳性烟草的三叶青花叶病毒表达量显著高于烟草病毒增殖蛋白3转基因阴性烟草;与烟草病毒增殖蛋白3转基因阴性烟草相比较,烟草病毒增殖蛋白3转基因阳性烟草的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、最大光化学效率(Fv/Fm)、实际光化学量子效率(ΦPS Ⅱ)、光化学淬灭系数(qP)及电子传递效率(ETR)显著下降,而非光化学淬灭系数(NPQ)显著上升。怀玉山三叶青烟草病毒增殖蛋白3具有典型烟草病毒增殖蛋白3的结构特征,氨基酸序列及核酸序列与同源物种相似度高,进化上高度保守,且可促进三叶青烟草花叶病毒的增殖,降低植株的光合作用效率。
关键词:怀玉山三叶青;烟草病毒增殖蛋白3;基因克隆;功能分析;蛋白结构
中图分类号:S567.901 文献標志码: A
文章编号:1002-1302(2022)06-0032-09
收稿日期:2021-04-27
基金项目:国家自然科学基金(编号:31960079);江西省重点研发计划一般项目(编号:20192BBGL70050、20202BBG73010);江西省教育厅科学技术研究项目(编号:GJJ201704);上饶市重点研发计划一般项目(编号:2020C002);上饶市平台载体建设项目(编号:2020J001、2019I017)。
作者简介:尹明华(1973—),江西永新人,女,硕士,教授,主要从事植物生物技术研究工作。E-mail:yinminghua04@163.com。
三叶崖爬藤(Tetrastigma hemsleyanum Diels et Gilg)是我国特有珍稀濒危药用植物,别称三叶青、金线吊葫芦、蛇附子、石老鼠,为葡萄科(Vitaceae)崖爬藤属(Tetrastigma)多年生蔓生藤本[1]。三叶青全草均可入药,以地下块根和果实的药用效果最好[2]。现代医学研究表明,三叶青对于高热、肺炎、肝炎、胃炎等诸多严重感染性疾病均有显著疗效[3]。另外,三叶青所含的三叶青黄酮、β-谷甾醇、多糖等能很好地抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,且无毒无副作用,是目前公认的“植物抗生素”[4]。三叶青一般采用扦插无性繁殖,极易感染和积累烟草花叶病毒(tobacco mosaic virus,TMV)[5]。烟草花叶病毒是一种单链RNA病毒,寄主范围广,能侵染茄科、葫芦科、豆科、十字花科、藜科、苋科、番杏科和商陆科等 30 科 300 多种植物。TMV 侵染植物后叶片常表现为表面斑驳、泡斑、畸形、坏死等症状,对农业生产造成严重危害[6]。烟草花叶病毒在宿主体内的复制和运输需要依靠一些宿主因子才能完成[7]。 近年来在拟南芥(Arabidopsis thaliana)中一些宿主因子基因陆续被发现,并被证实支持病毒的复制,如烟草病毒增殖蛋白1(tobamovirus multiplication 1,TOM1)、烟草病毒增殖蛋白2 (TOM2)和烟草病毒增殖蛋白3 (TOM3)[8]。因此,克隆三叶青烟草病毒增殖蛋白3基因并对其进行功能分析,对研究烟草病毒增殖蛋白3基因在三叶青中的表达和三叶青烟草花叶病毒的增殖具有重要意义。关于烟草病毒增殖蛋白3研究的报道较少。宋静静等构建了马铃薯StTOM1和 StTOM3双干扰植物双元表达载体并对其进行了转化验证,StT1-StT3 马铃薯中StTOM1基因 mRNA的表达水平下调了 78%,StTOM3基因下调了 81%[9]。目前,对三叶青的研究主要集中在化学成分、药理临床、种植栽培、组织培养等方面[10],关于三叶青烟草病毒增殖蛋白3方面的研究尚未见报道。利用RT-PCR 技术克隆怀玉山三叶青烟草病毒增殖蛋白3基因,并采用生物信息学方法、烟草转基因技术和实时定量 PCR进行序列、功能和组织表达分析,为揭示怀玉山三叶青烟草病毒增殖蛋白3的生物学功能提供理论依据,为从分子水平调控怀玉山三叶青烟草花叶病毒增殖提供新思路。
1 材料与方法
1.1 试验材料
怀玉山三叶青2个栽培种怀玉1号和怀玉2号试管苗。试验于2020年8月至2021年3月在上饶师范学院生命科学学院进行。
1.2 试验方法
1.2.1 总RNA提取和cDNA第1链合成 用Trizol 试剂提取怀玉2号试管苗的总 RNA,提取步骤按说明书进行,使用紫外分光光度计和琼脂糖凝胶电泳检测 RNA 的浓度和完整性。以提取获得的 RNA为模版,按照 M-MLV cDNA 第1链合成试剂盒说明书合成 cDNA 第1链。逆转录引物用 Oligo(dT)18 Primer:5′-GGCCACGCGTCGACTAGTACTTTTTTTTTTTTTTTTTT-3′,具体步骤按说明书进行。
1.2.2 烟草病毒增殖蛋白3基因的克隆 利用转录组组装的Unigene序列信息(TRINITY_DN3523_c0_g1),运用 Primer Premier 5.0 设计引物(F:ATGGCGCCGACGGCAGAGGTAG;R:GCGAATAGGATGATATTGTGTGAT)。PCR反应体系(总体积50 μL)包括17 μL ddH2O、25 μL 2×Phanta Max Buffer、1 μL dNTP Mix(各10 mmol/L)、2 μL 模板DNA、2 μL引物1(10 μmol/L)、2 μL 引物2(10 μmol/L)、1 μL Phanta Max Super-Fidelity DNA Polymease(1 U/μL)。PCR扩增条件:95 ℃ 30 s;95 ℃ 15 s,45~55 ℃ 15 s,72 ℃ 1 min,39个循环;72 ℃ 5 min。PCR 产物经 1%琼脂糖凝胶电泳检测后,将含有目的基因的条带与 pMD19-T 载体连接并用热激法转化到感受态细胞Escherichia coli DH5α,经鉴定正确的阳性转化子提取质粒送往生工生物工程(上海)有限公司进行测序。
1.2.3 烟草病毒增殖蛋白3基因的生物信息学分析 使用 BioEdit软件翻译基因序列为氨基酸序列,用 ProtParam预测酶的理化性质,用 ProtScale预测酶的疏/亲水性。使用GOR I软件在线预测酶的二级结构。使用SWISS-MOLD在线预测酶的三级结构。采用 WoLFPsort在线预测基因的表达部位。通过软件DNAMAN和 Bioedit进行氨基酸序列比对,利用MEGA5.0软件进行系统进化树的构建。
1.2.4 载体构建 用BamHⅠ酶切载体pRI101-GFP线性化,回收后和目的基因片段重组反应。酶切反应体系包括4 μL 10×K/10×L Buffer、5 μL 载体质粒、2 μL BamHⅠ和ddH2O(补足至40 μL)。酶切产物纯化后与上述PCR产物进行重组反应。重组连接反应體系(总体积10 μL)包括4 μL 线性化载体、1 μL 插入片段、2 μL 5×CE Ⅱ Buffer、1 μL Exnase Ⅱ和ddH2O(补足至10 μL)。重组产物转化大肠杆菌DH5α细胞。挑取PCR阳性的转化子摇菌培养提取质粒,同时扩增产物送测序。扩增和测序引物为插入目的基因两侧的载体序列,分别为 35S-F:5′-GACGCACAATCCCACTATCC-3′;GFP-JR:5′-GGGTGAGCTTGCCGTAGGTG-3′。
1.2.5 烟草叶片亚细胞定位 将构建好的载体质粒转入农杆菌GV3101,涂布卡那霉素抗性平板,挑取单克隆于YEB液体培养基,在28 ℃摇床内小摇、大摇培养2 d,菌体4 000 r/min离心4 min,去上清后菌体用10 mmol/L MgCl2(含120 μmol/L乙酰丁香酮)悬浮液重悬,调整D600 nm值至0.6左右;用无针头的1 mL注射器吸取农杆菌菌液,从烟草叶片下表皮(背面)压迫注射;将注射完成的烟草植株弱光培养2 d,即可观察。接种2 d后取注射区域的烟草叶片,制作玻片,在激光共聚焦显微镜(FluoView FV1Oi,OLYMPUS公司)下观察、拍照;同时以空载体转化的农杆菌作为对照重复上述操作。叶绿体荧光信号说明:叶绿体荧光信号激发波长640 nm,发射波长675 nm;绿色荧光蛋白(GFP)信号说明:绿色荧光蛋白GFP激发光488 nm,发射光510 nm。
1.2.6 烟草病毒增殖蛋白3转基因株系PCR检测 烟草叶片用农杆菌侵染后均经过4次筛选/继代,诱导出抗性芽,再转入伸长培养基中。采用PCR对其再生苗进行鉴定,得到烟草病毒增殖蛋白3基因的烟草转基因株系。PCR扩增体系(共20 μL)包括7 μL ddH2O、10 μL 2×Taq Master Mix、1 μL 模板DNA、1 μL引物1(10 μmol/L)、1 μL引物2 (10 μmol/L)。PCR反应程序:95 ℃ 5 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 60 s,35个循环;72 ℃ 5 min。
1.2.7 烟草病毒增殖蛋白3转基因株系和非转基因株系移栽苗的病毒接种和光合指标检测 培养3个月后,取含烟草花叶病毒的三叶青试管苗叶片放在研钵中并加入适量磷酸缓冲液研磨成糊状病样汁液;然后在烟草病毒增殖蛋白3转基因阳性株系和阴性株系移栽苗幼嫩的叶面上撒少许等量金刚砂,蘸取含烟草花叶病毒的烟草试管苗等量病样汁液在撒了金刚砂的叶面上轻抹 3次(模拟蚜虫的病毒田间传播),之后用无菌水清洗叶面;然后放入智能人工气候室内浇灌MS液体培养基培养;2个月后采用林国卫等的方法[5]对三叶青烟草花叶病毒在烟草病毒增殖蛋白3转基因阳性株系和阴性株系上的表达量进行qRT-PCR检测,同时采用Li-6400便携式光合测定仪(LI-COR公司,美国)测定烟草病毒增殖蛋白3转基因阳性株系和阴性株系移栽苗的光合参数和叶绿素荧光参数。所有数据均表示为平均值±标准差,并使用SPSS19.0软件进行统计分析,应用单因素方差分析(One-way ANOVA)检验差异显著性(α=0.05)。
1.2.8 烟草病毒增殖蛋白3基因的组织表达分析 分别取怀玉1号和怀玉2号试管苗的根、茎、叶RNA 500 ng,反转录为cDNA。荧光定量 PCR(qRT-PCR,SYBR GreenⅠ)检测内参基因为GAPDH。设计引物(F:CCTATCCCAGTCACGGTCAT;R:ACAGGGAAGCGTTGTAGCA)。qRT-PCR 检测采用 20 μL 反应体系,PCR反应程序:95 ℃ 10 min;95 ℃ 10 s,51 ℃ 34 s,95 ℃ 15 s,40个循环。使用 2-ΔΔCT 法计算基因表达水平。试验重复3次。所有数据均表示为平均值±标准差,并使用SPSS19.0软件进行统计分析,应用单因素方差分析(One-way ANOVA)检验烟草病毒增殖蛋白3基因组织表达的差异显著性(α=0.05)。
2 结果与分析
2.1 怀玉山三叶青烟草病毒增殖蛋白3基因cDNA序列
通过PCR扩增技术(图1),怀玉山三叶青烟草病毒增殖蛋白3基因cDNA总长度为873 bp,G+C 含量为44.22%(图2)。
2.2 怀玉山三叶青烟草病毒增殖蛋白3氨基酸序列
Protparam预测的怀玉山三叶青烟草病毒增殖蛋白3氨基酸序列见图3。怀玉山三叶青烟草病毒增殖蛋白3由290个氨基酸组成,分子量为33 374.79 u,等电点9.72,为疏水性蛋白。各氨基酸的数目和比例为Ala(A)(26,9.0%)、Arg(R)(17,5.9%)、Asn(N)(9,3.1%)、Asp(D)(6,21%)、Cys(C)(4,1.4%)、Gln(Q)(11,3.8%)、Glu(E)(9,3.1%)、Gly(G)(11,3.8%)、His(H)(6,2.1%)、Ile(I)(22,7.6%)、Leu(L)(38,131%)、Lys(K)(10,3.4%)、Met(M)(5,1.7%)、Phe(F)(24,8.3%)、Pro(P)(13,4.5%)、Ser(S)(12,4.1%)、Thr(T)(14,4.8%)、Trp(W)(8,28%)、Tyr(Y)(12,4.1%)、Val(V)(33,11.4%)。带负电残基总数(Asp+Glu)为15,正电荷残基总数(Arg+Lys)为27。序列的N端为M(Met),C端为R(Arg)。失稳指数(Ⅱ)计算为40.09,该蛋白质为不稳定蛋白质。
2.3 怀玉山三叶青烟草病毒增殖蛋白3亲疏水性
从图4可知,高峰值(正值)的区域表示疏水的区域,而低谷值(负值)的区域是亲水区域。结果表明,最大疏水值为3.0左右,在该多肽中说明该处的疏水性最强;亲水峰最大值为-3.0左右,在该多肽中说明该处的亲水性最强。整个蛋白质表现出高度的疏水性,说明该蛋白为疏水性蛋白质。
2.4 怀玉山三叶青烟草病毒增殖蛋白3二级结构
GOR 预测显示其二级结构由α螺旋(Hh,5724%)、β-片层(Ee,1069%)、 无规则卷曲(Cc,32.07%)构成(图5)。从分布位点来看,C端和N端含无规则卷曲、β-片层和α-螺旋,且无规则卷曲、β-片层和α-螺旋则散布于整个蛋白质中。
2.5 怀玉山三叶青烟草病毒增殖蛋白3三级结构
SWISS-MODEL预测显示怀玉山三叶青烟草病毒增殖蛋白3的三级结构为单体(图6)。
2.6 怀玉山三叶青烟草病毒增殖蛋白3亚细胞定位预测
采用 WoLFPsort在线软件对怀玉山三叶青烟草病毒增殖蛋白3基因的表达部位进行预测(图7),结果表明,定位于质膜中的数量为8,液泡膜中为4,内质网中为1,表明怀玉山三叶青烟草病毒增殖蛋白3基因主要存在质膜、液泡膜和内质网中。
2.7 怀玉山三叶青烟草病毒增殖蛋白3系统进化分析
通过Blastp比对取同源性最高的全15个蛋白,从构建的进化树(图8)可见,怀玉山三叶青与Herrania umbratica(哥倫比亚锦葵)、Durio zibethinus(榴莲)、Carica papaya(番木瓜)、Tripterygium wilfordii (雷公藤)、Pistacia vera(开心果)、Punica granatum(石榴)、 Nelumbo nucifera(莲)和Vitis vinifera(欧亚种葡萄)、Vitis riparia(河岸葡萄)在一个大分支下,说明在进化上亲缘关系较近,尤其是与Vitis vinifera(欧亚种葡萄)、Vitis riparia(河岸葡萄)烟草病毒增殖蛋白3(GenBank:XP_002275179.1、GenBank:XP_034684444.1)在同一小分支下,说明两者在进化上具有最高的亲缘关系。
2.8 怀玉山三叶青烟草病毒增殖蛋白3同源蛋白的序列比对信息
比对结果见图9,其中※号区域是该蛋白家族的保守结构域。
2.9 怀玉山三叶青烟草病毒增殖蛋白3基因目的片段扩增与瞬时表达载体构建
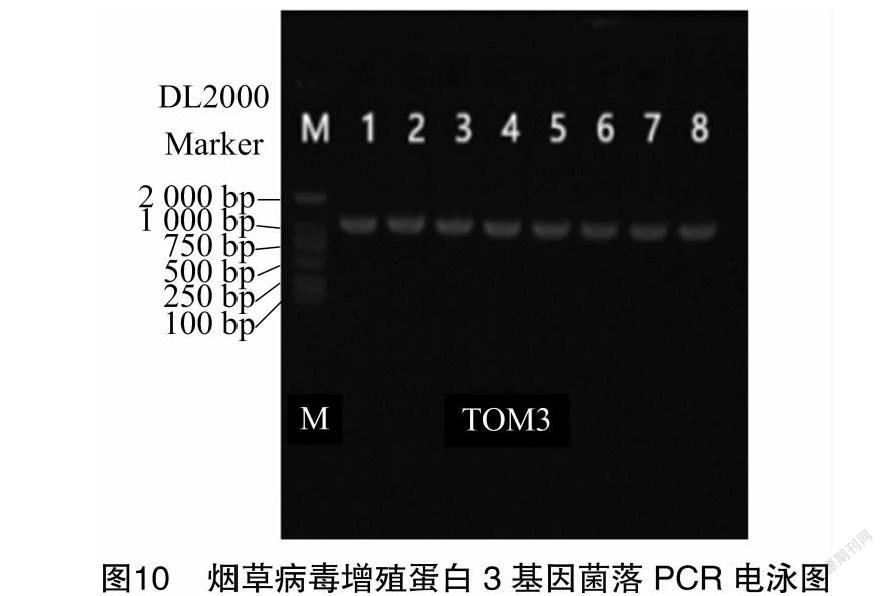
以提供的目的基因序列设计引物(去掉终止密码子TAG/TAA/TGA)进行PCR扩增。将PCR产物进行凝胶电泳。结果显示,在目标位置扩增到单一条带,大小正确。将条带切胶回收,即为目的基因片段(图10)。用BamHI酶切载体pRI101-GFP线性化,回收后和目的基因片段重组反应。重组产物转化大肠杆菌DH5α细胞。挑取PCR阳性的转化子摇菌培养提取质粒,对重组质粒进行酶切检测,同时扩增产物送测序。测序比对结果显示,目的基因已插入载体,表达载体构建准确(图11)。
2.10 怀玉山三叶青烟草病毒增殖蛋白3亚细胞定位分析
通过烟草叶片瞬时表达,将烟草病毒增殖蛋白3融合绿色荧光蛋白(GFP)的载体质粒2301-TP2A-GFP转入农杆菌,吸取农杆菌液,压迫注入烟草叶片下表皮(背面)进行烟草病毒增殖蛋白3亚细胞定位分析(图12)。利用激光共聚焦显微镜观察,融合GFP的烟草病毒增殖蛋白3转化烟草叶片只在细胞质(可能包括细胞膜)和细胞核膜观察到绿色荧光,表明烟草病毒增殖蛋白3定位于细胞质(可能包括细胞膜)和细胞核膜,与 WoLFPsort在线软件预测结果基本一致。
2.11 怀玉山三叶青烟草病毒增殖蛋白3转基因烟草鉴定、GUS组织化学染色和光合特征
图13为烟草病毒增殖蛋白3转基因阳性烟草和阴性烟草PCR检测,通过PCR检测筛选出烟草病毒增殖蛋白3转基因阳性烟草和阴性烟草。由图14可见,怀玉山三叶青烟草花叶病毒侵染后,烟草病毒增殖蛋白3转基因阳性烟草根茎叶的TMV表达量显著高于转基因阴性烟草。光合生理的测定结果表明,与怀玉山三叶青烟草病毒增殖蛋白3转基因阴性烟草相比较,怀玉山三叶青烟草病毒增殖蛋白3转基因阳性烟草的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、最大光化学效率(Fv/Fm)、实际光化学量子效率(ΦPSⅡ)、光化学淬灭系数(qP)及电子传递效率(ETR)显著下降,而非光化学淬灭系数(NPQ)显著上升(表1)。
2.12 怀玉山三叶青2个栽培种不同器官中烟草病毒增殖蛋白3基因的表达分析
以怀玉山三叶青的GAPDH为内参,利用实时荧光定量PCR分析怀玉山三叶青烟草病毒增殖蛋白3基因在怀玉山三叶青2个栽培种不同器官中的表达情况。结果显示,怀玉山三叶青烟草病毒增殖蛋白3基因在根、茎、叶中均有表达,但在不同组织器官的表达情况差异显著(图15),但均在叶中表达量最高。
3 结论与讨论
烟草花叶病毒侵染宿主后,需要依靠宿主内一些病毒增殖蛋白(如TOM1、TOM2和TOM3)才能完成其自身的复制[9]。研究表明,在拟南芥、烟草、番茄、辣椒等植物中TOM1和TOM3基因可以促进TMV、CMV、ToMV等病毒的复制,说明TOM1和TOM3基因在不同物种之间存在一定的保守性[11]。宋静静克隆了马铃薯StTOM3基因的cDNA和基因组DNA序列,获得的cDNA长度为 1 254 bp,全长基因组DNA长度为6 245 bp[11]。StTOM3基因含有多个高疏水性区域,为7次跨膜蛋白。马铃薯StTOM3基因编码297个氨基酸,与拟南芥StTOM3基因在核苷酸水平上的同源性为612%,在氨基酸水平上同源性达到72.9%,相似性达到83.8%[12]。番茄基因ToTOM3全长cDNA共有1 267个核苷酸,包含1个含888个核苷酸的编码区、72个核苷酸的5′非编码区和307个核苷酸的3′非编码区,编码1个含295个氨基酸、推测是一种7次跨膜蛋白的分子量为34.4 ku的蛋白质[13]。本试验结果表明,怀玉山三叶青烟草病毒增殖蛋白3基因cDNA总长度为873 bp,G+C 含量为44.22%,怀玉山三叶青烟草病毒增殖蛋白3由290个氨基酸组成,分子量为33 374.79 u,等电点为9.72,为疏水性蛋白。怀玉山三叶青烟草病毒增殖蛋白3在进化上与Herrania umbratica(哥伦比亚锦葵)、Durio zibethinusl(榴莲)、Carica papaya(番木瓜)、Tripterygium wilfordii (雷公藤)、Pistacia vera(开心果)、Punica granatum(石榴)和 Nelumbo nucifera(莲)和Vitis vinifera(欧亚种葡萄)、Vitis riparia(河岸葡萄)的亲缘关系较近,尤其是与Vitis vinifera(葡萄)烟草病毒增殖蛋白3(GenBank:XP_002275179.1、GenBank:XP_034684444.1)在进化上具有最高的亲缘关系。说明怀玉山三叶青烟草病毒增殖蛋白3基因具有保守性。这些保守区段的发现将为其他物种新的怀玉山三叶青烟草病毒增殖蛋白3基因的克隆提供序列依据。从碱基组成和G+C含量基本平衡来看,怀玉山三叶青烟草病毒增殖蛋白3基因G+C的含量越高,基因稳定性越高,三叶青烟草病毒增殖蛋白3基因基本处于稳定状态,这可能为三叶青烟草病毒增殖蛋白3基因稳定遗传与进化提供了保证。
本研究表明,怀玉山三叶青烟草病毒增殖蛋白3在氨基酸序列水平上除了与 TOM3-like、TOM3 isoform X2和TOM3 isoform X1具有较高的同源性,还与Herrania umbratica(哥伦比亚锦葵)、Durio zibethinusl(榴莲)等其他植物中一些未知功能的跨膜蛋白具有高度同源性,暗示许多植物中可能存在类似的功能蛋白(在此称之为 TOM 家族)參与病毒复制过程中 RNA 复制复合体的装配、特异选择和招募 RNA 复制模板、激活 RNA的合成等[14-18],或是与运动蛋白或胞间连丝相互作用,参与病毒的体内运输[19-22]。这些 TOM 膜蛋白很可能作为病毒复制酶的一种框架结构,同时还可以作为病毒蛋白和其他寄主因子的锚定物参与病毒复制复合体的形成[23-25]。
研究表明,拟南芥TOM1和TOM3 基因均编码跨膜蛋白,其同源性为 56%,主要与 TMV 复制蛋白中的螺旋酶相互作用,帮助复制酶复合体锚定在内质网膜或液泡膜等高密度生物膜上[26]。本试验通过软件预测怀玉山三叶青烟草病毒增殖蛋白3主要存在质膜、液泡膜、内质网中;而烟草叶片亚细胞定位分析表明,烟草病毒增殖蛋白3定位于细胞质(可能包括细胞膜)和细胞核膜中。本试验结果与前人的研究结果一致。Kumar等认为与液泡膜相关的宿主蛋白TOM1和TOM3是烟草病毒高效增殖所必需的[27]。有研究表明,转反义ToTOM3或RNAi的番茄植株推迟发病时间并且症状显著减轻,生物学测定结果表明转反义ToTOM3或RNAi的转基因番茄植株显著抑制CMV和TMV在番茄体内的积累,证实番茄ToTOM3基因是CMV和TMV的寄主因子基因[13]。
在本试验中,怀玉山三叶青烟草花叶病毒侵染后,怀玉山三叶青烟草病毒增殖蛋白3转基因阳性烟草根茎叶中的怀玉山三叶青TMV表达量显著高于转基因阴性烟草。表明怀玉山三叶青烟草病毒增殖蛋白3可以促进怀玉山三叶青烟草花叶病毒的增殖,也证明怀玉山三叶青ToTOM3基因是怀玉山三叶青烟草花叶病毒的寄主因子基因。
马铃薯ToTOM3基因在马铃薯的基因组中为单拷贝基因,且在马铃薯营养生长和生殖生长时期的各个器官内都有表达[11]。相对定量RT-PCR试验表明ToTOM3基因在番茄子叶期、5叶期、10叶期、结果期等4个生育期的茎、根、叶及结果期的花、果等组织中均有表达,而且表达量基本一致,说明ToTOM3属于组成型表达基因[13]。本试验结果与此不同,怀玉山三叶青烟草病毒增殖蛋白3基因在根、茎、叶中均有表达,但在不同组织器官中的表达情况差异显著,在叶中表达量最高。表明,怀玉山三叶青烟草病毒增殖蛋白3基因主要的表达位置在叶片。植物病毒一旦侵染会导致植物种性退化,产量下降,品质变劣。究其原因是植物的无性繁殖极易感染,从而使植物的光合效率下降[28]。在本试验中,与怀玉山三叶青烟草病毒增殖蛋白3转基因阴性烟草相比较,怀玉山三叶青烟草病毒增殖蛋白3转基因阳性烟草的净光合速率、气孔导度、蒸腾速率、最大光化学效率、实际光化学量子效率、光化学淬灭系数及电子传递效率显著下降,而非光化学淬灭系数显著上升,表明怀玉山三叶青烟草病毒增殖蛋白3通过怀玉山三叶青烟草花叶病毒的增殖继而影响植株的光合作用,这是植物产量下降、品质变劣的根本原因。本研究首次从怀玉山三叶青基因组中克隆出烟草病毒增殖蛋白3基因,并对克隆的基因序列和其氨基酸序列进行了生物信息学、亚细胞定位以及功能和组织表达分析,为三叶青烟草花叶病毒增殖的研究补充了基础资料。同时,由于烟草花叶病毒的复制和维持需要合适的寄主因子,通过调控寄主因子,阻断烟草花叶病毒在怀玉山三叶青体内的复制和运输,就有可能达到防治烟草花叶病毒病和减轻病害症状的目的。这种策略对怀玉山三叶青烟草花叶病毒病的防治具有普遍意义,是最有希望的新的抗怀玉山三叶青烟草花叶病毒策略之一。
参考文献:
[1]Chu Q A,Chen W,Jia R Y,et al. Tetrastigma hemsleyanum leaves extract against acrylamide-induced toxicity in HepG2 cells and Caenorhabditis elegans[J]. Journal of Hazardous Materials,2020,393:122364.
[2]Zhu B Q,Qian C D,Zhou F M,et al. Antipyretic and antitumor effects of a purified polysaccharide from aerial parts of Tetrastigma hemsleyanum[J]. Journal of Ethnopharmacology,2020,253(18):112663.
[3]Hu W Y,Zheng Y J,Xia P G,et al. The research progresses and future prospects of Tetrastigma hemsleyanum Diels et Gilg:a valuable Chinese herbal medicine[J]. Journal of Ethnopharmacology,2021,271:113836.
[4]Ji T,Ji W W,Wang J A,et al. A comprehensive review on traditional uses,chemical compositions,pharmacology properties and toxicology of Tetrastigma hemsleyanum[J]. Journal of Ethnopharmacology,2021,264:113247.
[5]林國卫,闻 静,石光禹,等. 侵染怀玉山三叶青的病毒RT-PCR鉴定[J]. 分子植物育种,2020,18(3):968-975.
[6]王嘉琪,刘 勇,张松柏,等. 纳米材料结合的dsRNA对烟草花叶病毒侵染的抑制[J]. 中国生物防治学报,2018,34(5):715-721.
[7]Decroocq V,Sicard O,Alamillo J M,et al. Multiple resistance traits control plum pox virusInfection in Arabidopsis thaliana[J]. Molecular Plant-Microbe Interactions,2006,19(5):541-549.
[8]Yamanaka T,Imai T,Satoh R,et al. Complete inhibition of Tobamovirus multiplication by simultaneous mutations in two homologous host genes[J]. Journal of Virology,2002,76(5):2491-2497.
[9]宋静静,蒙姣荣,卢晓静,等. 马铃薯StTOM1和StTOM3双干扰植物双元表达载体的构建及转化验证[J]. 基因组学与应用生物学,2014,33(1):22-28.
[10]Zhu R Y,Xu X F,Ying J L,et al. The phytochemistry,pharmacology,and quality control of Tetrastigma hemsleyanum Diels & Gilg in China:a review[J]. Frontiers in Pharmacology,2020,11:550497.
[11]宋静静.马铃薯候选寄主因子基因StTOM1-A、StTOM1-B和StTOM3的克隆和功能鉴定[D]. 南宁:广西大学,2014:50-51.
[12]熊 伟.马铃薯ToTOM3基因的克隆与表达StTOM3-RNAi转基因马铃薯的构建[D]. 南宁:广西大学,2006:74-75.
[13]蒙姣荣.番茄RNA病毒寄主因子基因ToTOM3的克隆与功能鉴定[D]. 广州:华南农业大学,2005:59-60.
[14]Choudhary N,Kumari P,Panda S.RNA plant viruses:biochemistry,replication and molecular genetics[M]//Applied plant virology. Amsterdam:Elsevier,2020:183-195.
[15]Xu D L,Zhou G H.Characteristics of siRNAs derived from Southern rice black-streaked dwarf virus in infected rice and their potential role in host gene regulation[J]. Virology Journal,2017,14(1):27.
[16]Tsujimoto Y,Numaga T,Ohshima K,et al. Arabidopsis tobamovirus MULTIPLICATION (TOM) 2 locus encodes a transmembrane protein that interacts with TOM1[J]. The EMBO Journal,2003,22(2):335-343.
[17]Yamanaka T,Ohta T,Takahashi M,et al. TOM1,an Arabidopsis gene required for efficient multiplication of a Tobamovirus,encodes a putative transmembrane protein[J]. Proceedings of the National Academy of Sciences of the United States of America,2000,97(18):10107-10112.
[18]Yamanaka T,Imai T,Satoh R,et al. Complete inhibition of Tobamovirus multiplication by simultaneous mutations in two homologoushostgenes[J].JournalofVirology,2002,76(5):
2491-2497.
[19]Chen M H,Citovsky V. Systemic movement of a Tobamovirus requires host cell pectin methylesterase[J]. The Plant Journal,2003,35(3):386-392.
[20]Chen J,Ahlquist P.Brome mosaic virus polymerase-like protein 2a is directed to the endoplasmic Reticulum by helicase-like viral protein 1a[J]. Journal of Virology,2000,74(9):4310-4318.
[21]Dorokhov Y L,Mkinen K,Frolova O Y,et al. A novel function for a ubiquitous plant enzyme pectin methylesterase:the host-cell receptor for the tobacco mosaic virus movement protein[J]. FEBS Letters,1999,461(3):223-228.
[22]Lartey R T,Ghoshroy S,Citovsky V.Identification of an Arabidopsis thaliana mutation (vsm1) that restricts systemic movement of tobamoviruses[J]. Molecular Plant-Microbe Interactions,1998,11(7):706-709.
[23]Ishibashi K,Nishikiori M,Ishikawa M.Interactions between Tobamovirus replication proteins and cellular factors:their impacts on virus multiplication[J]. Molecular Plant-Microbe Interactions,2010,23(11):1413-1419.
[24]Fujisaki K,Ravelo G B,Naito S,et al. Involvement of THH1,an Arabidopsis thaliana homologue of the TOM1 gene,in Tobamovirus multiplication[J]. The Journal of General Virology,2006,87(Pt 8):2397-2401.
[25]Asano M,Satoh R,Mochizuki A,et al. Tobamovirus-resistant tobacco generated by RNA interference directed against host genes[J]. FEBS Letters,2005,579(20):4479-4484.
[26]Hagiwara Y,Komoda K,Yamanaka T,et al. Subcellular localization of host and viral proteins associated with Tobamovirus RNA replication[J]. The EMBO Journal,2003,22(2):344-353.
[27]Kumar S,Dubey A K,Karmakar R,et al. Inhibition of TMV multiplication by siRNA constructs against TOM1 and TOM3 genes of Capsicum annuum[J]. Journal of Virological Methods,2012,186(1/2):78-85.
[28]Fereres A,Moreno A.Behavioural aspects influencing plant virus transmission by homopteran insects[J]. Virus Research,2009,141(2):158-168.
