南疆地区牛支原体分离鉴定及致病性
2022-04-14刘庆国赵金玉宋浩楠武军元
刘庆国,周 鹏,赵金玉,宋浩楠,武军元
(塔里木大学动物科学与技术学院,新疆 阿拉尔 843300)
牛支原体可引起乳房炎、肺炎、关节炎等疾病,影响牛的眼、耳、脑等其他器官[1],也是牛呼吸道疾病综合征(BRD)的主要参与者,对养牛业造成了重大的损失[2]。尽管牛支原体不是人畜共患病,但可以感染男性并引起睾丸炎、睾丸精囊炎和精液质量下降,在世界范围内造成了重大的经济、健康和福利问题。在2019—2020 年南疆地区牛支原体流行病学调查中显示,南疆地区较北疆地区的牛支原体感染情况更为严重。调查的10 个南疆规模化养殖场均存在牛支原体感染,平均感染率为22.86%,现将调查结果介绍如下。
1 材料与方法
1.1 材料
1.1.1 病料 采集南疆不同地区疑似因牛支原体病病死牛肺脏5 份及患有呼吸道疾病的牛鼻拭子若干。病牛多见体温升高、精神萎靡、食欲不振、眼口鼻分泌物增多,有脓性鼻液。病死后剖检可见肺脏大理石样变,病变处可见隆起,内有干酪样病灶。
1.1.2 主要试剂及仪器 C1000 Touch™PCR 仪,购自Bio-Rad(中国)有限公司;XMTP 2045 型恒温水浴锅、GSP 9080WBE 型隔水式恒温式培养箱,购自上海博讯实业有限公司;细菌基因组DNA 提取试剂盒,购自天根生化科技(北京)有限公司;PPLO Broth,PPLO Agar,购自BD(中国);SPF 鸡胚,购自北京梅里亚维通实验动物技术有限公司(中国)。
1.2 方法
1.2.1 样本采集及处理
1)鼻拭子采集及处理。对牛鼻腔周围进行消毒,取无菌棉签采集鼻腔内分泌物,放入提前准备好的MTB[1]液体培养基中,培养12 h。吸取培养物200 μL,通过 0.45 μm 细菌滤器接种到新的 MTB 液体培养基中培养2 d。
2)肺脏采集及处理。对病死牛肺脏尽早采集并避免污染。带回后在超净台下对肺脏病健交界处进行烧烙灭菌并做十字切口,取黄豆大小组织,放入离心管中并加入1 mL 生理盐水进行匀浆。再将其进行简短低速离心,吸取上清液200 μL 通过0.45μm细菌滤器接种到MTB 液体培养基中培养2 d。
1.2.2 病原的纯化 使用牛支原体特异引物对培养物进行PCR 检测,将阳性培养物盲传3 代,使其生长稳定。将培养物倍比稀释至10-3~10-6,分别接种到MTA 固体培养基[1]上,培养 2~4 d。当菌落出现明显的牛支原体菌落特征时,使用10 μL 灭菌枪头将其挑至MTB 液体培养基中,反复3 次纯化后保菌。
1.2.3 形态学观察 菌落生长后使用40 倍光学显微镜观察。
1.2.4 PCR 鉴定 牛支原体特异引物及支原体通用引物均由生工生物工程(上海)股份有限公司合成。引物信息见表1。
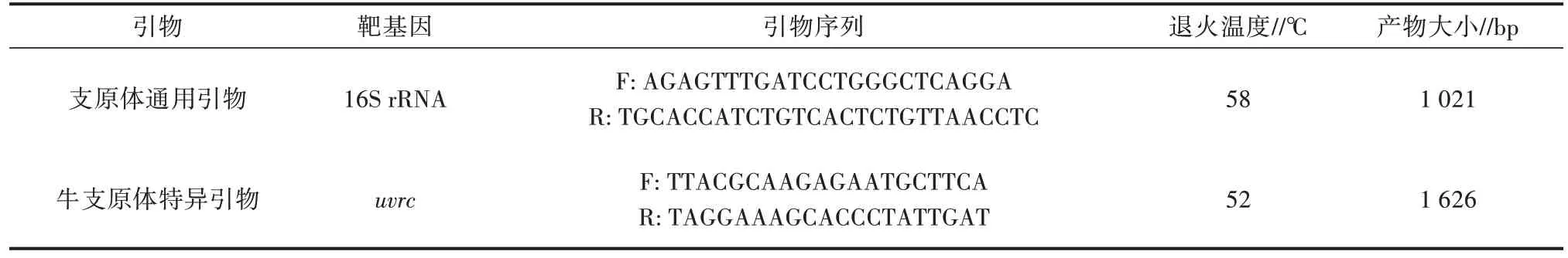
表1 引物信息
1)细菌组DNA 制备。细菌组DNA 制备参照说明书提取。
2)PCR 扩增。PCR 反应体系 10 μL,2×TaqPCR MasterMix 5 μL;Primer F(10 μmol/L)0.3 μL;Primer R(10 μmol/L)0.3 μL;ddH2O 3.4 μL;模板 DNA(约 100 ng/μL)1 μL。反应条件见表2。

表2 反应条件
3)克隆和测序。使用琼脂糖回收试剂盒对PCR产物进行回收纯化。并将载体与回收产物进行连接后转化到DH5α 中,通过蓝白斑筛选与质粒PCR 检测是否转化成功。将成功转化的菌株送往测序。
1.2.5 序列分析 测序完成后,通过NCBI网站下载牛支原体及其他相关序列。使用DNAstart 软件进行同源性比对分析(表3),使用MEGA 7.0 软件构建系统进化树。
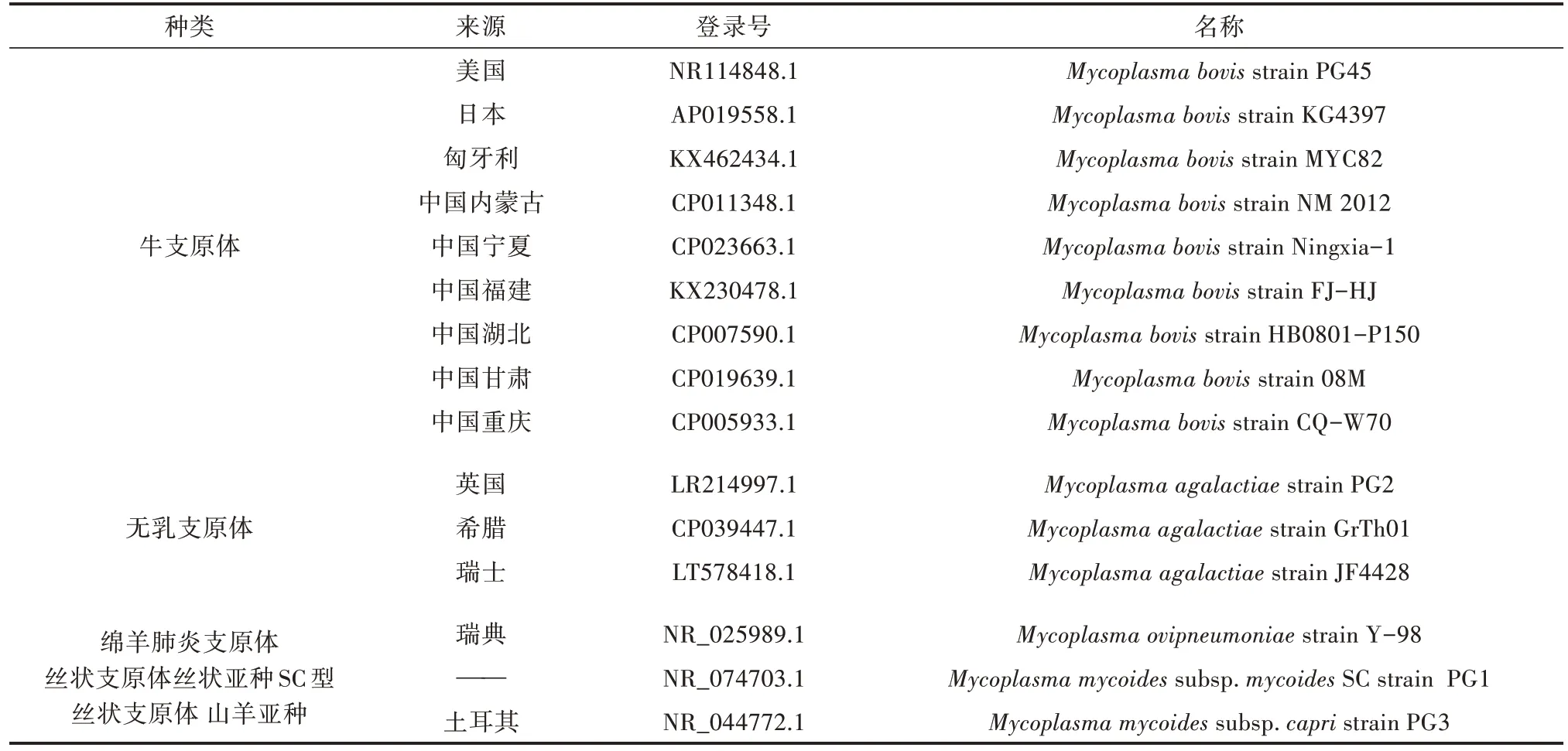
表3 用于比对分析的支原体16S rRNA 基因序列
1.2.6 菌株和鸡胚的处理 取浓度为109CCU/mL牛支原体纯培养物,在超净台下使用生理盐水反复洗涤3 次,备用。将鸡胚气室向上倾斜40°置于37.5 ℃水床,并盖上棉被保温。每日翻蛋2 次,并弃去无精蛋、死胚、弱胚,挑选出发育胚体大小相近的鸡胚。
1)接种方法。将鸡胚消毒,在超净台下向7 日龄鸡胚的尿囊腔接种0.2 mL(109CCU/mL)洗涤后的菌液,每组10 只,并设生理盐水对照组和空白对照组。接种完成后继续孵化,弃掉24 h 内死亡的鸡胚。
2)鸡胚检测。将24 h 后死亡的鸡胚,放入4 ℃冰箱过夜,使其尿囊液析出。无菌抽取尿囊液进行PCR 检测、分离鉴定及记录数据。观察至15 日龄,未死亡鸡胚统一进行检测。
2 结果与分析
2.1 病原的分离与纯化
使用牛支原体特异引物进行PCR 检测阳性的培养物经过MTB 液体培养基盲传3 代、MTA 固体培养基纯化3 次后,从5 份病死牛肺脏及若干鼻拭子中获得3 份纯培养物。在低倍镜下可观察到煎蛋样的菌落(图1)。
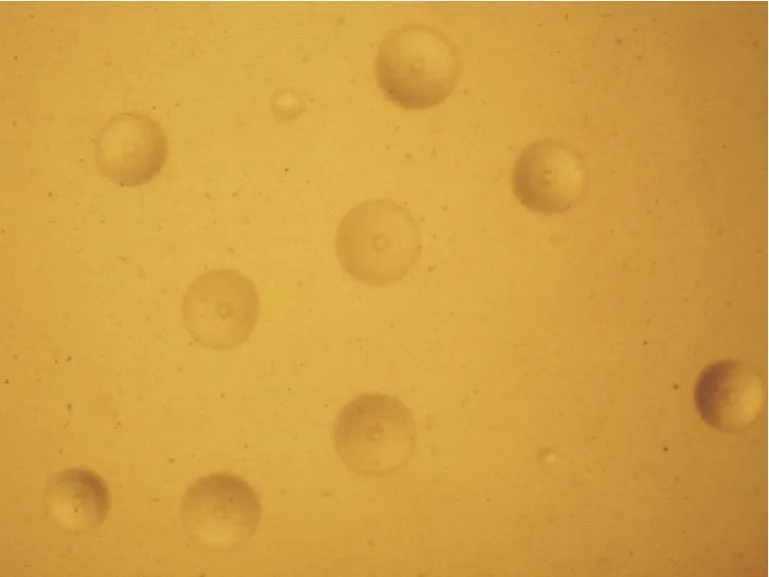
图1 分离株形态观察(40×)
2.2 PCR 检测结果
牛支原体通用引物及牛支原体特异引物分别在1 021 及1 626 bp 处可见明亮清晰的目的条带,确定为牛支原体(图2)。

图2 PCR 检测结果
2.3 序列分析
2.3.1 同源性分析 将克隆测序所得的3 株16S rRNA 序列与NCBI 中的参考序列进行比对。结果显示,本研究中的3 株牛支原体之间同源性为98.2%~98.5%,分离株 1 与 KG4397 同源性最近;分离株 2 与CQ-W70、KG4397 同源性最近;分离株3与NM2012等同源性最近(图3)。
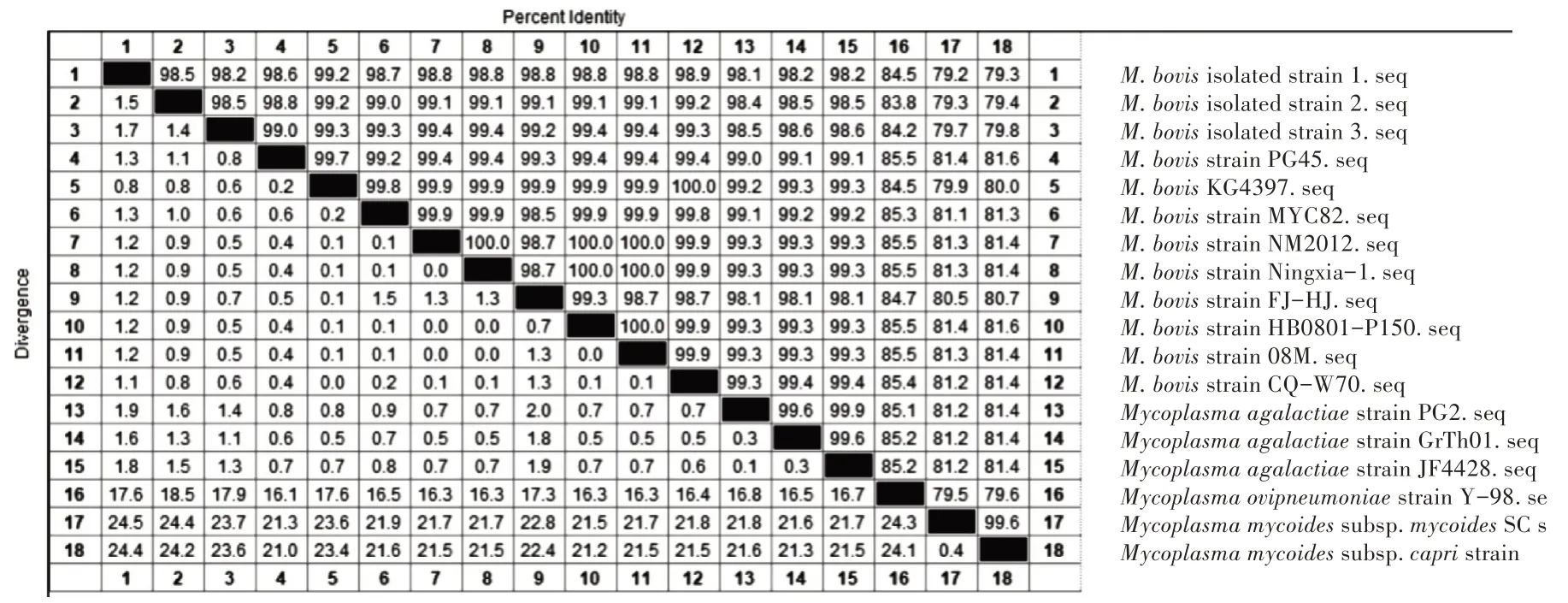
图3 牛支原体分离株16S rRNA 基因序列与参考序列核苷酸同源性对比
2.3.2 系统进化树分析 试验中的分离株与牛支原体分离株PG45、KG4397、MYC82、NM2012、Ningxia-1、FJ-HJ、HB0801-P150、08M、CQ-W70 聚成一个类群,亲缘关系较近。试验分离株1 与牛支原体分离株FJ-HJ 亲缘关系最近,分离株2 与牛支原体分离株NM2012、MYC82 亲缘关系最近,分离株3 与牛支原体分离株MYC82 亲缘关系最近(图4)。

图4 基于支原体的16S rRNA 基因序列构建的系统进化树
2.4 鸡胚感染后变化
由图5 可知,正常发育鸡胚发育较快,有尿酸盐析出,胚体体积占鸡胚体积比重较大;而经牛支原体感染后存活的鸡胚发育较慢,大部分无尿酸盐析出,胚体体积占鸡胚体积比重较小;牛支原体感染后可以造成部分鸡胚死亡[3],胚体表面有明显充血、出血(图5)。

图5 鸡胚感染后变化
2.5 不同菌株感染结果
由表4 可知,试验分离株1 在对鸡胚的致死率(20%)、尿酸盐沉积率(30%)、活胚平均重(9.50 g)所表现出的毒力,均高于试验分离株2 及分离株3。

表4 鸡胚感染试验结果
3 讨论
牛支原体自发现至今各主要养牛国均有该病原体的存在[4],南疆地区养牛数量较多,其感染率也较高(22.86%)[1]。牛感染该病原体后往往不会表现出临床症状,会间歇性排毒且传播方式多样[5]。这使得引种[6]、使用外来精液[7]等都存在被感染的风险。一旦该病原体进入牛场后非常容易进一步传播,如挤奶时造成的传播[7]、犊牛食用被污染的乳汁造成的传播、牛接触被污染的垫草等造成的传播[8]、牛与牛直接接触造成的传播,甚至吸入污染的空气造成的传播[9]。当该病原体广泛存在于牛场后,部分免疫力低的牛会出现非特异性的临床症状,如乳腺炎、呼吸道症状、关节炎、增重下降等。造成的经济损失难以估计。
当牛场被感染后,因其非特异性的症状及隐性感染的存在,很难确定哪些牛被感染过,即使通过检测确定了,对其进行针对性的治疗并不能完全消灭场内的牛支原体。完全淘汰后坚持自繁自养看似可行,但从经济方面及实施难度上考虑不划算。
疫苗是解决该问题的较好途径[10],当然疫苗的研发也存在着诸多挑战,比如牛支原体具有可变表面脂蛋白(Vsps),在体外和体内经历高频的变化,使得牛支原体具有强大的抗原变异能力[11],使牛支原体疫苗在大部分情况下预防效果不佳[12]。
牛支原体疫苗的开发及相关研究离不开分离鉴定和致病力检测,但由于试验成本较高,且试验繁琐仅能对一部分分离株进行致病性检测,不利于后续研究的进行。而范媛[3]、吴翠兰等[13]通过 SPF 鸡胚对牛支原体进行致病性检测后发现牛支原体对鸡胚具有一定致病性,且试验成本低,但牛支原体对鸡胚的致病性与对牛的致病性是否一致仍需进一步研究。本试验参照其方法进行了致病性检测,为后续研究提供数据支持。结果表明,分离株1 的致病性比分离株 2、分离株 3 强。但参照范媛[3]、吴翠兰等[13]的试验结果来看,均为弱毒株。
