山东省多主棒孢对三种常用杀菌剂的敏感性监测及对氟吡菌酰胺的抗性
2022-04-14李桂香李秀环郝新昌李智文刘峰刘西莉
李桂香,李秀环,,郝新昌,李智文,刘峰,刘西莉
山东省多主棒孢对三种常用杀菌剂的敏感性监测及对氟吡菌酰胺的抗性
李桂香1,李秀环1,2,郝新昌1,李智文3,刘峰2,刘西莉1
1西北农林科技大学旱区作物逆境生物学国家重点实验室,陕西杨凌 712100;2山东农业大学植物保护学院,山东泰安 271018;3陕西省农药管理检定所,西安 710003
【】由多主棒孢()引起的黄瓜靶斑病是世界公认的黄瓜三大病害之一,严重影响着黄瓜的产量和品质。随着防治药剂的连续使用,其抗药性问题日益突出。本研究旨在明确山东省多主棒孢对常用杀菌剂的抗性情况,为黄瓜靶斑病的药剂防治提供理论依据,同时筛选高效混配药剂为多主棒孢的抗药性治理提供数据支持。从山东省不同地区采集、分离纯化获得140株多主棒孢,采用室内菌丝生长速率法测定多主棒孢对3种常用杀菌剂(苯醚甲环唑、咪鲜胺和氟吡菌酰胺)的敏感性,并利用Modeller v9.19程序同源建模及AutoDock4.2.6分子对接软件包分析多主棒孢对氟吡菌酰胺的抗性。结合室内菌丝生长抑制和离体叶片防治效果试验筛选氟吡菌酰胺和咪鲜胺的复配最佳配比。经过异常值分析并剔除,敏感菌株频率分布均呈单峰,分别确定苯醚甲环唑对多主棒孢121株敏感菌株的EC50范围为0.29—6.80 μg·mL-1,平均EC50值为2.44 μg·mL-1;咪鲜胺对129株敏感菌株的EC50范围为0.01—0.57 μg·mL-1,平均EC50值为0.16 μg·mL-1;而氟吡菌酰胺对136株多主棒孢的EC50范围为0.56—47.54 μg·mL-1,平均EC50值为6.94 μg·mL-1。经测序分析发现31.62%多主棒孢菌株SdhC亚基发生S73P点突变。分子对接结果表明,SdhC亚基上发生S73P突变后,氨基酸的刚性增强,并且空间位阻变大,使氟吡菌酰胺与Ser73之间的氢键作用消失,从而亲和力降低,导致抗药性的发生。交互抗性分析结果表明氟吡菌酰胺与咪鲜胺不存在交互抗性,两者以7﹕3混用增效系数1.84,表现为增效作用,且相同剂量处理下,混剂的防治效果高于两个单剂处理的防治效果。山东省不同地区多主棒孢群体对不同杀菌剂的敏感性存在差异,对氟吡菌酰胺已产生不同程度的抗性,其中SdhC上点突变S73P的发生频率相对较高,导致病原菌琥珀酸脱氢酶与氟吡菌酰胺的结合能力下降。氟吡菌酰胺与咪鲜胺以7﹕3混用能够提高防治黄瓜靶斑病的效果,建议生产上可将氟吡菌酰胺与咪鲜胺交替或混合使用,用于治理目前多主棒孢对氟吡菌酰胺等SDHI类杀菌剂的抗性问题。
多主棒孢;黄瓜靶斑病;敏感性;S73P突变;分子对接;增效作用
0 引言
【研究意义】黄瓜靶斑病又称褐斑病、小黄点病,是由多主棒孢()侵染引起的一种气传性叶部病害[1]。近年来,随着设施栽培模式的增加,黄瓜靶斑病在山东省的发生逐年加重,严重影响黄瓜的产量和品质[1-2]。多主棒孢具有喜温好湿的特点,保护地高温高湿环境为孢子萌发和繁殖提供了适宜条件,有利于病害的传播和蔓延。该病一般在3月中旬开始发生,4、5月份逐渐蔓延加重,其田间发生率一般为10%—25%,若防治不力,发病率可达60%—70%,甚至100%,导致提前拉秧、严重减产[3-5]。由于缺乏抗病品种,生产上主要采用化学药剂防治黄瓜靶斑病,因其病原菌繁殖速度快,遗传变异大,因此定期进行药剂抗性水平监测分析非常重要。【前人研究进展】目前在我国登记用于防治黄瓜靶斑病的药剂主要有QoI(苯醌外部抑制剂quinone outside inhibitor,吡唑醚菌酯、肟菌酯、嘧菌酯)、DMI(14-脱甲基化抑制剂demethylation inhibitor,苯醚甲环唑、戊唑醇、咪鲜胺、氯氟醚菌唑)和SDHI(琥珀酸脱氢酶抑制剂succinate dehydrogenase inhibitor,氟吡菌酰胺、氟唑菌酰羟胺、氟唑菌酰胺)三大类杀菌剂(中国农药信息网,http://www.chinapesticide.org.cn/hysj/index.jhtml),苯醚甲环唑、咪鲜胺和戊唑醇等DMI类杀菌剂,通过抑制多主棒孢麦角甾醇的合成,进而影响细胞膜的流动性和完整性,抑制病原菌的生长从而控制该病原菌引起的病害,而氟吡菌酰胺等SDHI类杀菌剂作用于线粒体电子呼吸传递链的复合物II(琥珀酸脱氢酶),通过阻止电子从铁硫中心到泛醌的传递而抑制病原菌的呼吸作用,是目前中国防治靶斑病的高效杀菌剂品种。随着田间防治药剂的长期使用,多主棒孢已对苯并咪唑类杀菌剂多菌灵、苯菌灵、噻菌灵和甲基硫菌灵[6-9],N-苯基氨基甲酸酯类杀菌剂乙霉威[10],SDHI类杀菌剂啶酰菌胺、氟吡菌酰胺、吡噻菌胺和萎锈灵[11-15],QoI类杀菌剂嘧菌酯、氟嘧菌酯、烯肟菌胺、吡唑醚菌酯和丁香菌酯[6,16-19]以及DMI类杀菌剂环唑醇和丙硫菌唑[20]均产生不同程度的抗性。Li等[19]检测了2019—2020年采自我国山东省不同地区的131株多主棒孢对吡唑醚菌酯的敏感性,结果表明对QoI类杀菌剂呈高抗性水平,抗性频率高达100%,抗性机制为发生G143A突变;Duan等[6]对2017—2018年采自我国不同省份的共619株多主棒孢的抗药性监测结果显示,所有菌株均对苯并咪唑类杀菌剂和QoI类杀菌剂产生抗性,且均含有G143A点突变,而上的E198A、E198A&M163I、E198A&F167Y或E198A&F200S导致多主棒孢对苯并咪唑类杀菌剂产生抗性;Zhu等[11]研究表明,2005—2017年采自我国7个不同地区的798株多主棒孢菌株中有27.8%的菌株对啶酰菌胺表现出抗性,对其中37株抗性菌株靶基因进一步分析发现,在啶酰菌胺高抗(抗性倍数>50)菌株中存在B-H278Y、D-H105R和D-G109V单氨基酸突变,在中抗(抗性倍数为7—50)菌株中发生C-S73P、B-I280V和D-D95E单氨基酸突变。已有研究表明,同种病原菌对同一类不同药剂产生的抗性机制也不尽相同,不同类型突变体对不同SDHI类杀菌剂的敏感性水平差异较大,如SdhB亚基上的H278Y突变菌株对氟吡菌酰胺表现敏感,但对啶酰菌胺表现高抗,SdhC亚基上的S73P突变菌株对萎锈灵表现为敏感,而对啶酰菌胺表现中抗[11,14-15]。【本研究切入点】鉴于山东地区已经普遍使用DMI类杀菌剂苯醚甲环唑、咪鲜胺等和SDHI类杀菌剂氟吡菌酰胺等药剂用防治黄瓜靶斑病、白粉病、炭疽病等病害,及时了解田间多主棒孢对其敏感性变化状况,对于指导药剂的科学选择和使用至关重要。【拟解决的关键问题】明确山东不同黄瓜产区多主棒孢对3种常用杀菌剂的敏感性,并探究其对氟吡菌酰胺的抗性机制,确定氟吡菌酰胺与咪鲜胺混用防治黄瓜靶斑病的可行性,为多主棒孢的抗药性治理提供科学依据。
1 材料与方法
1.1 试验材料
供试菌株:2019—2020年,从山东省不同地区的黄瓜保护种植地采集病叶,在室内进行分离培养,纯化后分离并鉴定共获得140株田间多主棒孢菌株,其中济南13株、德州14株、泰安24株、聊城18株、临沂27株、潍坊28株、淄博16株,这些地区常年使用已登记的QoI(吡唑醚菌酯等)、DMI(苯醚甲环唑等)及SDHI(氟吡菌酰胺等)类药剂用于黄瓜靶斑病的防治。
供试药剂:95.0%苯醚甲环唑原药,山东潍坊润丰化工股份有限公司;98.0%咪鲜胺原药,江苏辉丰生物农业股份有限公司;96.0%氟吡菌酰胺原药、41.7%氟吡菌酰胺悬浮剂,拜耳作物科学(中国)有限公司;250 g·L-1咪鲜胺水乳剂,美国富美实公司;48%代森锰锌悬浮剂,陕西标正作物科学有限公司。
培养基:马铃薯葡萄糖培养基(PDA):马铃薯200 g,葡萄糖18 g,琼脂粉15 g,去离子水1 L,121℃高压灭菌20 min。用于菌株的分离、纯化、培养、保存以及对苯醚甲环唑和咪鲜胺的敏感性测定。YBA培养基:酵母提取物10 g,胰蛋白胨10 g,醋酸钠20 g,琼脂粉15 g,去离子水1 L,121℃高压灭菌20 min。用于对氟吡菌酰胺的敏感性测定。
1.2 试验方法
1.2.1 敏感性测定 采用菌丝生长速率法[12],在无菌操作台中,配置成对照加6个浓度梯度的含药平板。苯醚甲环唑在PDA培养基中的最终系列浓度为0、0.01、0.1、1、5、10和50 μg·mL-1;咪鲜胺的终浓度为0、0.01、0.05、0.1、0.5、1和10 μg·mL-1;氟吡菌酰胺在YBA培养基上[13]的药剂浓度为0、0.1、1、5、10、25和50μg·mL-1。在培养5 d多主棒孢菌落边缘处打取直径为5 mm的菌饼,倒置接种至梯度浓度药剂平板中央,于恒温培养箱中黑暗条件下28℃培养5 d。以十字交叉法量取菌落生长直径,计算抑制率。抑制率(%)=(对照菌落净生长直径-处理菌落净生长直径)/对照菌落净生长直径×100。每个处理设置3个重复,试验进行3次。利用DPS v6.50软件完成抑制中浓度(EC50)计算、毒力回归方程及异常值分析,并采用SPSS 23.0软件Shapiro-Wilk法对EC50进行正态分布检验。
1.2.2 靶基因氨基酸突变位点检测 将多主棒孢在PDA平板上活化预培养5 d,从菌落边缘打取菌饼,接种在铺有玻璃纸的PDA平板上,待菌丝铺满玻璃纸后(约5 d),刮取菌丝并收集在2 mL的EP管中,同时加入两颗直径5 mm的灭菌钢珠,在液氮中充分冷冻,然后置于球磨仪(弗尔德(上海)仪器设备型号:MM400)进行充分研磨成粉末状,采用CTAB(十六烷基三甲基溴化铵)法[14]提取多主棒孢基因组DNA。提取的DNA样品使用超微量分光光度计(赛默飞世尔科技(中国)有限公司,型号:Nannodrop one)进行纯度和浓度的测定,提取的DNA保存于-20℃备用。
根据//的序列信息,用Primer Premier 5.0设计特异性引物(表1),采用北京聚合美生物科技有限公司2×M5 Hiper plus Taq HiFi PCR mix进行靶基因的全长PCR扩增,反应体系(20 μL):2×M5 Hiper plus Taq HiFi PCR mix 10 μL,上游引物和下游引物10 μmol·L-1(表1),模板DNA 1 μL,ddH2O补足20 μL。PCR反应程序:94℃ 5 min,94℃ 20 s,53.9℃ 20 s,72℃ 1 min,步骤2—4进行30个循环,72℃ 5 min,PCR产物4℃保存,PCR反应仪器为伯乐生命医学产品(上海)有限公司的T100TMThermal Cycler。扩增和时,将循环条件中退火温度分别设置为55.0和57.5℃,延伸时间分别设置为30 s和1 min。使用1%琼脂凝胶电泳检测PCR产物,送至北京擎科生物科技有限公司进行测序。根据测序结果,将核苷酸序列转换为氨基酸序列,比对各菌株的SdhB、SdhC和SdhD亚基氨基酸序列差异。

表1 本研究使用引物
1.2.3 分子对接验证 选择蛋白晶体进行序列比对。通过NCBI的Protein BLAST工具检索蛋白质数据库(protein data bank,PDB)中的晶体结构,在检索结果中,寄生线虫()琥珀酸脱氢酶复合物II晶体结构3VR8[21],分辨率为2.81 Å,与Sdh蛋白的序列一致性达到了61.98%,并且3VR8中包含血红素底物结构,因此选择晶体3VR8结构作为构建Sdh结构的模板。
Sdh模型构建:基于模板蛋白三维结构文件以及序列比对文件,由序列的相似性推测结构的相似性,采用Modeller v9.19程序[22]对3VR8蛋白进行同源模建,从而获取目标蛋白合理的三维结构模型,并采用Amber14力场[23]对蛋白模型进行分子力学优化。分别用PROCHECK和Verify 3D程序对优化后的蛋白模型进行评价。
分子对接:将构建得到的Sdh蛋白结构进行分子力学优化处理,作为分子对接的受体。分子对接采用AutoDock4.2.6软件包[24]将配体对接到受体活性区,分别获取氟吡菌酰胺的结构,加氢,并采用MOPAC程序[25]优化结构,计算PM3原子电荷[26]。最后,采用Autodock Tools 1.5.6[27]分别处理配体和受体的结构,将对接的盒子包裹活性位点,X、Y、Z 3个方向的格点数设为40×40×40,格点间距为0.375 Å,对接盒子中心点坐标为-39.478、-11.131、-53.923,对接次数设为100,其余参数采用默认值。
分子对接的结果在空间结构上可能有不合理的原子接触,采用能量优化的方法对这些作用力进行释放,使其更趋于稳定结构。能量优化采用Amber14力场[23],优化过程分两步进行:先进行2 000步的最陡下降法优化,再用2 000步的共轭梯度法对结构进行进一步优化,将最终的结果作为后续分析的模型。
1.2.4 抗性分析 选取对氟吡菌酰胺敏感程度不同的60株多主棒孢测定对苯醚甲环唑和咪鲜胺的敏感性,分别以氟吡菌酰胺和其他药剂EC50的对数值为横、纵坐标作图,进行Spearman rank秩相关分析,相关系数是衡量两个变量间相关性的重要指标,当>0.05时,二者不存在交互抗性,当≤0.05时,两药剂存在不同强度的交互抗性。
1.2.5 氟吡菌酰胺和咪鲜胺最佳配比筛选 将氟吡菌酰胺与咪鲜胺分别按照9﹕1、4﹕1、7﹕3、3﹕2、1﹕1、2﹕3、3﹕7、1﹕4、1﹕9的比例配制成1×104μg·mL-1的混剂母液,并稀释成系列浓度,参照1.2.1的方法配制含混剂0、0.01、0.05、0.1、0.5、1、5和10 μg·mL-1的含药培养基平板,接菌后放在28℃恒温培养箱黑暗培养5 d,每处理重复3次。计算各处理EC50。采用Wadley法进行评价[28]:增效系数SR>1.5为增效作用;0.5≤SR≤1.5为相加作用;SR<0.5为拮抗作用,并按照下式计算:
混剂EC50(理论)(μg·mL-1)=1/[氟吡菌酰胺的质量分数/EC50(氟吡菌酰胺)+咪鲜胺的质量分数/ EC50(咪鲜胺)];增效系数(SR)=EC50(理论)/EC50(实测)。
1.2.6 防治试验 采用离体叶片试验法比较混剂(氟吡菌酰胺﹕咪鲜胺=7﹕3)与单剂氟吡菌酰胺和咪鲜胺对黄瓜靶斑病的防治效果。剂量设置分别为氟吡菌酰胺150 μg·mL-1、咪鲜胺150 μg·mL-1、氟吡菌酰胺﹕咪鲜胺(7﹕3)100、150和200 μg·mL-1。摘取健康、大小一致的3—4叶期黄瓜叶片(津研4号),放在铺有吸水纸的保鲜盒中,使用手持式喷雾器将1 mL药液均匀喷施到单个叶片表面,以喷施清水为对照,室温静置12 h,待叶片基本晾干后,在每片叶子中心做一个无菌撞针创伤,并将多主棒孢菌饼接种到创伤处,每个处理5片黄瓜叶,3次重复。然后将处理后的叶片放置在25℃、相对湿度80%条件下培养3 d后,对病叶进行拍照处理,使用ImageJ 1.51软件统计病斑面积。防治效果(%)=(对照病斑面积-处理病斑面积)/(对照病斑面积-菌饼面积)×100。
采用DPS v6.50单因素方差分析(ANOVA),然后利用最小显著性差异(LSD)法分析各处理间差异显著性,<0.05表示差异显著。使用Excel 2016进行相关柱状图和散点图的制作。
2 结果
2.1 山东省不同地区多主棒孢对3种杀菌剂的敏感性
不同地区菌株对不同杀菌剂敏感性存在差异。从对苯醚甲环唑的敏感性测定结果可以看出(图1-A),德州地区的敏感性显著低于济南、泰安和淄博地区,其平均EC50为4.50 μg·mL-1。其中,济南地区多主棒孢最敏感,平均EC50为2.08 μg·mL-1。整个山东地区EC50最高值为20.86 μg·mL-1,最低为0.29 μg·mL-1(图2-A),经过分析剔除异常值,选择的121株多主棒孢对苯醚甲环唑的敏感性平均EC50为2.44 μg·mL-1,敏感频率分布呈单峰状态,且符合正态分布(>0.05),可以作为相对敏感基线。

A:苯醚甲环唑difenoconazole;B:咪鲜胺prochloraz;C:氟吡菌酰胺fluopyram。图中数值为平均值,通过LSD法测定各处理差异显著性,不同字母表示差异显著(P<0.05)The data in the figure are mean EC50 values, and different letters represent significant difference (LSD, P<0.05)
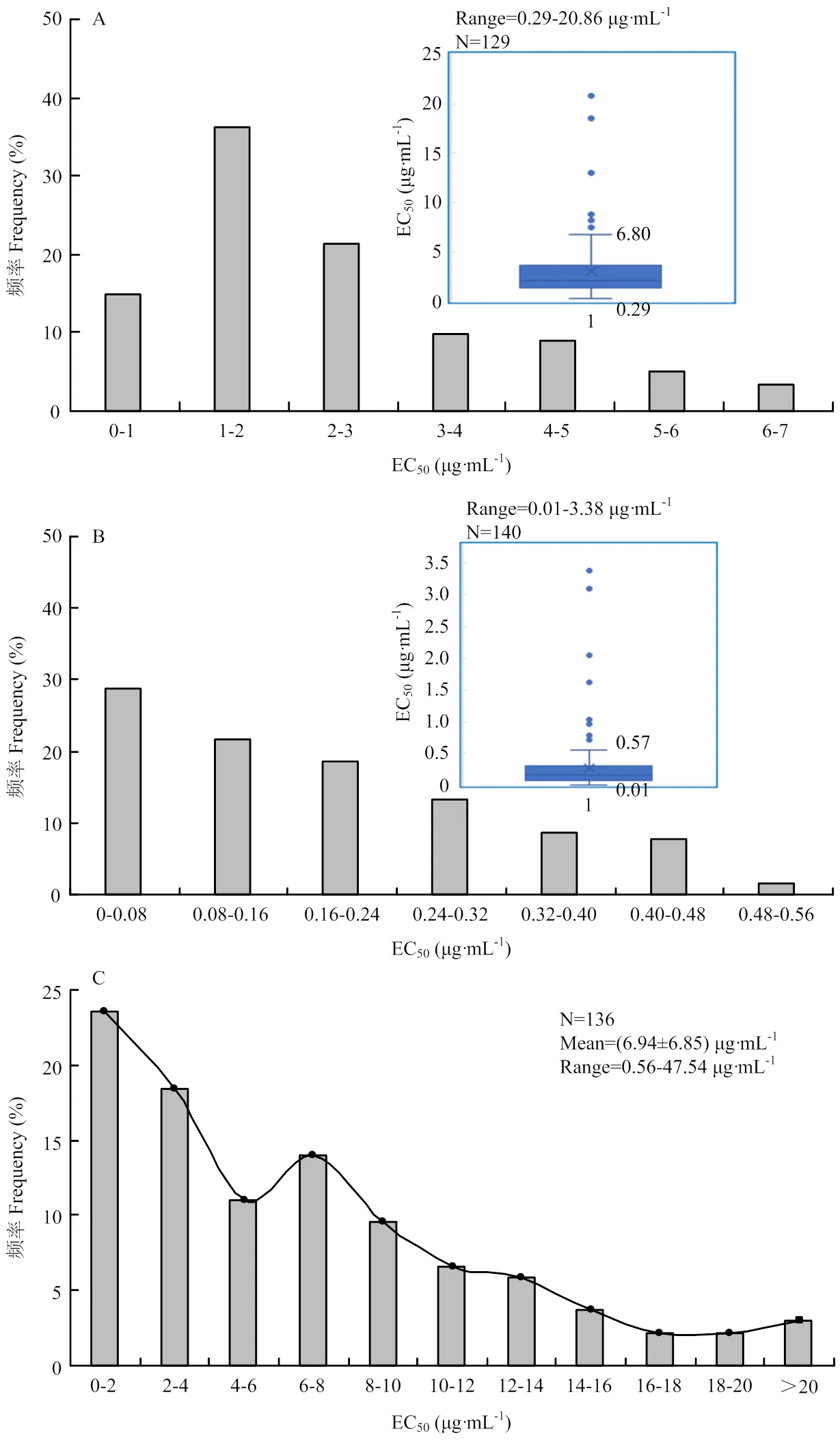
A:苯醚甲环唑difenoconazole;B:咪鲜胺prochloraz;C:氟吡菌酰胺fluopyram
不同地区菌株对咪鲜胺的敏感性无显著差异(图1-B),平均EC50均在0.50 μg·mL-1以下,其敏感范围为0.01—3.38 μg·mL-1(图2-B),经分析剔除异常值,选择的129株多主棒孢对咪鲜胺的敏感性平均EC50值为0.16 μg·mL-1,敏感频率分布呈单峰状态,且符合正态分布(>0.05),可以作为山东省多主棒孢对咪鲜胺的相对敏感基线,用于后期田间抗性监测。
不同地区菌株对氟吡菌酰胺的敏感性差异较大(图1-C、2-C),EC50范围为0.56—47.54 μg·mL-1,平均值为(6.94±6.82)μg·mL-1。其中聊城地区平均EC50为11.53 μg·mL-1,敏感性显著低于济南、德州、临沂和潍坊地区。聊城地区菌株最不敏感,其EC50高达47.54 μg·mL-1。多个地区的敏感频率分布呈多峰状态,且不符合正态分布(<0.05),表明存在明显的敏感性分化现象。
2.2 抗氟吡菌酰胺的靶基因氨基酸突变位点
对采自山东省的136株多主棒孢进行氟吡菌酰胺敏感性检测及序列比对,发现其中仅有42株菌株在SdhB、SdhC、SdhD上无任何突变位点,SdhC-S73P点突变的发生频率最高,为31.62%,其他位点突变(如SdhB-H278Y、SdhB-I280V、SdhC-N75S、SdhC- H134R和SdhDG135V)发生频率之和为37.50%(表2)。
2.3 分子对接验证
通过对底物-蛋白结合位点的结合模式进行分析(图3),氟吡菌酰胺与蛋白的结合区域主要在血红素附近。参与氟吡菌酰胺与Sdh结合的相互作用氨基酸残基如图3-C所示,二者相互作用的氨基酸中,形成较好的疏水口袋,使得药剂与蛋白稳定结合,其中包含大量的疏水氨基酸残基,表明疏水作用可能是受体-配体结合的重要驱动力,另外部分氨基酸与氟吡菌酰胺形成氢键加强了蛋白与药剂的结合。当受体蛋白S73P中丝氨酸突变为脯氨酸后,氨基酸的刚性增强,并且空间位阻变大,同时使氟吡菌酰胺与Ser73之间的氢键作用消失,亲和力由-28.33 kJ·mol-1降至-26.40 kJ·mol-1。

表2 山东省多主棒孢的Sdh亚基不同点突变发生频率
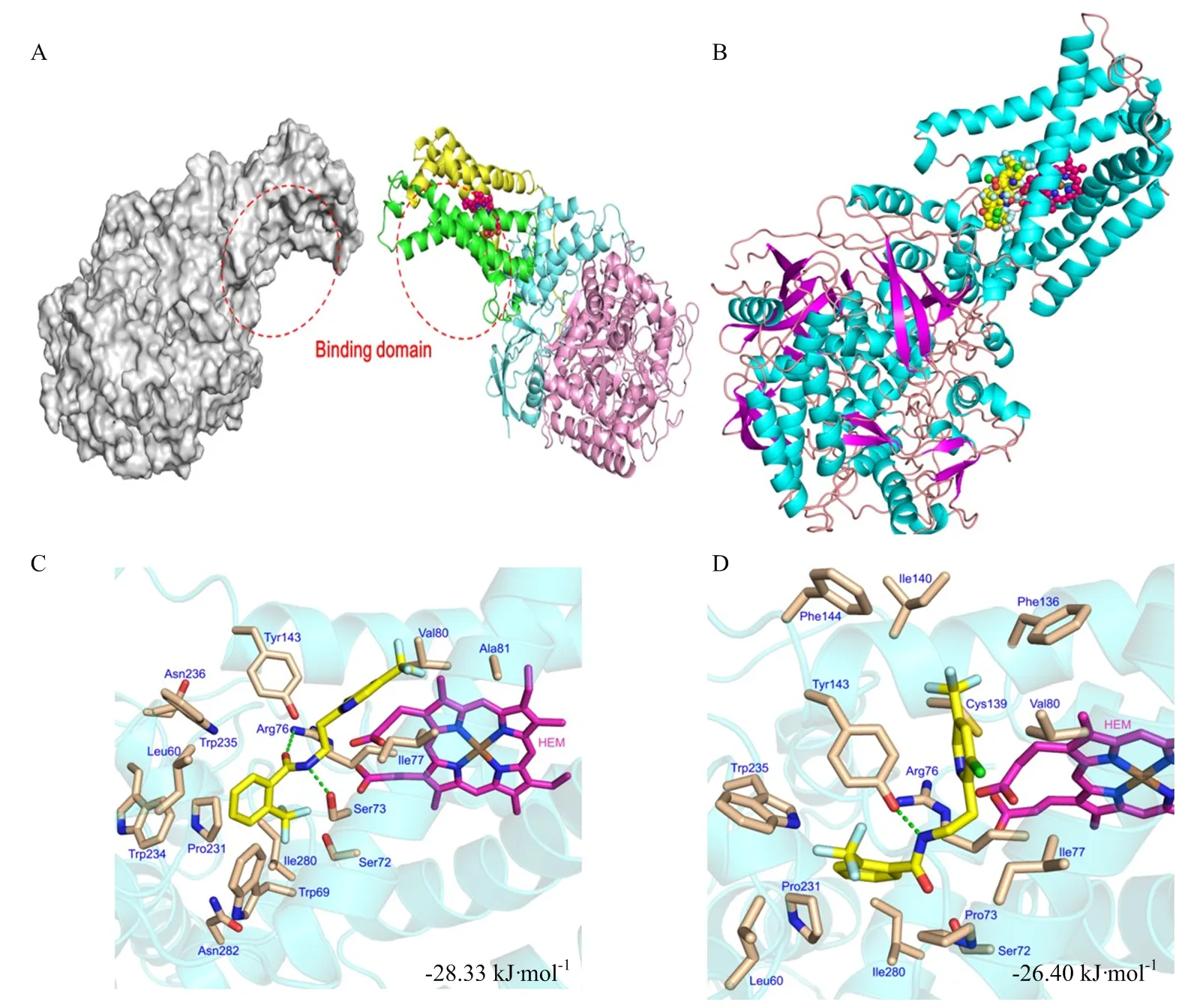
A:呼吸链复合物II结构中的配体结合区位置Binding domain in the respiratory chain complex II structure;B:氟吡菌酰胺与Sdh蛋白结合模式图The binding position of fluopyram and SDH protein;C:氟吡菌酰胺与亲本SdhC-S73氨基酸的相互作用Interaction of fluopyram with the parental SdhC-S73 amino acids;D:氟吡菌酰胺与突变体SdhC-P73氨基酸的相互作用,绿色虚线表示氢键作用Interaction of fluopyram with the mutant SdhC-P73 amino acids, the green dotted line represents hydrogen bond
综上所述,氟吡菌酰胺主要依靠氢键和疏水作用结合在SDH的配体活性区域,而突变位点导致配体与活性口袋中氨基酸的结合模式发生变化,影响了蛋白与氟吡菌酰胺之间的氢键和疏水作用,进而导致蛋白与氟吡菌酰胺的亲和力降低,使病原菌对氟吡菌酰胺表现出抗性。
2.4 交互抗性分析
分别测定氟吡菌酰胺的敏感菌株和抗性突变体对DMI类杀菌剂苯醚甲环唑和咪鲜胺的敏感性。通过秩相关方法进行交互抗性分析(图4),结果表明,氟吡菌酰胺与苯醚甲环唑及咪鲜胺均不存在交互抗性(>0.05),进一步说明这些药剂与氟吡菌酰胺的作用靶标位点不同,在田间可以用来与氟吡菌酰胺复配或轮换使用,以降低抗性风险。
2.5 氟吡菌酰胺与咪鲜胺混用的最佳配比筛选
从图5中可以看出,当氟吡菌酰胺与咪鲜胺的比例为7﹕3时对多主棒孢的EC50为0.28 μg·mL-1,增效系数SR为1.84,表现为明显的增效作用。在其他混用比例下均表现为相加作用,其中比例为1﹕1时EC50为0.25 μg·mL-1,SR为1.37。
2.6 氟吡菌酰胺与咪鲜胺混用对黄瓜靶斑病的防治效果
离体叶片试验结果表明(图6),氟吡菌酰胺与咪鲜胺以7﹕3混用,在200 μg·mL-1剂量下对黄瓜靶斑病的防治效果最高,为78.76%,显著高于两单剂和对照药剂代森锰锌的防治效果。在相同的150 μg·mL-1剂量下,混用的防治效果为73.93%,显著高于咪鲜胺的防治效果,略高于氟吡菌酰胺防治效果,但差异性并不显著。

图4 氟吡菌酰胺与苯醚甲环唑(A)和咪鲜胺(B)的交互抗性
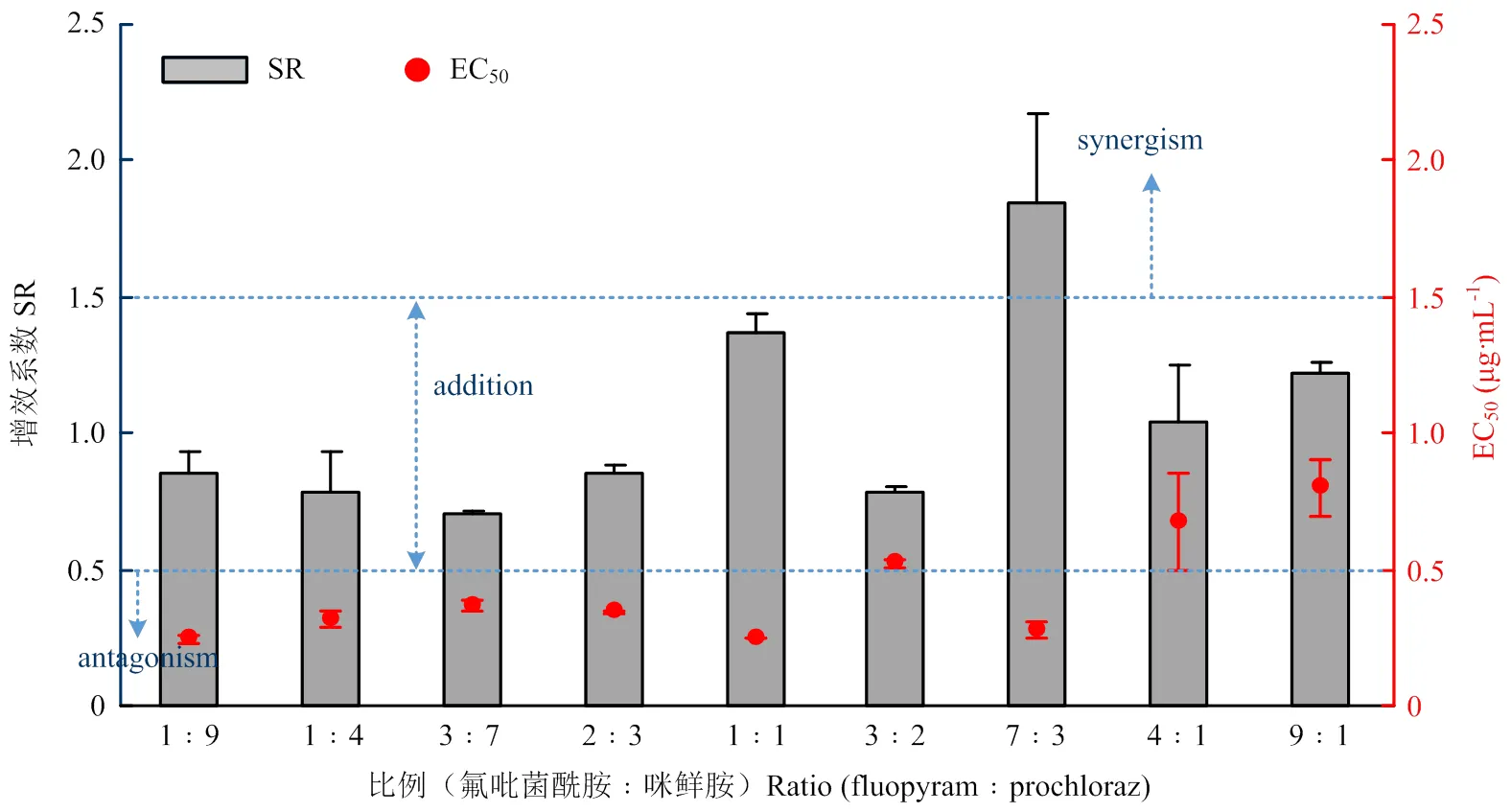
图5 氟吡菌酰胺和咪鲜胺最佳混合比例筛选
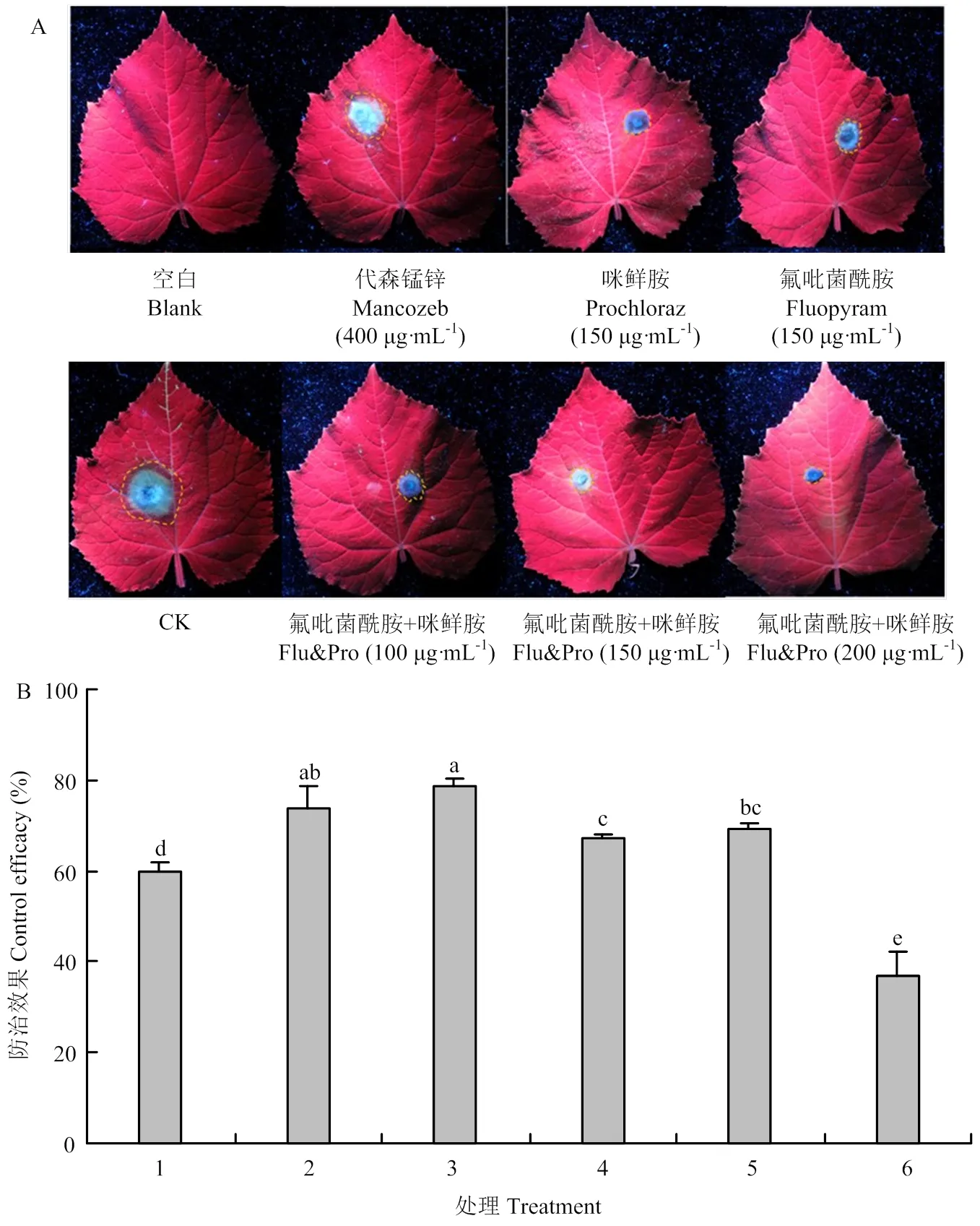
A:各处理叶片发病情况Disease status of leaves of different treatments。B:各处理防治效果,柱上标不同字母表示差异显著(P<0.05)Control efficacy of different treatments, different letters on the bars represent significant difference (P<0.05)。1:氟吡菌酰胺﹕咪鲜胺fluopyram﹕prochloraz (7﹕3) 100 μg·mL-1;2:氟吡菌酰胺﹕咪鲜胺fluopyram﹕prochloraz (7﹕3) 150 μg·mL-1;3:氟吡菌酰胺﹕咪鲜胺fluopyram﹕prochloraz (7﹕3) 200 μg·mL-1;4:咪鲜胺prochloraz 150 μg·mL-1;5:氟吡菌酰胺fluopyram 150 μg·mL-1;6:代森锰锌Mancozeb (400 μg·mL-1)
3 讨论
3.1 多主棒孢对3种杀菌剂敏感性监测
黄瓜靶斑病在我国北京、山东、甘肃、河北、广东和黑龙江等多个省(直辖市)以及在日本、韩国、美国等普遍发生,已经成为黄瓜生产上的一种重要病害[5,29]。而其病原菌多主棒孢极易变异,被FRAC列为高等抗性风险病原菌,因此及时准确进行药剂抗性水平的监测分析非常必要。病原菌的敏感性数值变化范围越宽,在药剂选择压存在情况下产生抗性的可能性越大,这些信息对于预测田间实际抗药性的发生和指导生产用药非常重要[28]。本研究分别测定了山东省多主棒孢对常用杀菌剂苯醚甲环唑、咪鲜胺和氟吡菌酰胺的敏感性,结果表明不同地区菌株对苯醚甲环唑的敏感性差异显著,EC50分布范围为0.29—20.86 μg·mL-1,表明群体中已出现对苯醚甲环唑敏感性降低的分化亚群体,因此经剔除异常值,选择了多主棒孢敏感频率分布呈单峰分布的121株菌的平均EC502.44 μg·mL-1为相对敏感基线。该数值低于张乃楼等[30]报道的辽宁省多主棒孢对苯醚甲环唑的敏感基线(7.12 μg·mL-1)。不同地区菌株对咪鲜胺的敏感性无显著差异,其EC50跨度为0.01—3.38 μg·mL-1,最大值为最小值的375倍,因此推测田间可能已存在抗性菌株,克隆并比较分析了不同敏感性多主棒孢中的,未发现与咪鲜胺抗性相关的点突变,剔除异常值,选择了对咪鲜胺敏感频率分布呈单峰状态的129株的平均EC500.16 μg·mL-1为相对敏感基线,该值与纪明山等[31]报道的辽宁省多主棒孢对咪鲜胺的敏感基线(0.16 μg·mL-1)相当,可用于后期的田间抗性监测。
3.2 多主棒孢对氟吡菌酰胺的抗性机制
山东省不同地区的多主棒孢对氟吡菌酰胺的敏感性差异较大,其敏感频率分布呈多峰状态,EC50范围为0.56—47.54 μg·mL-1,平均值为6.94 μg·mL-1,与Ishii等已报道日本菌株的敏感性和Shi等报道的野生型敏感性对比(<1 μg·mL-1)[13,15],敏感性明显降低,可以推断已存在大量抗性菌株。可能与多年来啶酰菌胺、氟吡菌酰胺等SDHI类杀菌剂的使用有关,是否也与地域性个体敏感性差异有关尚待明确。多主棒孢对SDHI类杀菌剂的主要抗性机制为在SdhB、SdhC或SdhD上发生点突变,其中已报道的突变位点有SdhB-H278R/Y、SdhB-I280V、SdhC-S73P、SdhC- N75S、SdhD-S89P、SdhD-D95E、SdhD-H105R和SdhD-G109V[11-12,20,32-33],除SdhC-S73P、SdhC-N75S和SdhD-S89P外,其余点突变已进行转化验证[14]。本研究采集的野生供试菌株中仅有30.88%为敏感菌株,其他均存在抗性点突变,其中SdhC-S73P突变频率近1/3。通过分子对接模拟氟吡菌酰胺与SDH蛋白结合,发现S73P突变后,周围与氟吡菌酰胺结合的氨基酸发生变化,氢键消失,蛋白的亲和力明显降低,从而表现为对氟吡菌酰胺的敏感性下降。
3.3 防治黄瓜靶斑病的复配杀菌剂配方筛选
在防治黄瓜靶斑病使用药剂时应注意合理用药,药剂混配使用是延缓抗性的产生和发展、延长药剂使用寿命的重要措施。目前在我国用于防治黄瓜靶斑病的杀菌剂均以复配的形式登记使用,如氟吡菌酰胺与肟菌酯混剂。目前QoI类杀菌剂的抗性问题日益严重[6],已不宜作为混剂品种使用。本研究选择了不存在交互抗性的氟吡菌酰胺和咪鲜胺进行复配,经室内毒力筛选确定两者在7﹕3混用时增效作用最大,离体叶片防治效果试验也证明该配比混剂在相同剂量下的防治效果高于两单剂,未来还需要进一步验证其田间防病效果。
4 结论
山东地区黄瓜靶斑病菌(多主棒孢)群体对DMI类杀菌剂的敏感性已有所下降,但抗性不显著;而对于氟吡菌酰胺等SDHI类药剂已产生不同程度的抗性,且已存在多种突变位点,其中SdhCS73P的突变发生频率较高,且该点突变导致病原菌琥珀酸脱氢酶与氟吡菌酰胺的结合能力下降。氟吡菌酰胺与咪鲜胺以7﹕3混配使用能够有效提高防治黄瓜靶斑病的效果,有待进一步田间验证。
[1] 李宝聚, 高苇, 石延霞, 谢学文. 多主棒孢和棒孢叶斑病的研究进展. 植物保护学报, 2012, 39(2): 171-176.
LI B J, GAO W, SHI Y X, XIE X W. Progress in researches on Corynespora leaf spot. Journal of Plant Protection, 2012, 39(2): 171-176. (in Chinese)
[2] 李长松, 张眉, 李林, 李凡, 齐军山, 徐作珽, 张博. 山东省黄瓜棒孢叶斑病(褐斑病)病原菌鉴定和防治. 中国蔬菜, 2009(18): 29-33.
LI C S, ZHANG M, LI L, LI F, QI J S, XU Z T, ZHANG B. Identification of cucumber target leaf spot (brown spot) pathogen and its control. China Vegetables, 2009(18): 29-33. (in Chinese)
[3] 邹庆道, 傅俊范, 朱勇, 房德纯. 黄瓜褐斑病病原菌鉴定及生物学特性研究. 沈阳农业大学学报, 2002, 33(4): 258-261.
ZOU Q D, FU J F, ZHU Y, FANG D C. Identification of pathogen from cucumber target leaf spot and research on biological characteristics. Journal of Shenyang Agricultural University, 2002, 33(4): 258-261. (in Chinese)
[4] 于淑晶, 王满意, 田芳, 赵卫光, 边强, 李宝聚. 黄瓜棒孢叶斑病的防治及抗药性研究进展. 农药, 2014, 53(1): 7-11.
YU S J, WANG M Y, TIAN F, ZHAO W G, BIAN Q, LI B J. Progress in research on control of cucumber Corynespora leaf spot and fungicide resistance. Agrochemicals, 2014, 53(1): 7-11. (in Chinese)
[5] 孙炳学, 石延霞, 朱发娣, 谢学文, 柴阿丽, 李宝聚. 多主棒孢SdhB-H278R突变位点AS-real-time PCR定量检测体系的建立. 中国农业科学, 2018, 51(24): 4647-4658.
SUN B X, SHI Y X, ZHU F D, XIE X W, CHAI A L, LI B J.Establishment of AS-real-time PCR for quantitatively detecting the H278R allele in theassociated within cucumber. Scientia Agricultura Sinica, 2018, 51(24): 4647-4658.(in Chinese)
[6] DUAN Y B, XIN W J, LU F, LI T, LI M X, WU J, WANG J X, ZHOU M G. Benzimidazole- and QoI-resistance inpopulations from greenhouse-cultivated cucumber: an emerging problem in China. Pesticide Biochemistry and Physiology, 2019, 153: 95-105.
[7] HASAMA W, SATO M. Occurrence and distribution of fungicide- resistant field isolates of, causal fungus of target leaf spot of cucumber, in Kyushu and Okinawa districts. Kyushu Plant Protection Research, 1996, 42: 26-30.
[8] DATE H, KATAOKA E, TANINA K, SASAKI S, INOUE K, NASU H, KASUYAMA S. Sensitivity of, causal agent of Corynespora leaf spot of cucumber, to thiophanate-methyl, diethofencarb and azoxystrobin. Japanese Journal of Phytopathology, 2004, 70(1): 10-13.
[9] AVOZANI A, REIS E M, TONIN R B. Sensitivity loss by, isolated from soybean, to the fungicide carbendazim. Summa Phytopathologica, 2014, 40(3): 273-276.
[10] 黄大野. 基于微管蛋白靶标的几种蔬菜主要病原真菌耐药性与抗药性机理的研究[D]. 沈阳: 沈阳农业大学, 2012.
HUANG D Y. Tolerance and resistance mechanism of several main pathogenic fungi of vegetable base on tubulin[D]. Shenyang: Shenyang Agricultural University, 2012. (in Chinese)
[11] ZHU F D, SHI Y X, XIE X W, CHAI A L, LI B J. Occurrence, distribution and characteristics of boscalid-resistantin China. Plant Disease, 2019, 103(1): 69-76.
[12] MIYAMOTO T, ISHII H, SEKO T, KOBORI S, TOMITA Y. Occurrence ofisolates resistant to boscalid on cucumber in Ibaraki Prefecture, Japan. Plant Pathology, 2009, 58(6): 1144-1151.
[13] ISHII H, MIYAMOTO T, USHIO S, KAKISHIMA M. Lack of cross-resistance to a novel succinate dehydrogenase inhibitor, fluopyram, in highly boscalid-resistant isolates ofand. Pest Management Science, 2011, 67(4): 474-482.
[14] SHI Y X, SUN B X, XIE X W, CHAI A L, LI L, LI B J. Site-directed mutagenesis of the succinate dehydrogenase subunits B and D fromreveals different fitness costs and sensitivities to succinate dehydrogenase inhibitors. Environmental Microbiology, 2021, 23(10): 5769-5783.
[15] SHI Y X, ZHU F D, SUN B X, XIE X W, CHAI A L, LI B J. Two adjacent mutations in the conserved domain of SdhB confer various resistance phenotypes to fluopyram in. Pest Management Science, 2021,77(9): 3980-3989.
[16] ISHII H, YANO K, DATE H, FURUTA A, SAGEHASHI Y, YAMAGUCHI T, SUGIYAMA T, NISHIMURA K, HASAMA W. Molecular characterization and diagnosis of QoI resistance in cucumber and eggplant fungal pathogens. Phytopathology, 2007, 97(11): 1458-1466.
[17] MACKENZIE K J, XAVIER K V, WEN A, TIMILSINA S, ADKISON H M, DUFAULT N S, VALLAD G E. Widespread QoI fungicide resistance revealed amongtomato isolates in Florida. Plant Disease, 2020, 104(3): 893-903.
[18] RONDON M N, LAWRENCE K S.isolates from soybean in Alabama detected with G143A mutation in the cytochrome b gene. Plant Health Progress, 2019, 20(4): 247-249.
[19] LI X H, LI C C, LI G X, ZHU J M, LIU F, JIANG L, MU W, LIU X L. Detection of a point mutation (G143A) inofthat confers pyraclostrobin resistance. Horticulturae, 2021, 7(6): 155.
[20] TERAMOTO A, MEYER M C, SUASSUNA N D, CUNHA M G D.sensitivity ofisolated from soybean to fungicides and field chemical control of target spot. Summa Phytopathologica, 2017, 43(4): 281-289.
[21] SHIMIZU H,Osanai A, Sakamoto K, Inaoka D K, Shiba T, Harada S, Kita K. Crystal structure of mitochondrial quinol-fumarate reductase from the parasitic nematode. Journal of Biochemistry, 2012, 151(6): 589-592.
[22] SALI A, BLUNDELL T L. Comparative protein modelling by satisfaction of spatial restraints. Journal of Molecular Biology, 1993, 234(3): 779-815.
[23] MAIER J, MARTINEZ C, KASAVAJHALA K, Wickstrom L, Hauser K, Simmerling C. ff14SB: Improving the accuracy of protein side chain and backbone parameters from ff99SB. Journal of Chemical Theory and Computation, 2015, 11(8): 3696-3713.
[24] MORRIS G M, HUEY R, LINDSTROM W, SANNER M F, BELEW R K, GOODSELL D S, OLSON A J. AutoDock4 and AutoDockTools4: Automated docking with selective receptor flexibility. Journal of ComputationalChemistry, 2009, 30(16): 2785-2791.
[25] STEWART J J. MOPAC: a semiempirical molecular orbital program. Journal of Computer-Aided Molecular Design, 1990, 4(1): 1-103.
[26] STEWART J J. Optimization of parameters for semiempirical methods. III. Extension of PM3 to Be, Mg, Zn, Ga, Ge, As, Se, Cd, In, Sn, Sb, Te, Hg, Tl, Pb, and Bi. Journal of Computational Chemistry, 1991, 12(3): 320-341.
[27] SANNER M F. Python: a programming language for software integration and development. Journal of Molecular Graphics and Modelling, 1999, 17(1): 57-61.
[28] 毕秋艳, 赵建江, 张诗琪, 韩秀英, 吴杰, 路粉, 王文桥. 河北省梨树褐斑病菌对不同机制杀菌剂的敏感性及其与戊唑醇敏感性的关系. 植物病理学报, 2021, 51(2): 248-257.
BI Q Y, ZHAO J J, ZHANG S Q, HAN X Y, WU J, LU F, WANG W Q. Sensitivity offrom pear in Hebei Province to different classes of fungicides and correlation coefficient with tebuconazole. Acta Phytopathologica Sinica, 2021, 51(2): 248-257. (in Chinese)
[29] 禾丽菲, 李晓旭, 朱佳美, 慕卫, 刘峰. 不同杀菌剂对黄瓜靶斑病菌的毒力作用特性比较. 农药学学报, 2018, 20(1): 25-32.
HE L F, LI X X, ZHU J M, MU W, LIU FComparison of toxicity properties of different types of fungicides againston cucumber. Chinese Journal of Pesticide Science, 2018, 20(1): 25-32. (in Chinese)
[30] 张乃楼, 李亚美, 康文强, 孙青彬, 祁之秋. 辽宁省黄瓜靶斑病菌对苯醚甲环唑和戊唑醇的敏感性. 农药学学报, 2014, 16(4): 452-456.
ZHANG N L, LI Y M, KANG W Q, SUN Q B, QI Z QSensitivity ofto difenoconazole and tebuconazole in Liaoning Province. Chinese Journal of Pesticide Science, 2014, 16(4): 452-456. (in Chinese)
[31] 纪明山, 龙怡云, 祁之秋. 辽宁省黄瓜褐斑病菌对咪鲜胺的敏感性检测. 江苏农业科学, 2010(2): 127-128.
JI M S, LONG Y Y, QI Z Q. Sensitivity ofto prochloraz in Liaoning Province. Jiangsu Agricultural Sciences, 2010(2): 127-128. (in Chinese)
[32] MIYAMOTO T, ISHII H, STAMMLER G, KOCH A, OGAWARA T, TOMITA Y, FOUNTAINE J M, USHIO S, SEKO T, KOBORI S.Distribution and molecular characterization ofisolates resistant to boscalid. Plant Pathology, 2010, 59(5): 873-881.
[33] ZHU J M, ZHANG L Y, LI H, GAO Y Y, MU W, LIU F.Development of a LAMP method for detecting the N75S mutant in SDHI-resistant. Analytical Biochemistry, 2020, 597: 113687.
Sensitivity ofto Three Common Fungicides and Its Resistance to Fluopyram from Shandong province
LI GuiXiang1, LI XiuHuan1,2, HAO XinChang1, LI ZhiWen3, LIU Feng2,LIU XiLi1
1State Key Laboratory of Crop Stress Biology for Arid Areas, Northwest A&F University, Yangling 712100, Shaanxi;2College of Plant Protection, Shandong Agricultural University, Taian 271018, Shandong;3Institute for the Control of Agrochemicals of Shaanxi Province, Xi’an 710003
【】Corynespora target spot caused byis recognized as one of the three most serious worldwide diseases of cucumber, which seriously affects the yield and quality of cucumber. With the continuous use of commercial fungicides, resistance problem ofincreased seriously. The objective of this study is to (i) clarify the resistance profile ofin cucumber from Shandong province to three common fungicides; (ii) provide a theoretical basis for the fungicide control of Corynespora target spot of cucumber; (iii) provide data support for the screening of highly efficient mixed fungicides for the resistance management of.【】A total of 140isolates were isolated from Shandong province. The sensitivity ofto difenoconazole, prochloraz and fluopyram was investigated using mycelium growth rate method. The relationship of SdhC-S73P and fluopyram-resistance was analyzed using Modeller v9.19 and AutoDock4.2.6 software. The optimal ratio of fluopyram and prochloraz was also screened usingmycelial growth method and detached leaf assay. 【】After data outlier analysis and elimination, the EC50values of the 121isolates to difenoconazole ranged from 0.29 to 6.80 μg·mL-1, and produced an unimodal distribution with a mean of 2.44 μg·mL-1. The EC50values of the 129isolates to prochloraz ranged from 0.01 to 0.57 μg·mL-1with a mean of 0.16 μg·mL-1, and also produced an unimodal distribution. The EC50values of the 136isolates to fluopyram ranged from 0.56 to 47.54 μg·mL-1, with a mean of 6.94 μg·mL-1. Many fluopyram-resistant isolates with different resistant factors were detected, andthe mutation frequency of fluopyram-resistant isolates containing S73P in SdhC was 31.62%. Molecular docking results showed that after the S73P mutation occurred on the SdhC subunit, the rigidity of the amino acid increased, and the steric hindrance became larger, so that the hydrogen bond between fluopyram and Ser73 disappeared, so the affinity was reduced, leading to the occurrence of fluopyram resistance. No cross-resistance was detected between fluopyram and prochloraz. The highest synergistic effect of fluopyram and prochloraz was 1.84 at a ratio of 7﹕3. The control efficacy of the mixture (fluopyram﹕prochloraz=7﹕3) against Corynespora target spot was higher than that of single fungicide (fluopyram or prochloraz) at the same dose.【】The sensitivity offrom different regions to fungicide is different in Shandong province. Most ofisolates showed fluopyram resistance and many point mutations in SdhB, SdhC and SdhD were detected. Among them, the frequency of S73P mutation in SdhC was the highest. The control efficacy of the mixture of fluopyram and prochloraz in 7﹕3 against Corynespora target spot in cucumber was more excellent compared with that of single fungicide. It is suggested that the fluopyram can be used alternately or in mixture with prochloraz to control the resistance ofto SDHI fungicides such as fluopyram.
; Corynespora target spot; fungicide sensitivity; S73P mutation; molecular docking; synergistic effect

10.3864/j.issn.0578-1752.2022.07.008
2021-10-19;
2021-12-06
国家重点研发计划(2016YFD0201305)、陕西省创新能力支撑计划(2020TD-035)
李桂香,E-mail:lgx2018@nwafu.edu.cn。李秀环,E-mail:lixiuhuan2021@nwafu.edu.cn。李桂香和李秀环为同等贡献作者。通信作者刘西莉,Email:seedling@nwafu.edu.cn
(责任编辑 岳梅)
