局部栓塞联合靶向免疫综合治疗肝肉瘤样癌1例报告
2022-04-14张林枝陆荫英陈博文
雷 进, 张林枝, 陆荫英,,, 陈博文, 左 石,4
1 贵州医科大学 临床医学院, 贵阳 550004; 2 解放军总医院第五医学中心 肝病医学部, 北京 100039;3 北京大学三〇二临床医学院, 北京 100039; 4 贵州医科大学附属医院 肝胆外科, 贵阳 550004
肝肉瘤样癌(hepatic sarcomatous carcinoma, HSC) 是肝脏的一种罕见恶性肿瘤,该病极为罕见,并有肉瘤和癌的双重成分,对其认识不足导致诊断与治疗上极为困难。
1 病例资料
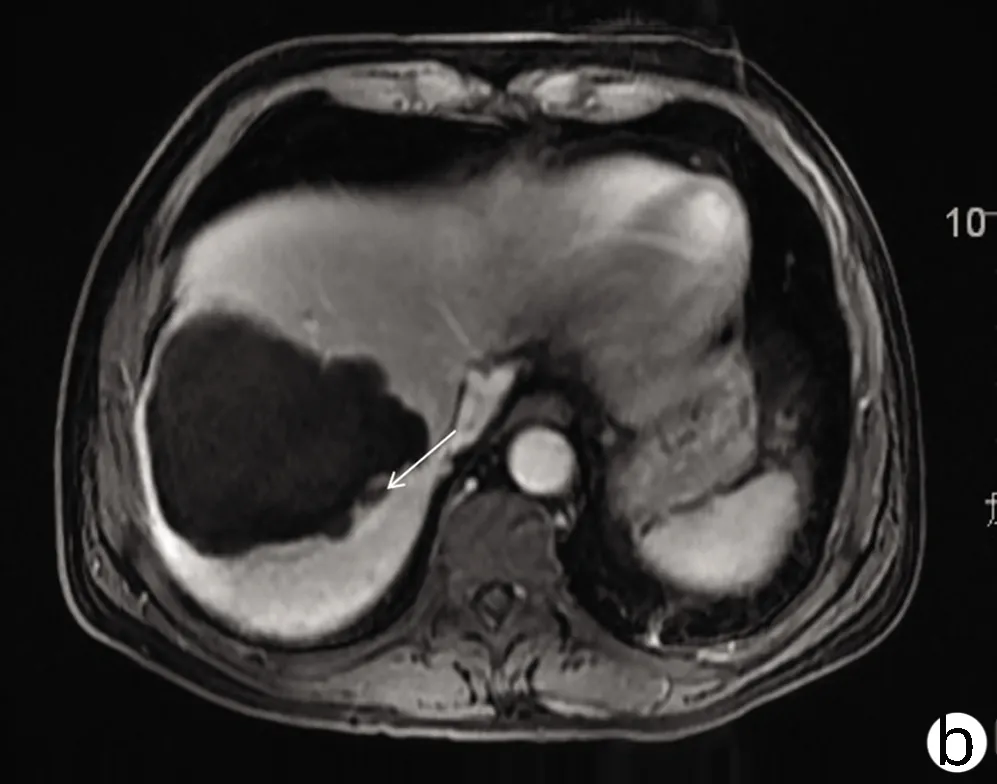
患者男性,61岁,因“右下腹不适1个月”于2021年1月4日就诊于解放军总医院第五医学中心,查肿瘤标志物AFP、糖类抗原19-9(CA19-9)、癌胚抗原(CEA)均正常,白蛋白27 g/L、直接胆红素7.2 μmol/L、总胆红素14.1 μmol/L、丙氨酸氨基转移酶与天冬氨酸氨基转移酶分别为22 U/L、37 U/L,乙型肝炎表面抗原阴性。既往高血压病史35年、糖尿病史23年规律治疗至今,病情控制较好。于2021年1月15日行肝内病灶穿刺,免疫组化结果示(图1):Vimentin(+),CK(+),Hepa(-),CK19(散+),CD34(+),Ki67(50%~75%),EMA(+),CEA(-),AFP(-),P53(25%~50%),CK7(-),CK20(-),CD68(灶状+),S-100(灶状+)。病理结合免疫组化结果考虑HSC。肝脏增强MRI示(图2):肝右上叶及肝左右叶交界区不均匀稍长T1、T2信号影,最大截面积约有8.6 cm×10.8 cm,增强扫描动脉期呈不均匀强化,门静脉期及延迟期呈不均匀稍低信号影,门静脉右支及肝中静脉局部受累,左侧肾上腺多发结节考虑转移,肝门及腹膜后多发淋巴结肿大,较大者约1.4 cm×2.7 cm,考虑淋巴结转移。该患者因CNLC肿瘤分期较晚(Ⅲb期),无外科手术适应证,故于2021年1月20日行肝动脉吉西他滨载药微球栓塞术,术后联合安罗替尼+程序性细胞死亡受体1(programmed cell death 1, PD-1)单抗(信迪利单抗注射液)辅助治疗。此后,患者于2021年2月底再次入院,影像学提示残留部分活性可能,予介入治疗术后继续靶向联合免疫治疗。2021年4月15日入院后再次介入治疗,术后因胸部CT提示肺内结节,且此次化验结果中肿瘤标志物CA19-9(74.67 U/mL)较前升高,更换治疗策略为瑞戈非尼联合PD-1单抗治疗。患者于2021年5月27日再次入院行磁共振检查,提示原病灶边缘残留活性可能(图3),部分肿大淋巴结较前缩小。该患者从入院经过3次介入治疗(图4)并联合靶向+PD-1单抗治疗,随访5个月患者一直保持部分缓解状态。
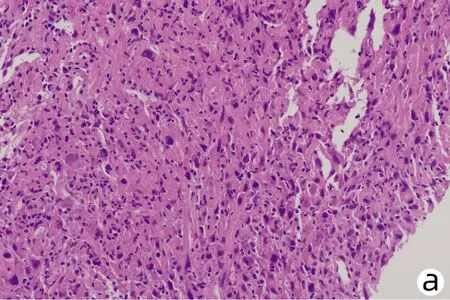
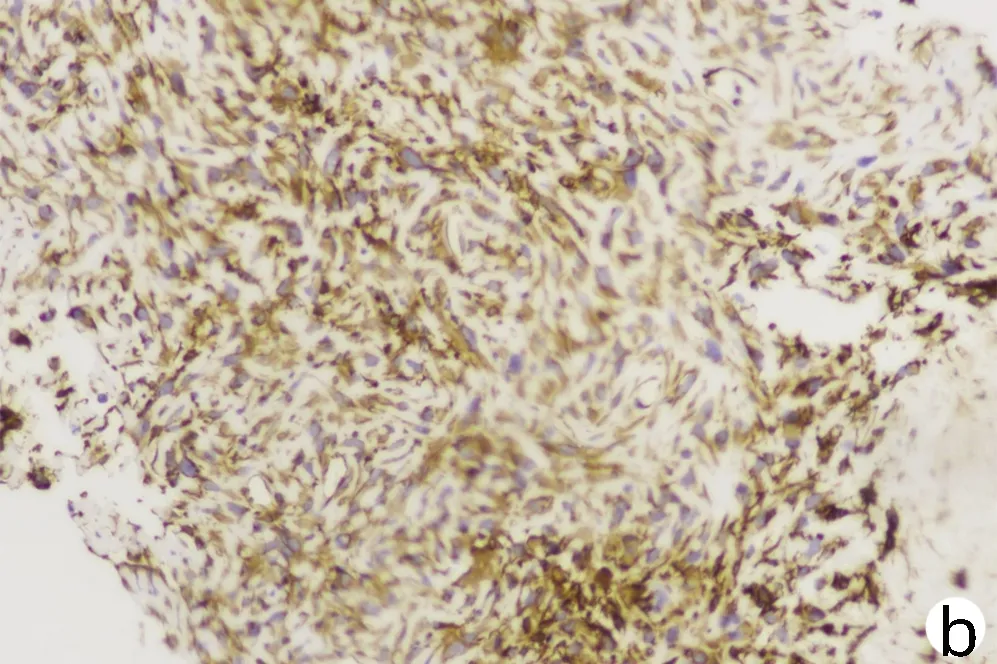
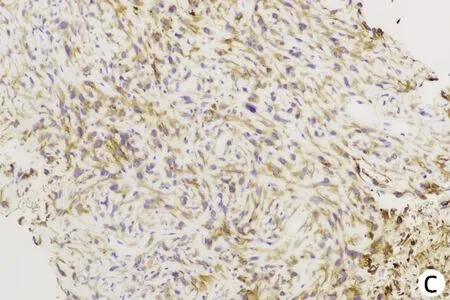
注:a,见多个核大深染肿瘤细胞,部分成梭形(HE染色,×100);b,Vimentin弥漫强阳性(免疫组化,×200);c,CK 弥漫强阳性(免疫组化,×200)。
2 讨论
HSC也称为梭形细胞癌,是一种罕见的肝癌类型,由上皮和间质梭形细胞组成,占原发性肝癌的1.8%~3.9%[1],该病常见于50~70岁的男性患者[2],但已有研究报道中最小年龄仅有2岁[3]。由于该病极其少见,发病机制尚待明确,目前普遍认为HBV感染与其相关,甚至有报道称其HBV感染率比肝细胞癌(HCC)患者更高[4]。经导管动脉化疗栓塞、新型抗血管生成药物(舒尼替尼)、射频消融或经皮乙醇注射治疗肉瘤样改变的HCC病例可能加快HSC的发展或加速肉瘤样增生[5]。同时,已有报道中还提示HSC的发生可能与TP53等基因的突变有关[6]。
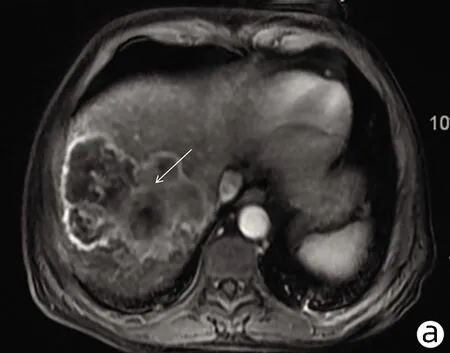
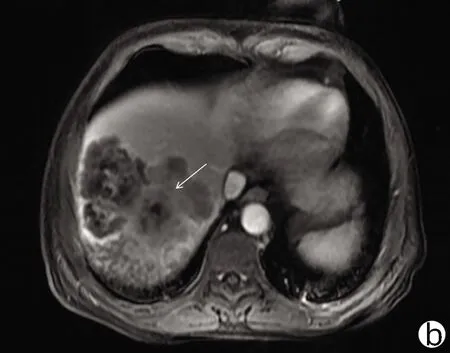
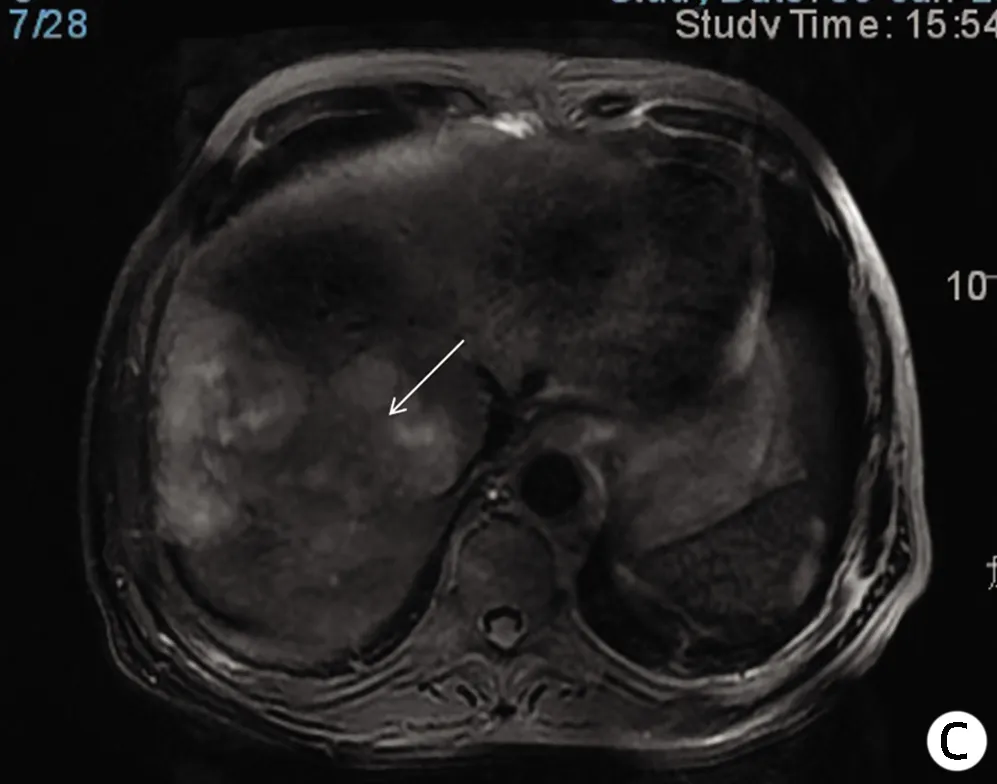
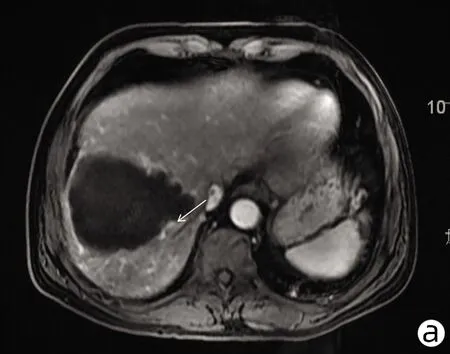
注:a,动脉期呈不均匀轻中度强化;b,门静脉期呈不均匀稍低信号;c,稍 长T2信号病变;d,DWI轻度高信号。箭头指向均表示HSC病灶。
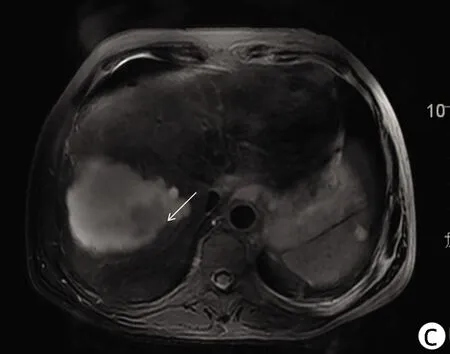
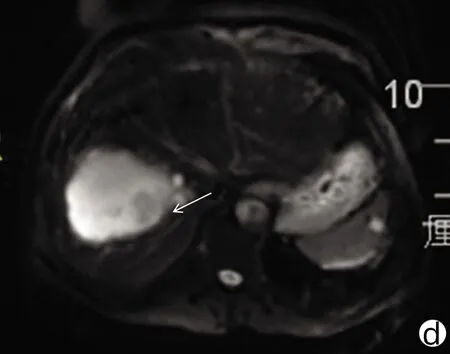
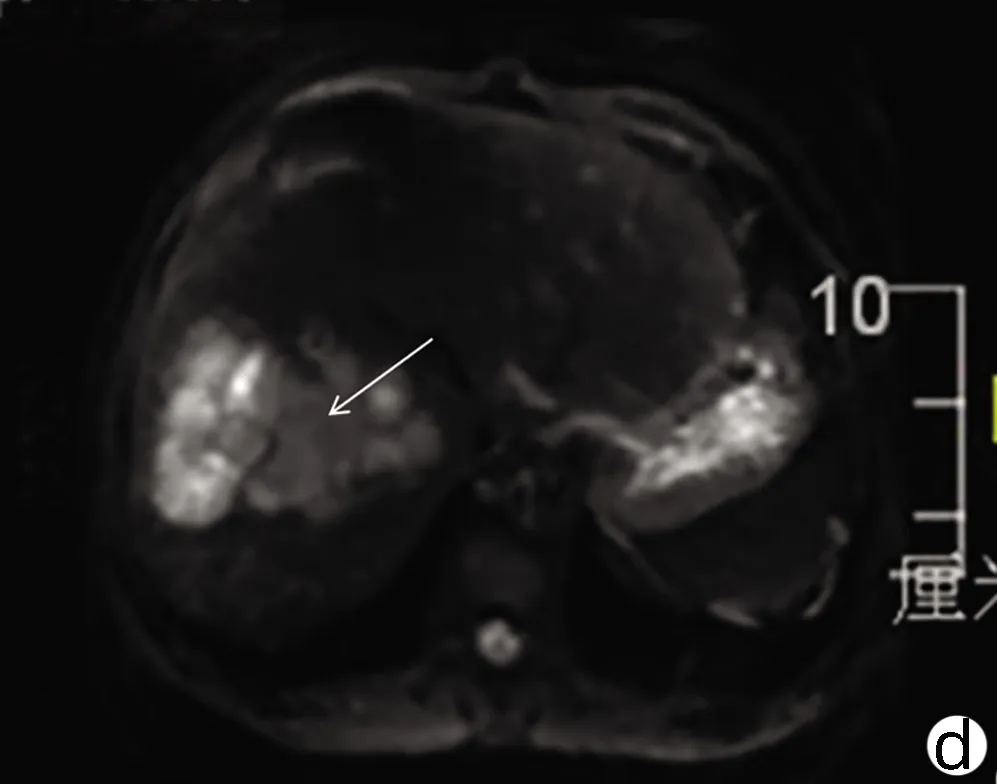
注:a,动脉期边缘少许强化,大部未见强化;b,门静脉期病灶边缘呈稍低信号;c,病灶边缘稍长T2信号病变;d,病灶边缘DWI轻度高信号。 箭头表示原病灶边缘异常情况。
HSC病理类型多样,包括血管肉瘤、未分化(胚胎)肉瘤、平滑肌肉瘤和上皮样血管内皮瘤[7]等。因此,该病通常没有特定的症状与体征,临床表现以腹痛为主,其次为乏力、发热和黄疸,也可表现为不明原因的纳差、体质量减轻等症状[8]。HSC患者实验室检查只有约10%的患者出现AFP升高,而CA19-9和CEA升高率(29.4%,17.6%)显著高于AFP[4]。部分患者出现血清白蛋白水平降低,血清C反应蛋白水平、中性粒细胞计数升高,这可能与HSC生长过快,肿瘤中央大量坏死诱发炎症有关[9]。
影像学检查呈现肉瘤和癌的双重影像特征,病灶多位于肝右叶、单发,最大直径平均6~8.5 cm[1,4]。B超检查见低回声灶,其内部为不均匀回声改变,伴或不伴有完整的包膜[10]。CT平扫主要表现为密度不均、形状不一、病灶边缘清楚的低密度灶。增强CT以动脉期肿瘤边缘强化,门静脉期及延迟期持续强化为主要表现。通常在MRI扫描T1WI序列上呈低信号,T2WI、DWI序列上呈轻度高信号[4]。然而,HSC患者影像学并无特异性。最终诊断以病理检查示CK阳性、Vimentin阳性、Ki-67指数增高为主要依据[11],免疫组化示:HSC的肉瘤成分(100%)、部分肝癌细胞成分(40.0%)中显示程序性细胞死亡蛋白配体1(PD-L1)高表达,部分患者(26.7%)p53高表达;此外,β-连环蛋白核、上皮肿瘤标志物细胞角蛋白、上皮细胞膜蛋白也可见表达。转录组分析不仅显示调节上皮-间充质转化的基因上调,涉及炎症反应和细胞信号通路的因子如肿瘤坏死因子也显著上调,同时还发现胆汁酸、脂肪酸相关基因下调[9,12]。
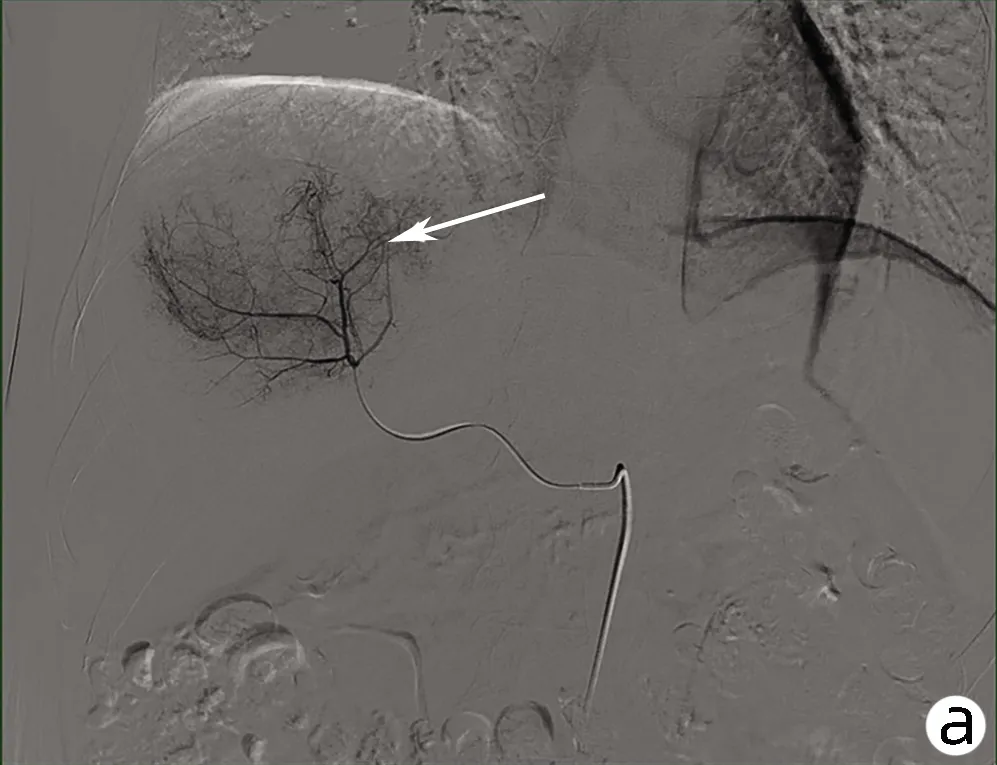

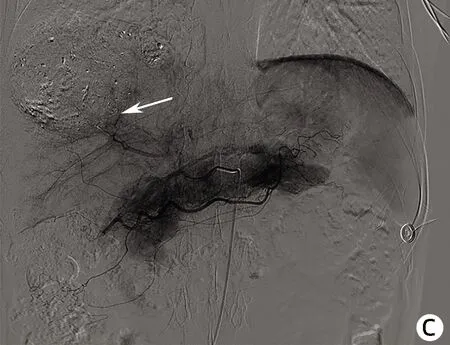
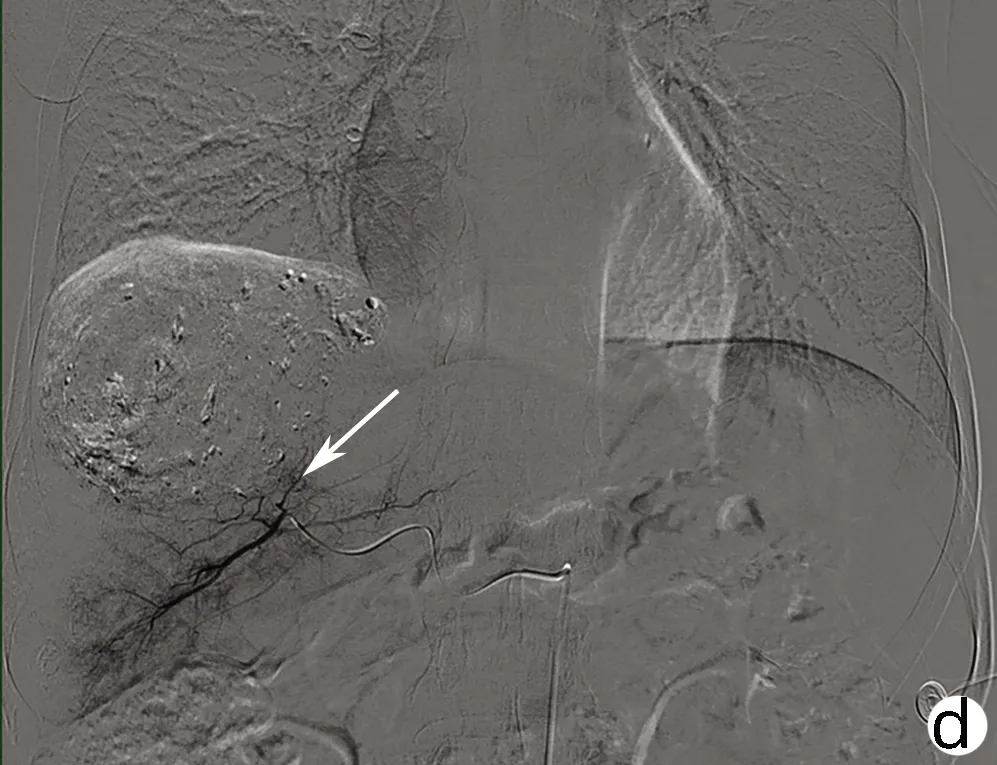
注:a,2021年1月20日第1次肝动脉造影,动脉期肝右动脉远端分支增粗,可见肿瘤血管。b,2021年3月1日第2次肝动脉造影,动脉期肝右动脉远端分支增粗,可见肿瘤血管,但较第1次造影明显减少。c,2021年4月23日第3次肝动脉造影,动脉期肝右动脉肿瘤血管减少。d,2021年4月23日第3次介入术后,未见明显肿瘤血管。 箭头均指示肝 脏肿瘤血管造影情况。
本就少见的HSC加上其多样性,临床上容易误诊为肝脓肿、肝内胆管癌(intrahepatic cholangiocarcinoma, ICC)以及HCC。以下两点有助于HSC与HCC鉴别:(1)HSC病例CA19-9和CEA升高率显著高于HCC,而AFP升高率明显低于HCC;(2)HSC患者的肿瘤直径更大、分期更晚,邻近胆管扩张、肝内转移和淋巴结肿大、肿瘤内坏死和假性包膜的发生率更高[4]。与HCC相比,HSC更容易误诊为ICC和肝脓肿,延误最佳治疗时间。虽然目前HSC的病例报告较少,但已有多篇HSC误诊为肝脓肿的个案报道[13-14]。临床上,共有的临床表现包括右上腹疼痛、持续发热伴或不伴寒战、恶心、呕吐、腹泻和体质量减轻[5]。实验室检查两者均可见白细胞计数、红细胞沉降率和C反应蛋白升高。病灶周围增强和中心坏死不仅是肝脓肿最典型的影像学特征,同样是HSC影像学最多见的表现[4]。由于HSC侵袭性很强、生长过快导致肿瘤中央大量坏死的缘故还可出现HSC继发肝脓肿的可能,对于两者的鉴别无疑更难[15]。这些提示HSC有化脓性肝脓肿的非特异性表现,可能延误恶性肿瘤的诊断,因此,当老年患者出现肝脓肿症状与体征,经过标准的肝脓肿治疗后病情未得到缓解,此时应考虑HSC的可能。目前已有研究显示HSC与ICC的鉴别可在临床症状、肿瘤标志物CA19-9、肝硬化、胆石症、瘤内出血、假性包膜方面存在显著差异性[4]。ICC在影像学表现为包膜回缩、病变远端胆管扩张和血管包裹较HSC常见,而肝内和肝外转移在HSC更为常见。此外,实验室检查CA19-9升高并伴有碱性磷酸酶升高在ICC中更为常见[16]。虽然这些特征有助于两者的鉴别,但两种疾病常有重叠表现,所以鉴别HSC与ICC时应综合考虑临床、实验室指标以及影像学表现,必要时行病理检查确诊。
与其他实体瘤一样,尽管HSC的肿瘤特性使手术切除HSC的预后并不理想,但早期HSC患者手术治疗是目前最佳的治疗方式。在一项30例原发性肝肉瘤患者的研究[17]中指出,接受R0手术切除的患者比未接受R0手术切除的患者有更好的预后。曾有经手术完全切除后11年仍存活的报道[3];一篇针对308例HSC患者的报道显示[18],271例患者接受部分肝切除术后5年生存率高达70%。然而,相比于HCC患者,更多的患者在发现HSC时就已经发展为中晚期,面临初诊即错失手术良机的患者,使用什么治疗方式始终没有明确。既往曾有使用介入、消融、靶向药物等治疗方式的报道,但由于样本量极少,并没有充分的证据能对其治疗效果作出评价。近年来,免疫检查点抑制剂已被批准用于治疗10多种癌症,客观缓解率为15%~20%,且安全性良好[19]。同时,已有研究[13]证实HSC与HCC患者相比,HSC肉瘤组织中PD-L1、B7-H3成分更高,这意味着,HSC患者使用免疫检查点抑制剂可能会比HCC患者有更好的预后。但目前HSC使用免疫治疗的数据缺乏,Zhu等[20]报道了1例54岁HSC男性患者,接受根治性肝部分切除术后复发,经索拉非尼、仑伐替尼靶向药物治疗后效果不佳,最后采用纳武利尤单抗(PD-1单抗)治疗,患者达到持续8个月的完全缓解期。然而,也有HSC患者使用特瑞普利单抗(PD-1单抗)联合安罗替尼治疗2周后死亡的报道[14]。而此病例采用介入后靶向联合PD-1单抗的治疗策略使患者获得5个月甚至更长的部分缓解期。但这些均为个案报道,联合免疫药物的治疗效果还需后期不断探索。
综上所述,对于同时具有罕见性、组织多样性、高侵袭性、鉴别困难几大特性的HSC患者,在诊断、鉴别和治疗等方面都是棘手的问题,综合分析患者各种特性有助于其诊断。目前晚期HSC患者治疗方式还在探索阶段,但局部治疗联合靶向+免疫的治疗策略可能成为治疗晚期HSC的风向标。
伦理学声明:本例报告已获得患者知情同意。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:雷进负责资料分析,撰写论文;张林枝、陈博文负责提出具体修改意见并进行修改;左石、陆荫英负责拟定撰写思路,指导文章写作并最终定稿。
