肉苁蓉防治宫腔粘连的作用机制研究*
2022-04-14李敏艳刘文娥安建平杨琴
李敏艳,刘文娥,安建平,杨琴
1 湖南中医药大学研究生院 湖南长沙 410007
2 湖南中医药大学第一附属医院 湖南长沙 410007
宫腔粘连(intrauterine adhesion,IUA)是妇科常见疾病,由宫腔机械操作、炎性反应等多种原因引起子宫内膜基底层损伤,使子宫内膜发生粘连或纤维化,导致宫腔部分或完全封闭的病理症状。临床常表现为月经量减少、闭经、盆腔疼痛及不孕等症状,严重影响育龄期女性生殖及身心健康。
肉苁蓉其性味甘、咸,温;归肾、大肠经,具有补肾阳、益精血、润肠通便的功效[1-2]。有研究表明[3]肉苁蓉具有类性激素样的效应,能调整肾-天癸-冲任-胞宫轴,改善机体盆腔内环境,促进子宫内膜间质和腺体的修复和增殖。因此,本论文应用网络药理学研究方法探索“补肾”类中药肉苁蓉对IUA的作用机制,为临床上IUA药物的使用及早期干预提供理论依据,在临床上具有重要的意义。
资料与方法
1 肉苁蓉活性成分与基因靶点的获取
在TCMSP数据库中,将药物筛选阈值设定为口服生物利用度(OB)≥30%,类药性(DL)≥0.18,检索肉苁蓉的活性成分及对应的靶蛋白。利用Uniprot数据库和Perl语言,将靶蛋白转化为对应基因名。
2 IUA靶点基因收集
在GeneCards、OMIM、PharmGkb这三个数据库中,以“intrauterine adhesion”为检索词,分别检索出IUA疾病靶基因,取并集获得IUA的疾病靶基因集。
3 肉苁蓉防治IUA潜在靶点的获取
利用R语言软件将肉苁蓉药物靶基因与IUA疾病靶基因取交集,获得肉苁蓉防治IUA的潜在靶点,并构建Venn图。
4 肉苁蓉防治IUA的“药物-活性成分-潜在靶点”网络构建
将肉苁蓉活性成分与潜在靶点相匹配,采用Cytoscape3.8.0软件构建“药物-活性成分-潜在靶点”网络图。利用插件Network Analyzer进行拓扑学分析筛选出肉苁蓉防治IUA的关键活性成分。
5 肉苁蓉防治IUA互相作用蛋白网络图(PPI)构建
将获得的潜在靶点导入String数据库,构建PPI网络。利用CytoNCA插件进行参数设置,挖掘该调控网络中的关键靶点。
6 GO和KEGG富集分析
运用R语言调用Bioconductor数据包对潜在靶点进行GO分析和KEGG通路富集分析,对分析结果进行可视化,构建“通路-潜在靶点”网络图。
7 分子对接验证
将筛选出的核心靶点和关键有效成分进行分子对接验证。在Pubchem和PDB数据库中分别获取对接小分子和靶基因的大分子蛋白构像。运用AutoDock1.5.6软件进行分子对接,计算对接自由能,筛选出最佳、最合理的对接方式进行分析验证。
结 果
1 肉苁蓉的主要活性成分作用靶点
在TCMSP数据库中共得到肉苁蓉活性成分5个,分别为β-谷甾醇(beta-sitosterol)、花生四烯酸(arachidonate)、全草含苏齐内酯(suchilactone)、木脂素(Yangambin)、槲皮素(quercetin),其对应靶蛋白共221个,在Uniprot数据库中将靶蛋白转化为对应的基因名,去重后获得靶基因154个。
2 疾病靶标的筛选
在Genecards、OMIM、PharmGkb数据库分别筛选出疾病靶点3279个、95个、971个,取并集共获取肉苁蓉防治IUA的疾病靶点3880个,与肉苁蓉药物靶点取交集,得到药物-疾病潜在靶点117个,构建Venn图(见图1)。
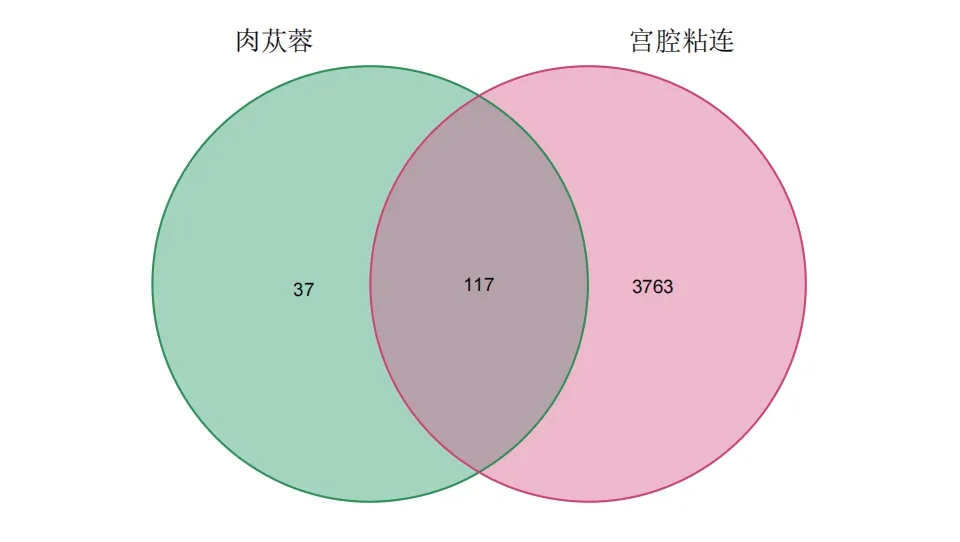
图1 肉苁蓉防治宫腔粘连交集基因Venn图
3 构建药物-活性成分-潜在靶点网络
运用 Cytoscape 3.8.0软件构建“药物-活性成分-潜在靶点”网络图,共有节点123个,150边条,有效成分按对应的潜在靶点数值大小(degree值)进行排序,分别为槲皮素113个、β-谷甾醇21个,全草含苏齐内酯7个,木脂素5个,花生四烯酸4个(见图2)。由此可知肉苁蓉在治疗IUA时槲皮素和β-谷甾醇可作用于多靶点发挥主要作用,而其他活性成分参与并不多,说明槲皮素和β-谷甾醇可能是肉苁蓉治疗IUA的关键活性成分。

图2 肉苁蓉防治IUA“药物-成分-潜在靶点”网络图
4 PPI网络图构建
在STRING数据库对117个潜在靶点进行相互作用分析,设置combined score>0.9,输出目标文件,导入Cytoscape3.8.0软件中绘制PPI网络图,共得到99个节点和340条边的(见图3A),运用CytoNCA插件设置参数进行两次筛选,获得肉苁蓉治疗IUA的核心靶点基因为JUN、MAPK1、AKT1、TP53、RB1、TNF、CCND1、RELA、MYC等9个(见图3B、3C)。

图3 肉苁蓉防治IUA共同靶点PPI网络图
5 GO和KEGG分析
通过GO功能富集分析,肉苁蓉与IUA相关的潜在关键靶点基因涉及生物过程(Biological Process,BP)富集条目2086条,主要包括细胞对化学应激的反应、脂多糖的反应、活性氧代谢过程等;细胞组成(cellular component,CC)52条,主要包括膜筏、膜微域、膜区等;分子功能(molecular function,MF)148条,主要包括DNA聚合酶转录因子结合、RNA聚合酶Ⅱ-特异性DNA-结合转录因子结合、泛素样蛋白连接酶结合等(见图4)。
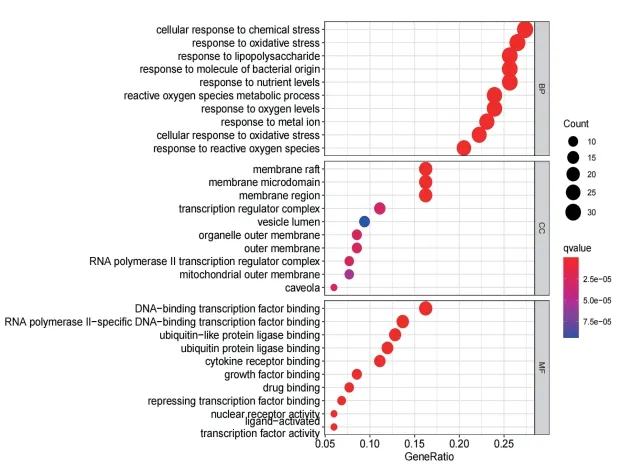
图4 肉苁蓉防治IUA潜在靶点GO气泡图
KEGG富集分析结果显示共154条通路,其主要涉及代谢、肿瘤、病毒感染、炎性反应等多种信号通路(见图5)。以通路富集的基因数目对排序前20的通路及对应的基因导入Cytoscape3.8.0中构建“潜在靶点-通路”网络并进行可视化(见图6A)。根据Degree值取排名前10的靶蛋白制作柱状图(见图6B),依次为 AKT1、MAPK1、TP53、RELA、CCND1、CDKN1A、RAF1、CASP3、TNF、BAX。

图5 肉苁蓉防治IUA潜在靶点KEGG气泡图

图6 肉苁蓉预防IUA“潜在靶点-通路”网络图
6 分子对接验证结果
将PPI网络和KEGG富集分析获得关键靶点取交集获得核心靶点为AKT1、MAPK1、TP53、TNF、RELA、CCND1。并与肉苁蓉的活性成分逐一进行分子对接。将对接结果绘制成热图(见图7A)。根据配体和受体结合能越低,结合越稳定的原理,可以看出槲皮素、β-谷甾醇与关键靶点结合效果较佳,其中槲皮素与RELA对接效果最佳,能量为-9.7kcal/mol,分子对接情况如图所示(见图BCD)。
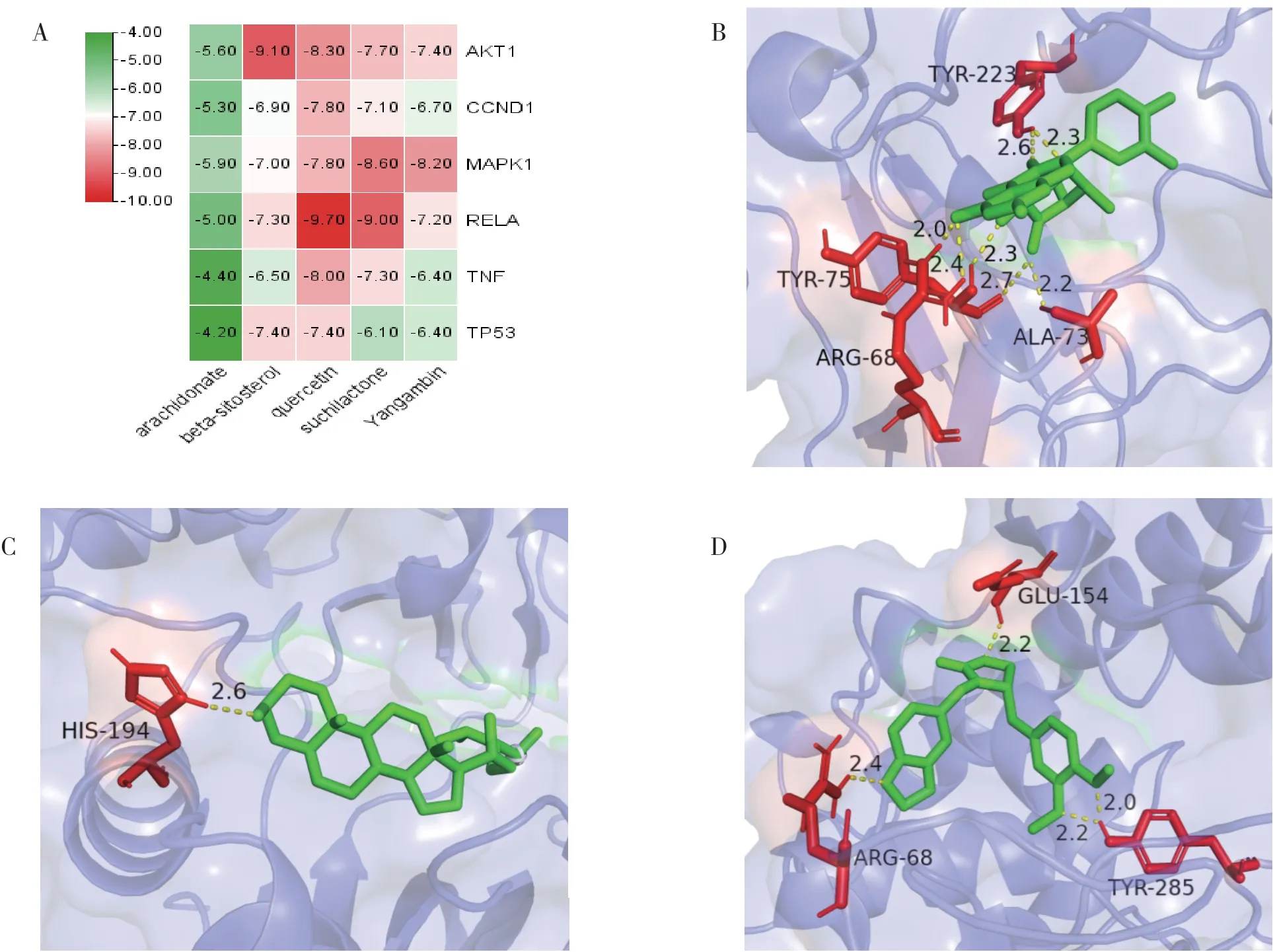
图7 A图为肉苁蓉主要活性成分与核心靶基因对接能量值热图;B图为槲皮素与RELA对接分子结构图;C图为β-谷甾醇与AKT1对接分子结构图;D图为全草含苏齐内酯与RELA对接分子结构图。
讨 论
IUA在中医传统医学中属于“月经量少”“闭经”“不孕”等范畴。IUA多由金刃损伤所致,金创之法对胞宫造成损伤,导致胞脉、冲任、气血受损,耗伤肾之元气精血,而肾为先天之本,主生殖,为天癸之源,冲任之本,气血之根,故多出现经少、闭经,不孕等情况。后代医家认为宫腔粘连的病机为肾虚血瘀,肾虚为本,血瘀为标,属本虚标实,故治疗当以补肾为主。
本研究检索出肉苁蓉的五种有效成分,推断出槲皮素、β-谷甾醇为肉苁蓉防治IUA的关键有效成分。分子对接结果也证实槲皮素、β-谷甾醇对接结果较其他活性成分更佳,推测出槲皮素、β-谷甾醇是肉苁蓉防治IUA发挥作用的主要成分。通过GO分析,推断肉苁蓉防治IUA的作用机制是通过有效成分和某些DNA/RNA聚合酶转录因子、泛素样蛋白连接酶等结合调节活性氧代谢、参与细菌来源分子反应、炎症反应、氧化应激等生物过程实现的。现代药理学表明,槲皮素、β-谷甾醇具有抗氧化、抗炎、抗菌、抗病毒、抗癌、抗纤维化等生物活性[4-5]。槲皮素具有清除氧自由基及超氧阴离子,并通过提高超氧化物歧化酶活性,降低丙二醛含量,可以减轻组织的氧化应激损伤和病理性修复[6-8]。槲皮素还可调控TLR4/NF-kB通路,调节NO释放,降低TNF-α、IL-1β等炎症因子的分泌,减轻炎症反应,并抑制细胞的凋亡[9-10]。研究发现β-谷甾醇也可调控NF-kB/MAPK信号通路减少细胞中炎性因子生成,发挥抗炎,抗氧化作用,减轻细胞的损伤[11-12]。此外,β-谷甾醇可减少细胞外基质CollagenⅠ的沉积,促进α-平滑肌肌动蛋白(α-SMA)的表达,抑制组织、器官纤维化病理过程[13]。
肉苁蓉防治IUA筛选出核心靶点为AKT1、CCND1、MAPK1、RELA、TNF、TP53,预测肉苁蓉防治IUA主要通过调节这些基因靶点发挥作用。目前大量实验研究[14-15]发现抑制TNF、IL炎症因子和TGF-β1、MAPK1、AKT蛋白的分泌,可减轻IUA的粘连程度,其机制主要与减轻子宫内膜修复过程中炎症反应及纤维化的发生,促进子宫内膜的修复与再生。RELA是NF-kB信号通路中的重要转录因子,可调控 TNF-α、IL-17等多种炎性介质的表达来介导炎症反应,参与细胞免疫及凋亡等生物过程[16]。宫腔内的肿瘤也是引起IUA重要原因之一,TP53、CCND1主要调节细胞增殖分化,从而影响IUA的发生发展。
KEGG分析结果显示,其富集通路主要涉及炎症反应、病毒感染、恶性肿瘤及内分泌紊乱等方面,主要包括AGEs-RAGE、HIF、TNF、IL等通路及通路调控因子。AGEs-RAGE信号通路是抗纤维化的主要通路之一,糖化终产物(AGEs)可以刺激单核巨噬细胞分泌TNF-α、IL-1等因子来促进细胞基质中层连蛋白(Laminin)的表达,诱导间皮细胞合成基质增加,导致大量基质蛋白堆积或基质成分被AGEs修饰而发生结构改变,最终诱发纤维化病理改变[17]。此外,AGEs-RAGE通路还可以调控上皮细胞内氧化酶系统,促进炎症因子的表达,导致细胞炎症损伤与凋亡[18]。HIF在IUA患者子宫内膜中表达,并与IUA的粘连纤维化成正相关,HIF可调控缺氧调节机制,缺氧时HIF-1α诱导p53上调抑制细胞周期进程,导致G2/M细胞的积聚,并激活TGF-β、CTGF等因子,促进纤维化的发生[19]。TNF-α、IL作为纤维化因子、炎症介质和免疫调节因子,与IUA的发生发展密切相关,促进炎症反应,刺激血管收缩,使子宫内膜缺血缺氧情况加重,促进IUA的形成[20]。
综上,本研究通过网络药理学预测肉苁蓉防治IUA的分子机制研究得出槲皮素、β-谷甾醇是肉苁蓉预防IUA关键有效成分,主要通过作用AKT1、MAPK1、RELA、TNF等基因靶点来调节AGE-RAGE、HIF、TNF等多条信号通路发挥作用,其作用生物机制与调控纤维化、炎症反应、氧化应激反应、细菌病毒感染等密切相关。这些机制有部分在当前已有的文献中得到证实,但仍有部分机制可能需要后续实验研究加以证明。因此,对肉苁蓉防治IUA的分子机制的研究有一定参考价值,可为后续实验设置提供思路。
