玉米不同残体添加对棕壤团聚体中氨基糖分配的影响
2022-04-13薛萍落裴久渤汪景宽
薛萍落,马 南,裴久渤,汪景宽
(沈阳农业大学土地与环境学院/土肥资源高效利用国家工程实验室/农业农村部东北耕地保育重点实验室,辽宁沈阳 110866)
微生物是土壤碳氮循环的重要枢纽,既为其转化过程提供驱动力,又可作为土壤碳氮的“源”和“汇”参与循环[1]。土壤团聚体是土壤结构的基本单元,对土壤中碳氮的动态变化起重要调控作用[2],可为微生物生存提供不同的微环境,如水气状况、孔隙度等,从而影响微生物群落及其代谢活动的空间分布[3–4]。可见,土壤碳氮、团聚体和微生物三者之间具有复杂的作用关系。对于农田生态系统而言,外源有机物(如秸秆)的加入会扰乱这种平衡,改变土壤碳氮的循环过程[5]。秸秆还田后可为土壤中微生物提供能源,刺激微生物活性,导致微生物大量繁殖,同时也引起大量微生物死亡[6],成为微生物残留物在土壤中积累,转化为土壤中的碳氮[6]。此外,秸秆还田会影响土壤团聚体构成,改变土壤结构[7–8],引起不同团聚体中的微生物群落迅速变化[9]。因此,探究秸秆还田后微生物残留物在土壤团聚体中的富集状况与转化过程,对明确土壤碳氮形成和转化的微生物学机制具有重要意义[10]。
氨基糖作为微生物细胞壁的残留物,能相对稳定存在于土壤中,可反映微生物的长期作用效应[11],成为评价微生物对土壤碳氮贡献的重要标识物[12–13]。当前,土壤中已有11种氨基糖被证明存在,然而只有氨基葡萄糖(glucosamine,GluN) 、氨基半乳糖(galactosamine,GalN)、氨基甘露糖(man-nosamine,ManN)和胞壁酸 (muramic acid,MurA) 4 种氨基糖目前可被定量[10–11,14–15]。氨基葡萄糖主要来源于真菌,胞壁酸唯一来源于细菌,氨基半乳糖和氨基甘露糖来源尚不明确[16–17],但氨基半乳糖常被认为主要由细菌合成,而氨基甘露糖因其含量很低且来源尚不明确,对其的研究与其它3种氨基糖相比较少[18]。由于氨基葡萄糖与胞壁酸的异源性,其比值常被用来指示真菌和细菌的群落组成[14–15,19]。研究表明,不同团聚体中氨基糖对外源有机物添加的响应不同,其中秸秆和猪厩肥添加后土壤各粒级氨基糖含量的顺序表现为黏粒>砂粒>粉粒[20]。添加秸秆可引起团聚体中氨基糖从粗粒级向细粒级的迁移[21]。化肥配施猪粪处理显著增加各级团聚体中氨基糖的含量,且不同级别团聚体中真菌和细菌的分布特征不同[22]。
秸秆根、茎叶残体由于碳、氮含量不同,还田后对微生物扰动存在差异[23]。同时土壤养分、微生物活性和数量等方面的差异也会引起土壤微生物群落结构的变化[24–26],这些因素会对土壤中微生物的代谢活动产生不同的影响,进而造成团聚体中微生物残体氨基糖的分配差异。已有研究表明,高肥力土壤较低肥力土壤拥有更高的微生物量、大团聚体占比、酶活性及全然不同的微生物群落组成[27–30]。因此,本研究分别将玉米根茬和茎叶残体添加到高、低肥力棕壤中,研究其对土壤团聚体中氨基糖分配的影响,利用氨基糖微生物指示的异源性,阐明真菌和细菌的群落变化,为深入理解土壤团聚体中微生物在碳氮养分高效利用中的作用提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 供试土壤 供试土壤于2019年9月下旬(玉米收获后)采自沈阳农业大学棕壤长期定位试验土壤。该试验站 (海拔 75 m,41°49′ N、123°34′ E)于1987 年建立,气候为北温带大陆性季风气候,年平均温度7℃~8℃,年平均降雨量730 mm,集中在夏季,土壤为黄土性母质的壤质棕壤。玉米为该试验站长期连作作物,通常于每年4月下旬施肥、耕种,9月下旬收获并测产。高肥力土壤选取高量有机肥配施氮磷肥处理(年施有机肥折合N 135 kg/hm2,化肥 N 75 kg/hm2和 P2O567.5 kg/hm2,HF),低肥力土壤为不施肥对照处理(LF)。采用五点取样法和四分法采集土样,将采集后的棕壤室温风干后,剔除可见根系和石砾等杂质,过2 mm筛备用。供试土壤基本理化性质如表1。
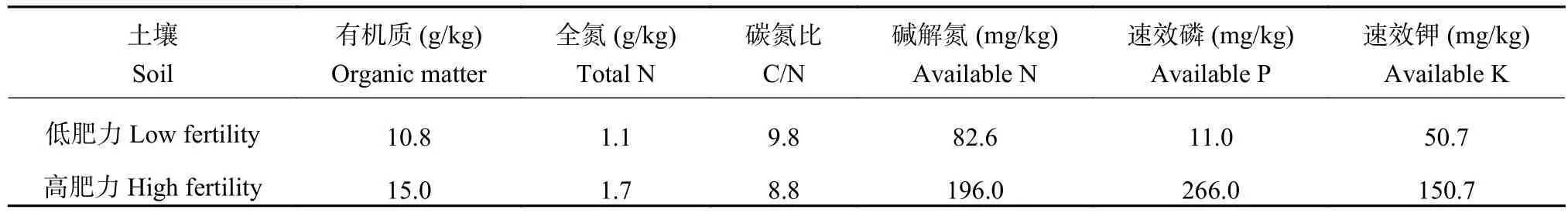
表1 供试土壤基础理化性质Table 1 Basic properties of tested soils
1.1.2 供试有机物料 供试有机物料为玉米根茬和茎叶残体,于田间采集,首先在105℃下杀青 30 min,然后60℃烘8 h,剪成2 cm小段,粉碎机粉碎后过40目筛备用。根茬和茎叶残体碳、氮含量如表2。
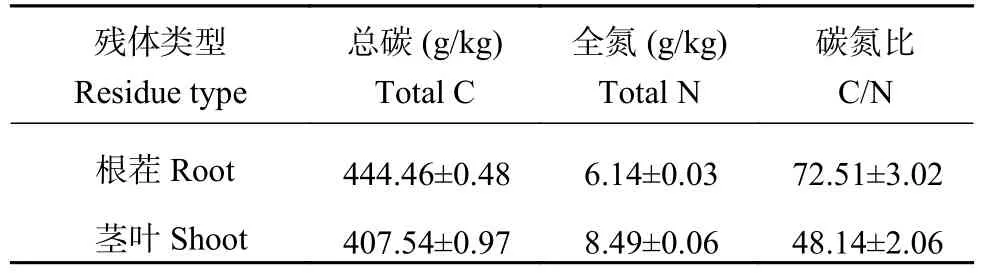
表2 玉米残体碳氮含量Table 2 Carbon and nitrogen content in maize root and shoot
1.2 试验设计
称取过 2 mm 筛的风干土 250 g (烘干重计),置于1000 mL培养瓶中,调节土壤含水量至田间持水量40%,用带孔盒盖(盒盖直径11 cm,均匀扎有20个大小一致的孔隙)封口,25℃恒温避光预培养7天。将5 g (250 g烘干土质量的2%)磨碎的玉米残体样品(根茬、茎叶)与预培养土壤充分混匀后封盖继续放入培养箱(25℃恒温避光)培养360天。培养过程中利用称重法每周对土壤进行补水,确保土壤含水量保持在田间持水量的60%。培养试验共设6个处理:1)低肥棕壤添加玉米根茬(LF+R);2)低肥棕壤添加玉米茎叶(LF+S);3)高肥棕壤添加玉米根茬(HF+R);4)高肥棕壤添加玉米茎叶(HF+S);5)不添加玉米残体的低肥力棕壤(LF);6)不添加玉米残体的高肥力棕壤(HF)。每个处理 3 次重复。分别在培养第0、30、60、180、360天进行取样,土壤样品采用干筛法进行团聚体分级并称重,分级土样风干后,过0.15 mm筛,一部分用于土壤碳氮含量测定,另一部分进行氨基糖提取和含量测定。
1.3 土壤团聚体分级
将采集的新鲜土壤样品在4℃条件下均匀风干至含水量10%左右。将100 g土样置于自动筛分仪(Retsch AS 200,Germany)中,筛子孔径为 250 μm,设定振幅为1.5 mm震动2 min,将土样筛分为大团聚体 (粒径≥250 μm)和微团聚体 (粒径<250 μm)[31–32]。
1.4 土壤样品测定
1.4.1 土壤样品碳、氮含量测定 利用元素分析仪( EA,Germany)测定土壤 (过 0.15 mm 筛)总有机碳和全氮含量,并计算C/N。
1.4.2 土壤样品氨基糖测定 土壤样品中氨基糖含量采用Zhang等[14]方法进行测定。简略步骤如下:以0.4 mg氮为称量标准,用分析天平称取过0.15 mm筛的风干土壤样品,即:称样量(g)= 0.4/全氮含量,置于水解瓶中,加入 10 mL 6 mol/L 的 HCl,在105℃下水解8 h,冷却后加入100 μL的肌醇(内标1),振荡摇匀后过滤至心形瓶,在52℃真空状态下旋转蒸干。加入约20 mL水将残余物溶解至50 mL离心管中,然后用0.4 mol/L KOH和稀HCl将溶解液的pH调至中性(6.6~6.8),使溶液中的Fe、Al 等金属离子沉淀,在3000 r/min离心机上离心 10 min去除铁铝沉淀。上清液进行二次旋蒸,旋蒸后的干燥物用无水甲醇溶解后转入小离心管再次以3000 r/min 离心 10 min (去除 KCl 盐分),上清液 (氨基糖部分)转移至5 mL衍生瓶中45℃下氮吹(去除无水甲醇),干燥后加入 1 mL 水和 100 μL N-甲基氨基葡萄糖( 内标 2),封口膜扎紧摇匀后冷冻干燥。另取3个5 mL的衍生瓶作为标准样品,均加入100 μL的胞壁酸,氮吹后加入100 μL 3种氨基糖混合标准液[D-(+)-氨基葡萄糖、D-(+)-氨基半乳糖、D-(+)-甘露糖胺]、100 μL 肌醇、100 μL N-甲基氨基葡萄糖、1 mL水,封口摇匀后与样品一起进行冷冻干燥。
向干燥后的衍生瓶中加入300 μL的衍生试剂(氰化反应),盖紧后涡旋,置于80℃水浴锅中加热30 min,期间摇晃2次,拿出冷却至室温后,加入1 mL乙酸酐(乙酰化反应),涡旋后在80℃水浴锅中加热60 min,期间摇晃3次,再次冷却至室温后加入 1.5 mL 二氯甲烷,最后用 1 mL 1 mol/L HCl和 3 mL蒸馏水(每次1 mL)进行有机相的提取,最后一次提取中尽可能把水移除,提取出的有机相在45℃条件下氮吹干燥,用200 μL乙酸乙酯-正己烷混合液(1∶1)溶解干燥物并转入带有衬管的气相色谱瓶中,以待上机。
1.5 计算方法
土壤各级团聚体中氨基糖含量(mg/kg)依据内标法,采取如下公式计算:
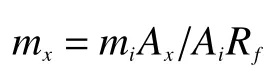
式中:mx为每种氨基糖在各级团聚体中的含量,以各级团聚体风干质量为基础;mi为添加的内标物肌醇的质量;Ai和Ax分别为样品测定中肌醇和氨基糖的峰面积;Rf为每种氨基糖的相对校正因子,利用标准样品中氨基糖和肌醇的校正因子计算。
1.6 数据分析
采用 Origin 2019 和 Microsoft Office Excel 2013对试验数据进行处理和绘图,用SPSS 25.0软件对试验结果进行方差分析,不同处理间的显著性采用重复测量方差分析,P<0.05为差异显著。
2 结果与分析
2.1 不同处理下土壤团聚体中C/N变化
由图1可知,添加根茬和茎叶残体处理的土壤C/N变化趋势均随培养时间的延长先升高后降低,最高值均出现在培养第30天。培养一年后,各处理土壤团聚体中的C/N均显著高于CK (P<0.05),低肥力土壤C/N值大于高肥力土壤;大团聚体中C/N值以根茬处理大于茎叶处理,微团聚体中茎叶处理大于根茬处理。
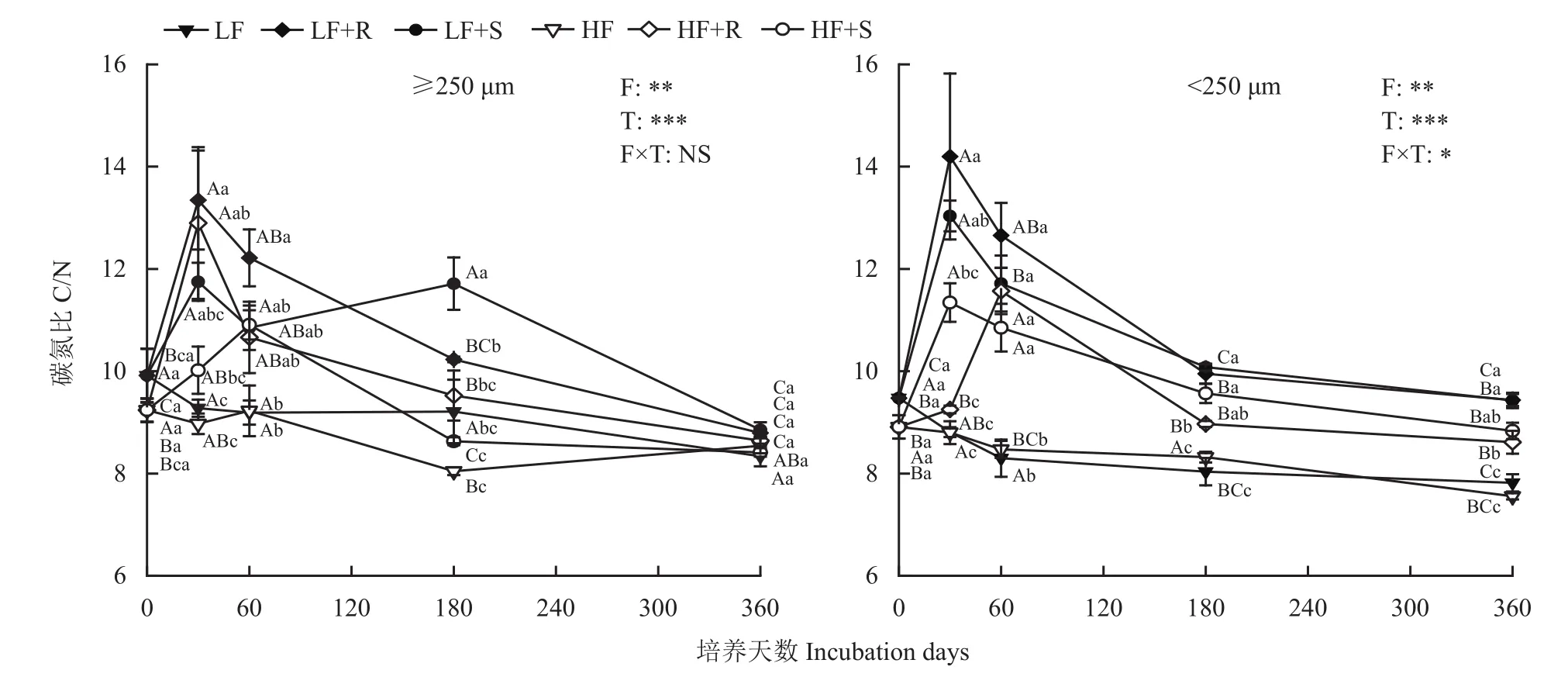
图1 玉米不同部位残体添加后不同肥力棕壤团聚体中C/N的动态变化Fig. 1 Dynamic changes in C/N ratios in soil aggregates with different fertility levels after different parts of maize residues addition
2.2 不同处理下土壤团聚体中氨基糖含量变化
氨基糖总量主要包括氨基葡萄糖、甘露糖胺、氨基半乳糖和胞壁酸,其中甘露糖胺含量很低,因此常用氨基葡萄糖、氨基半乳糖和胞壁酸3种单糖之和表示土壤中氨基糖总量[33]。各处理中,氨基葡萄糖占氨基糖总量的68.5%~76.4%,氨基半乳糖占18.4%~27.4%,胞壁酸占3.1%~5.4%。
2.2.1 团聚体中氨基糖总量变化 肥力水平和玉米残体类型对大团聚体和微团聚体中氨基糖总量的影响均极为显著(P<0.001)。培养初期,微团聚体氨基糖总量高于大团聚体,培养180天之后大团聚体高于微团聚体,且培养结束时大团聚体和微团聚体中的氨基糖总量差异显著(P<0.001)。由图2 (a、b)可知,培养开始后,添加玉米根茬和茎叶残体处理的土壤团聚体中的氨基糖总量均呈现下降趋势,在培养30天时含量达到最低,随后逐渐增加,至培养180天达到峰值,之后又开始下降,但在培养第360天时仍显著高于对照(P<0.05)。此时,高肥力和低肥力土壤大团聚体中的氨基糖总量分别为1198.47 mg/kg (HF)和 1012.03 mg/kg (LF),微团聚体中分别为 1046.85 mg/kg (HF)和 959.60 mg/kg (LF),高肥力土壤高于低肥力土壤(P<0.05)。
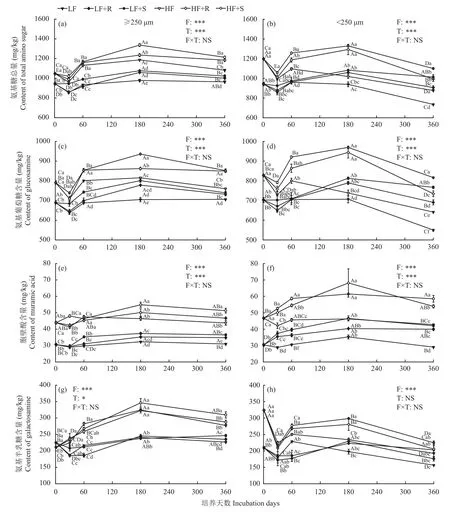
图2 玉米不同部位残体添加后不同肥力棕壤团聚体中氨基糖含量的动态变化Fig. 2 Dynamic changes in amino sugar contents in soil aggregates with different fertility levels after different parts of maize residues addition
不同玉米残体类型对各级团聚体中氨基糖总量的影响,在培养一年后的表现均为茎叶>根茬,其中大团聚体茎叶和根茬处理的氨基糖总量分别是CK的1.09、1.07倍,微团聚体中分别是CK的1.31、1.18倍。
2.2.2 团聚体中氨基葡萄糖含量变化 培养初期微团聚体中的氨基葡萄糖含量高于大团聚体,培养结束时大团聚体氨基葡萄糖含量高于微团聚体(P<0.05)。由图2 (c、d)可知,各级团聚体添加玉米残体处理的氨基葡萄糖含量变化趋势与氨基糖总量变化一致,即培养初期呈现下降趋势,培养30天时达到含量最低值,随后逐渐增加,至培养180天达到峰值后开始下降,培养第360天时仍显著高于对照处理(P<0.05)。此时,高肥力和低肥力土壤大团聚体中的氨基葡萄糖含量分别为 850.66 mg/kg (HF)、735.27 mg/kg (LF),微团聚体中的含量分别为775.47 mg/kg (HF)、728.86 mg/kg (LF),高肥力土壤>低肥力土壤 (P<0.05)。
不同玉米残体类型对各级团聚体中氨基葡萄糖含量影响的表现均为茎叶>根茬,大团聚体中茎叶和根茬处理分别是CK处理的1.09、1.08倍,微团聚体中分别是CK处理的1.33、1.20倍。
2.2.3 团聚体中胞壁酸含量变化 肥力水平和玉米残体类型均显著影响胞壁酸含量(P<0.001),团聚体级别对胞壁酸含量有极显著影响(P<0.001)。胞壁酸含量在高肥力和低肥力土壤中均表现为微团聚体>大团聚体,培养第30、60、360 天差异显著(P<0.05)。
由图2 (e、f)可知,大团聚体中胞壁酸含量变化趋势与总氨基糖和氨基葡萄糖含量相似,其中高肥添加茎叶处理存在一个短暂升高而后下降的阶段,微团聚体中胞壁酸含量则一直维持上升趋势,到培养180天达到峰值后才逐渐下降直到培养结束。培养结束时,高肥力和低肥力土壤大团聚体中的胞壁酸含量分别为 48.99 mg/kg (HF)、35.67 mg/kg (LF),微团聚体中的含量分别为 56.20 mg/kg (HF)、41.01 mg/kg (LF),两个粒级团聚体的胞壁酸含量均以高肥力土壤>低肥力土壤(P<0.05)。
此外,培养结束时,茎叶处理各级团聚体中胞壁酸含量均大于根茬处理,茎叶和根茬处理大团聚体中胞壁酸含量分别是CK的1.17、1.09倍,微团聚体中分别是CK的1.40、1.31倍。
2.2.4 团聚体中氨基半乳糖含量变化 氨基半乳糖含量在大团聚体中受肥力水平和残体类型的显著影响(P<0.05),团聚体级别对氨基半乳糖含量有极显著影响(P<0.001),且在微团聚体中氨基半乳糖含量仅受肥力水平的极显著影响(P<0.001)。培养结束时,大团聚体中氨基半乳糖含量大于微团聚体,且变化趋势与氨基葡萄糖、胞壁酸和总氨基糖含量均不相同,并未表现出较明显的规律性。
由图2 (g、h)可知,培养结束时,大团聚体中的氨基半乳糖含量分别为298.81 mg/kg (HF)和241.08 mg/kg (LF),微团聚体中分别为 215.19 mg/kg(HF)和 189.72 mg/kg (LF),团聚体中氨基半乳糖的含量表现为高肥力土壤>低肥力土壤(P<0.05)。此外,大团聚体和微团聚体中氨基半乳糖含量均以茎叶处理>根茬处理,大团聚体中茎叶和根茬处理分别是CK处理的1.10、1.04倍,微团聚体中分别是CK的1.23、1.09倍。
2.3 不同处理下土壤团聚体中氨基葡萄糖和胞壁酸比值变化
由图3可知,整个培养期间,团聚体中氨基葡萄糖和胞壁酸比值受土壤肥力水平和玉米残体类型的显著影响(P<0.05)。团聚体级别对氨基葡萄糖和胞壁酸比值有极显著影响(P<0.001)。
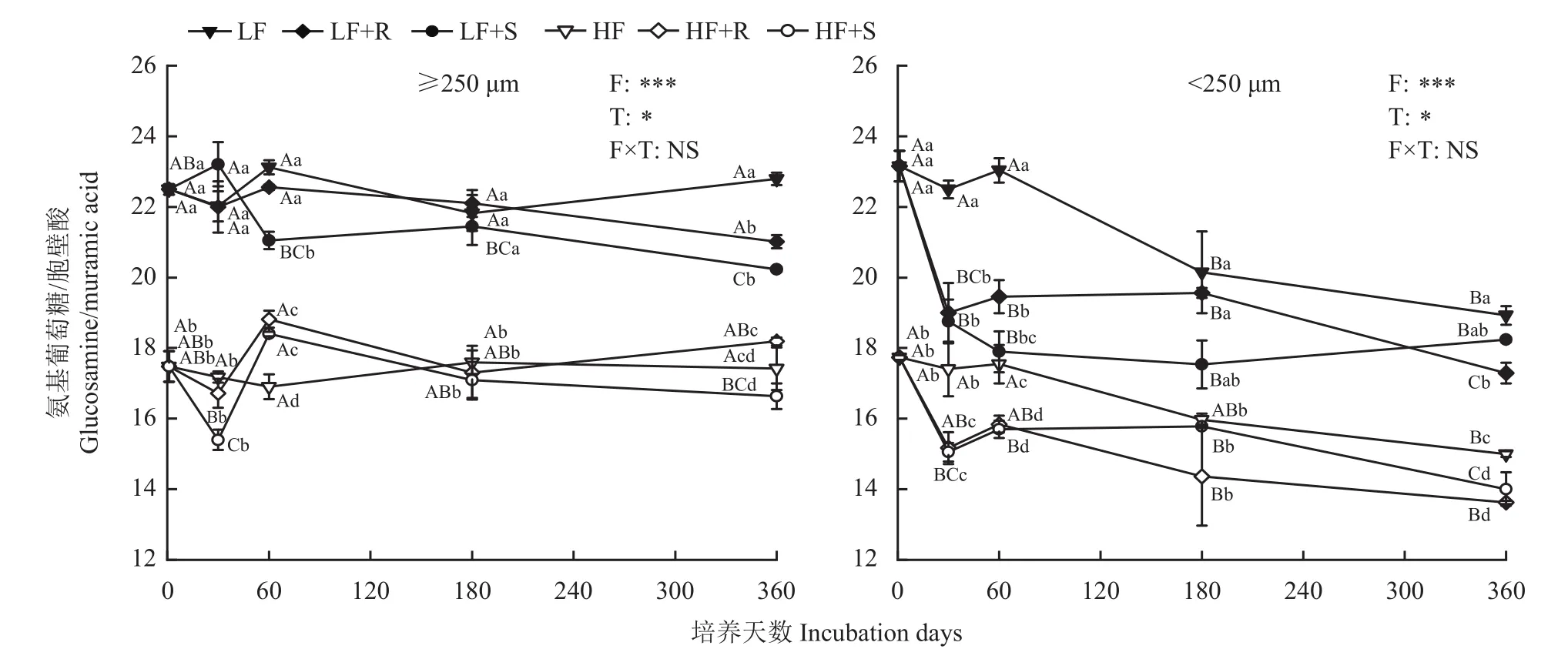
图3 玉米不同部位残体添加后不同肥力棕壤团聚体中氨基葡萄糖和胞壁酸比值的动态变化Fig. 3 Dynamic changes in the ratio of glucosamine to muramic acid in soil aggregates with different fertility levels after different parts of maize residues addition
培养结束时,大团聚体中氨基葡萄糖和胞壁酸比值大于微团聚体(P<0.05),低肥力土壤>高肥力土壤(P<0.05)。大团聚体中,根茬处理的比值大于茎叶处理(P<0.05),微团聚体中则是茎叶处理大于根茬处理(P<0.05)。
3 讨论
3.1 玉米残体类型对土壤团聚体中氨基糖分配的影响
通过分析不同部位玉米残体添加对各级团聚体中氨基糖含量的变化,可以探明团聚体尺度下不同玉米秸秆残体类型还田后对微生物源碳氮积累的影响。总体而言,添加不同残体类型可在不同程度上显著提高土壤团聚体中氨基糖含量并影响其在各级团聚体中的分配。大团聚体的氨基葡萄糖含量高于微团聚体,微团聚体中胞壁酸含量高于大团聚体,这主要因为大团聚体中的孔隙有利于真菌菌丝的伸展[34],而微团聚体中更高的黏粒含量,则更有利于细菌的吸附和保存[35]。其中,虽然各团聚体内氨基糖总量和氨基葡萄糖含量受残体类型的影响程度不一,但培养初期总体均出现下降,主要是因为秸秆输入后提供了大量碳源,且C/N较大,加入的短时间内会使微生物处于缺氮的状态[36],微生物生长受限,残留物氨基糖的合成也随之减弱[37]。同时,由于茎叶自身的C/N小于根茬(表2),能提供相对较多的氮素供微生物生长,因此氨基糖总量和氨基葡萄糖含量的下降速度低于根茬。培养前期C/N的变化趋势表明(图1),随着秸秆分解,激发了土壤中氮素矿化,这符合氮矿化理论,即秸秆输入将导致短期内氮素有效性迅速降低,C/N失衡,引起土壤氮素矿化以满足微生物生长[38]。同时,秸秆在微生物的驱动下会逐渐腐解释放氮素到土壤中[39],当氮素充足时,土壤中的微生物快速繁殖同时伴有微生物体死亡,微生物逐渐以残体的形式开始在土壤中积累[6],因此氨基糖总量和氨基葡萄糖含量显著升高。微团聚体中胞壁酸含量培养初期未出现下降趋势,可能是因为秸秆的加入可促进氮素在微团聚体中的富集,能够满足细菌生长代谢所需[20],细菌对活性养分的竞争能力又强于真菌[40],因此微团聚体中真菌出现下降趋势,而细菌则未出现。氨基半乳糖的含量变化情况尽管也因不同类型残体的加入而出现不同程度的波动,但未表现出较明显的规律性,说明其来源较为复杂。目前认为氨基半乳糖主要来源于细菌,但也有研究证明,与细菌相比真菌对氨基半乳糖有更大的贡献[41–42]。虽然氨基半乳糖的来源仍无法确定,但其对氨基糖总量的贡献较大,仅次于氨基葡萄糖且远高于胞壁酸[6],因此其在微生物源碳氮养分形成与循环过程中的作用不可忽视。培养180天后加入秸秆残体的各处理氨基糖含量均又出现不同水平的下降,表明微生物残留物降解,土壤微生物缺乏养分[43]。有研究证明,土壤中缺乏养分时氨基糖可作为一种能源和氮源,被优先分解利用[23,39]。本试验培养后期无其余养分添加且秸秆进入缓慢分解阶段,导致土壤中可利用养分减少,限制了微生物生长,因此积累的微生物细胞壁残留物会被分解以满足生长所需,造成了氨基糖含量的减少。
整个培养期内,茎叶处理的总氨基糖及各氨基单糖含量高于根茬处理。因为根茬含有较多的木质素等不易被分解的物质,而茎叶中的糖类、纤维素和半纤维素等均为易分解物质[44],可快速被微生物利用导致茎叶处理的氨基糖含量高于根茬。此外,培养结束时,大团聚体中添加根茬处理的氨基葡萄糖和胞壁酸比值高于茎叶处理,微团聚体中则相反,表明添加根茬有利于大团聚体中真菌群落的生存,而茎叶有利于真菌群落在微团聚体中的生存,说明玉米残体不同部位的输入对团聚体中微生物群落组成的影响不同,从而可进一步证明不同秸秆部位还田,会对团聚体中氨基糖的积累与分配产生不同程度的影响。因此,研究不同玉米残体还田后土壤团聚体内氨基糖的分配情况及微生物群落变化,对于明析微生物在土壤碳氮养分循环方面的贡献是十分必要的。
3.2 土壤肥力对土壤团聚体中氨基糖分配的影响
本试验中高肥棕壤各处理的总氨基糖及各氨基单糖含量在各级团聚体中均显著高于低肥(P<0.05),主要是高肥棕壤含有更多的活性养分和微生物量,这与李丽东等[21]的研究结果一致,即氨基糖在高有机质土壤中的积累高于低有机质土壤。其中,胞壁酸含量在大团聚体高肥添加茎叶处理的培养初期存在一个短暂升高而后下降的阶段,低肥棕壤中则不存在,主要是高肥棕壤中相对含有更多可利用氮素[45],其次茎叶中含有更多的易分解物质和氮[44],与根茬相比在腐解过程中更能够补充土壤中的活性氮[46],这两种途径的氮素供给可暂时满足细菌生长所需,而后随着细菌的不断繁殖氮素又成为了限制其生长的关键因子。
同时,因自身所含养分差异,高低肥力棕壤对真菌和细菌群落的影响不同。本研究中无论是大团聚体还是微团聚体低肥棕壤氨基葡萄糖和胞壁酸比值均显著大于高肥棕壤(P<0.05),说明低肥棕壤有利于真菌群落的生存,高肥棕壤有利于细菌群落的生存。有研究表明,有机质含量较低的棕壤比高有机质的黑土更有利于真菌残留物氨基葡萄糖在砂粒积累[21],主要是与高肥棕壤相比,较瘠薄的低肥棕壤由于可利用的活性养分相对较少,难降解底物比例较高且难以被细菌利用,导致真菌成为优势种群[20]。此外,与真菌相比细菌的生长代谢更易受环境中可利用养分的影响,低肥棕壤中磷、钾含量的缺乏同样会影响细菌的增殖[47]。同时,添加植物残体后,氮素匮乏的土壤对菌根真菌的生长更有利[47],而偏高的菌根真菌会导致细菌残体的降解[48–49]。
综上,不同部位残体还田到不同肥力土壤后,对各级团聚体中氨基糖产生与积累的影响不同。其中茎叶还田更能促进团聚体中氨基糖的积累,同时考虑到由于真菌自身难降解的特性,玉米残体还田可能对低肥土壤碳氮养分的改善更有意义。
4 结论
高肥力土壤有利于团聚体中氨基糖的累积,添加玉米茎叶的提高作用大于添加根茬。低肥力土壤有利于真菌群落的生存,高肥力土壤有利于细菌群落的生存。添加根茬促进了大团聚体中真菌残留物的积累,而茎叶促进了微团聚体中真菌残留物的积累。
