黄酒生物胺的研究进展
2022-04-13刘慕妆黄芷珊钟先锋黄桂东
刘慕妆,任 红,孙 哲,黄芷珊,钟先锋,黄桂东*
(1.佛山科学技术学院 食品科学与工程学院,广东 佛山 528231;2.广东省传统发酵食品工程技术研究中心,广东 佛山 528231;3.广东省食品流通安全控制工程技术研究中心,广东 佛山 528231;4.佛山市酿造工程技术研究中心,广东 佛山 528231;5.佛山市农业生物制造工程技术研究中心,广东 佛山 528231)
黄酒是中国传统酿造酒[1],以稻米、黍米、玉米、小米、小麦等为主要原料,经蒸煮、加曲、糖化、发酵、压榨、过滤、煎酒、贮存、勾兑而成[2]。其含有较丰富的营养物质,如氨基酸、低聚糖和微量元素等[3],被誉为“液体蛋糕”。黄酒营养丰富、风味独特,但同时也会存在一些潜在有害物质,生物胺就是其中之一。生物胺是碱性的含氮化合物[4],在食品尤其是发酵食品中广泛存在,它是荷尔蒙、核苷酸、蛋白质等生理活性物质的前体[5]。适量摄入可以促进人体生长代谢、提高免疫力、控制血压水平和清除自由基等[6-7],过量摄入则会引起人体多种不良反应,如皮疹、瘙痒、恶心、呕吐、腹泻、腹痛、头痛和高血压等[8]。
黄酒中含有多种生物胺,最为常见的是色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺。按照化学结构,可将生物胺分为脂肪胺(腐胺、尸胺、亚精胺、精胺等)、芳香胺(苯乙胺、酪胺等)和杂环胺(色胺、组胺等);根据其组成成分又可以分为两类:单胺和多胺。单胺主要有酪胺、组胺、腐胺、尸胺、苯乙胺、色胺等,多胺主要包括精胺和亚精胺等。
生物胺随黄酒摄入人体后,可在胺类氧化酶的作用下氧化为醛、羧酸等活性较低的氧化产物[9],而酒精会在一定程度上抑制胺类氧化酶的活性[10],从而增加了生物胺在人体的积累,使得生物胺的潜在危害增加。因此,控制黄酒中生物胺的含量,已成为提高黄酒生物安全性的重要关注点之一。本文综述了黄酒生物胺的合成、代谢途径及含量水平,分析了影响生物胺形成的因素、控制措施,总结了黄酒生物胺含量的检测方法,以期为控制黄酒生物胺含量,规范生产管理,保障安全生产提供科学参考。
1 黄酒中的生物胺合成、代谢途径及含量水平
1.1 生物胺的合成机制
氨基酸发生脱羧反应生成相应的生物胺,是发酵食品中生物胺主要的合成途径,该反应需要在微生物分泌的特异性氨基酸脱羧酶的作用下发生[11-12]。生物胺的合成机制如图1所示,游离氨基酸首先通过转运蛋白从微生物细胞外运送至细胞内,然后在特异性氨基酸脱羧酶催化作用下进行脱羧反应,生成相应的生物胺,最后生物胺再次通过转运蛋白运送到微生物细胞外。除需要有前体物质氨基酸和含氨基酸脱羧酶的微生物外,生物胺的合成还需要具有适宜微生物生长以及维持氨基酸脱羧酶活性的环境条件[13]。

图1 微生物中生物胺的合成途径Fig.1 Synthetic pathway of biogenic amines in microorganisms
黄酒生产过程中易形成生物胺,这是由于[14]:①其生产选用蛋白质含量丰富的谷物为原料,在黄酒生产过程会产生一定量氨基酸(色氨酸、苯丙氨酸、赖氨酸、组氨酸、酪氨酸、鸟氨酸、谷氨酸、精氨酸等),为生物胺的形成提供了前体物质;②传统黄酒生产多采用开放式的半固态发酵,多种微生物参与了黄酒发酵过程,其中含有乳酸菌等生物胺产生菌;③黄酒的发酵温度和pH条件适宜微生物的生长繁殖和维持氨基酸脱羧酶活性(氨基酸脱羧酶的最适温度及pH:20~37 ℃、4.04~4.33[15])。
1.2 黄酒生物胺的代谢途径
黄酒生物胺的代谢途径如图2所示,当少量生物胺随黄酒摄入人体后,可在肠道的胺氧化酶(如单胺氧化酶、二胺氧化酶和多胺氧化酶)的作用下被代谢成醛、羧酸等生理活性较低的产物[16]。然而,当生物胺含量过高或胺氧化酶活性受到抑制或干扰时,生物胺无法被充分代谢,进而转化为对人类健康造成严重问题的有毒代谢物[16]。研究发现,易感体质、胃肠道疾病以及药物和酒精的摄入都会抑制胺氧化酶活性,即使是少量的生物胺也不能有效代谢[17]。据报道,当酒精度为12%vol时,91%的胺类氧化酶活性会受到抑制[18],这会增强人体对生物胺的易感性。因此,对于酒类中生物胺的限量标准应比一般食品更加严格。
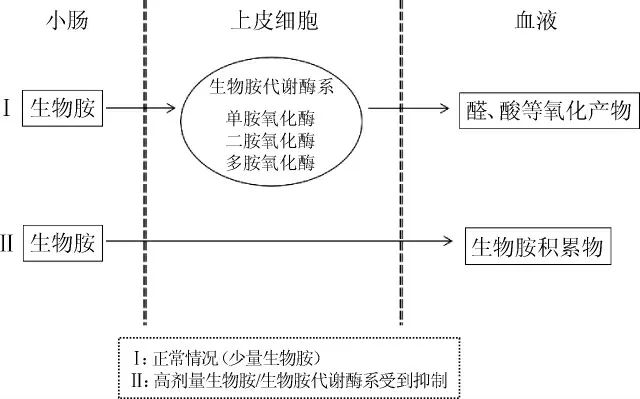
图2 生物胺在肠道中的代谢途径Fig.2 Metabolism pathway of biogenic amines in intestinal tract
1.3 黄酒中生物胺含量水平
食品中生物胺的毒性已被广泛研究,普遍认为,当生物胺含量过高时会引起瘙痒、皮疹,引起恶心、呕吐、腹泻、腹痛,引起头痛、高血压等症状[8]。色胺、苯乙胺会引起呼吸增加、血压升高、头痛等症状[19];酪胺会扩张瞳孔、扩张脸板组织、引起流泪和唾液分泌等症状[20];组胺会引起胃肠反应,进而引发恶心、呕吐、腹泻和腹部绞痛等症状[21-22];尸胺、腐胺、亚精胺、精胺可与亚硝酸盐发生反应,形成致癌的亚硝基胺,也可作为食品腐败的指标[23]。据报道[24],单次摄入100 mg的酪胺会引发偏头痛;单次摄入3 mg 的苯乙胺会引起偏头痛;单次摄入8~40 mg组胺会导致轻微中毒,单次摄入40 mg 以上组胺会引发中等中毒症状,单次摄入超过100 mg组胺则会导致严重中毒,引发头晕、昏厥、口腔灼烧感、无法吞咽和瘙痒等症状。
当前,国际上针对食品生物胺还没有统一的限量标准,美国规定水产品中组胺含量不得超过50 mg/kg[25];欧盟规定食品中组胺含量不得超过100 mg/kg,酪胺含量不得超过100~800 mg/kg[26];我国在食品生物胺限量方面的国标GB 2733—2015《食品安全国家标准鲜、冻动物性水产品》也仅涉及水产品中的组胺,规定鲐鱼、鲹鱼等高组胺鱼类中的组胺含量≤400 mg/kg,其他鱼类中的组胺含量≤200 mg/kg[27]。国外和国内对黄酒中生物胺的限量都还未有明确规定。一些国家规定了葡萄酒中组胺的含量[28]:澳大利亚和瑞士规定≤10 mg/L,法国规定≤8 mg/L,荷兰规定≤3.5 mg/L,而德国更加严格,规定≤2 mg/L。

表1 不同国家或地区生物胺的限量Table 1 Limited quantity of biogenic amines in different countries or regions
目前,已有许多学者对黄酒中的生物胺进行了分析测定。张敬等[32]对我国市面上32个葡萄酒样品、32个啤酒样品、12个黄酒样品中的生物胺含量进行了检测,结果表明,黄酒中总生物胺平均含量达78.3 mg/L,远高于啤酒和葡萄酒中的总生物胺平均值。LU Y M等[33]对我国14个来自不同产区的黄酒样品中生物胺含量进行了检测,结果表明,样品中总生物胺的平均含量为107 mg/L。ZHONG J J等[34]对39个来自不同厂家的黄酒样品中生物胺含量进行了检测,结果表明,样品中总生物胺的平均含量可达115 mg/L,绝大多数黄酒中的组胺含量低于澳大利亚和瑞士标准(10mg/L),而94.84%的样品中组胺含量超过德国设定的在葡萄酒中的最大推荐限值(2 mg/L)。综上所述,黄酒中的生物胺含量仍需进一步的关注。
2 影响黄酒中生物胺形成的因素
影响黄酒中生物胺形成的主要因素为微生物、氨基酸种类及含量、pH和温度、生产工艺、贮藏条件等,如图3所示。

图3 影响生物胺形成的因素Fig.3 Influencing factors of biogenic amine formation
2.1 酿造过程中微生物对黄酒生物胺形成的影响
乳酸菌是黄酒酿造过程中影响生物胺形成的重要因素,它大部分来源于麦曲和酒母,也有少部分来源于环境以及生产时所用的器具设备[15]。研究表明,乳酸菌是黄酒中生物胺的主要产生菌之一,包括乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、肠球菌属(Enterococcus)等[35-36]。张无疾等[37]分析了黄酒前酵生产过程中主要微生物对生物胺形成的影响,结果表明,乳酸菌总数与生物胺含量呈正相关,说明乳酸菌是黄酒前酵过程中影响生物胺形成的重要微生物。
黄酒中的组胺通常被认为是由乳酸菌产生,其他细菌产生很少或尚未引起相关重视。ZHANG J等[38]研究结果表明,黄酒曲中的肠杆菌科(Enterobacteriaceae)是中国黄酒中组胺形成的重要原因。因此,在发酵早期抑制肠杆菌科(Enterobacteriaceae)生长,是防止中国黄酒中组胺过量形成的途径之一。
2.2 氨基酸种类及含量对黄酒生物胺形成的影响
生物胺形成的前体物质是氨基酸(色氨酸、苯丙氨酸、赖氨酸、组氨酸、酪氨酸、鸟氨酸、谷氨酸、精氨酸等),其含量对生物胺的形成有一定影响。许禄[39]分析黄酒不同酿造时期氨基酸总量和生物胺总量,发现前酵期间氨基酸总量与生物胺总量呈极显著正相关(P<0.01)。黄酒中氨基酸主要来源是米饭和麦曲中所含蛋白质经蛋白酶分解后产生以及酵母等微生物自溶后内容物释放产生。蛋白质水解得到前体氨基酸(色氨酸、苯丙氨酸、赖氨酸、组氨酸、酪氨酸、鸟氨酸、谷氨酸、精氨酸等)含量增加,生物胺形成随之增加[15]。因此,可通过控制蛋白酶水解,达到控制前体氨基酸含量,进而达到控制黄酒中生物胺含量的目的。
2.3 黄酒生产及贮藏过程中的pH和温度对黄酒生物胺形成的影响
黄酒生产过程中的环境因素会对生物胺的生成会造成一定影响,这是由于它们会影响微生物生长以及氨基酸脱羧酶活性,其中影响较大的两个因素是pH和温度。
pH是影响生物胺形成的关键因素之一。pH对生物胺的形成有两方面的影响,一方面,酸性会刺激乳酸菌产生应激反应,产生碱性的生物胺保护自身生长繁殖[40-41];另一方面,酸性也会导致微生物生长繁殖及氨基酸脱酸酶的活性受到抑制,影响氨基酸转化为生物胺的脱羧反应,生物胺的形成受到抑制[42]。生物胺的最终含量是由二者平衡决定。
温度是影响黄酒生物胺含量的另一关键因素,在发酵过程中,生物胺形成最适宜的温度是20~37 ℃,低于5 ℃或高于40 ℃时,微生物生长及氨基酸脱羧酶活性均受到一定程度的抑制,生物胺的积累变缓[43]。在贮藏过程中,温度也会影响生物胺含量,贮藏温度越高越利于生物胺的积累。栾同青[44]探究了4 ℃、20 ℃及37 ℃三种贮藏温度对黄酒中生物胺含量的影响。结果表明,在三种温度下贮藏时,生物胺含量增加,其中在37 ℃时,生物胺含量增幅最大,20 ℃次之、4 ℃生物胺含量最小。因次,将温度控制在适宜范围,是控制黄酒生物胺含量的重要措施之一。
3 黄酒生物胺的控制措施
3.1 改良相关菌株
3.1.1 筛选低产生物胺的乳酸菌
乳酸菌是黄酒中产生生物胺的重要微生物,对其进行改良可以控制生物胺的产生。在黄酒生产过程中,选用具有降生物胺或低产(不产)生物胺的乳酸菌来发酵黄酒可以控制黄酒中生物胺的产生。LIU S P等[45]从某地黄酒发酵液中筛选出不产生物胺的三株乳酸杆菌,分别是植物乳杆菌(Lactobacillus plantarum)JN01、希尔氏乳杆菌(Lactobacillus hilgardii)JN02、希尔氏乳杆菌(Lactobacillus hilgardii)JN013。其中,植物乳杆菌(Lactobacillus plantarum)JN01接种于发酵醪时,生物胺浓度显著降低24%。XIONG Z Q等[46]从黄酒样品中分离出不产生物胺的杜兰肠球菌(Enterococcus durans)AR315,结果表明,在浸米阶段和发酵阶段添加杜兰肠球菌(Enterococcus durans)AR315,总生物胺水平分别较对照显著降低45.1%和27.6%(P<0.05)。因此,采用不产生物胺的乳酸菌作为发酵剂是一种显著减少生物胺形成的有效策略,具有工业化应用潜力。
3.1.2 筛选能分泌胺类氧化酶的乳酸菌
利用低产或不产生物胺,且对生物胺具有降解作用的菌株来发酵黄酒,目前已报道多种能分泌胺类氧化酶的乳酸菌,如沙克乳酸杆菌(Lactobacillus sakei)、植物乳杆菌(Lactobacillus plantarum)、干酪乳杆菌(Lactobacillus casei)等[47]。魏晓璐等[48-53]研究均表明,从黄酒发酵过程中筛选出的某些植物乳杆菌(Lactobacillus plantarum),可产生胺氧化酶,对发酵醪中的生物胺具有降解作用,这些菌可以作为降低发酵食品中生物胺的备选功能菌,以提高发酵食品的安全性。
3.1.3 添加能抑制产生物胺菌株生长的外源功能性微生物
在发酵系统中,使用外源功能性微生物来调节生物胺含量是一种常见的方法。外源功能性微生物对生物胺生成的相关菌株有抑制作用,可以起到控制生物胺生成的作用。XIA X L等[54-55]研究表明,植物乳杆菌和木糖葡萄球菌以1∶2的比例添加到黄酒发酵醪时,乳酸菌和葡萄球菌属会抑制生物胺产生菌的生长,达到抑制生物胺形成的作用。邢旋等[56]从麦曲中筛选分离出不产生物胺的戊糖片球菌(Pediococcus pentosaceus),这种菌可以产生细菌素,细菌素是一类蛋白质或肽类物质,它们由某些细菌产生,具有一定的抗菌活性,能抑制多种产生物胺菌的生长繁殖,能减少黄酒生物胺的形成。郝淑月等[57]从黄酒麦曲中分离筛选Pontibacter beigonshangensis和戊糖片球菌(Pediococcus pentosaceus)M25。Pontibacter beigonshangensis能够诱导戊糖片球菌(Pediococcuspentosaceus)M25产生细菌素,对黄酒中某些产生物胺菌有抑制作用。Pontibacterbeigonshangensis和戊糖片球菌(Pediococcus pentosaceus)M25自身不产生物胺。Pontibacter beigonshangensis和戊糖片球菌(Pediococcus pentosaceus)M25制备强化功能曲来酿造黄酒,可使黄酒中的生物胺含量降低29.8%。
3.2 改进浸米工艺
传统工艺酿造黄酒过程中,首先进行浸米。一方面,浸米阶段常在露天敞口环境下进行,这会使环境中的部分的微生物进入米浆水中,其中包括产生物胺的菌;另一方面,较长的浸米时间会使大米中的糊粉层进入米浆水并随之进入发酵醪,糊粉层中含有的蛋白质可在相应酶的作用下分解为大量氨基酸。两方面都促使了生物胺的生成。据报道[48,50],浸米阶段是黄酒发酵醪中生物胺的主要来源,发酵醪中生物胺含量与浸米水和浸泡大米中生物胺含量均呈正相关(相关系数R2分别为0.83和0.92),且浸泡大米对发酵醪中总生物胺含量的方差贡献率为71.15%,表明控制浸米环节生物胺的积累是降低黄酒生物胺含量的一个有效途径。
在生产过程中可以通过改良浸米工艺来达到控制生物胺含量的作用,魏晓璐[48]采用不浸米的淋米蒸饭工艺进行蒸饭并添加4%的植物乳杆菌(Lactobacillus plantarum)扩配液进行降低黄酒生物胺含量的研究。结果表明,淋米且添加乳酸菌酿造工艺有效地降低了生物胺含量,增加了酯类物质含量,使得黄酒更加绵柔。该工艺可在一定程度上使米浆水的排放量减少,能耗及环境污染降低,具有一定的工业应用价值。
刘彩霞[50]开发了乳酸菌循环酸化浸米工艺,将植物乳杆菌以7.5%的比例添加至浸米初始阶段,浸米过程中形成了以植物乳杆菌为主导的微生物区系,使得浸米水中的生物胺含量降低了93.84%。将浸泡大米落料发酵后发现,相较于传统浸米,循环浸米酿制黄酒中生物胺含量降至1/12。该工艺具有一定的参考价值。
3.3 控制氨基酸含量
氨基酸作为合成生物胺的前体物质,对其含量进行控制,也可对生物胺含量起到一定的控制作用。黄酒发酵过程中氨基酸可由蛋白质水解产生,因此可以通过控制蛋白酶活性来达到控制氨基酸含量的目的。由PEP4基因编码的酵母蛋白酶A,是一种天冬氨酸蛋白酶,是酵母菌中重要的蛋白酶[58],在发酵后期,可水解蛋白质为生物胺的产生提供氨基酸。基于以上原理,GUO X W等[59]通过敲除黄酒酿造酵母PEP4基因来达到降生物胺含量的目的,结果发现,与野生型菌株相比,该敲除菌株的蛋白酶A活性和氨基酸浓度显著降低,生物胺产量从180.1 mg/L下降到134.2 mg/L,降低了25.5%,其中酪胺、尸胺和组胺质量浓度也分别下降了57.5%、24.6%和54.3%。研究结果为降低黄酒发酵过程中生物胺的产生提供了新策略。
值得注意的是,氨基酸同时也赋予黄酒丰富的营养物质,降低氨基酸含量的同时可能会影响黄酒的营养价值,因此,在发酵过程中,需以高质量黄酒生产为前提,平衡氨基酸和生物胺两者之间的关系。
4 生物胺的检测方法
4.1 高效液相色谱法
目前黄酒生物胺含量分析检测的主要手段是高效液相色谱法,它具有分析速度快、检测灵敏度高、定量分析准确等特点[61],是我国食品生物胺含量检测的标准方法[62]。由于黄酒成分复杂,直接检测会造成干扰,需对黄酒样品进行前处理。黄酒样品的前处理主要是提取、净化、衍生。常用的提取试剂有高氯酸[63]、盐酸[64]、三氯乙酸等[65]。净化是指清除提取液中不需要或有害的杂质,使生物胺得到纯化,其方法主要有液-液萃取、液-液微萃取、固相萃取[66]。由于高效液相色谱大多连接紫外或荧光检测器,而大部分生物胺没有荧光或紫外发色基团,因此常需要对样品中的生物胺进行衍生化处理后才能对其进行检测。丹磺酰氯是目前生物胺定性和定量分析中最为常用的一种衍生试剂,此外,还有苯甲酰氯、邻苯二甲醛、异硫氰酸苯酯等[67-69]。
HUANG K J等[69]采用超声辅助分散液-液微萃取结合高效液相色谱-荧光检测技术,对黄酒样品中章鱼胺、酪胺和苯乙胺三种生物胺进行了提取和测定。此方法有效提高了提取效率,并减少了有机溶剂消耗量。YE W等[70]采用盐析辅助液-液萃取结合高效液相色谱技术,测定了酒精饮料中生物胺的含量。传统液-液萃取的萃取剂为水和乙腈,该方法在水和乙腈的基础上加入了硫酸铵进行盐析反应,降低了萃取剂的浪费并且使样品中的杂质得到有效去除,方法回收率可达94.5%,能够较准确的检测生物胺含量。ZHANG Y等[71]采用固相萃取结合高效液相色谱技术,测定了黄酒中的生物胺的含量。使用绿洲MCX滤筒的固相萃取程序对所有生物胺显示出卓越的净化效率,并有效地消除了干扰。所得方法经过充分验证,显示出良好的检测限、准确度和精密度。综上所述,高效液相色谱法较为准确、稳定,能够达到生物胺定性和定量分析的要求。
4.2 薄层色谱法
薄层色谱法是一种微量、简便的检测方法,不需昂贵设备,可同时检测多个样品,它兼备了纸色谱和柱色谱的优点,适合小量样品的分离[72]。李燕君[72]优化并建立了一种薄层层析法,测定了黄酒中9种生物胺的含量,该方法的检出限0.125~5.000 μg/mL,定量限5~20 μg/mL,平均加标回收率88.4%~114.8%,相对标准偏差3.1%~9.8%。能达到与高效液相色谱相似的效果。生物胺定性、定量分析的薄层色谱方法学研究,对于后续开发和建立简便、快速、高通量的生物胺检测方法有一定价值。
4.3 液质联用法
高效液相色谱与质谱联用法不需要衍生化,灵敏度高,检测限低,分析时间短等优点[73],但检测成本高。王可利等[74]建立了测定黄酒中6种生物胺的液质联用法,提高了大批量样品检测前处理效率,同时解决了检测中出现的假阳性问题。在食品安全质量控制和研究要求方面,需要高灵敏度的检测方法,以检测出生物胺的细微变化。因此,液质联用法是检测低浓度生物胺最合适的方法[75]。
4.4 离子色谱法
离子色谱法是利用各离子之间对离子交换树脂亲和力具有差异的原理进行分离,可用于分析阴离子、阳离子、极性及部分弱极性的有机化合物。生物胺具有阳离子特性,因此,比较适合使用离子色谱法进行分离。史亚利[76]用亲水性很强的新型阳离子交换柱IonPac CS18+CG18柱作为分离柱,电导检测器对黄酒中七种生物胺进行了检测,该方法检测限低,适用于黄酒生物胺的检测。与柱前衍生的高效液相色谱法相比,离子色谱法不需要对样品中的生物胺进行衍生处理,避免了衍生反应造成的副产物干扰,缩短了分析时间,提高了检测分析的准确度和稳定性。然而,离子色谱法需要使用较为大型、昂贵的离子色谱仪,成本较高,且携带不便,难以实现现场快速检测。
4.5 毛细管电泳法
毛细管电泳是一种以毛细管为分离通道、以高压直流电场为驱动力的新型液相分离技术,是测定食品中生物胺的较好方法。该技术快速、高效、试剂消耗低,且迁移时间低于液相色谱,但与其他检测方法相比灵敏度较低[77]。KOVÁCS A等[78]采用胶束电动毛细管电泳分离,紫外检测器检测葡萄酒等食品中的7 种生物胺,结果显示该方法灵敏度高、分离时间短。CORTACERO R S等[79]建立了毛细管电泳法测定啤酒中10 种生物胺含量的检测方法,该方法酒类生物胺的检测中具有良好的效果,而且操作简单,已在啤酒中生物胺的检测中得到广泛应用。
4.6 酶联免疫法
酶联免疫法是一种准确、灵敏、具有良好标准化潜力的检测方法[80]。免疫识别原理是将生物胺作为抗原,利用生物识别元素与抗原结合后进行含量检测。常用的生物识别元素有抗体、核酸适配体、肽、分子印迹聚合物等[81]。袁利鹏等[82]将组胺衍生化,制备出可特异性识别组胺衍生物的抗体,然后利用间接竞争酶联免疫吸附法测定鱼、虾和贝类中组胺含量。结果表明,该方法的检出限为0.1 ng/mL,回收率为98.9%~130.1%。该方法可以实现现场检测,具有一定的应用价值。
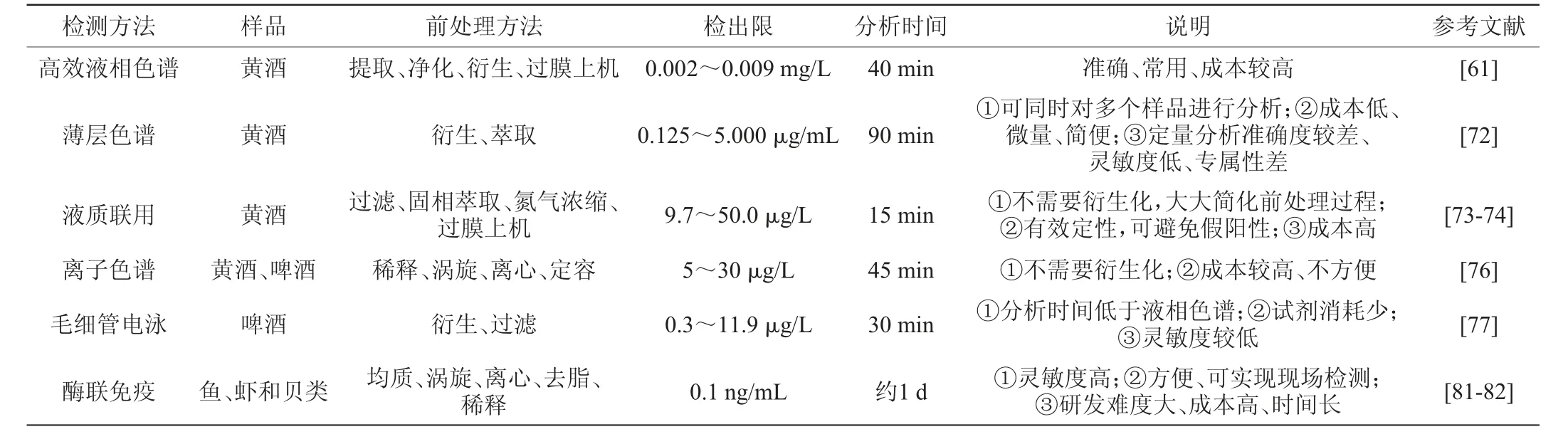
表2 生物胺常用检测方法Table 2 Common detection methods of biogenic amines
5 小结与展望
黄酒作为我国的传统发酵酒,其市场前景广阔。生物胺作为其中的生物安全风险性物质,仍有许多问题值得探讨:①目前我国还没有关于黄酒中生物胺的限量标准,需在这方面开展系统研究。通过对大批量黄酒样品的检测分析,并结合生物胺毒性阈值等相关研究,评估生物胺的可能摄入风险性,建立相关的法律法规;②目前对黄酒中生物胺的形成机理研究尚未深入,对生物胺产生菌还未有效了解,需加大该方面的研究,为控制黄酒生物胺含量提供更多思路;③黄酒生产企业应重视黄酒生产管理,提高质量和安全性;④高校及研究机构应加大对黄酒检测方法的研究,对现有的检测方法进行改进,建立准确、快速、高通量的生物胺检测方法,保障黄酒食用品质和安全性。
