蒽环类药物致心脏毒性潜在的生物标志物研究
2022-04-13赵恒谭琦杜晓宇谷泽慧王亚帝
赵恒 谭琦 杜晓宇 谷泽慧 王亚帝
(1.锦州医科大学第三临床学院,辽宁 锦州 121000; 2.锦州医科大学附属第三医院病理科,辽宁 锦州 121000;3.锦州医科大学附属第三医院精准医学科,辽宁 锦州121000)
乳腺癌以蒽环类药物(阿霉素、表阿霉素和吡南阿霉素等)为基础的联合治疗通常是一线治疗的标准方案,其疗效确切,不可或缺,但常由于心脏毒性副作用的产生,使患者不得不中止蒽环类药物的使用,从而影响乳腺癌的治疗效果[1]。通过临床研究和实践观察发现,心脏毒性作为蒽环类药物最严重的毒副作用,往往呈现进展性和不可逆性,特别是初次使用蒽环类药物的乳腺癌患者就可能造成其心脏损伤[2]。目前对于此类患者缺乏较好的治疗策略,而如今的诊断手段和治疗水平也不能有效地降低该类患者心脏损伤的发生率,究其原因主要在于蒽环类药物导致的心脏毒性是多因素和多步骤的复杂过程,目前的研究尚不足以完全揭示其发生和发展机制。所以寻求早期特异性诊断指标及有效判断预后的方法显得尤为重要。
本研究通过对蒽环类药物所致乳腺癌患者产生心脏毒性的微阵列芯片表达数据集进行差异分析,获得乳腺癌经蒽环类药物化疗后所致心脏毒性相关差异表达基因,通过生物信息学预测其相关的靶向微小RNA(microRNA,miRNA)并加以验证,从分子层面阐述miRNA在蒽环类药物致心脏毒性过程中发挥的生物学功能及主要作用机制,对全面分析蒽环类药物致心脏毒性的相关作用机制提供了理论基础。
1 材料与方法
1.1 数据挖掘与分析
GEO数据库挖掘与芯片数据集获取:从美国国家生物技术信息中心的GEO数据库(http://www.ncbi.nlm.nih.gov/geo/)进行芯片样本筛选(登录号GSE76314),芯片通过使用阿霉素诱导乳腺癌患者的特异性人诱导多能干细胞源性心肌细胞(hiPSC-CMs)重现个人对阿霉素引起的心脏毒性过程中信使RNA(messenger RNA,mRNA)的不同表达情况进行研究,从分子角度解释乳腺癌患者使用阿霉素引起心脏毒性过程的机制。该研究使用1 μmol阿霉素诱导6例乳腺癌患者的hiPSC-CMs细胞24 h,检测其mRNA的差异表达情况。对于每一个样本,所有探针的基因表达值简化为一个相对确定的平均基因表达值。而后估算缺失数据以及进行四分位的数据规范化。为避免多测试问题所导致的假阳性结果,应用本杰明·霍赫贝格法来修正原发P值为错误发现率,错误发现率<0.05为临界点。
1.2 基因本体分析
基因本体(gene ontology,GO)分析用来生成一个动态的受控词汇(字符表)应用于所有的真核生物基因组研究中。GO分析常用于研究和分析大规模的基因组和转录组数据,差异表达基因数据根据表达趋势的不同被分为上调和下调组,然后使用基因集执行分析工具包进行GO分析。以P<0.05为差异有统计学意义。
1.3 京都基因和基因组百科全书信号通路富集分析
对于差异表达基因的功能注释,京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路的富集表达使用KAAS界定。以P<0.05为差异有统计学意义。
1.4 明显差异表达基因的靶向miRNA预测
使用TargetScan 7.2(http://www.targetscan.org/vert_72/)和miRanda(http://www.miranda.org/) 对明显差异表达基因的靶向miRNA进行预测,为降低预测的假阳性率,对两个数据库结果取交集后进行后续筛选。
1.5 qPCR验证预测
使用0 μmol、5 μmol吡柔比星对人心肌细胞诱导24 h后,使用PCR仪进行扩增(94 ℃ 30 s,60 ℃ 15 s,72 ℃ 10 s,采集荧光信号40~45个循环),检测目标miRNA的相对表达量,采用2﹣△△CT表示,其中ΔΔCT=ΔCT(标准基因)-ΔCT(目的基因)。引物序列见表1。

表1 miR-1273g-3p引物序列
2 结果
2.1 差异表达基因及其生物学功能分析
通过对GSE76314数据集进行差异表达基因的分析及筛选,发现共有差异表达基因21 615个,其中上调表达基因9 814个,下调表达基因8 985个,无变化的基因2 816个。其中P<0.05的基因共有636个,上调表达基因287个,下调表达基因349个,界定|FC|>2为明显差异表达基因并列出,见表2和表3。

表2 表达上调的差异基因列表

表3 表达下调的差异基因列表
2.2 基因功能分析
对686个差异基因进行功能分析发现,这些基因的生物学进程主要集中在细胞-细胞黏附、对有毒物质的反应和脂质分解代谢过程等(图1);细胞组成主要包括:细胞质、核碎片和细胞-细胞黏附连接等(图2);分子功能主要富集于钙黏着蛋白结合、细胞黏附及磷脂结合等功能(图3)。
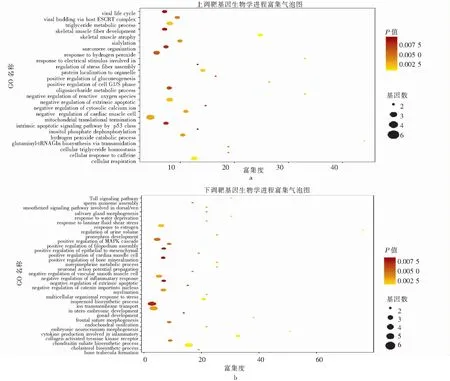
注:a为上调靶基因生物学进程富集图,b为下调靶基因生物学进程富集图。圆形大小代表该生物学进程中富集基因占比量,圆形越大代表富集的基因越多;颜色代表P值大小,颜色越黄代表P值越小。

注:a为上调靶基因细胞组成富集图,b为下调靶基因细胞组成富集图。圆形大小代表该细胞组成中富集基因占比量,圆形越大代表富集的基因越多;颜色代表P值大小,颜色越黄代表P值越小。
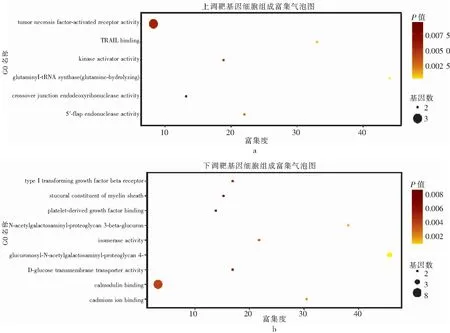
注:a为上调靶基因分子功能富集图,b为下调靶基因分子功能富集图。圆形大小代表富集基因占比量,圆形越大代表富集基因越多;颜色代表P值大小,颜色越黄代表P值越小。
2.3 信号通路分析
通过KEGG信号通路富集发现,表达上调的靶基因主要富集在色氨酸代谢、PPAR信号通路、范科尼贫血通路、氨酰tRNA生物合成、p53信号通路、脂肪细胞脂解的调控和哺乳动物的寿命调节途径等。表达下调的靶基因主要富集在萜类主链生物合成,甾体生物合成,硫酸软骨素/硫酸皮肤素的糖胺聚糖生物合成,细胞外基质受体相互作用,酮体的合成与降解,糖尿病并发症中的AGE-RAGE信号通路,缬氨酸、亮氨酸和异亮氨酸降解,黏着斑信号通路和N-聚糖生物合成等(图4)。

注:a为上调靶基因信号通路富集图,b为下调靶基因信号通路富集图。圆形大小代表该通路中富集基因占比量,圆形越大代表富集基因越多;颜色代表P值大小,颜色越黄代表P值越小。
2.4 差异基因的miRNA预测
使用miRanda、TargetScan 7.2数据库对选出显著上调[SNORD97、CSRP3、ANGPTL4、PDK4、金属硫蛋白1F(MT1F)、SLC25A48、MYLK3、EDA2R、TNFRSF10C和TECRL]和下调的基因[EPAS1、PDLIM2、ACAT2、S期激酶相关蛋白2(SKP2)、C5orf46、KIAA1199和OSR1]进行靶向miRNA预测,纳入Score>170,Energe<-30的miRNA进行后续研究,发现miR-1273g-3p是MT1F与SKP2的共同靶向miRNA,说明miR-1273g-3p可能在蒽环类药物致心肌毒性过程中发挥重要调控作用。详见表4和表5。
2.5 hsa-miR-1273g-3p验证
qPCR结果显示,与正常对照组相比,人心肌细胞经过吡柔比星诱导后,细胞中miR-1273g-3p表达明显上升(P<0.05)(图5)。
3 讨论
蒽环类药物作为乳腺癌、消化道肿瘤和淋巴瘤等实体恶性肿瘤联合治疗的一线治疗方案药物,常由于心脏毒性副作用的产生,使患者不得不终止对蒽环类药物的使用,从而影响治疗效果[1]。
目前,蒽环类药物所致心脏毒性的具体机制尚未完全明了,现有的证据表明其主要机制可能与蒽环类药物作用人体后所产生的自由基密切相关,大量自由基的产生可导致心肌细胞膜脂质过氧化和心肌线粒体DNA的损伤[3-6]。其他机制包括:药物毒性代谢产物的形成、核苷酸及蛋白质合成的抑制、血管活性胺的释放以及影响特异性基因的表达等[7-8]。新近的研究发现,miRNA与调节心脏的生长发育、机械重构和电重构等过程密切相关,并与心脏疾病也有密切关系[9]。例如,在心肌中由于应激作用,miRNA-21表达水平可明显升高,进而通过靶向抑制Ras/MEK/ERK信号通路的抑制因子萌芽RTK信号拮抗剂1(SPRY1)的表达,从而激活胞外ERK/MAPK信号通路,导致成纤维细胞增殖和心肌间质纤维化[10]。同样,Terentyev等[11]的研究表明,miRNA-1还可通过作用于蛋白磷酸酶2调节心肌细胞膜L2型钙通道以及导致肌质网兰尼碱受体2活化的Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ磷酸化,从而增加Ca2+的释放,加速心律失常的发生。杨宝峰等[12]应用特异性miRNA转基因小鼠模型,通过功能获得与功能缺失等方法研究miRNA在心肌纤维化中的作用,发现该miRNA可直接靶向转化生长因子-β受体,促进Ⅰ型与Ⅱ型受体复合物的形成并激活转化生长因子-β信号通路后诱导胶原分泌量增加,而反义寡核苷酸可消除该作用。

表4 表达上调的差异基因miRNA预测

表5 表达下调的差异基因miRNA预测

注:CON为正常对照组,THP为吡柔比星组;∗表示与CON组比较,P<0.05。
本研究利用GEO数据库中的GSE76314基因芯片原始数据,并使用软件包分析差异表达的mRNA,分析显示,对hiPSC-CMs使用1 μmol阿霉素诱导24 h后,有明显差异表达基因17个,其中上调基因10个,下调基因7个。对这些基因进行靶向miRNA预测发现,上调mRNA中MT1F和下调mRNA中的SKP2具有相同靶向miRNA,即miR-1273g-3p,说明miR-1273g-3p可能为参与蒽环类药物所致心脏毒性产生过程中的核心miRNA。目前针对miR-1273g-3p的研究主要集中在肿瘤方向,例如Mazza等[13]发现,血浆中高表达的miR-1273g-3p在胰腺癌中可作为候选致癌miRNA,且与胰腺癌的分期密切相关。Guo等[14]通过研究发现,乳腺导管癌患者血浆中miR-1273g-3p表达水平显著高于健康人,且在早期乳腺导管癌中具有一定诊断效力。上述研究提示miR-1273g-3p与肿瘤的发生和发展密切相关,但miR-1273g-3p在心脏疾病领域仍未见系统性研究,那么miR-1273g-3p是通过何种途径调控MT1F和SKP2,进而对心脏疾病产生影响的呢?
首先,通过对miR-1273g-3p的靶基因进行生物学功能和信号通路富集分析,发现其主要参与细胞-细胞黏附、对有毒物质的反应和脂质分解代谢等过程,KEGG信号通路富集发现,这些靶基因主要通过影响PPAR、p53等信号通路发挥生物学功能。最终,笔者预测出miR-1273g-3p可通过上调MT1F在蒽环类所致心脏毒性过程中产生重要作用。MT1F基因属于金属硫蛋白家族主要成员之一,其表达与炎症、应激、重金属解毒和必需微量元素稳态有关[15-16]。Alonso-Herranz等[17]发现,心肌梗死后7 d内金属硫蛋白1表达明显升高,进而调控基质金属蛋白酶1激活转化生长因子-β通路,最终导致心肌梗死后的心肌纤维化和不良重构发生。同时,miR-1273g-3p还可下调SKP2,而SKP2是调控细胞周期进程的关键因子[18]。目前相关研究认为SKP2的表达与肿瘤关系密切[19-20],还参与中枢神经系统[21]、循环系统机械性损伤和修复过程。Tamamori-Adachi等[22]通过对Wistar大鼠进行冠状动脉结扎构建大鼠缺血再灌注损伤模型,随后过表达/沉默大鼠体内的SKP2基因后发现,大鼠体内过表达的SKP2可显著改善左心室功能,促进心肌缺血后心功能的改善。另有研究[23]发现,高表达的SKP2可通过调控哺乳动物雷帕霉素靶蛋白信号通路抑制心肌细胞自噬与心肌肥大的产生。在乙醇所致的心脏收缩功能障碍中,心脏经乙醇刺激后通过促进单磷酸腺苷活化蛋白激酶磷酸化,抑制下游基因SKP2的表达,从而促进心肌细胞自噬[24]。然而SKP2在蒽环类药物所致的心肌损伤中鲜有报道。本文通过验证miR-1273g-3p在蒽环类药物所致心脏毒性中的表达情况,发现吡柔比星诱导心肌损伤组中miR-1273g-3p表达水平明显高于对照组。推测在蒽环类药物所致心脏毒性产生的过程中,miR-1273g-3p过表达可上调MT1F,下调SKP2,该过程的发生可能与有毒物质反应和心肌细胞增殖有关。
总之,本研究利用生物信息学技术筛选出乳腺癌患者蒽环类药物致心脏毒性相关差异表达mRNA,分析了其生物学功能和调控通路,并针对明显差异表达mRNA预测出具有核心功能的miR-1273g-3p,为后期实验研究提供数据和基础,但miR-1273g-3p能否通过调控SKP2和MT1F实现心脏保护作用尚需进一步研究。
