小麦转录因子TaWRKY28基因克隆与抗旱性分析
2022-04-13于永昂睢晓湉张夏冰
于永昂,睢晓湉,张 蕾,张夏冰
(河南科技学院 生命科技学院 现代生物育种河南省协同创新中心,河南 新乡 453003)
转录因子调控是维持细胞基因调控完整性的基本步骤,在植物生长发育、抵御生物胁迫和非生物胁迫中起着至关重要的作用[1-3]。植物在生长过程中会受到生物胁迫(病原菌侵入、病虫害等)和非生物胁迫(高温、高盐、干旱等)的影响,从而抑制其生长发育,造成各种作物质量、产量的下降,给人类生产带来极大危害[4-5]。当受到逆境胁迫时,植物胞外的信号(高温、高盐、干旱、病原菌等)通过一系列信号转导途径级联放大进入植物细胞核内,通过与其他防御相关蛋白的相互作用,激活或抑制下游相关防御基因的转录,从而响应植物对相关逆境胁迫的应答反应。转录因子MYC(myelocytomatosis)、NAC(NAM、ATAF1/2和CUC1/2)、ERF(ethylene responsive factor)、bZIP(basic region/leucine zipper)、WRKY 等在这一系列调控中起到非常重要的作用。其中,WRKY是植物中特有的一类转录因子[6]。WRKY最先从甘薯中分离[7],目前至少20种植物中发现转录因子WRKY,其可以参与生物和非生物胁迫的应答响应,如植物生长、发育、代谢、环境信号刺激及对病原菌的防御反应和抗病途径调控等重要的生物发育过程[8]。最典型的特点是其N端含有DNA结合区域,该区域高度保守,由约60个氨基酸组成WRKY结构域;C端具有Cys(2)-His(2)或Cys(2)-HisCys的锌指结构[9-10]。拟南芥AtWRKY25/26受到高盐、高温及渗透胁迫的诱导[11],AtWRKY57能通过激活与ABA相关基因的表达增强拟南芥的耐干旱能力[12]。将玉米ZmWRKY40基因转入拟南芥中,发现过表达拟南芥的过氧化物酶(POD)和 CAT活性提高, 活性氧(ROS)含量降低,进而增强了转基因株系的抗旱性,进一步分析发现ZmWRKY40基因表达受到干旱、盐害、高温和ABA诱导[13]。Zhu[14]等研究发现,葡萄VvWRKY30基因的表达受盐胁迫诱导,能够增强转基因植株对NaCl的抗性。研究表明,普通小麦基因组中至少含有200个WRKY基因[15],但目前仅有少数成员的功能被鉴定,其中TaWRKY10、TaWRKY44参与多种非生物胁迫逆境的应答,过表达能够增强植物的抗旱性[16]。Niu等[17]在小麦cDNA文库中发现了43个WRKY转录因子,其中TaWRKY2受干旱、盐和 ABA诱导表达,过表达TaWRKY2能提高转基因拟南芥的抗旱性和耐盐性。He等[18]研究发现,小麦TaWRKY1和TaWRKY33能够激活下游胁迫相关基因的表达,脱水处理时TaWRKY1和TaWRKY33转基因拟南芥脱水率较对照降低,且TaWRKY33还可以响应高温胁迫。虽然目前在小麦中已有多个WRKY转录因子报道,但与模式植物拟南芥和水稻相比,其抗逆性机理还不十分清楚。
为此,本研究从小麦百农207叶片中分离鉴定了TaWRKY28基因,利用生物信息学工具对其编码蛋白的理化特性进行系统分析;采用qRT-PCR技术分析NaCl、ABA、H2O2、干旱和低温等非生物逆境胁迫下TaWRKY28基因的表达水平,通过农杆菌浸染法将TaWRKY28转化至模式植物拟南芥,研究模式植物生理指标及其功能,为进一步探究TaWRKY28基因在非生物胁迫应答中的功能奠定基础。
1 材料与方法
1.1 试验材料
本试验所用材料为普通小麦品种百农207,由河南科技学院小麦遗传改良中心保存。挑取饱满一致的小麦种子置培养皿滤纸上萌发,培养条件为温度25 ℃、光照16/8 h(昼/夜),相对湿度75%,至三叶一心期取长势一致的小麦幼苗分别进行NaCl(100 mmol/L)、ABA(100 μmol/L)、H2O2(100 μmol/L) 、干旱(6% PEG-6000)和低温(4 ℃)处理,处理0,2,4,6,8和12 h后,取小麦幼苗叶片,并以正常生长幼苗为对照,将处理后样品在液氮中速冻后置于-80 ℃保存,用于分析目标基因逆境胁迫条件下的表达模式。取正常生长的小麦根、茎、叶、雌蕊和雄蕊,于-80 ℃保存,用于目标基因的组织表达模式分析。
1.2 试验方法
1.2.1 总RNA提取与cDNA合成 小麦总RNA的提取采用TIANGEN公司试剂盒, 按照TIANGEN公司提供的反转录试剂盒说明书进行cDNA第一链合成,并于-20 ℃保存备用。
1.2.2TaWRKY28基因克隆 根据小麦WRKY28基因序列(GenBank登录号:AK456622),设计用于PCR扩增的特异性引物TaWRKY28-F和TaWRKY28-R(表1)。以小麦正常生长叶片c-DNA为模板进行PCR扩增。PCR反应程序:94 ℃预变性3 min;94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸40 s,35个循环。回收纯化后,用pMD19-T载体连接目的片段,并转化大肠杆菌感受态细胞DH5α,随后挑取阳性克隆送华大基因公司测序。

表1 本研究所用引物序列
1.2.3 TaWRKY28生物信息学分析 利用ProtParam(ExPASy)在线分析软件分析TaWRKY28蛋白的理化性质,利用SOPMA和SWISS-MODEL预测蛋白的二级和三级结构,通过PlantCARE(http://bioinformatics.Psb.Ugent.be/webtools/plant-care/html/)网站预测顺式作用元件,通过Blast进行基因序列同源性比对分析,利用Clustral W和DNAMAN软件对氨基酸序列进行比对与分析,采用Mega 5.0软件Neighbor-Joining构建系统发育进化树。
1.2.4 TaWRKY28亚细胞定位 根据克隆得到的TaWRKY28基因序列设计引物GFP-TaWRKY28-F和GFP-TaWRKY28-R(表1),扩增带有酶切位点(XbaⅠ和BamH Ⅰ)TaWRKY28的ORF全长,PCR产物经XbaⅠ和BamH Ⅰ双酶切,与相同酶切的pBI121-GFP载体经T4连接酶连接后转化大肠杆菌DH5α感受态细胞,涂板挑斑进行PCR鉴定,挑选阳性菌液抽提质粒后进行酶切鉴定,将酶切鉴定成功的质粒送华大基因公司测序,将测序正确的质粒,命名为pBI121-TaWRKY28-GFP。将构建好的载体以及空载体pBI121-GFP转化农杆菌 GV3101后浸染洋葱表皮细胞,48 h后置于载玻片上,在激光共聚焦显微镜下观察。
1.2.5TaWRKY28基因的表达 为了研究TaWRKY的组织表达和逆境胁迫下的表达模式,按照试剂盒说明书提取1.1节中保存的小麦不同组织(根、茎、叶、雌蕊和雄蕊)及不同胁迫(NaCl,ABA,H2O2,干旱和低温)处理不同时间(0,2,4,6,8,12 h)的小麦总RNA,反转录合成cDNA。根据克隆的TaWRKY28基因序列设计荧光定量PCR引物qRT-TaWRKY28-F和qRT-TaWRKY28-R(表1),以小麦Actin为内参基因进行实时荧光定量PCR分析。用UltraSYBR Mixture(with ROX)试剂盒(康为世纪)进行qRT-PCR分析。反应体系:2×UltraSYBR混合液10 μL,上下游引物各0.4 μL,cDNA 2 μL,加水补足20 μL。扩增程序:95 ℃预变性10 min;95 ℃ 15 s,60 ℃ 1 min,40个循环。采用2-ΔΔCt法进行定量数据分析。
1.2.6TaWRKY28转基因拟南芥的获得 以TaWRKY28基因序列为模板,OE-TaWRKY28-F和OE-TaWRKY28-R(表1)为引物进行目的基因PCR扩增。将PCR产物与pCAMBIA1301载体(酶切位点为XbaⅠ和BamH Ⅰ)连接转化大肠杆菌 DH5α感受态细胞,筛选阳性克隆后提取质粒,转化农杆菌GV3101,菌落PCR鉴定后扩大培养。采用浸染法对野生型拟南芥Col-0进行转化,经潮霉素抗性筛选后收获单株,同样的方法继续筛选直至T3,该株系即为纯合转基因株系。
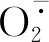
2 结果与分析
2.1 TaWRKY28基因克隆
以正常生长小麦幼苗叶片cDNA为模板进行
PCR扩增,扩增结果如图1所示。由图1可以看出,在1 000 bp左右处可见一条清晰的条带。切胶回收后连接pMD19-T 载体,转化产物经过菌落PCR筛选阳性克隆,对鉴定的阳性克隆进行测序。

M.DL5000 Marker;1.TaWRKY28基因
2.2 TaWRKY28生物信息学分析
生物信息学验证发现,获得的TaWRKY28基因片段长度为1 004 bp,ORF为978 bp,编码325个氨基酸(图2)。

图2 TaWRKY28基因核苷酸序列及其推导的氨基酸序列
预测该蛋白等电点为9.27,相对分子质量为34.87 ku,不稳定系数为47.25,属于不稳定蛋白。在组成TaWRKY28蛋白的所有氨基酸中,丙氨酸(Ala)比例最高,为总氨基酸量的13.5%;异亮氨酸(lle)和色氨酸(Trp)比例最低,分别为总氨基酸量的0.9%和0.6%;其含有35个负电性氨基酸残基(Asp+Glu),44个正电性氨基酸残基(Arg+Lys);脂肪族氨基酸指数68.31。ProtParam在线软件分析该蛋白的平均疏水指数为-0.541,为疏水性蛋白。
通过Blastp工具查找TaWRKY28蛋白的同源氨基酸序列,选取6个不同物种的WRKY氨基酸序列,分别为二穗短柄草(Brachypodiumdistachyon,XP_003563320)、水稻(Oryzasativa,DAA05093)、玉米(Zeamays,XP_008659853)、大麦(Hordeumvulgare,AGM37860)、高粱(Sorghumbicolor,XP_002437362)和谷子(Setariaitalica,XP_004965726),利用DNAMAN软件将TaWRKY28与其他物种氨基酸序列进行同源比对,发现该蛋白序列含有WRKY家族典型的WRKYGQK结构域,同时含有1个C2H2锌指结构域,因此属于Ⅱ型WRKY转录因子(图 3)。系统进化树分析结果(图4)表明,小麦TaWRKY28与大麦HvWRKY2在同一分支上且遗传距离较近,与玉米ZmWRKY1和毛白杨PtWRKY7的遗传距离较远。

图3 TaWRKY28与其他物种WRKY蛋白序列多重比较结果
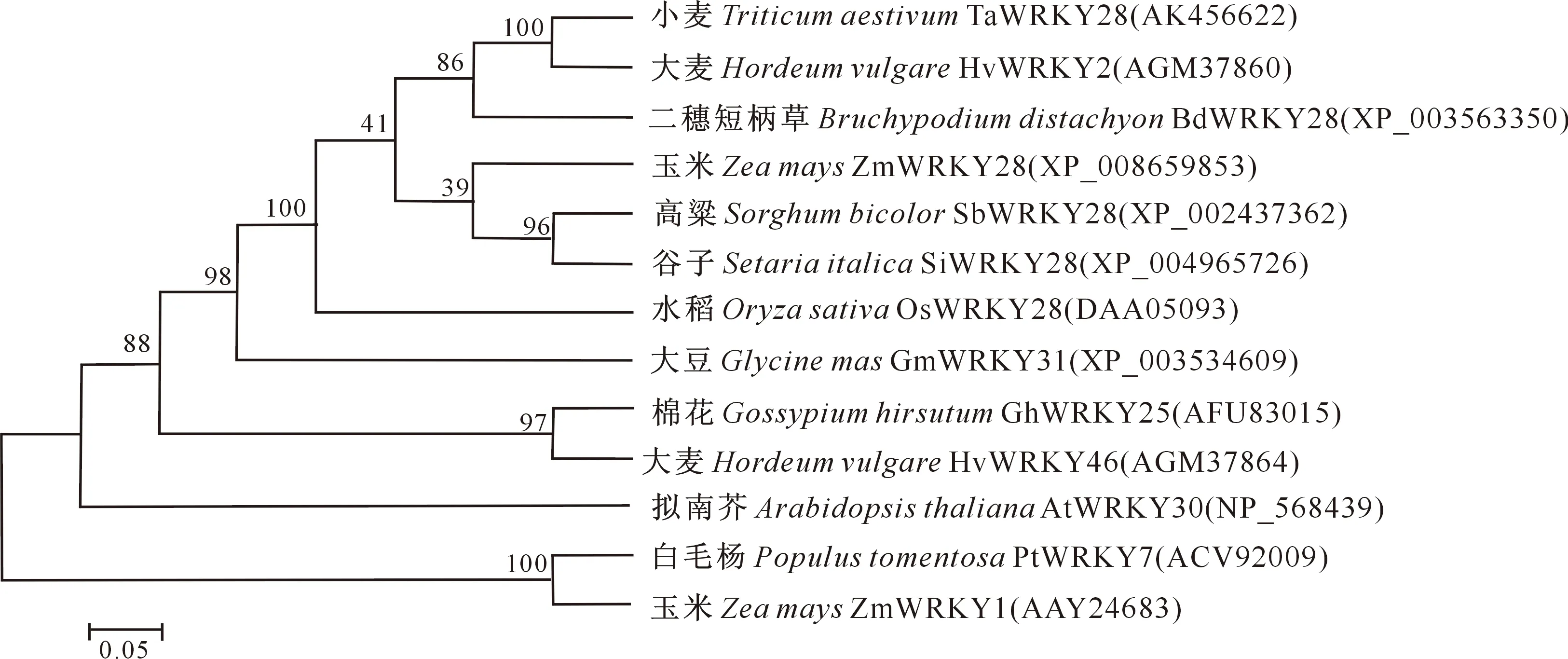
图4 TaWRKY28与其他植物同源WRKY蛋白的系统进化树分析
2.3 TaWRKY28蛋白亚细胞定位
构建pBI121-TaWRKY28-GFP载体,采用农杆菌介导的浸染方法将其转化到洋葱表皮细胞中,同时用转化不含目的基因的空载体pBI121-GFP作为对照,在激光共聚焦显微镜下观察发现,空载体pBI121-GFP在洋葱表皮细胞的细胞膜和细胞核都有绿色荧光,而pBI121-TaWRKY28-GFP只在洋葱表皮细胞的细胞核内有绿色荧光,表明TaWRKY28基因编码蛋白定位于细胞核(图5)。

图5 TaWRKY28蛋白亚细胞定位
2.4 TaWRKY28基因的表达分析
qRT-PCR分析结果(图6)表明,在正常生长小麦的根、茎、叶、雄蕊和雌蕊中均可检测到TaWRKY28的表达,但不同组织表达程度不同。其中,TaWRKY28在叶中相对表达量最高,雄蕊中次之,雌蕊中表达量最低,且TaWRKY28在叶片和雄蕊中的相对表达量显著高于其他组织。
*表示在 0.05 水平下组织间差异显著
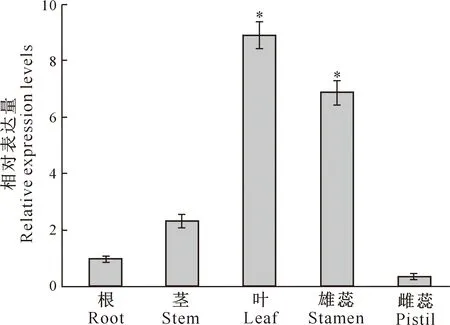
从图7可知,所有胁迫处理下,TaWRKY28的相对表达量均随胁迫时间的延长呈先上升后下降的变化趋势,只是不同处理相对表达量的最高点出现时间不同而已。在NaCl和ABA胁迫处理下,均在处理4 h时TaWRKY28的相对表达量达到最高;H2O2胁迫处理6 h时相对表达量达到最高值;低温处理4 h时相对表达量达到最高值;干旱处理2 h时TaWRKY28基因表达量最高,而在8 h时后表达量明显降低。
*与**分别表示同一处理不同处理时间在0.05和0.01水平下差异显著。下同
2.5 转基因拟南芥的表达量分析
qRT-PCR结果(图8)表明,与野生型(WT)相比,6个转基因拟南芥株系(L1、L2、L3、L4、L5和L6)的相对表达量均极显著提高,其中L1、L3、L6相对表达量更高。
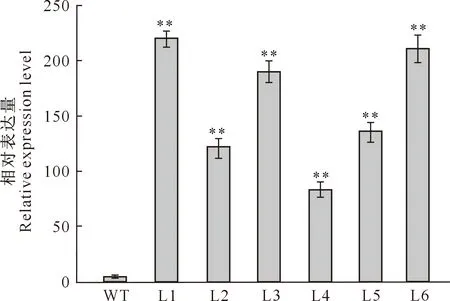
图8 转基因拟南芥植株TaWRKY28基因的相对表达量
2.6 转基因拟南芥耐旱性鉴定


A.转TaWRKY28基因拟南芥植株和野生型(WT)干旱胁迫表型;B.干旱胁迫后转基因拟南芥植株和野生型(WT)拟南芥植株叶片的DAB和NBT染色结果
由图10可以看出,在正常情况下,野生型拟南芥和转基因拟南芥株系SOD和POD活性无明显差异;干旱胁迫处理21 d后,转基因拟南芥株系SOD和POD活性均极显著高于野生型拟南芥(图10-A-B)。这表明过表达TaWRKY28基因能够提高拟南芥保护酶活性,进而增强拟南芥植株抗氧化能力。在正常情况下,野生型拟南芥和转基因拟南芥株系H2O2、脯氨酸和丙二醛(MDA)含量均无明显差异;干旱胁迫21 d后,转基因拟南芥株系H2O2和MDA含量极显著和显著低于野生型植株,而脯氨酸含量极显著高于野生型拟南芥(图10-C-E)。
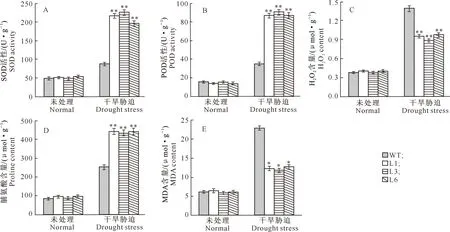
图10 转TaWRKY28基因拟南芥植株生理指标分析
3 讨 论

综上所述,本研究采用RT-PCR成功分离得到能够响应干旱胁迫的小麦TaWRKY28基因,过表达该基因能够提高转基因拟南芥植株的抗旱能力,为进一步利用该基因提高小麦抗旱性奠定了理论基础。
