斜外侧椎间融合术治疗单节段非特异性腰椎间隙感染的临床疗效分析
2022-04-13陈志达宋超林斌蔡弢艺蒋元杰涂承权黄锡明胡晓阳
陈志达 宋超 林斌 蔡弢艺 蒋元杰 涂承权 黄锡明 胡晓阳
非特异性腰椎间隙感染,又称化脓性腰椎间盘炎或化脓性腰椎间隙感染,其病原体主要为金黄色葡萄球菌、溶血型链球菌、沙门菌和假单胞菌等[1-2]。由于人口老龄化、艾滋病毒、糖尿病、恶性肿瘤、类固醇激素的使用,脊柱手术以及多重耐药细菌的出现等使其发病率逐年攀升[3-4]。文献报道,抗生素治疗6 周对大多数非特异性腰椎间隙感染病人效果明显,但仍有10%~20%的病人可能因脊柱不稳定、椎管内脓肿、神经功能受损和保守治疗失败须行手术治疗[5-6]。外科干预的目的是清除感染灶,恢复脊柱稳定,解除神经根或脊髓压迫,具体手术方案可分为微创手术和开放手术,前者如经皮内镜椎间盘切除引流术、CT 引导下经皮穿刺引流术等,后者如前路清创融合术、后路清创引流内固定术以及前后路联合手术等,但对于治疗方案的选择目前并没有达成共识。斜外侧椎间融合术(oblique lumbar interbody fusion,OLIF)作为一项较新的微创技术,由于其创伤小、出血少、住院时间短、融合率高等众多优势,目前已被广泛应用于各类腰椎退行性疾病[7]。我院2014年1月至2018年11月采用OLIF单一切口完成病灶清创、髂骨植骨、侧方螺钉内固定治疗32 例单节段非特异性腰椎间隙感染病人,本研究旨在探讨其临床疗效。
资料与方法
一、纳入标准与排除标准
纳入标准:①诊断为单节段非特异性腰椎间隙感染;②抗生素使用6周及以上无效,病程仍在持续或进展;③行OLIF入路前方病灶清创、髂骨植入、侧方螺钉固定术;④随访资料齐全。
排除标准:①诊断为多节段腰椎间隙感染;②单一节段特异性腰椎间隙感染;③因腰椎手术等其他原因导致的继发性感染;④行其他外科治疗;⑤重度骨质疏松及严重肥胖。
二、一般资料
共纳入32 例单节段非特异性腰椎间隙感染病人,其中男21例,女11例,年龄为(59.0±1.9)岁(38~78 岁)。感染节段L1/22 例,L2/37 例,L3/413 例,L4/510例。所有病人均在医师指导下进行至少6周的经验性抗生素治疗,抗生素使用时间为(6.8±0.9)周。所有病人均有明显的腰痛,10例病人合并不同程度的发热,其中8 例合并腰肌无力,4 例合并下肢疼痛或麻木,2 例合并双下肢感觉肌力明显减退。病人入院前均无腰背部有创操作及手术相关既往史。术前神经功能美国脊髓损伤协会(American Spinal Injury Association,ASIA)分级C级2例,D级4例,E级26例。根据Pola等[8]提出的椎间隙感染分型:A.3型3例,A.4型1例,B.1型13例,B.2型7例,B.3型2例,C.1型6例。术前共有10例病人行CT引导下穿刺标本细菌培养,检出6例阳性结果,分别为金黄色葡萄球菌5 例,铜绿假单胞菌1 例。术前白细胞(white blood cell,WBC)计数为(10.2±1.5)×109/L,C-反应蛋白(C-reactive protein,CRP)为(61.8±12.6)mg/L,红细胞沉降率(erythrocyte sedimentation rate,ESR)为(73.6±18.1)mm/h,降钙素原(procalcitonin,PCT)为(0.12±0.03)ng/mL。
三、手术方法
全麻后取右侧卧位,左髋弯曲放松腰大肌,腰下垫软枕。用“C”型臂X 线机透视确定责任椎间隙。贴保护膜,常规消毒、铺巾。在目标间盘中心前方3~4 cm 处,作平行于腹外斜肌走行的4 cm 长斜切口,依次切开皮肤、皮下筋膜,沿腹壁三层肌纤维走行逐层钝性分离肌层,手指推开腹膜外脂肪,探查并确认腰大肌前缘及与周边组织边界关系,用Cobb骨剥将腰大肌轻柔向背侧拉开,长柄直角拉钩置于大血管鞘下方,缓慢向前方拉开,使椎间隙暴露于视野下,配合吸引器吸出腰大肌周围渗出液或脓液,保证所有分离操作在干净的术野下进行。然后将导针插入责任椎间盘,再次透视确认无误后,置入工作通道。抽取术野脓液并钳取术中坏死椎间盘组织送病原学培养、药敏试验和病理学检查,仔细清除失活的椎间盘及感染性病变,用刮匙刮除累及的骨组织,直至到达正常骨质。清创范围由术前磁共振和术中直视下观察决定。清创区用过氧化氢溶液、聚维酮碘溶液和生理盐水反复冲洗数次,更换器械,量尺测量椎间缺损高度。从左髂前上棘位置作3 cm 长皮肤切口,骨凿凿取髂骨块,将凿取的三面皮质髂骨修剪成合适大小,植入缺损处进行椎间融合。在相邻椎体侧方分别固定两枚椎体螺钉,“C”型臂X 线机透视确定钉道位置满意,固定连接棒,再次冲洗伤口,切口内放置引流管,逐层闭合切口,无菌敷料覆盖。所有病人均由同一组医生完成手术。
四、术后处理及评价标准
根据病原学结果选择敏感抗生素抗感染2 周,部分病人病情较轻予出院后门诊输液。未获得病原学结果的病例,根据病理结果经验性使用头孢呋辛或喹诺酮类药物静脉滴注抗感染2 周,定期复查血常规、CRP、ESR、PCT 等指标,动态调整用药方案。术后第1 天指导病人在床上行双下肢功能锻炼,预防深静脉血栓形成。伤口引流量小于40 mL/d时,拔除切口引流管。拔管后复查腰椎X线片、三维CT等,确定植骨块和侧方螺钉位置以及矢状面平衡的改善情况。术后第3天在支具保护下下床活动,出院后继续佩戴胸腰椎支具不少于3个月。病人病情稳定出院后,继续口服敏感或广谱抗生素1个月以上,以腰痛症状明显缓解,没有发热症状,且连续3次复查血常规及炎症指标无明显异常后考虑停用抗生素。
记录病人手术时间、术中出血量、病原学培养结果、住院天数、随访时间。术后我院随访医生定期电话通知病人返院,病人每次返院随访时均重新进行抽血及拍片复查,门诊随访18~24个月。记录并比较术前、术后3个月、术后18个月的疼痛视觉模拟量表(visual analogue scale,VAS)评分、Oswestry功能障碍指数(Oswestry disability index,ODI)、WBC、CRP、ESR、PCT、整体腰椎前凸角(global lumbar lordosis angle,GLL)、椎间盘高度(disc space height,DSH)、局部腰椎前凸角(segmental lumbar lordosis angle,SLL),对病人进行疼痛、功能、检验及影像学评估,并统计神经功能恢复、椎间融合及并发症发生情况。
五、统计学分析
使用SPSS 20.0软件(IBM公司,美国)分析处理数据,计量资料按均数±标准差()表示,术前、术后3个月、术后18个月随访时各参数的比较采用方差分析,并行配对t检验作两两比较。检验水准α值取双侧0.05。
结 果
病人手术时间为(92.8±12.4)min,术中出血量为(108.5±32.9)mL。所有病人术中均取脓液或病灶组织培养,25 例病人培养检出阳性菌,其中19 例术中培养检出,6 例术中培养结果与术前穿刺培养结果一致。包括金黄色葡萄球菌10例,溶血性链球菌3例,大肠埃希菌3例,表皮葡萄球菌2例,白色葡萄球菌2例,铜绿假单胞菌2例,里昂葡萄球菌1例,肺炎克雷伯杆菌1例,波茨坦沙门菌1例。病理检查结果描述主要为骨组织变性坏死、炎细胞浸润、灶性坏死等。病人住院时间为(13.6±2.1)d(12~17 d),随访时间为(21.1±2.0)个月(18~24 个月)。术后18 个月随访时,仅1 例ASIA 分级D 级病人未完全恢复,余均恢复至E 级,所有病人未出现神经症状进一步加重或复发。所有病例末次随访时椎间均已骨性融合,均未出现手术相关并发症。
病人术后3个月、18个月随访时VAS评分、ODI均较术前降低,差异有统计学意义(P<0.05),疼痛及功能明显改善;术后3 个月、18 个月随访时炎症指标WBC、CRP、ESR、PCT与术前相比,差异有统计学意义(P<0.05),感染得到有效控制;术后3个月、18个月随访时GLL、DSH、SLL数值均较术前显著增大,差异有统计学意义(P<0.05),腰椎前凸角、椎间高度恢复详见表1。典型病例见图1、2。

图1 病人,女,56岁,诊断为L4/5椎间隙感染,Pola B.1型,为无节段不稳的破坏性椎间隙感染,病人反复发热,保守治疗无效,行斜外侧L4/5椎间清创植骨融合内固定术 a、b:术前腰椎正侧位X线片提示L4/5椎体骨质破坏;c、d:术前三维CT提示L4下终板和L5上终板破坏,周围软组织肿胀;e~g:术前MRI提示L4/5椎间隙破坏,椎旁软组织稍肿胀;h、i:术后第3天X线片提示L4/5 OLIF术后,椎间髂骨植骨,侧方螺钉内固定在位;j、k:术后第3天CT提示L4/5病灶清除髂骨植骨内固定术后改变,髂骨块位置良好,螺钉在位;l:术后病理提示送检组织中见增生变性的骨组织,纤维增生伴慢性化脓性炎;m~p:末次随访X线片及CT提示椎体间已完全骨性融合
表1 病人VAS评分、ODI、炎症指标、影像学参数比较(±s)
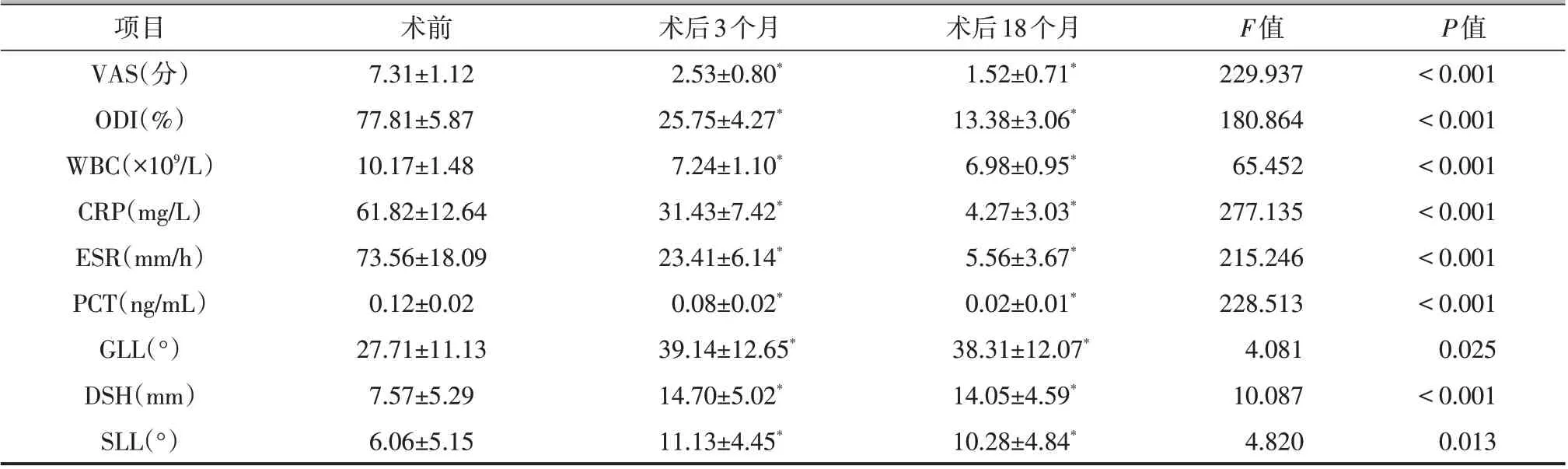
表1 病人VAS评分、ODI、炎症指标、影像学参数比较(±s)
注:与术前比较,*P<0.05
项目VAS(分)ODI(%)WBC(×109/L)CRP(mg/L)ESR(mm/h)PCT(ng/mL)GLL(°)DSH(mm)SLL(°)术前7.31±1.12 77.81±5.87 10.17±1.48 61.82±12.64 73.56±18.09 0.12±0.02 27.71±11.13 7.57±5.29 6.06±5.15术后3个月2.53±0.80*25.75±4.27*7.24±1.10*31.43±7.42*23.41±6.14*0.08±0.02*39.14±12.65*14.70±5.02*11.13±4.45*术后18个月1.52±0.71*13.38±3.06*6.98±0.95*4.27±3.03*5.56±3.67*0.02±0.01*38.31±12.07*14.05±4.59*10.28±4.84*F值229.937 180.864 65.452 277.135 215.246 228.513 4.081 10.087 4.820 P值<0.001<0.001<0.001<0.001<0.001<0.001 0.025<0.001 0.013
讨 论
一、非特异性腰椎间隙感染的手术治疗及OLIF入路技术要点
非特异性腰椎间隙感染是一种发病率较低且严重的脊柱疾病,病人常有严重的腰背痛和轻度发热。文献报道对感染早期病例明确诊断较为困难,延迟诊断往往会导致明显的骨质破坏、脊柱畸形、神经功能症状[9]。对于非特异性腰椎间隙感染的最佳治疗方法目前没有共识,多数脊柱外科医生认为保守治疗是一种安全有效的选择,适用于没有神经症状、脊柱不稳定、椎间盘相关并发症的病人。但对于出现神经症状、脊柱畸形、硬膜外脓肿形成或不耐受非手术治疗的病人,手术治疗是重要的应对策略。外科治疗的目的是清除感染、缓解症状、重建脊柱稳定性和获得微生物样本。具体选择何种手术方法仍有争议。Lee等[10]行单一腰椎后路切口完成了18例化脓性腰椎间隙感染病人的椎体间融合、自体髂骨植骨及椎弓根钉内固定操作,末次随访时腰椎前凸角平均恢复了12.5°,手术疗效满意。D'aliberti等[11]研究了40例腰椎间隙急性感染病人,通过单纯前路清创、可膨胀假体重建和前路固定,40 名病人中有39 名获得了骨性融合,证明了在急性感染期使用假体单纯前路脊柱重建术是安全有效且可行的。Lu 等[12]采用单一后路经椎间孔行腰椎椎间清创融合术(transforaminal lumbar interbody debridement and fusion,TLIDF)治疗腰椎间隙感染病人28例,采用自体骨移植和后路椎弓根螺钉内固定,18个月以上的随访结果显示TLIDF具有充分的感染控制和良好的融合效果,有效避免了前路或分期手术的风险。Lin等[13]采用全内镜下清创引流术(full endoscopic debridement and drainage,FEDD)治疗14 例单间隙感染的椎间盘炎病人,所有病人的腰背痛均即刻缓解,病人均未出现后凸畸形及手术相关并发症,他们认为FEDD 可能是广泛开放手术的有效替代方案,尤其是针对合并基础疾病的老年病人和一般情况差的病人。Duan等[14]探讨经皮内镜下清创术(percutaneous endoscopic debridement,PED)联合经皮椎弓根螺钉固定治疗45 例腰椎化脓性椎间隙感染病人的可行性和疗效,发现PED联合经皮椎弓根螺钉固定可以作为治疗腰椎间隙感染的一种有效选择,具有微创、住院时间短、避免长时间卧床等优点。而大多数骨科医生熟悉的仍然是传统后路手术,这是治疗非特异性腰椎间隙感染最常见的方法。为了从后方暴露前柱的感染,竖脊肌需要广泛剥离,须切除部分椎板,病变椎间盘和感染坏死组织有可能在此过程中无法彻底清创。Matsumoto等[15]对CT引导下经皮椎间隙引流治疗化脓性椎间隙感染进行了报道,他们认为如果腰大肌脓肿与椎间盘内脓肿相通,则CT引导下经皮椎间隙引流对化脓性椎间隙感染和继发性腰大肌脓肿病人是有效的。Xu 等[16]的研究同样印证了这一术式,他们采用CT引导下经皮穿刺清创引流术治疗23例多节段椎间隙感染病人,随访期间没有发现感染复发的迹象,提出术中CT引导下微创经皮清创冲洗术是治疗椎间隙感染的一种有效的微创方法。其实,无论是CT引导下还是内镜引导下的微创手术都被证明了具有很好的效果,然而开放手术仍然是标准术式,特别是在骨破坏程度较为严重的情况下。此外,对于是仅单纯减压还是需要进行融合,Noh等[17]认为当脊柱没有不稳定时,使用适当的抗生素,仅减压是有效的,当明确有不稳定性,可以使用减压加融合来获得稳定性。

图2 病人,男,57岁,诊断为L2/3椎间隙感染,Pola C.1型,病人双下肢感觉肌力明显减退,保守治疗无效,行斜外侧L2/3椎间清创植骨融合内固定术 a、b:病人术前腰椎X线正侧位片提示L2/3椎体骨质破坏;c、d:术前CT提示L2/3椎体骨质虫蚀状破坏,边缘毛糙,L2/3椎体感染;e~g:术前MRI提示L2/3椎间盘炎性感染,周围软组织肿胀,L3~S1椎间盘膨突出;h、i:术后第3天X线片提示L2/3椎间髂骨植骨,侧方螺钉位置良好;j、k:术后第3天CT提示L2/3病灶清除内固定术后,椎间高度恢复,植骨界面接触良好;l:术后病理提示送检组织中见增生变性的骨组织、软骨组织,符合化脓性炎;m~p:末次随访X线片及CT提示椎间已完全骨性融合,内固定在位
采用OLIF入路治疗非特异性腰椎间隙感染时,术前体位摆放、透视定位与常规腰椎退变性疾病的处理无差异。在进入腹膜后脂肪间隙到达腰大肌表面时,往往由于腰大肌水肿、肌内脓肿、周围炎症反应等原因导致腰大肌与腹主动脉之间的间隙不易分离,因此在显露病变椎间盘过程中需要术者在直视下仔细辨认,避免在分离过程中损伤大血管等结构。工作通道建立后,应确保通道下无任何软组织卡压,在进行椎间隙处理时,由于感染常累及椎体,部分病人有骨质破坏及椎间高度明显下降,可以用试模配合撑开椎间隙后再进行清创操作。因为感染灶时常累及对侧,故处理椎间盘时需突破对侧纤维环,完成对侧椎旁脓肿的清除。同时结合术前影像学及术中直视下的术野情况判断骨质受累范围,用各种型号的刮匙尽可能刮除受累椎体骨组织,直至抵达新鲜骨面,可不保留完整骨性终板,这是处理感染病例与常规OLIF 手术不同之处。碘伏及生理盐水反复冲洗,植骨床建立完善后,使用测量尺测量椎间隙高度及缺损骨面横径,修剪合适大小的髂骨块进行椎间植骨,常规OLIF手术可使用人工骨填充融合器进行植骨操作,但非特异性感染病例我们建议使用合适大小的自体髂骨,以降低感染率。
二、OLIF入路的适应证及优势
对于非特异性腰椎间隙感染的手术适应证,目前缺乏统一的原则,文献报道出现以下几种情况时,手术干预应当被施行[18]:①保守治疗未能缓解症状,活检阴性伴顽固性疼痛;②椎旁脓肿>2.5 cm;③当MRI 发现神经根、脊髓或硬膜囊受压或进行性神经功能损害症状;④脊柱畸形,如脊柱后凸或脊柱侧凸,预测畸形是感染终末结局。OLIF入路允许彻底清创或切除腹侧感染的椎间盘或椎体,可以直视下清楚地看到病灶并彻底的清创至健康骨组织,尽可能消除残余病灶。在我们的研究中,所有病人的症状都得到很好的控制并无一复发,感染控制率为100%。OLIF 技术自从2012 年提出以后,在国内外更多的是应用于各类退变性腰椎疾病,主要是间接减压和前柱高度的恢复,无法对后柱受累的病例进行治疗,因此我们选取的病例主要包括以下几类:①累及椎间盘及邻近椎体的椎间隙感染,伴或不伴有少量椎旁软组织累及;②骨破坏局限于单一椎间隙上下椎体,且无硬膜外脓肿形成;③脊柱不稳或节段性后凸来源于前柱。对应的Pola感染分型病例主要是A.3型、A.4型、B.1型、B.2型、B.3型和C.1型病例。
在OLIF 技术出现之前,许多外科医生倾向于采用前路腰椎间融合术(anterior lumbar interbody fusion,ALIF)、侧路腰椎间融合术(lateral lumbar interbody fusion,LLIF)或极外侧椎间融合术(extreme lateral interbody fusion,XLIF)等治疗非特异性腰椎间隙感染。Pee等[19]回顾性分析了60例化脓性腰椎间隙感染病人的临床资料,发现一期前路病灶清创、椎体间融合、后路螺钉内固定术是治疗非特异性腰椎间隙感染的可行术式。Blizzard 等[20]评估了XLIF联合经皮后路内固定治疗11 例腰椎间隙感染病人的临床疗效,研究结果表明经皮后路内固定腰椎融合术是一种微创技术,XLIF可能是一种安全有效的可以替代ALIF 治疗腰椎间隙感染的治疗举措。ALIF手术由于入路解剖结构复杂,术中大动脉损伤率为4.6%[21]。而文献报道OLIF 术中损伤主动脉的发生率为0.10%~0.55%[7],ALIF手术操作难度大,位置深,在临床上已较少应用于感染病例,OLIF 作为一项较新的手术方式,其学习曲线较短,解剖结构较ALIF更为简单,故更易被大多数脊柱外科医师所接受。XLIF与LLIF均属于经腰大肌的侧方融合技术,在一项LLIF与OLIF的回顾性病例研究发现,OLIF拥有较低的腰丛神经损伤风险[21]。同样,在总计43例病人中对OLIF 和LLIF 进行类似的比较发现,OLIF在预防大腿前方麻木方面明显更胜一筹[22]。因为OLIF避免了直接从前方对大血管的干扰,也避开了内脏器官,减少不必要的肌肉切开和神经操作的风险,降低了与手术方法相关的围手术期并发症,这也是近年来其在临床得到广泛发展的动力。针对腰椎间隙感染的治疗,理论上OLIF 入路清创术可避免ALIF 和LLIF/XLIF 的潜在手术风险,故本组研究病例均采用OLIF入路完成操作。同时,本组病例均获得良好手术效果,并未出现相关并发症。此外,一项国内OLIF治疗腰椎退行性疾病的Meta分析显示[23],术后手术节段椎间隙高度、椎间孔高度、椎间孔面积、硬膜横截面积、整体腰椎前凸角度、局部前凸角均有显著的改善。我们的病例在GLL、DSH 和SLL恢复方面效果也十分显著,GLL 术后即刻较术前增大约41.2%(P<0.05)。DSH 术后即刻较术前增高约93.4%(P<0.05)。SLL 术后即刻较术前增加约81.9%(P<0.05),术后18个月随访时虽然椎间高度有部分丢失,但较术前仍明显改善,所有病例末次随访时均达到了骨性愈合,且均未出现手术相关并发症。可见OLIF在椎间高度恢复、间接减压以及腰椎生理曲度恢复方面不仅仅局限于退行性疾病,对于部分非特异性椎间隙感染病人同样适用。
综上所述,OLIF技术应用于非特异性腰椎间隙感染,可以通过单一切口同时完成病灶清创、自体髂骨植骨、螺钉内固定,提高了诊断精准率和治疗效果,具有创伤小、并发症少、融合率高等优点。OLIF联合侧方螺钉内固定治疗Pola A.3~C.1 型非特异性腰椎间隙感染病例具有十分确切的可行性和安全性,值得临床推广应用。
