Fe增强Ni2(CO3)(OH)2臭氧分解抗湿性与催化性能
2022-04-12黎邦鑫张骞肖杰肖文艳周莹
黎邦鑫, 张骞, 肖杰, 肖文艳, 周莹
Fe增强Ni2(CO3)(OH)2臭氧分解抗湿性与催化性能
黎邦鑫1,2, 张骞2, 肖杰2, 肖文艳2, 周莹1,2
(西南石油大学1. 油气藏地质及开发工程国家重点实验室; 2. 材料科学与工程学院 新能源材料及技术研究中心, 成都 610500)
臭氧污染已成为我国继PM2.5之后的主要污染物, 传统的臭氧分解催化材料在湿润环境中性能不稳定。本工作采用水热法制备了一种铁掺杂改性的碱式碳酸镍催化剂(NiCH-Fe), 该催化剂可在60%相对湿度下稳定分解2.14 μg/L臭氧12 h, 去除率达99%。水分子吸附质量检测结果表明, NiCH-Fe表面的水分子吸附量比纯NiCH明显减少, 表面水分子吸脱附可逆; 密度泛函理论结果证明, Fe原子是新的代替Ni原子的臭氧吸附位点, 并且Fe原子对臭氧分子的吸附能力更强。此外, XPS表明作为活性位点的Fe元素在反应前后保持稳定。掺杂Fe后的催化材料具有优异的抗湿性与长效稳定性。本研究表明通过金属离子掺杂, 改变催化材料的表面性质, 可获得具有良好抗湿性能的臭氧催化分解材料, 这为进一步开发兼具高抗湿性和高活性的臭氧催化分解材料, 提供了有效的技术方法。
碱式碳酸镍; 掺杂; 臭氧催化分解; 抗湿性
近年来, 随着工业发展与汽车保有量的逐步提高、化石燃料大量燃放以及溶剂的大量使用, 挥发性有机物和氮氧化物的排放不断增加, 臭氧已经成为我国环境空气污染的首要污染物之一[1]。与室外环境相比, 室内环境中的臭氧污染更为严重: 家用电器、办公电器、空气净化器等在使用过程中均会产生臭氧。臭氧不但会造成呼吸系统、视觉系统的永久损伤, 而且会与室内环境中的其他气体发生反应, 加重室内污染[2-3]。虽然, 近年来空气中挥发性有机物和氮氧化物均得到了有效的控制, 对应的催化材料研究也逐步完善[4-6], 但环境中的臭氧浓度却呈现逐年增长的趋势[7]。臭氧作为一种强氧化剂, 可以长期留存在近地面与室内环境中, 时刻威胁着人体的健康, 因此净化环境中的臭氧污染已刻不容缓。
常温催化分解法是臭氧污染治理方法中条件温和且节能环保的处理手段之一, 常用的催化材料有贵金属[8]、过渡金属氧化物[9]、固体金属盐[10]等。但是臭氧污染气体中存在远高于臭氧浓度的水分子, 由于它与臭氧分子竞争活性位, 使臭氧在材料表面的吸附和反应位点的减少, 导致催化材料臭氧分解性能快速降低, 存在严重的抗湿性问题[11]。针对上述问题, 已有研究表明, 对传统的锰基催化材料进行掺杂[12]、复合[13]和晶格调控[14]能够通过提升催化材料位点的臭氧吸附性能或是减弱水分子的吸附, 有效地提升催化材料抗湿性能。镍基材料具有高效催化臭氧分解的性能[15], 也同样存在抗湿性问题, 但少有学者针对此类材料的抗湿性能的提升开展研究。
鉴于此, 本工作选用镍基催化材料碱式碳酸镍Ni2(CO3)(OH)2进行实验, 通过对这种具有抗湿问题的材料进行金属离子掺杂, 改变材料的表面组成, 使材料在湿润环境中获得稳定的臭氧催化分解能力。
1 实验方法
1.1 催化材料的制备
采用水热法制备碱式碳酸镍。首先, 配置NiCl2·6H2O(0.006 mol)、FeCl3(Ni : Fe=100 :,摩尔比)、尿素(0.024 mol)、480 mL的去离子水溶液; 然后, 在聚四氟乙烯高温反应釜中120 ℃下水热反应16 h; 抽滤洗涤(去离子水、乙醇)后, 在120 ℃下干燥12 h, 得到相应的%Fe掺杂量的碱式碳酸镍(NiCH-Fe%)催化材料。水热溶液中未加入FeCl3或NiCl2·6H2O, 以制备得到碱式碳酸铁(FeCH)、碱式碳酸镍(NiCH)样品。所有实验试剂均为分析纯, 采购自阿拉丁。
1.2 材料表征
采用χ’Pert PRO MPD型X射线衍射仪, 测试电压40 kV, 射线源为Cu k; ZEISS EV0 MA15扫描电子显微镜, 电压为20 kV; FEI Tecnai G2 F20透射电子显微镜; ASAP 2460比表面与孔隙度分析仪, 77.3 K; ESCALAB 250Xi光电子能谱仪分别对催化材料的结构、形貌、比表面积以及反应前后的结合能进行测试。
利用石英晶体微天平(QCM)测量材料表面吸附水分子的质量[16]。晶片基频为500 kHz, 采用乙醇配置0.01 g/mL的材料悬浊液, 取20 μL分散液, 在60 ℃环境下干燥24 h。为排除氧气的影响, 实验气体选用氮气, 配置干燥和相对湿度60%的两种气体用于测试, 经晶片表面的气流流速固定为5 mL/min。
1.3 性能测试
使用固定床反应器测试材料的臭氧分解性能。臭氧由真空紫外(185 nm)光源产生, 浓度为(40±2) ppm ((2.14±0.1) μg/L), 固定床管径8 mm, 催化材料筛选80目(187.5 μm), 用量100 mg, 混合300 mg石英砂; 反应温度控制在25 ℃, 经过装置的气流总流量为1.5 L/min, 湿度通过鼓泡装置控制。利用Model 106L(2B Technologies)检测臭氧浓度, 利用GSP-6 (精创)检测温湿度。
1.4 理论计算
利用Cambridge Sequential Total Energy Package(CASTEP)程序进行密度泛函理论(DFT)计算[17], 采用广义梯度近似(GGA/PBE)泛函说明交换关联能, 截断能设置为380 eV。在所有的计算中布里渊区采用的是2×2×1的k点。几何结构优化均在所有原子完全松弛下进行, 通过构建1.5 nm的真空层以避免周期性结构之间的相互作用, 以0.005 eV/nm和1×10–5eV阈值进行了优化。材料结构的吸附能(ad)通过以下公式计算:
ad=(composite+adsorbate)–composite–adsorbate(1)
其中(composite+adsorbate)对应吸附产物的总能量, 而composite与adsorbate分别对应其中的材料与相应的吸附物O3的能量。
2 结果与讨论
2.1 结构分析与表征
图1为NiCH与NiCH-Fe的XRD图谱, 由图可见, Fe掺杂催化材料均存在与PDF#40-0215标准卡片相对应的特征峰, 表明掺杂的催化材料中形成了碱式碳酸铁镍(Ni0.75Fe0.25(CO3)0.125(OH)2·0.38H2O), 随着Fe掺杂量的增加, 对应的特征峰强度明显增强, 特别是在掺杂20%Fe的样品中观察到了属于Ni(HCO3)2的特征峰(绿色三角标记), 而未掺杂Fe离子的催化材料无明显的特征峰, 这可能是由于Fe离子改变了水热前驱溶液的pH造成的[18]。根据相关文献报道[19], 合成得到的碱式碳酸镍Ni2(CO3)(OH)2为无定型材料。上述XRD数据表明Fe的掺杂能改变碱式碳酸镍的晶型, 得到掺杂有Fe元素的碱式碳酸铁镍, 并且随着铁离子掺入量的增加, 低结晶度的碱式碳酸镍向高结晶度的碱式碳酸铁镍与碳酸氢镍转化。
通过扫描电子显微镜观察NiCH-Fe5%样品的表面形貌, 如图2(a)所示, NiCH-Fe5%样品表面覆盖着一层绒毛状物质, 这与碱式碳酸镍形貌一致[20]。EDS元素分析结果显示, 样品表面均匀分布着Ni (图2(b))与Fe(图2(c))元素。对比NiCH(图2(d))与NiCH- Fe5%(图2(e))的TEM照片可发现, 掺杂前后的材料均由片层结构堆叠而成, 但未掺杂的NiCH结构致密, 仅边缘能够观察到片层状结构。NiCH-Fe5%微观片层结构清晰, 颗粒尺寸小于未掺杂Fe的样品, NiCH-Fe5%的高分辨TEM照片(图2(f))显示出对应碱式碳酸镍与碱式碳酸铁镍的两种晶格条纹, 这与XRD分析结果一致。对比SEM与TEM照片, Fe掺杂前后的NiCH样品表面微观形貌相近, 但掺杂后样品的颗粒尺寸明显减小, 这可能是材料比表面积增加的原因。Fe与Ni在材料表面的分布均匀, 说明Fe元素成功进入了材料的晶格, 使材料掺杂后拥有不同的反应活性位点。如图3(a)所示, 材料N2吸脱附数据表明掺杂Fe对催化材料的比表面积影响明显。掺杂少量Fe可以显著提升材料的表面积, 而过量掺杂Fe则会使催化材料的比表面积急剧降低, 这可能是Fe过量掺杂引起材料结晶度升高以及晶型转化造成的。同时, 图3(b)材料的孔径分布趋势除FeCH外无明显变化。因此, 掺杂适量Fe能够明显提升催化材料的比表面积, 并为臭氧催化分解提供更多的反应位点。

图2 NiCH-Fe5%样品的(a)SEM照片及其上Ni(b)、Fe(c)元素的EDS分布; (d) NiCH和 (e) NiCH-Fe5%的TEM照片; (f) NiCH-Fe5%的HRTEM照片
2.2 臭氧分解性能测试
制备材料的臭氧分解性能测试结果如图4(a)所示。不同Fe掺杂量的催化材料在60%的相对湿度下表现出不同的臭氧分解性能。未掺杂Fe的NiCH材料反应30 min后臭氧分解性能下降至90%, 而掺杂量为摩尔分数1%、10%的NiCH材料臭氧分解性能稳定在96%左右。NiCH-Fe20%在反应开始3 min内性能下降明显, 之后在测试时间内恢复到95%。5个样品中仅NiCH-Fe5%材料在测试时间内维持了100%的臭氧分解效率。
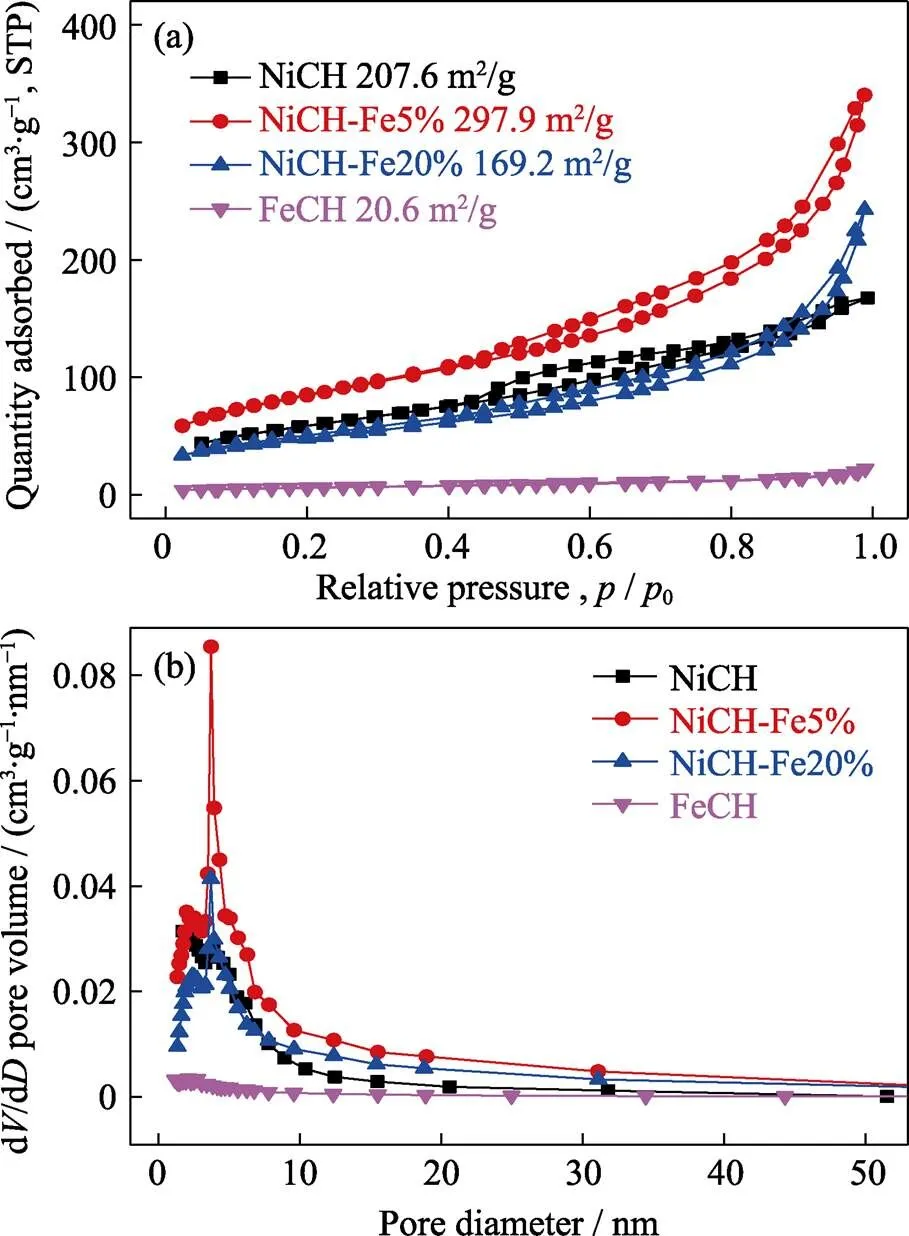
图3 NiCH、NiCH-Fe、FeCH的(a)氮气吸脱附等温曲线与(b)孔径分布图
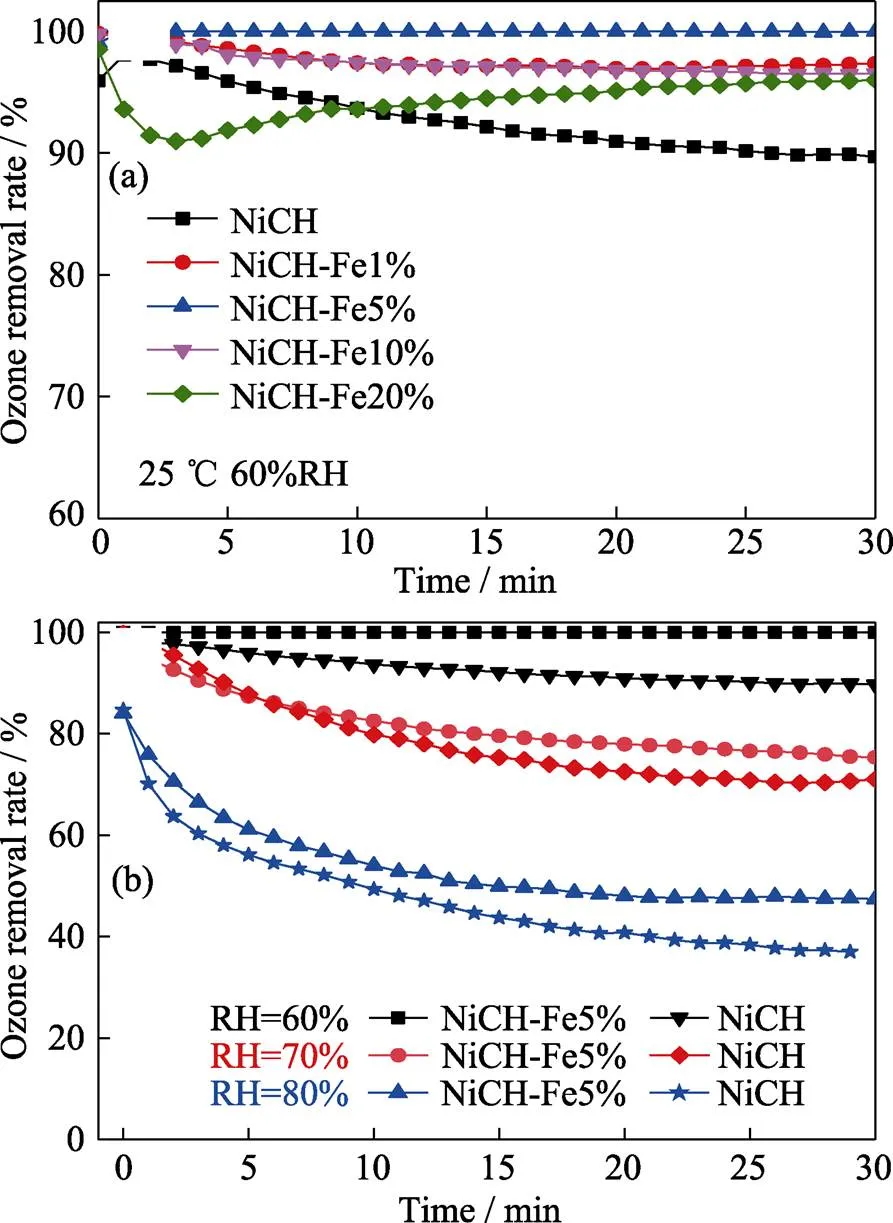
图4 (a)不同铁掺杂量的NiCH-Fe在60%相对湿度下与(b)NiCH-Fe5%材料在60%、70%、80%相对湿度下的臭氧去除率
基于以上测试结果, 进一步探究NiCH-Fe5%的抗湿性能, 测试结果如图4(b)表示。NiCH-Fe5%催化材料在相对湿度高于60%的条件下, 催化性能受湿度影响明显, 随着湿度增加, NiCH-Fe5%臭氧分解性能明显下降, 在80%的湿度下臭氧分解性能仅能稳定在50%, 但较未掺杂材料均有提升。以上结果表明, 相较于未掺杂的碱式碳酸镍, 掺杂Fe可以较好地改善催化材料的抗湿性能。长时间臭氧分解性能测试结果表明, 掺杂Fe的催化材料不仅具有较好的抗湿性能, 而且还表现出较好的长效稳定性, 可在较长的时间内保持99%的臭氧分解性能, 远高于商业MnO2(图5)。
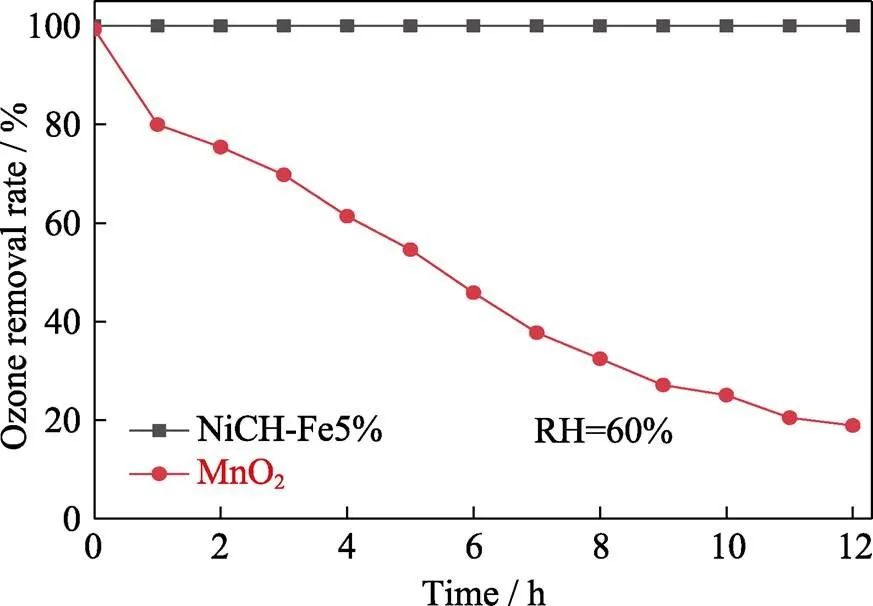
图5 NiCH-Fe5%与MnO2的长时间臭氧分解性能测试
2.3 催化材料表面性质
通过XPS检测催化材料反应前后元素价态的变化。NiCH-Fe5%中Ni元素的2p3/2结合能为857.0 eV, 以Ni2+的形式存在[21]; Fe元素2p3/2的结合能为713.4 eV, 对应Fe(Ⅲ)[22]。对比反应前后NiCH-Fe5%中Fe、Ni的结合能发现, NiCH-Fe5%与臭氧反应使其中Ni的结合能提高了0.68 eV(图6(a)), 但Fe元素的结合能无明显变化(图6(b))。这表明材料中的Ni原子被臭氧氧化[23], 反应前后可逆性差, 而掺杂的Fe价态稳定。Ni材料元素价态变化往往会引起材料晶体结构变化, 从而导致材料催化活性改变[24]。掺杂Fe元素提高了镍基臭氧催化分解材料的结构稳定性, 使NiCH-Fe5%性能达到长效稳定。
材料的抗湿性与材料表面对水分子的吸附性密切相关, 通过QCM检测了掺杂前后材料表面的水分子吸附情况[16], 如图7所示。NiCH-Fe5%在60%相对湿度下水分子的吸附量较未掺杂材料明显减少, 仅为0.03 g/g的吸附量。材料表面水分子均可在干燥气流中脱除, 说明水分子在材料表面的吸附是可逆的。以上实验结果表明, 掺杂Fe可以明显降低催化材料表面水分子的吸附量, 因此在湿润环境中NiCH- Fe5%表现出更好的抗湿性与催化稳定性。
2.4 理论计算
依据材料的晶体结构参数, 建立了NiCH-Fe理论计算模型, 用于计算表面臭氧吸附性质。由XRD数据可以获取如图8所示模型, 臭氧的可能吸附位点标记为Fe、O1、O2、Ni, 未掺杂的样品中以Ni替换Fe位点。
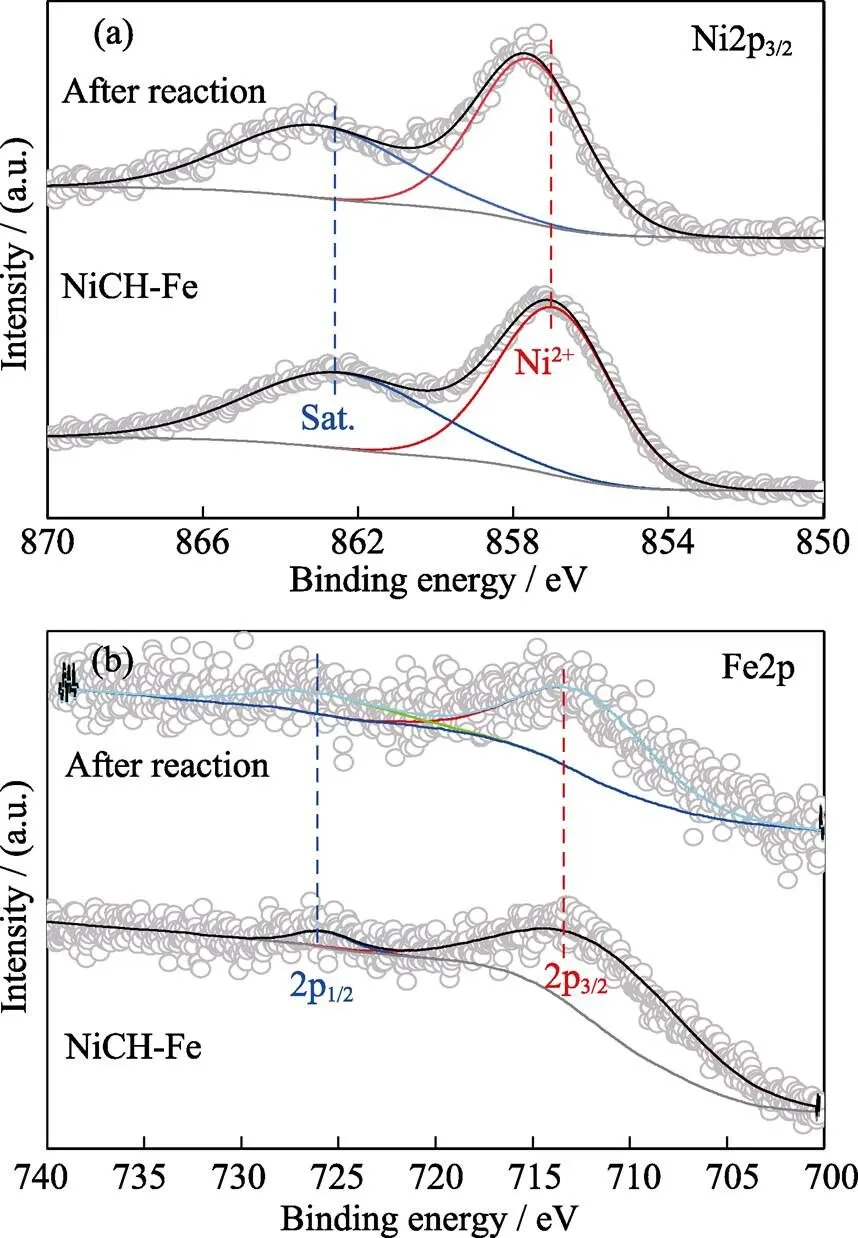
图6 NiCH-Fe5%反应前后的(a)Ni2p3/2和(b)Fe2p的XPS图谱
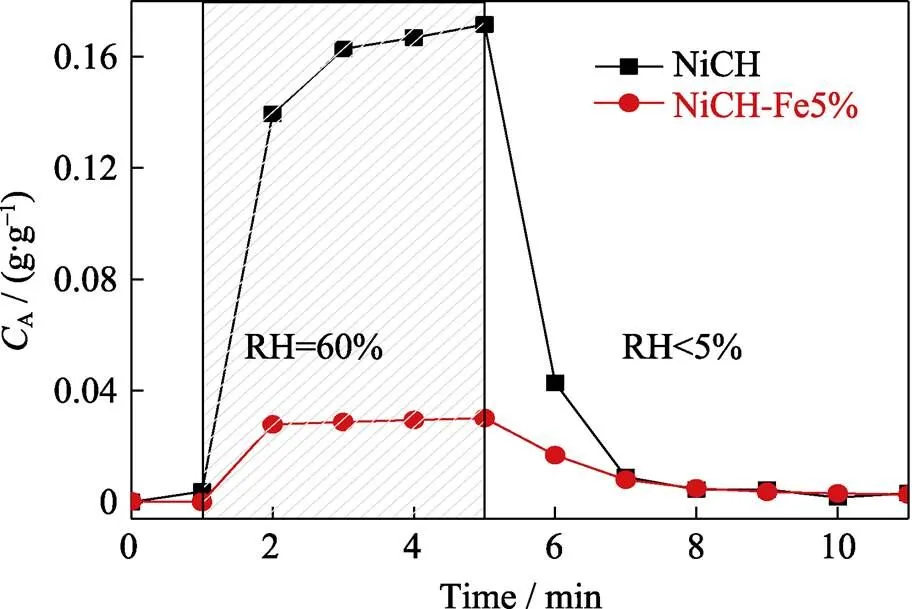
图7 NiCH与NiCH-Fe5%材料表面水分子吸附曲线
计算得到的臭氧与水分子的吸附能结果如表1所示。对比NiCH与NiCH-Fe上不同位点臭氧的吸附能, 可以发现臭氧在未掺杂材料中活性位点Ni原子上的吸附能较负, 表明未掺杂催化材料中Ni为催化臭氧分解反应中的吸附位点[25]; 而掺杂Fe后, NiCH-Fe表面Fe位点的吸附能较Ni更负, 为–1.93 eV, 表明臭氧更容易吸附在掺杂后NiCH-Fe材料的Fe原子上。对比位点上水分子吸附能的改变, 掺杂Fe后材料对臭氧吸附能力的提升远大于水分子, 竞争吸附中臭氧依然占据主要地位。因此, Fe元素的掺杂不但丰富了材料的臭氧吸附活性位点, 而且增强了材料对臭氧的吸附捕获能力, 有利于进一步提升催化材料催化分解臭氧的能力。
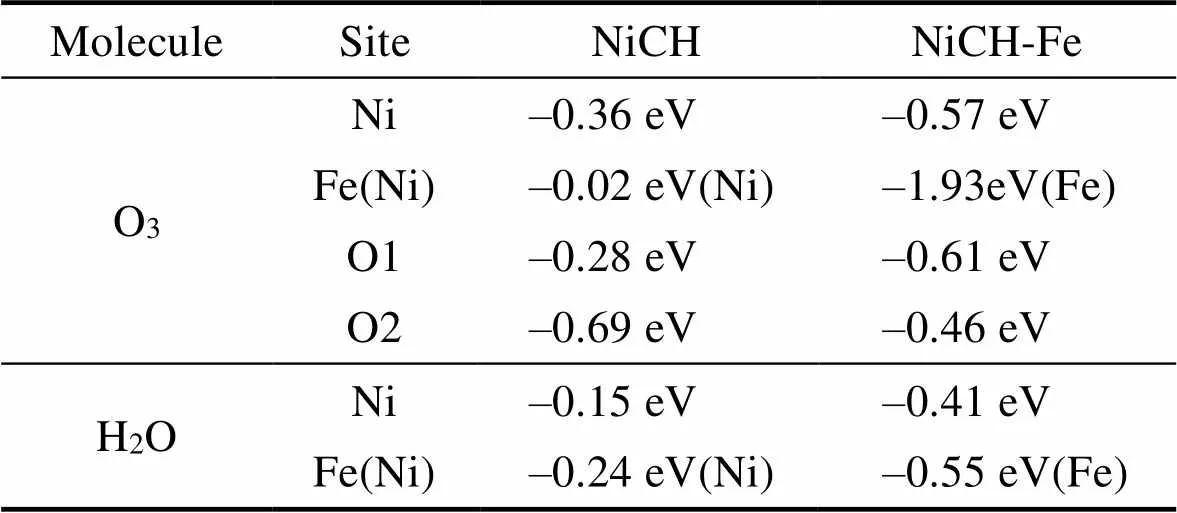
表1 NiCH与NiCH-Fe上不同位点臭氧与水分子的吸附能
3 结论
掺杂Fe元素可以有效提升碱式碳酸镍对臭氧的分解能力, 提高了在臭氧分解反应过程中反应位点的价态稳定性, 并通过增强材料表面吸附臭氧的能力, 使其反应中水分子吸附量减少, 最终获得能够在60%相对湿度的环境中稳定去除臭氧的催化材料NiCH-Fe5%。本实验分析了掺杂元素如何改变催化材料的性质, 从吸附原理方面探究了催化材料抗湿性能提升的原因, 促进了对现有催化材料抗湿性能稳步提升问题的研究, 同时也为新型抗湿性臭氧催化材料的研发提供了方案。
[1] Mullins J T. Ambient air pollution and human performance: contemporaneous and acclimatization effects of ozone exposure on athletic performance.,2018, 27(8): 1189–1200.
[2] FU P F, CHEN S J. Indoor air pollution caused by ozone reactions and problems in disinfection and purification by using ozone air cleaners.(), 2006, 20(3): 73–75.
[3] SHAO G M. The hazards of ozone pollution and protective measure in copy room.,2017, 02: 80–83.
[4] WU F, ZHAO Z Y, LI B X. Interfacial oxygen vacancy of Bi2O2CO3/PPy and its visible-light photocatalytic NO oxidation mechanism., 2020, 35(5): 541–548.
[5] ZHANG R Y, LI C J, ZHANG A L,. Research progress on the preparation and application of monolithic photocatalysts.,2020, 34(3): 3001–3016.
[6] CAO Y H, ZHENG Q, RAO Z Q,. InP quantum dots on g-C3N4nanosheets to promote molecular oxygen activation under visible light.,2020, 32(10): 2689–2692.
[7] WANG T, XUE L K, BRIMBLECOMBE P,. Ozone pollution in China: a review of concentrations, meteorological influences, chemical precursors, and effects.,2017, 575: 1582–1596.
[8] Li X T, Ma J Z, He H. Tuning the chemical state of silver on Ag-Mn catalysts to enhance the ozone decomposition performance., 2020, 54(18): 11566–11575.
[9] Dhandapani B, Oyama S T. Gas phase ozone decomposition catalysts.,1997, 11(2): 129–166.
[10] Jia J B, Zhang P Y. Catalytic decomposition of airborne ozone by MnCO3and its mechanism.,2018, 40(1): 21–28.
[11] Lian Z H, Ma J Z, He H. Decomposition of high-level ozone under high humidity over Mn-Fe catalyst: The influence of iron precursors.,2015,59: 156–160.
[12] Yang Y J, Zhang P Y, Jia J B. Vanadium-doped MnO2for efficient room-temperature catalytic decomposition of ozone in air.,2019, 484: 45–53.
[13] Gong S Y, Chen J Y, Wu X F,synthesis of Cu2O/reduced graphene oxide composite as effective catalyst for ozone decomposition., 2018, 106: 25–29.
[14] Jia J B, Zhang P Y, Chen L. Catalytic decomposition of gaseous ozone over manganese dioxides with different crystal structures.,2016, 189: 210–218.
[15] YU H F. Catalytic decompostion of ozone over monolithic catalysts with deferect ninch salt precursors.(), 2019, 40(6): 27–30.
[16] Spinella K, Mosiello L, Palleschi G,. Development of a QCM (Quartz Crystal Microbalance) biosensor to the detection of aflatoxin B1.,2013, 2(4): 112–119.
[17] Clark S J, Segall M D, Pickard C J,. First principles methods using CASTEP., 2005, 220(5/6): 567–570.
[18] Dai S G, Zhang Z F, Xu J M,.Raman study of nickel bicarbonate for high-performance energy storage device.,2019, 64: 103919–1–9.
[19] Yu Z M, Su X L, Wei D H,. Tiny basic nickel carbonate arrays/reduced graphene oxide composite for high-efficiency supercapacitor application.,2019, 14(4): 96–103.
[20] Xi C Y, Zhu G X, Liu Y J,. Belt-like nickel hydroxide carbonate/ reduced graphene oxide hybrids: synthesis and performance as supercapacitor electrodes.:,2018, 538: 748–756.
[21] Biesinger M C, Payne B P, Lau L W M,. X-ray photoelectron spectroscopic chemical state quantification of mixed nickel metal, oxide and hydroxide systems.,2009, 41(4): 324–332.
[22] Yamashita T, Hayes P. Analysis of XPS spectra of Fe2+and Fe3+ions in oxide materials.,2008, 254(8): 2441–2449.
[23] Stoyanova M, Konova P, Nikolov P,. Alumina- supported nickel oxide for ozone decomposition and catalytic ozonation of CO and VOCs., 2006,122(1/2): 41–46.
[24] Hu C W, Yamada Y, Yoshimura K. Fabrication of nickel oxyhydroxide/palladium (NiOOH/Pd) nanocomposite for gasochromic application.,2018, 177: 120–127.
[25] Abbasi A, Sardroodi J J. Application of TiO2-supported Au for ozone molecule removal from environment: a van der Waals- corrected DFT study., 2019, 16(7): 3483–3496.
Iron-doping Enhanced Basic Nickel Carbonate for Moisture Resistance and Catalytic Performance of Ozone Decomposition
LI Bangxin1,2, ZHANG Qian2, XIAO Jie2, XIAO Wenyan2, ZHOU Ying1,2
(1. State Key Laboratory of Oil and Gas Reservoir Geology and Exploitation, Southwest Petroleum University, Chengdu 610500, China; 2. The Center of New Energy Materials and Technology, School of Materials Science and Engineering, Southwest Petroleum University, Chengdu 610500, China)
Ozone pollution is taking more dominant position in China than PM2.5, traditional ozonolysis catalytic materials have limited performance in humid conditions. In this study, an iron-doped basic nickel carbonate catalyst (NiCH-Fe) was successfully fabricateda facile hydrothermal method, which could stably decompose 2.14 μg/L ozone at 60% relative humidity for 12 h with nearly 100% removal ratio. The result of the Quartz Crystal Microbalance test showed that the water molecules adsorbed on the surface of NiCH-Fe were significantly reduced as compared with that adsorbed on pure NiCH, which were favorable for the competitive adsorption of ozone. Density functional theory results proved that Fe atoms were new sites instead of Ni atoms and had stronger adsorption capacity for ozone molecules. In addition, the XPS results demonstrated that the iron atoms serving as active sites were substantially stable in the reaction. Therefore, material doped with Fe provided excellent moisture resistance and long-term stability.This work provides an effective technical method for the development of materials with high moisture resistance ability for efficient ozone catalytic decomposition.
basic nickel carbonate; doping; ozone decomposition; moisture resistance
1000-324X(2022)01-0045-06
10.15541/jim20210127
TQ174
A
2021-03-04;
2021-05-01;
2021-05-25
四川省重大科技专项(2020ZDZX0008); 四川省重点研发项目(2021YFSY0046)
Science and Technology Major Projects Sichuan (2020ZDZX0008); Key R&D Program of Sichuan (2021YFSY0046)
黎邦鑫(1995–), 男, 硕士研究生. E-mail: 1449569638@qq.com
LI Bangxin(1995–), male, Master candidate. E-mail: 1449569638@qq.com
张骞, 副教授. E-mail: zhangqian@swpu.edu.cn
ZHANG Qian, associate professor. E-mail: zhangqian@swpu.edu.cn
