铜绿假单胞菌核酸检测用试剂盒国家参考品的研究
2022-04-12梁丽陈驰石继春王春娥龙新星刘茹凤黄洋李康徐潇李江姣徐颖华叶强
梁丽,陈驰,石继春,王春娥,龙新星,刘茹凤,黄洋,李康,徐潇,李江姣,徐颖华,叶强
铜绿假单胞菌(Pseudomonas aeruginosa)为假单胞菌属的一种革兰氏阴性菌,也被称为绿脓杆菌。在自然界水、土壤与空气中均广泛存在[1]。铜绿假单胞菌污染常见于凉拌菜、熟肉制品、饮用水等食品领域。例如在水源水或成品水中检出铜绿假单胞菌,甚至多批次样品的检出率大于 10%,为一种重要的水源和食源性致病菌[2-4]。因此在我国饮用天然矿泉水(GB 8537-2016)[5]和包装饮用水(GB 19298-2014)[6]的国家标准中均明确规定不得检出铜绿假单胞菌。此外,在 2015年我国颁布的《化妆品安全技术规范》也要求化妆品中不得有铜绿假单胞菌检出[7]。铜绿假单胞菌作为医院内感染的主要病原菌之一,在机体免疫力低下时,例如术后和恶性肿瘤的患者容易感染本菌,且铜绿假单胞菌的耐药性强,在治疗时往往需要使用多种抗生素进行联合用药[8-9]。因此,快速而准确地鉴定出铜绿假单胞菌对保障食品安全和人民健康具有重要的意义。
尽管铜绿假单胞菌为食品、化妆品等微生物常规检测项目之一,但所推荐的检测方法为传统细菌培养法[6]。作为细菌检测“金标准”的细菌培养法,其准确度高,但耗时长、灵敏度较低。随着检测技术的不断发展以及铜绿假单胞菌的全基因信息解析[10],各种分子生物学技术,包括单一 PCR、多重 PCR、定量 PCR 技术、环介导等温扩增技术等,凭借强特异性、高灵敏度、简便省时等优点,已经被广泛应用在铜绿假单胞菌的检测和研究中[2,11-13]。但至今尚无铜绿假单胞菌相关国家参考品,导致不同企业的产品缺乏统一的标准衡量,不利于行业水平的整体提升。本研究研制了铜绿假单胞菌核酸检测试剂盒用国家参考品,以期为未来相关定性检测试剂盒的质量控制和评价提供物质基础。
1 材料与方法
1.1 材料
1.1.1 菌株 10 株不同来源的铜绿假单胞菌标准菌株用于阳性参考品的制备(表1);用于制备阴性参考品的菌株分别为:嗜麦芽窄食假单胞菌 CMCC(B)10701、恶臭假单胞菌 CMCC(B)10716、荧光假单胞菌 CMCC(B)10711、布氏假单胞菌 CMCC(B)10712、摩氏假单胞菌CMCC(B)10713、金黄色葡萄球菌 CMCC(B)26001、肺炎克雷伯菌 CMCC(B)46117、肺炎链球菌 CMCC(B)31001、脑膜炎奈瑟菌 CMCC(B)29052、大肠埃希菌 CMCC(B)44113,上述菌株均来源于中国食品药品检定研究院的中国医学细菌保藏管理中心。

表1 本研究所用 10 株铜绿假单胞菌的特性
1.1.2 主要试剂和仪器 普通营养琼脂培养基购自北京三药公司科技开发公司;细菌基因组 DNA 提取试剂盒购自天根生化科技(北京)有限公司;Premix Taq 和 DL2000 均购自日本 Takara 公司;铜绿假单胞菌核酸测定试剂盒分别购自北京华大吉比爱生物技术有限公司、中山大学达安基因股份有限公司和江苏硕世生物科技股份有限公司;其他试剂为国产分析纯。
细菌培养箱为北京中仪国科科技有限公司产品;荧光定量 PCR 仪为美国 ABI 公司产品;VITEK 全自动微生物生化鉴定仪为梅里埃诊断产品有限公司产品;microTyper MS 飞行时间质谱系统为江苏天瑞仪器股份有限公司产品。
1.2 方法
1.2.1 铜绿假单胞菌参考菌株的培养和鉴定 将 10 株铜绿假单胞菌复苏后分别接种至普通营养琼脂平板培养基中,观察菌落形态,全自动微生物生化鉴定仪进行生化鉴定。选取琼脂平板上培养的第 2 代单菌落,进行飞行质谱鉴定。同时将上述菌种新鲜过夜培养物按照试剂说明书提取细菌全基因组 DNA,以其为模板,参考文献[14],使用16S rRNA 基因通用引物进行扩增,产物送生工生物工程(上海)股份有限公司测序,最后将测序拼接结果提交NCBI 数据库进行 Blast 比对分析。
1.2.2 候选参考品的制备 将上述 10 株铜绿假单胞菌复苏后新鲜培养物制备成菌悬液,经加热灭活并验证灭活合格后,采用无菌生理盐水将铜绿假单胞菌的灭活菌液稀释至5.0 × 106个/ml,以每管 0.5 ml 定量分装。同时,选取铜绿假单胞菌 CMCC(B)10126 灭活菌悬液制备重复性和最低检出限候选参考品,菌液浓度稀释至 5.0 × 106个/ml,定量分装每管 0.8 ml。
同时,将 10 株阴性参考品菌株接种于各自适宜生长的培养基上,按上述铜绿假单胞菌相同操作处理,制备灭活菌悬液,最终稀释至 1.0 × 106~ 1.0 × 107个/ml,以每管0.5 ml定量分装,所有候选参考品样品均保存于 -20 ℃备用。
1.2.3 候选参考品特性分析 为了评价候选参考品的均匀性,从上述制备的 150 套候选参考品中随机抽取阳性(P1 ~P10)、重复性和最低检出限候选参考品样品各 10 支,使用铜绿假单胞菌核酸测定试剂盒进行检测,计算不同样品检测结果 Ct 值的变异系数(CV)。同时,将长期放置 -20 ℃ 冰箱保存的阳性(P1 ~ P10)和最低检出限候选参考品取出,反复冻融 3 次和 5 次,并将候选阳性、最低检出限候选参考品分别放置于 4 ℃、25 ℃、37 ℃ 条件下 3、7、14 d,然后与 -20 ℃ 保存的对应样品进行平行测定比较分析,系统评价候选参考品稳定性。
1.2.4 候选参考品验证分析 选用 3 种不同厂家的铜绿假单胞菌试剂盒进行候选参考品验证研究,包括对已稀释10 倍的阳性(P1 ~ P10)和阴性(N1 ~ N10)进行检测分析,评价候选参考品的准确性和特异性;并对已稀释 10 倍的重复性候选参考品进行重复检测 10 次,进行 2 次独立实验检测分析,评价候选参考品的重复性。同时,采用无菌生理盐水倍比系列稀释最低检出限参考品(5.0 × 106个/ml)成 4 个稀释度 1.0 × 105、1.0 × 104、1.0 × 103和 1.0 ×102个/ml,检测分析和评价候选参考品的最低检出限。
1.2.5 候选参考品协作标定 将所有检测候选参考品样品编盲,组织国内 5 家生产铜绿假单胞菌试剂盒企业的实验室进行协作标定,按照拟定协作标定方案,要求使用各自生产的试剂盒分别进行候选参考品的准确性、特异性、重复性和最低检出限验证分析,并至少进行两次独立实验,最终将所有原始结果提交中国食品药品检定研究院作统一分析。
1.3 统计学处理
应用 SPSS 22 统计分析软件对本研究候选参考品的稳定性实验结果数据进行 Kruskal-Wallis 非参数检验分析,以P< 0.05 为差异有统计学意义。
2 结果
2.1 铜绿假单胞菌参考菌株的鉴定分析结果
用于制备阳性候选参考品的 10 株铜绿假单胞菌标准菌株的革兰氏染色、菌落生长形态以及 VITEK 生化鉴定结果均符合铜绿假单胞菌的特征。质谱鉴定结果均为铜绿假单胞菌,且分值在 2.16 ~ 2.45 之间,表明结果鉴定可信度和准确度高。16S rRNA 基因测序分析显示 10 株菌株与NCBI 数据库中收录的铜绿假单胞菌模式菌株 JCM5962的 16S rRNA 基因序列相似度均大于 97%(表1),进一步证实所用标准菌株均为铜绿假单胞菌。
2.2 候选参考品的特性分析结果
各种候选参考品菌液经加热灭活处理后,验证分析显示所有灭活菌液在各自适宜的平板培养基上均无细菌生长,表明候选参考品菌液灭活合格。候选参考品的均匀性检测结果显示,阳性(P1 ~ P10)、最低检出限和重复性候选参考品不同样品间的 Ct 值基本一致,检测结果 CV 值为 1.35%~ 4.04% 之间(表2),表明本研究制备的候选参考品的分装均匀度良好。
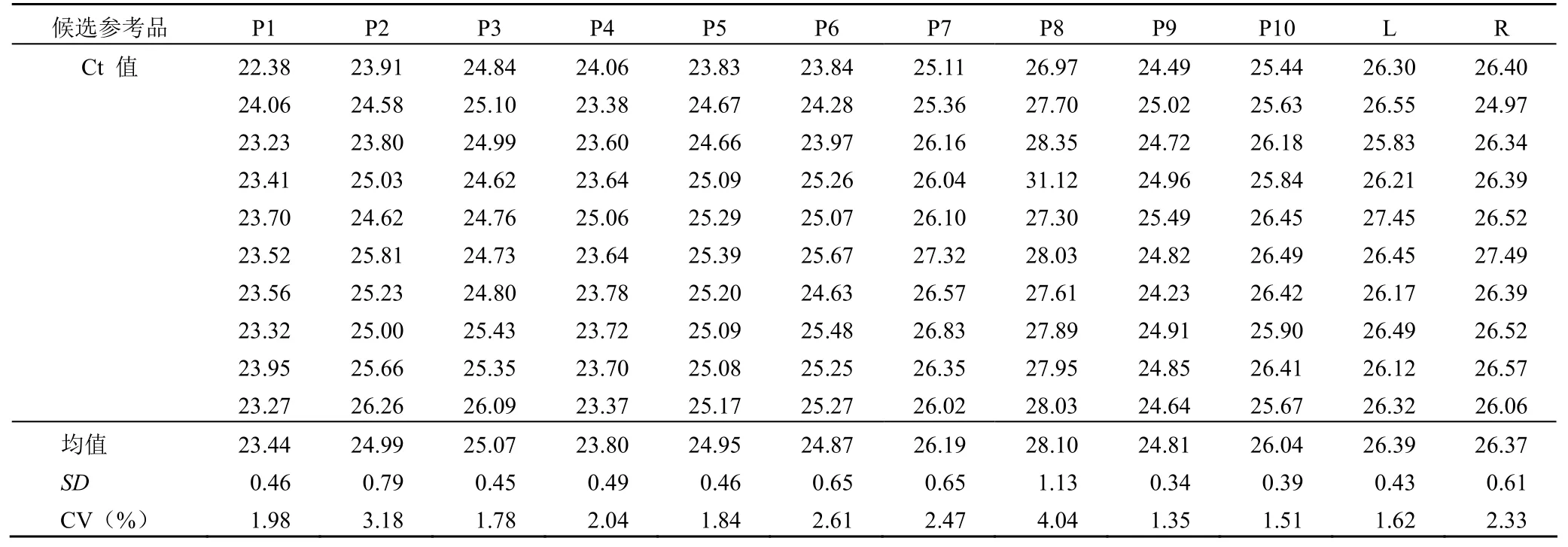
表2 候选参考品的分装均匀度分析结果
此外,候选参考品经反复冻融 3 次和 5 次处理后,以及分别于 4 ℃、25 ℃、37 ℃ 放置 3、7 和 14 d 后,检测分析结果与 -20 ℃ 保存的各候选参考品结果相比,除阳性候选参考品 P3 样品在 37 ℃ 放置 14 d 未能检出,其他样品均能成功检出,不同温度样品 Ct 值的 CV 值在7.98% ~ 13.38% 之间,均小于 15%(图1),经统计学分析均无显著差异(P> 0.05),结果表明候选参考品具有良好稳定性。
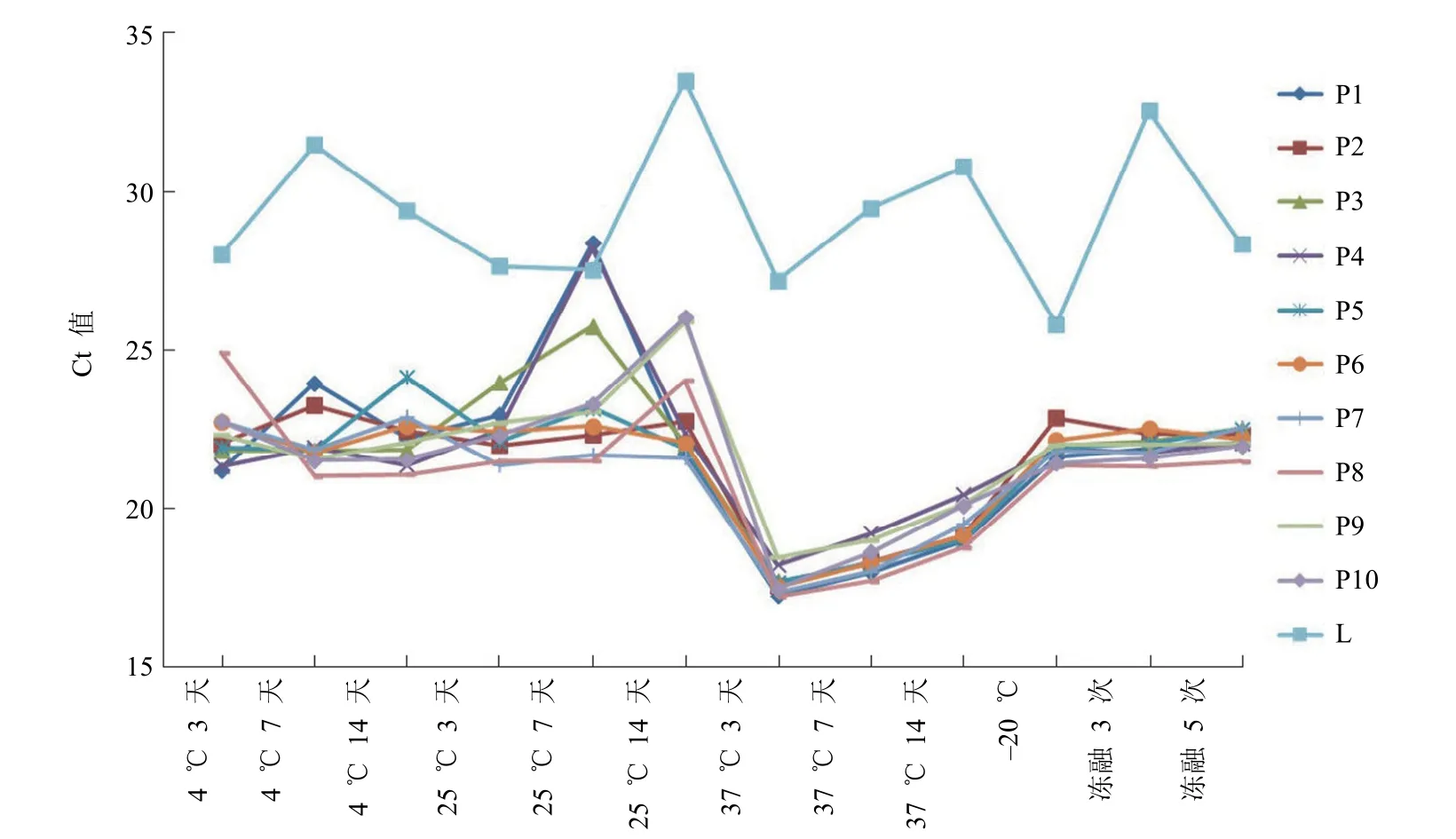
图1 候选参考品的稳定性分析结果(P1 ~ P10分别代表阳性候选参考品;L 代表最低检出限和重复性候选参考品)
2.3 候选参考品验证分析结果
3 种不同厂家生产试剂盒检测对 P1 ~ P10 阳性候选参考品稀释样品均显示为阳性,而所有 N1 ~ N10 阴性候选参考品稀释样品均显示为阴性。重复性验证实验分析结果显示 3 种不同厂家生产试剂盒检测重复候选参考品样本的Ct 值之间的 CV 值分别为 0.94%、4.63% 和 1.34%,均小于 5.0%,表明候选参考品的重复性良好。此外,最低检出限验证分析结果显示其中 2 家试剂盒的最低检出限为1.0 × 104个/ml,而另外一个试剂盒的最低检出限为 1.0 ×103个/ml。
2.4 候选参考品协作标定结果
协作标定分析结果显示除 E 实验室未能检测出 P8阳性候选参考品样品,其余实验室对 P1 ~ P10 样品均检测为阳性;而所有实验室阴性候选参考品检测结果均符合要求;重复性候选参考品检测结果显示各实验室检测 Ct 值的 CV 值均在 5.0% 以内。同时,发现协作标定实验室的最低检出限参考品结果也不尽相同,例如 A 和 B 实验室结果为 1.0 × 105个/ml,编号 C 和 E 实验室结果为1.0 × 104个/ml,D 实验室最低检出限可达 1.0 × 102个/ml(表3)。
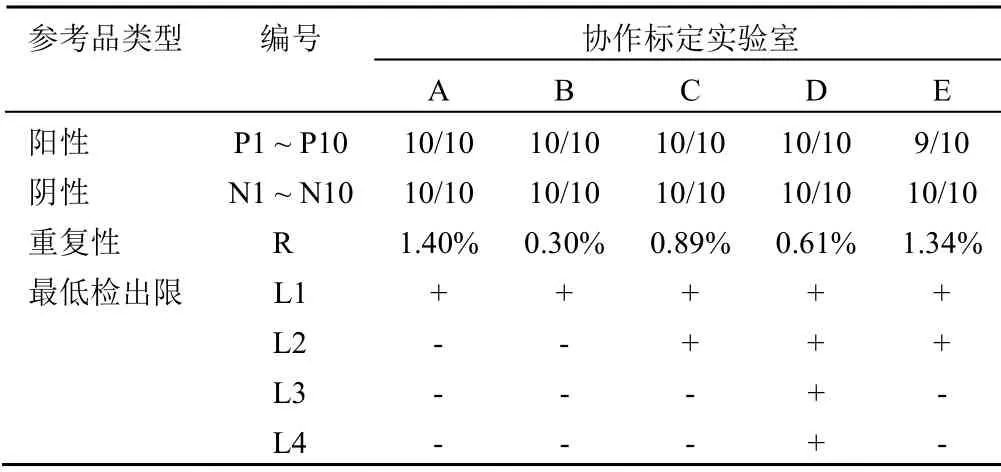
表3 候选参考品协作标定结果
3 讨论
随着分子生物学技术的发展,特异性靶基因核苷酸序列技术在多种病原体诊断和检测领域的应用具有革命性的时效性与灵敏度的改变[11]。为了保证检测结果的准确性和可溯源性,检测用相关国家参考品的使用就显得尤为重要[15-16]。为了研制高质量的国家参考品,从中国医学细菌保藏管理中心保存大量铜绿假单胞菌标准菌株中选取了 10 株不同来源铜绿假单胞菌作为阳性参考品制备菌株,尽管这些菌株在我们实验室均有完整形态和生化鉴定记录,本研究仍进行了传统形态特征与生化、质谱、16S rRNA 基因序列分析以及后续全基因组测序方法(结果未显示)多种不同原理鉴定分析方法对这些菌株进行验证。在制备阴性参考品菌株的选择时,也充分考虑了与铜绿假单胞菌感染部位相同或感染症状相似且常见的同一种属其他病原体,以及其他类似食源性病原体,从而尽可能确保本研究研制的国家参考品使用阳性和阴性参考品菌株具有代表性。
作为评价标准物质的最关键参数之一,参考品的稳定性优劣直接影响其质量。依据《中国药典》2020 版《生物制品国家标准物质制备和标定规程》要求,在研制国家参考品时应设置不同温度和不同时间进行候选参考物质的稳定性评价[15]。本研究将各种候选参考品经反复冻融 3 次和5 次后,以及分别于 4 ℃、25 ℃、37 ℃ 放置 3、7 和14 d 后进行检测分析,结果发现即使在 37 ℃ 放置 14 d的极端温度条件下,也仅有个别样品未能检出,其他结果与-20 ℃ 保存的样品分析结果无显著性差异,这些结果表明候选参考品的稳定性良好。
在国家参考物质研制过程中,为了保证参考品特性值的准确性,要求 3 个实验室及以上进行参考品协作验证研究[17]。本研究组织国内 5 家生产铜绿假单胞菌核酸测定试剂盒厂家实验室进行候选参考品的协作标定研究,发现除厂家 5 的产品不能成功检出 P8 阳性参考品样品,其他阳性和阴性候选参考品检测分析均符合规定要求。事实上,本研究前期候选参考品特性分析时,也使用了该厂家的铜绿假单胞菌核酸测定试剂盒产品,多次实验均能成功检测 P8 样品。推测这种不一致的结果可能与协作标定研究的实验操作相关。同时,也提示在以后使用参考品进行质量控制时,应严格按照推荐使用条件进行操作使用。此外,协作标定研究也表明不同试剂盒的最低检出量参考品略有不同,可能与各自试剂盒检测灵敏度相关。但总体远低于实际应用中阳性样品存在的菌体数量,均满足检测需求。
综上所述,本实验室成功建立了铜绿假单胞菌核酸检测国家参考品(参考品文号:210023-201901),该参考品具有良好的均匀性和稳定性,能够用于铜绿假单胞菌核酸检测相关质量控制和评价。
