抗生素微生物检定法测定酒石酸泰万菌素预混剂的有效含量
2022-04-11田新岳马春芳吴春燕崔生玲余永涛
田新岳,张 雯,马春芳,吴春燕,邵 倩,崔生玲,杨 奇,余永涛*
(1.宁夏大学农学院,宁夏银川 750021;2.宁夏兽药饲料监察所,宁夏银川 750004)
酒石酸泰万菌素(tyvanillin tartrate)是大环内酯类抗生素,对金黄色葡萄球菌、肺炎链球菌、炭疽杆菌、猪丹毒丝菌、李斯特氏菌、腐败梭菌、气肿疽梭菌等均有较强的抑制作用,对鸡毒支原体和滑液囊支原体也具有较强的抗菌活性,被广泛应用于鸡、猪支原体病,猪回肠炎和慢性肺阻塞猪蓝耳病等的治疗[1-5]。此外,酒石酸泰万菌素还具有抗炎作用[6]。
酒石酸泰万菌素是一种微生物发酵合成的抗生素,由酒石酸泰万菌素A、酒石酸泰万菌素B、酒石酸泰万菌素C和酒石酸泰万菌素D组成,其主要成分为酒石酸泰万菌素A。2017版《兽药质量标准》中收录的酒石酸泰万菌素剂型有酒石酸泰万菌素可溶性粉、酒石酸泰万菌素预混剂[7],其中酒石酸泰万菌素预混剂由酒石酸泰万菌素和脱脂米糠或脱脂大豆粉混合而成。各种剂型中酒石酸泰万菌素的含量测定方法是抗生素微生物检定法(管碟法)。该方法操作步骤繁杂、影响因素较多,准确度和重复性与高效液相色谱法(HPLC)等化学方法相比较差,近些年有逐渐被HPLC等其他方法替代的趋势[8-9]。但是该法采用活菌检测,灵敏度高,能直接显示抗生素的抗菌活性[10],特别是由微生物发酵产生的多种组分抗生素如酒石酸泰乐菌素、大观霉素、庆大霉素等[11],仍主要采用该法来测定其含量。酒石酸泰万菌素预混剂生产工艺和原辅料的差异会对酒石酸泰万菌素含量的测定结果产生重要影响,其影响因素有试验设计、标准品含量、称样量、稀释步骤[12],不同菌悬液浓度也会造成抑菌圈大小、形状的改变,从而影响试验结果。兽药质量分析标准方法验证的目的是证明采用的方法适用于检测要求,只有经过方法学验证的检测方法才能应用于药品含量检测[11,13]。根据《中国兽药典》(2025版)的修订要求,需要对抗生素微生物检定法测定酒石酸泰万菌素预混剂中酒石酸泰万菌素含量的方法进行方法学验证,从而为酒石酸泰万菌素预混剂的含量检测提供可靠的技术保证。
因此,本研究采用抗生素微生物检定法对预混剂中酒石酸泰万菌素含量测定方法进行线性、准确度、精密度、专属性、耐用性等方法学验证,并对初始菌液浓度、超声提取时间等影响因素进行考察,最后应用方法学验证过的方法对酒石酸泰万菌素预混剂样品进行含量测定,以期为酒石酸泰万菌素预混剂中酒石酸泰万菌素含量测定方法的修订提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种及试剂 泰万菌素标准品(822 IU/mg,批号k0691908),中国兽医药品监察所提供;藤黄微球菌[CMCC28001],中国兽医药品监察所提供;20%酒石酸泰万菌素预混剂(批号20200931),湖北回盛生物科技有限公司产品;抗生素检定培养基Ⅱ号(pH7.8~8.0),分别购于青岛海博生物技术有限公司、北京陆桥技术股份有限公司、北京索莱宝科技有限公司。
1.1.2 主要仪器 抑菌圈自动测量分析仪(ZY-300IV)、牛津杯自动放置器(ZY-300G),购自北京先驱威锋技术开发公司;电子天平(UAE100、AE240),F28-pH计,购自上海梅特勒-托利多仪器有限公司;超声清洗仪(KQ-250B),购自昆山市超声仪器有限公司;电热水浴锅,购自树立仪器有限公司。
1.2 方法
1.2.1 溶液与双碟的制备
1.2.1.1 泰万菌素标准品储备液的制备 精密称取泰万菌素标准品30.41 mg于25 mL容量瓶中,加700 mL/L甲醇制成1000 IU/mL的泰万菌素标准品储备液,4℃保存备用。
1.2.1.2 泰万菌素标准品溶液的制备 精密量取5 mL泰万菌素标准品储备液到50 mL容量瓶中,加入磷酸盐缓冲液(pH8.0)稀释定容至刻度线,分别精密量取稀释后的溶液5 mL,加入50 mL和100 mL容量瓶中,然后在容量瓶中加入磷酸盐缓冲液稀释并定容,制成5 IU/mL(SL)、10 IU/mL(SH)的泰万菌素标准品溶液。
1.2.1.3 酒石酸泰万菌素预混剂供试品溶液的制备 精密称取20%规格的酒石酸泰万菌素预混剂125 mg于25 mL容量瓶中,加入适量700 mL/L甲醇超声,恢复室温后定容离心,制成1000 IU/mL的溶液。精密量取5 mL 1000 IU/mL的溶液于50 mL容量瓶中,在容量瓶中加入磷酸盐缓冲液(pH=8.0)稀释定容,分别精密量取5 mL稀释后的溶液到50 mL和100 mL容量瓶中,在容量瓶中加入磷酸盐缓冲液定容稀释制成5 IU/mL(TL)、10 IU/mL(TH)的供试品溶液。
1.2.1.4 磷酸盐缓冲液(pH8.0)的制备 取磷酸氢二钾9.8 g、磷酸二氢钾0.2 g,加水至1000 mL,过滤,115℃高压蒸汽灭菌30 min,冷却备用。
1.2.1.5 双碟的制备 取直径约90 mm、高17 mm的一次性无菌培养皿,注入115℃高压蒸汽灭菌30 min的抗生素检定培养基Ⅱ号(pH7.8~8.0)培养基20 mL,使其在培养皿内均匀摊布,放置水平台面上待其凝固,作为底层培养基。另取适量同种培养基115℃高压蒸汽灭菌30 min,冷却至53℃后加入试验菌悬液并混匀,然后将含菌培养基在每个培养皿加入5 mL,使其在底层上均匀摊布,作为菌层。用牛津杯自动放置器在每个培养皿中放置牛津杯,并用陶瓦圆盖覆盖备用。
1.2.2 菌悬液的制备和含菌培养基的制备 菌悬液的制备:取藤黄微球菌CMCC28001营养琼脂斜面培养物,将藤黄微球菌Ⅱ代甘油保存液接种于营养琼脂斜面上,于26℃培养24 h,用适量9 g/L生理盐水将菌苔洗下,将其以1 mL/个的比例继续接种于新的营养琼脂斜面培养物继续在26℃培养24 h,加入适9 g/L生理盐水将菌苔洗下,置于4℃冰箱备用,储存时间不得超过7 d。
含菌培养基的制备:取抗生素检定培养基Ⅱ号(pH7.8~8.0)溶解,115℃高压蒸汽灭菌30 min,在53℃左右加入适量菌悬液,振荡摇匀备用。
1.2.3 最适菌液浓度的确定 分别以0.5、1、2、3、4、5、6 mL藤黄微球菌悬液加入100 mL培养基内配制7种不同浓度的菌层培养基,配制高低浓度分别为10 IU/mL和5 IU/mL的标准品及样品稀释液,按照SH→TH→TL→SL的顺序加入稀释后的抗生素溶液,观察形成抑菌圈的情况,用抑菌圈测量仪测量抑菌圈大小(应在在18 mm~22 mm之间)。
1.2.4 线性考察 精密称取泰万菌素标准品,用700 mL/L甲醇配制成1000 IU/mL的标准品溶液。精密量取该溶液5 mL至100 mL容量瓶中,加磷酸盐缓冲液(pH8.0)稀释制成100 IU/mL的溶液。再分别精密吸取2.64、3.30、4.13、5.00、6.25、8.0、10.00、12.50 mL 100 IU/mL的溶液至100 mL容量瓶中,用磷酸盐缓冲液(pH8.0)稀释至刻度线,制成中间浓度为5 IU/mL及C1-8(2.64、3.30、4.13、5.00、6.25、8.05、10.00、12.05 IU/mL)各浓度标准品溶液。取双碟24个,每碟中间隔的2管分别加入5 IU/mL的标准品稀释液,将每3个双碟分成一组,共8组,依次加样,置37℃培养16 h,测量抑菌圈直径。以浓度(C,IU/mL)的对数为横坐标(X),抑菌圈直径相对应各浓度的直径与中心点浓度直径的差值(D,mm)为纵坐标(Y)进行线性回归,得回归方程,确定线性范围。
1.2.5 超声处理时间的确定 精密称取20%规格的酒石酸泰万菌素预混剂125 mg于25 mL容量瓶中,加700 mL/L甲醇溶液适量,分别用超声处理10、15、20 min,放冷,按照1.2.1.3配置供试品溶液,按照抗生素微生物检定法[11]测定,对结果进行比较,确定适宜的超声处理时间。
1.2.6 准确度试验(回收率试验) 精密称取泰万菌素标准品适量,按比例(每1 mg含有1000 IU酒石酸泰万菌素)加入辅料,制成浓度相当于标示量80%、100%、120%的供试品溶液。根据抗生素微生物检定法方法进行测定,比较结果,计算回收率。
1.2.7 精密度试验 精密称取相同质量的供试品6份进行测定,计算RSD。
1.2.8 专属性试验 用样品中除酒石酸泰万菌素以外的辅料替代抗生素进行试验,观察测量是否出现抑菌圈。
1.2.9 耐用性 耐用性是采用单因素分析法对不同培养时间、不同厂家培养基进行试验,比较测定结果,计算RSD。
培养时间的考察:分别培养14 h、16 h、20 h后,按照抗生素微生物检定法对结果进行测定,比较结果。
不同厂家培养基的考察:分别使用3个不同厂家相同类型的抗生素检定培养基(Ⅱ号高pH),按照抗生素微生物检定法对样品进行测定,比较结果。
2 结果
2.1 最适菌液浓度
分别以0.5、1、2、3、4、5、6 mL藤黄微球菌悬液加入100 mL培养基内配制7种不同浓度的菌层培养基,配制高低浓度分别为10 IU/mL和5 IU/mL的标准品及样品稀释液,观察形成抑菌圈的情况,测量抑菌圈大小,结果见表1。
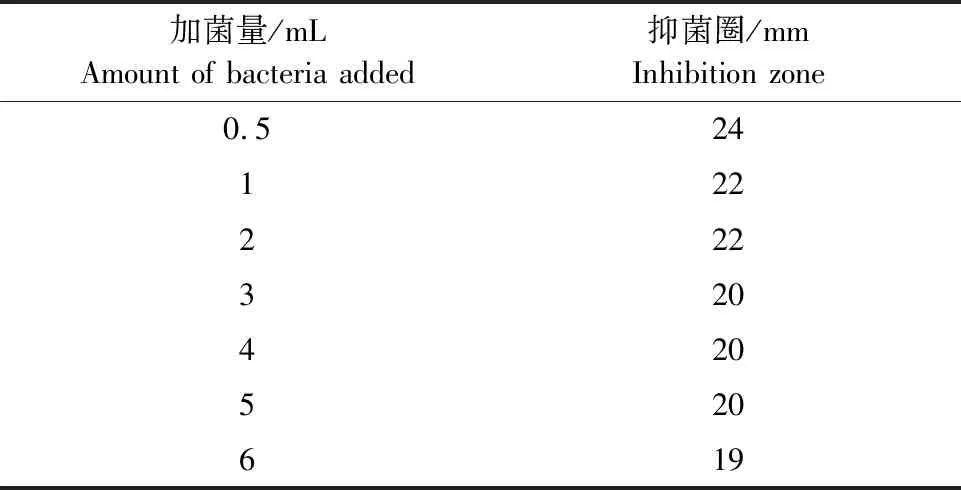
表1 加菌量与抑菌圈的关系Table 1 Relationship between adding amount of bacteria and inhibition zone
2020版《中国兽药典》附录1201抗生素微生物检定法[11]规定标准品溶液高剂量抑菌圈直径需在18 mm~22 mm范围内,要保证每次高剂量的抑菌圈在20 mm左右,本试验选择3 mL为加菌量。
2.2 线性
以各浓度的对数值为横坐标,相对应各浓度的直径与中心点浓度直径的差值为纵坐标作线性分析,得线性图见图1。回归方程y=0.760 8+0.159 5(x-16.927 5),相关系数R2为0.996 6。当酒石酸泰万菌素浓度在2 IU/mL~10 IU/mL的范围时浓度对数值与直径差值成良好的线性关系。
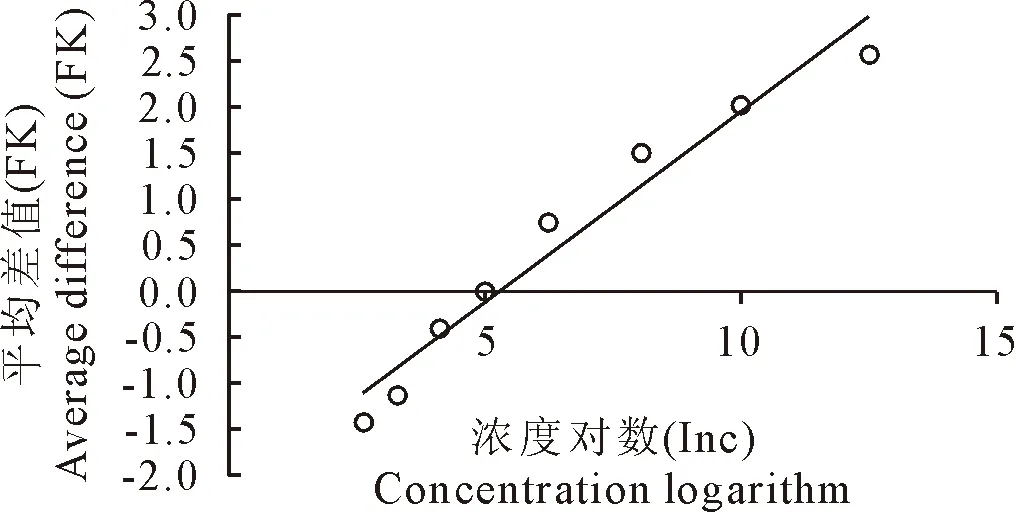
图1 标准曲线(n=8)Fig.1 Standard curve (n=8)
2.3 最适超声处理时间
不同超声处理时间对测定结果影响较大(表2)。不同的超声处理时间,对抗生素含量检测影响较大,可能原因是当超声处理10 min时,药品溶解不充分,供试品含量低于标准品溶液;当超声处理20 min时,由于处理时间过长,药品随着甲醇蒸发,导致供试品溶液与标准品溶液浓度差距大,偏离平行。所以,当超声处理15 min,测得结果最为准确,可信限率不超过5%,标示量在90%~110%之间,此时药品溶解最也较为充分。

表2 不同超声时间对结果的影响Table 2 Influence of different ultrasonic time on the results
2.4 准确度试验(回收率试验)
20%酒石酸泰万菌素预混剂含量测定的准确度结果见表3,标示量为80%、100%、120%的样品回收率在98%~101%范围内,平均回收率为100.24%,RSD为1.21%,结果符合2020版《中国兽药典》附录9101兽药质量标准分析方法验证指导原则[11],表明该方法准确度良好。

表3 加样回收率结果Table 3 Result of sample recovery
2.5 精密度试验
20%酒石酸泰万菌素预混剂含量测定的6次结果平均含量为标示量的102.9%,RSD为1.15%,精密度良好,结果见表4。
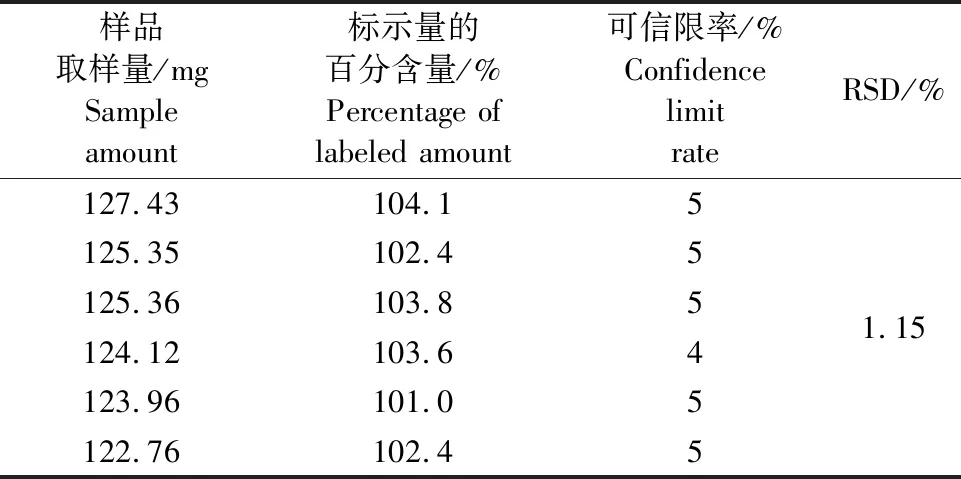
表4 20%酒石酸泰万菌素预混剂含量测定的精密度结果Table 4 Precision result of the determination of 20% tylvalosin tartrate premix
2.6 专属性试验
用辅料脱脂米糠代替酒石酸泰万菌素进行试验,结果未出现抑菌圈。结果表明,辅料对结果测定无影响,表明本方法专属性良好。
2.7 耐用性
采用单因素分析法分析不同培养时间、不同厂家培养基对测定结果的影响。不同培养时间结果RSD为1.94%,表明不同培养时间对测定结果影响较小(表5)。3个厂家的培养基结果RSD为0.20%,表明不同厂家培养基对测定结果影响较小,见表6。这些数据表明本方法耐用性良好。

表5 20%酒石酸泰万菌素预混剂不同培养时间的含量测定结果Table 5 Content determination results of 20% tylvalosin tartrate premix at different incubation times
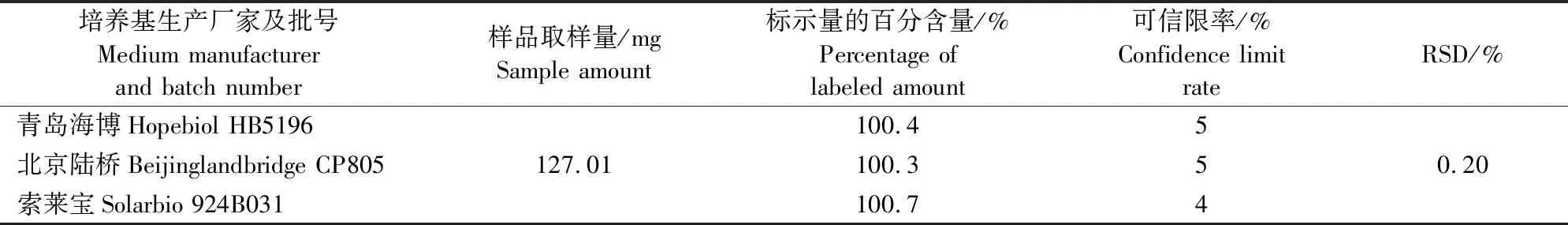
表6 20%酒石酸泰万菌素预混剂不同培养基的含量测定结果Table 6 Content determination results of 20% tylvalosin tartrate premix in different culture media
2.8 样品含量测定
对4个厂家5个批次的酒石酸泰万菌素预混剂,按上述方法对其进行含量测定,结果见表7,标示量在90%~110%之间,可信限率不得超过5%,均符合2017版《兽药质量标准》。
3 讨论
本研究采用抗生素微生物检定法对酒石酸泰万菌素预混剂的有效含量进行测定,选择菌液浓度为每100 mL培养基加3 mL菌悬液,超声时间15 min时药品溶解最好。酒石酸泰万菌素预混剂在2 IU/mL~10 IU/mL范围内具有良好的线性,线性方程为y=0.760 8+0.159 5(x-16.927 5),相关系数为R2=0.996 6,具有很高的显著性,20%酒石酸泰万菌素预混剂含量测定的准确度结果见表3,样品回收率在98%~101%范围内,平均回收率为100.24%,RSD为1.21%,精密度结果平均含量为标示量的102.9%,RSD为1.15%,结果见表4。专属性试验结果未出现抑菌圈,表明辅料对抗生素微生物检定法的结果测定无影响。不同培养时间含量测定结果RSD为1.94%,表明不同培养时间对测定结果影响较小。3个厂家的培养基含量测定结果RSD为0.20%,表明不同厂家培养基对含量测定结果影响较小。由于不同培养时间和不同厂家的培养基对结果测定影响较小,所以该方法耐用良好。目前有关酒石酸泰万菌素预混剂的含量测定尚未见文献,本研究对酒石酸泰万菌素预混剂的含量测定进行线性、准确度、精密度、专属性、方法耐用性等研究,以期为酒石酸泰万菌素预混剂的含量测定提供技术支持。
抗生素微生物检定法操作复杂,耗时,易受环境影响,影响因素有很多,比如实验台面不水平[14],如果台面不水平会导致双碟底层和菌层不平整,使得抑菌圈不完整;牛津杯[15]的重量大小也会影响试验结果,所以要选择重量一致的牛津杯,避免牛津杯重量不一致使得抗生素在琼脂中扩散不均匀引起试验误差。制备菌层时,菌层培养基温度过高会导致加入的藤黄微球菌失活;如果温度过低,又会导致菌层凝结成块[16],所以当其培养基温度在53℃时加入菌悬液制备菌层既保证了藤黄微球菌的生物活性,又防止了菌层凝结而影响试验结果。标准品在称量时要在室温平衡半小时以保证称量的准确[17]。张文刚[12]对抗生素微生物检定法测定酒石酸泰万菌素的不确定度进行评估,发现要尽可能减少稀释步骤,三步稀释最佳,所以我们在试验时采用三步稀释并在稀释过程中精密准确。抗生素的微生物检定法操作复杂,每一个因素都有可能影响试验结果的准确性,所以我们在进行试验时,要在水平的实验台面上进行操作,控制菌层温度,精准称量标准品和供试品,稀释时精密量取准确定容以保证试验结果的准确性。
