氨氮胁迫对锦绣龙虾代谢酶和抗氧化酶活力的影响*
2022-04-11周钱森任宪云
周钱森 任宪云 徐 垚 刘 萍 李 健
氨氮胁迫对锦绣龙虾代谢酶和抗氧化酶活力的影响*
周钱森1,2任宪云2,3徐 垚2,4刘 萍2,3李 健2,3①
(1. 水产科学国家级实验教学示范中心 上海海洋大学 上海 201306;2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东 青岛 266071;3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071;4. 江苏海洋大学 江苏省海洋生物资源与环境重点实验室/江苏省海洋生物技术重点实验室 江苏 连云港 222005)
为了研究急性氨氮胁迫对锦绣龙虾()抗氧化系统及氨氮代谢机制的影响,通过设置对照[(0.24±0.07) mg/L]、低浓度[(1.04±0.08) mg/L]、中浓度[(9.75±0.21) mg/L]和高浓度[(19.87±0.46) mg/L]氨氮胁迫方法对锦绣龙虾进行48 h急性实验,测定鳃与肝胰腺中抗氧化及氨氮代谢酶的活性,同时测定相关基因mRNA的相对表达变化情况。结果显示,氨氮胁迫下锦绣龙虾鳃和肝胰腺组织总抗氧化能力(T-AOC)、超氧化物歧化(SOD)活力有不同程度的升高,6~12 h均显著高于对照组(<0.05);高浓度组胁迫48 h时T-AOC、SOD活力则均被抑制;过氧化脂质(LPO)含量随胁迫时间的延长逐渐增加,48 h均显著高于对照组(<0.05)。氨代谢相关酶谷氨酰胺合成酶(GS)、谷氨酸脱氢酶(GDH)、谷草转氨酶(GOT)、黄嘌呤氧化还原酶(XOD)的酶活在氨氮胁迫下与对照组相比均有不同程度的上调,表明其共同参与离子氨的代谢转运。肝胰腺中GDH、GOT基因表达量在12~24 h显著高于对照组(<0.05),在鳃组织中变化趋势基本相同。由此可见,不同浓度的氨氮胁迫会对锦绣龙虾抗氧化酶活性造成不同程度的诱导;锦绣龙虾主要通过在肝胰腺GS、GDH等代谢相关酶的共同作用下合成无毒的谷氨酰胺以避免氨在体内过量积累。本研究结果可为锦绣龙虾氨解毒代谢机制的深入研究提供理论依据。
锦绣龙虾;氨氮胁迫;抗氧化;氨代谢酶
近年来,随着养殖技术的快速发展及市场需求的增加,高密度集约化养殖已成为主流养殖模式,水体中残饵和排泄物使得氨氮超标成为一种常态化的环境问题(Zhang, 2018)。水体中氨氮以非离子氨(NH3)和铵离子(NH4+)形式存在的氮,二者动态平衡,受水质的温度、盐度和pH等参数影响可相互转换(周平, 2013; 蔡真珍等, 2015)。氮主要是以NH3形式经鳃组织进入甲壳动物机体(Roumieh, 2013)。氨氮中毒会导致甲壳动物免疫低下、生长迟缓,同时伴随炎症反应和氧化应激等(Koo, 2005; Chen, 1995; Cheng, 2002)。研究发现,由于环境胁迫因子改变诱导的生理效应可能经氧化还原途径实现(Romano, 2007),当机体受到氨氮胁迫且超出自身调节阈值时,抗氧化系统被破坏,机体清除活性自由基(reactive oxygen species, ROS)能力下降,脂质过氧化产物增加,导致机体氧化损伤(Reinehr, 2007)。
目前,关于水产动物氨氮转运代谢机制的研究已有一定基础,主要通过以下代谢途径减少生物体内氨氮的积累,从而降低毒性:(1)通过谷氨酰胺合成途径,如斑节对虾() (周发林等, 2016)、凡纳滨对虾() (熊大林等, 2019)等可通过谷氨酰胺合成酶(glutamine synthetase, GS)、谷氨酸脱氢酶(glutamate dehydrogenase, GDH)等合成谷氨酰胺实现机体内氨的转运;(2)通过氨基酸代谢途径,如大弹涂鱼() (杨洋等, 2019)、泥鳅()(Chew, 2001)、大菱鲆()(孟振等, 2020)等通过相关转氨脱氢酶将氨转化为自由氨基酸储存;(3)通过鸟氨酸循环途径,如中国明对虾() (李少飞等, 2014)、三疣梭子蟹() (刘胜男等, 2015)等通过鸟氨酸氨甲酰基转移酶(OTC)结合精氨酸酶(arginase)等形成尿素;(4)通过嘌呤核苷酸分解途径,如挪威海螯虾() (Bernasconi, 2011)等可经黄嘌呤氧化还原酶(xanthine oxidoreductase, XOD)等形成尿酸。
锦绣龙虾隶属于十足目(Decapoda)、腹胚亚目(Pleocyemata)、龙虾科(Palinuroidea)、龙虾属()(梁华芳等, 2012)。锦绣龙虾()作为我国主要龙虾养殖品种之一,经济价值高,但其人工繁育尚未突破,主要依靠捕捞野生苗种(Liu, 2016; 梁华芳等, 2012),利用适温的地下海水进行陆基工厂化流水养殖和循环水集约化养殖。高密度的养殖条件下,氨氮已成为影响虾类正常生理代谢的重要环境因素之一。氨氮胁迫下,甲壳动物解毒代谢机制方面的研究主要集中在谷氨酰胺合成酶、谷氨酸脱氢酶、谷草转氨酶(glutamic oxalacetic transaminase, GOT)等(赵海涛, 2006; Qiu, 2018; Geng, 2020)。本研究侧重于锦绣龙虾的解毒代谢途径在氨氮胁迫下的响应机制,测定了氨氮胁迫下锦绣龙虾鳃及肝胰腺组中代谢关键酶GS、GDH、GOT、XOD活性和、基因mRNA表达量、抗氧化酶总抗氧化能力(T-AOC)、超氧化物歧化(SOD)活性及过氧化脂质(LPO)含量,旨在为锦绣龙虾氨解毒代谢机制的深入研究提供理论依据。
1 材料与方法
1.1 实验材料
实验所用锦绣龙虾购于海南省琼海市永贺生物科技有限责任公司,平均体长为(15.6±0.2) cm,平均体重为(187.0±0.5) g,暂养于黑色PVC桶中,实验用水为过滤净化后的天然海水,盐度为32.57,水温为23.7℃,pH为8.14,每日07:00更换砂滤海水,连续充气,10 d后开始正式实验。
1.2 实验方法
1.2.1 实验设计 实验浓度设置参考Chen (1988)和钟硕良等(1997)测定海水养殖池塘底层水的氨氮浓度(0~46 mg/L和0.01~29.3 mg/L)、Zhao(2020)关于氨氮对虾类生理免疫影响的汇总以及预实验结果,选用NH4Cl (分析纯,RG≥99.5%)配置不同实验组的氨氮浓度,分别为对照组(0.24±0.07) mg/L、低浓度组(1.04±0.08) mg/L、中浓度组(9.75±0.21) mg/L和高浓度组(19.87±0.46) mg/L。采用奈氏试剂法测定各实验组实际氨氮浓度。每组3个平行,每天07:00和17:00按照对应浓度梯度进行全换水,实验期间不投饵。
1.2.2 样品采集和处理 在胁迫0、6、12、24和48 h时,从每组的每个平行中随机挑选3尾龙虾,快速解剖取得鳃、肝胰腺组织,分别称取0.2 g,剪碎后加入1∶9的预冷生理盐水,超声波冰浴破碎,4℃低温4000 r/min离心20 min,取上清液,置于–80℃冰箱保存,用于酶活测定。剩余组织放于1.5 mL EP管投入液氮中储存,用于基因mRNA表达量分析。
1.2.3 氧化酶与氨氮代谢相关酶活性测定 按照南京建成生物工程研究所试剂盒说明书测定T-AOC、SOD、GS、GDH、GOT、XOD酶活力和LPO含量。
1.3 基因mRNA的表达分析
1.3.1 引物设计 根据锦绣龙虾目的基因cDNA序列,利用引物设计软件Primer Premier 5.0设计qRT-PCR引物,上述引物由生工生物工程(上海)有限公司合成,其序列见表1。
1.3.2 RNA提取 使用总RNA提取试剂盒提取处理后组织RNA,核酸定量仪检测RNA浓度,1.5%非变性琼脂糖凝胶电泳检测其完整性。
表1 本研究所用引物

Tab.1 Primers used in this study
1.3.3 cDNA第一链的合成 组织RNA经过RNA-free的DNA酶消化后,使用HiScript®Ⅱ Q RT superMix for qPCR(+g DNA wiper)试剂盒进行反转录合成cDNA第一链,–20℃保存备用。
1.3.4 荧光定量PCR扩增 按照ChamQTMSYBR®Color qPCR master mix说明书进行PCR扩增。反应体积10 μL:5.0 μL SYBR color qPCR master mix (2×),4.0 μL cDNA,0.2 μL Rox reference dyeⅡ (50×),上下游引物各0.4 μL (10 μmol/L),将上述试剂在1.5 mL离心管内混匀后,分装入96孔PCR板中。反应程序:95℃ 30 s;95℃ 10 s,60℃ 30 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。每个样品3个重复,加样完成后瞬时离心,收集液体在管底,在ABI 7500 Fast荧光定量PCR仪进行扩增,使用2–ΔΔCt法计算目的基因、的相对表达量。
1.4 数据分析
所有分析采用SPSS 18.0.0软件进行单因素方差分析(one-way ANOVA),使用OriginPro 2016软件作图。
2 结果与分析
2.1 氨氮胁迫对锦绣龙虾氨氮代谢相关酶活性的影响
2.1.1 对锦绣龙虾鳃和肝胰腺GS活性的影响 如图1所示,对照组谷氨酰胺合成酶(GS)活性变化不显著(>0.05),各时间低、中浓度组鳃和肝胰腺GS活力点均显著高于对照组(<0.05),高浓度组GS活力在48 h受到显著抑制(<0.05)。不同浓度组鳃组织GS活性呈先升高后降低的变化趋势,除24 h高浓度组与对照组无显著差异外(>0.05),其他时间点均有显著差异(<0.05)。不同浓度组肝胰腺GS活力均在12 h达到最大值,随后低浓度组无明显变化趋势,中、高浓度组呈下降趋势。

图1 锦绣龙虾不同组织谷氨酰胺合成酶活性随氨氮胁迫时间的变化
A:鳃;B:肝胰腺。不同字母表示不同组之间差异显著(<0.05)。下同
A: Gill; B: Hepatopancreas. Different letters indicate significant difference in different groups (<0.05). The same as below
2.1.2 对锦绣龙虾鳃和肝胰腺GDH活性的影响 如图2所示,随着胁迫时间的延长,中、高浓度组鳃和肝胰腺中的谷氨酸脱氢酶(GDH)活力呈先升高后降低的变化趋势。中浓度组鳃GDH活力在12 h达到最大值且显著高于其他组(<0.05),高浓度组在48 h时显著低于对照组(<0.05)。中、高浓度组肝胰腺GDH活力最大值分别出现在6 h和12 h,与对照组相比具有显著差异(<0.05)。
2.1.3 对锦绣龙虾鳃和肝胰腺GOT活性的影响 如图3所示,低浓度组鳃谷草转氨酶(GOT)活力在6~ 48 h变化规律不明显,但与对照组均有显著差异(< 0.05)。中浓度组呈先升高后下降的趋势,高浓度组出现先降低后升高再降低的波浪式变化,最大值均出现在12 h且显著高于对照组(<0.05)。48 h高浓度组鳃GOT活力受到显著抑制(<0.05)。中浓度组肝胰腺GOT活力出现先升高后降低再升高的波浪式变化,高浓度组呈先升高后下降的变化趋势。
2.1.4 对锦绣龙虾鳃和肝胰腺XOD活性的影响 如图4所示,随着胁迫时间的延长,各浓度组鳃黄嘌呤氧化酶(XOD)活力呈先上升后下降的变化趋势,中、高浓度组XOD活力显著升高,分别在12、24 h均达到最大值且显著高于对照组(<0.05)。低、中浓度组各时间点肝胰腺XOD活力均显著高于对照组(<0.05)。而高浓度组6~24 h均显著高于对照组(<0.05),48 h肝胰腺XOD活力受到显著抑制(<0.05)。
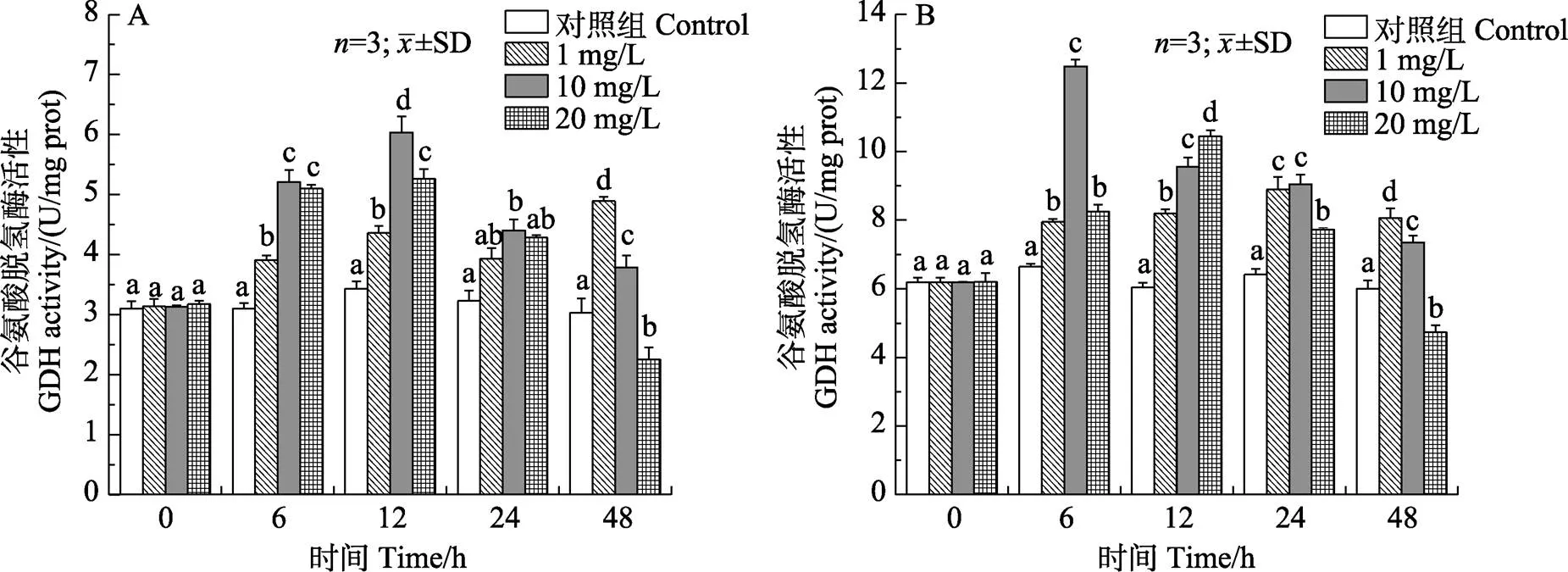
图2 锦绣龙虾不同组织谷氨酸脱氢酶活性随氨氮胁迫时间的变化
A:鳃;B:肝胰腺
A: Gill; B: Hepatopancreas

图3 锦绣龙虾不同组织GOT活性随氨氮胁迫时间的变化
A:鳃;B:肝胰腺
A: Gill; B: Hepatopancreas
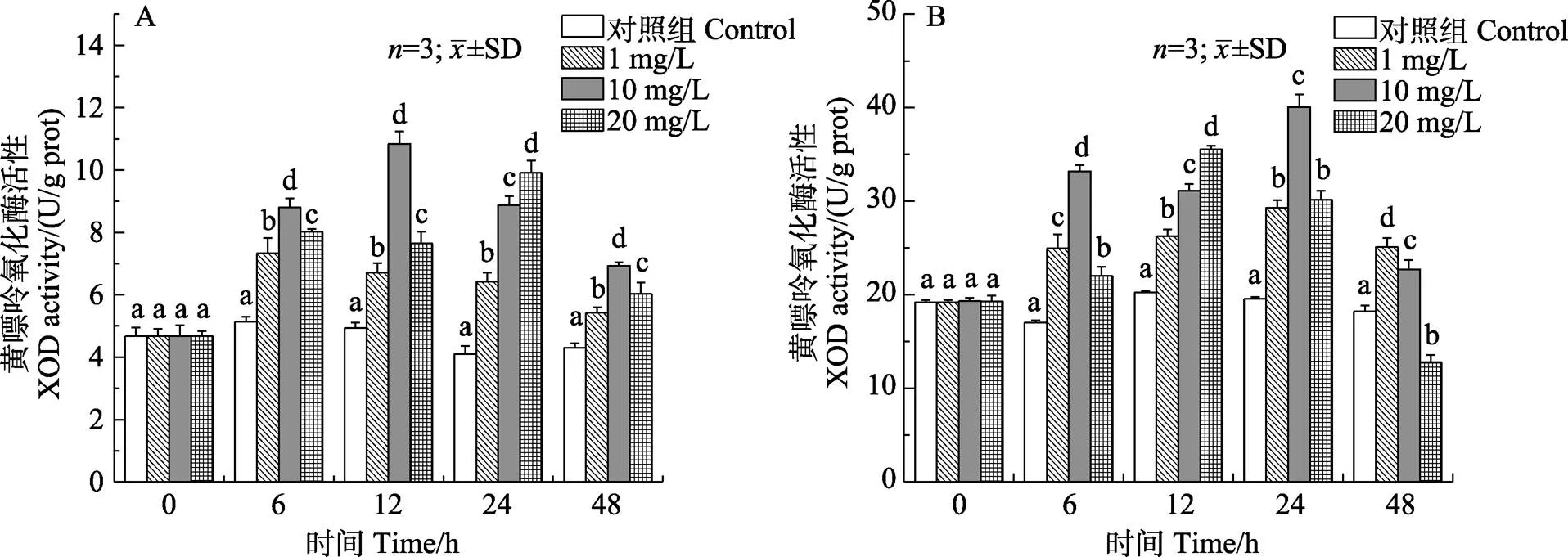
图4 锦绣龙虾不同组织黄嘌呤氧化酶活性随氨氮胁迫时间的变化
A:鳃;B:肝胰腺
A: Gill; B: Hepatopancreas
2.2 氨氮胁迫对锦绣龙虾氨氮代谢相关基因表达的影响
2.2.1 对锦绣龙虾鳃和肝胰腺中基因表达的影响 如图5所示,各浓度组鳃和肝胰腺谷氨酸脱氢酶()基因相对达量表现出明显的时效性。低、中浓度组鳃组织相对表达量呈现先上升后下降再上升的变化趋势,除6 h外,各时间点均显著高于对照组(<0.05)。而高浓度组鳃组织相对表达量则呈先上升后下降的趋势。不同浓度组肝胰腺相对表达量均呈先上升后下降的变化趋势,除48 h外,各时间点均与对照组有显著差异(<0.05)。
2.2.2 对锦绣龙虾鳃和肝胰腺中基因表达的影响 如图6所示,低、中浓度组鳃谷草转氨酶()基因的相对表达量呈先升高后降低再升高的波浪式变化,高浓度组则出现先升高后下降的变化趋势,除6 h外,其余各时间点鳃相对表达量均显著高于对照组(<0.05)。随着胁迫时间的延长,中、高浓度组肝胰腺相对表达量最大值均出现在12 h,与对照组相比具有显著差异(<0.05),除48 h外,各时间点均与对照组有显著差异(<0.05)。
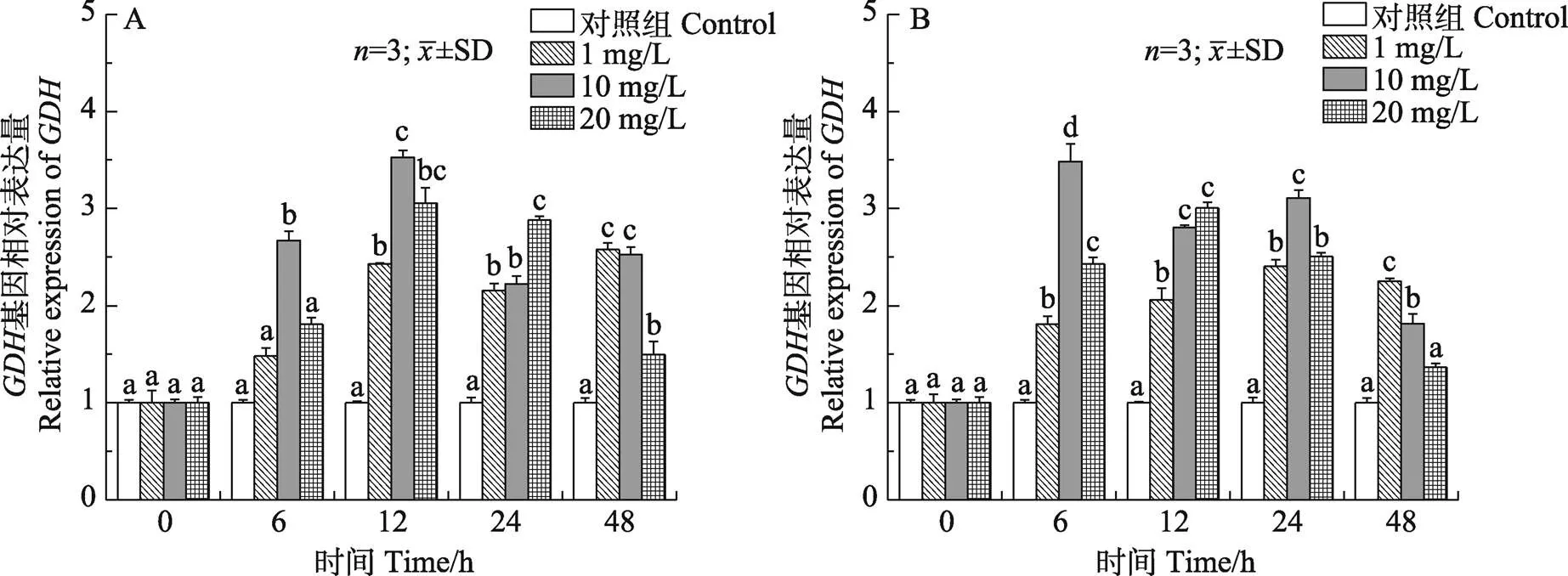
图5 锦绣龙虾不同组织GDH基因相对表达量随氨氮胁迫时间的变化
A:鳃;B:肝胰腺
A: Gill; B: Hepatopancreas

图6 锦绣龙虾不同组织GOT基因相对表达量随氨氮胁迫时间的变化
A:鳃;B:肝胰腺
A: Gill; B: Hepatopancreas
2.3 氨氮胁迫对锦绣龙虾抗氧化酶活性的影响
2.3.1 对锦绣龙虾鳃和肝胰腺T-AOC活性的影响 如图7所示,随着胁迫时间的延长,低浓度组鳃T-AOC活力呈持续升高的趋势,而中、高浓度组均呈先升高后下降的变化趋势,最大值均出现在12 h且显著高于对照组(<0.05)。中、高浓度组肝胰腺T-AOC活性最大值分别出现在12 h和6 h,与对照组相比差异显著(<0.05)。低、中浓度组48 h T-AOC活性仍显著高于对照组(<0.05),高浓度组则被显著抑制(<0.05)。
2.3.2 对锦绣龙虾鳃和肝胰腺SOD活性的影响 如图8所示,在胁迫过程中,各浓度组SOD活性随胁迫时间的延长均呈先上升后下降的趋势。低、中浓度组鳃SOD活性最高值均出现在12 h,高浓度组则在6 h,且均显著高于对照组(<0.05)。低、中浓度组肝胰腺SOD活性最大值均出现在12 h,与对照组相比有显著差异(<0.05)。高浓度组SOD活性在48 h被显著抑制(<0.05)。
2.4 氨氮胁迫对锦绣龙虾LPO的影响
锦绣龙虾肝胰腺中脂质过氧化物(LPO)含量明显高于鳃组织(图9)。低、中浓度组鳃和肝胰腺LPO含量逐步提升,高浓度组呈先升高后下降的变化趋势,不同浓度组在48 h均与对照组有显著差异(<0.05)。

图7 锦绣龙虾不同组织T-AOC活性随氨氮胁迫时间的变化
A:鳃;B:肝胰腺
A: Gill; B: Hepatopancreas
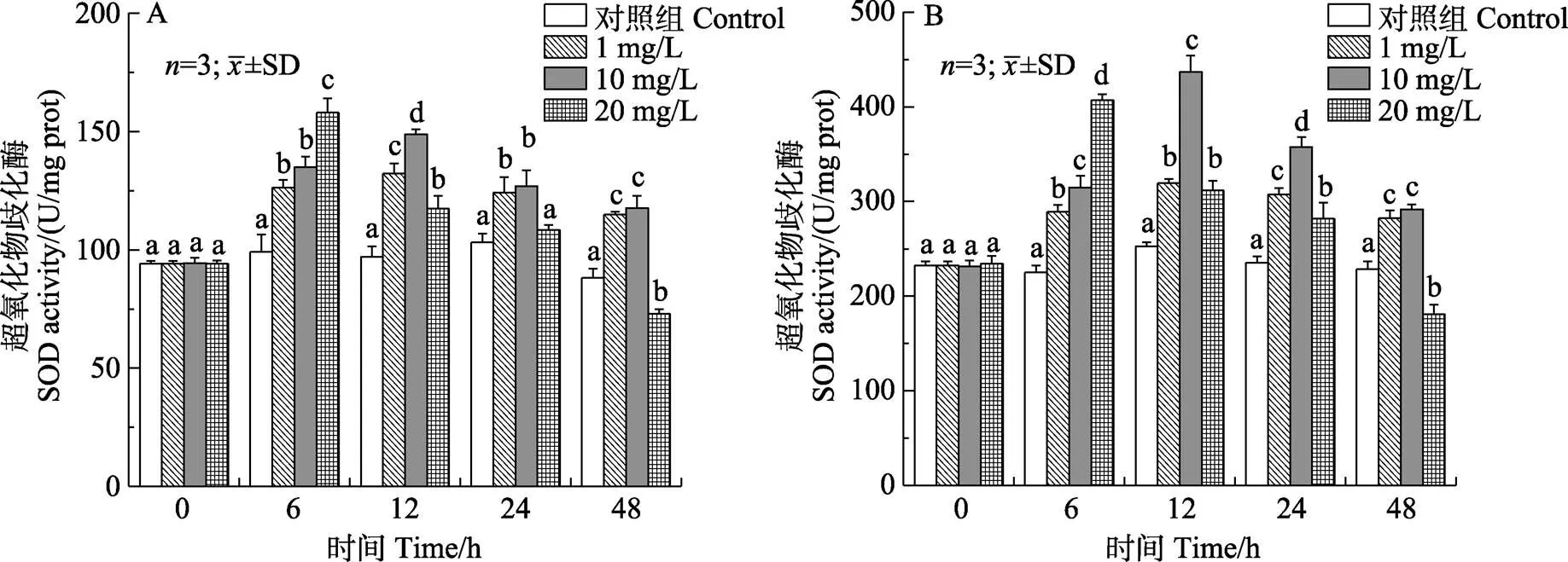
图8 锦绣龙虾不同组织SOD活性随氨氮胁迫时间的变化
A:鳃;B:肝胰腺
A: Gill; B: Hepatopancreas

图9 锦绣龙虾不同组织脂质过氧化物含量随氨氮胁迫时间的变化
A:鳃;B:肝胰腺
A: Gill; B: Hepatopancreas
3 讨论
3.1 氨氮胁迫对锦绣龙虾代谢机制的影响
研究表明,当水体环境中氨氮含量发生改变时,水生生物排泄方式也会发生变化,尿素排泄量增加(Chen, 1995)。在浓度为25 mmol/L氨氮胁迫下,砂栖胡鲶()谷氨酰胺和尿素含量显著增加,认为其在高氨水平下可诱导鸟氨酸–尿素循环将氨解毒为谷氨酰胺和进一步转化为尿素排泄来缓解氨氮毒性(Bodhisattwa, 2018)。金鱼()在浓度为3.6 mmol/L的高氨水平下,脑中谷氨酰胺增加4倍(Wilkie, 2015)。本研究结果显示,氨氮胁迫下,低、中浓度组GS酶活在氨氮胁迫12 h内急速升高,随后在24 h显著下降,为了降低氨氮在体内的积累,机体可能通过主动运输或者被动扩散的方式消除多余的氨氮,同时启动解毒代谢机制,表明锦绣龙虾具有一定的氨氮耐受能力。但48 h时,高浓度组GS酶活受到抑制,长时间氨氮胁迫使机体调节能力越来越弱,龙虾体内会出现过多的自由基而抑制相关酶活力,相关研究还见于中华乌塘鳢() (Anderson, 2002)、三疣梭子蟹(刘胜男等, 2015)等。氨氮胁迫组GDH活力的显著上调与周发林等(2016)的实验结果基本一致,表明在氨氮胁迫下将氨合成中性、无毒的谷氨酰胺是锦绣龙虾重要的氨代谢途径。随着胁迫时间的延长,锦绣龙虾体内氨氮逐渐积累,其排泄方式发生改变,6 h后GOT表达量显著上调,推测是其催化转氨反应生成天门冬氨酸参与尿素形成的缘故。虽然然而尿素形成十分消耗能量,甲壳动物的主要排氨途径仍是合成谷氨酰胺,GOT表达量再次下调。氨氮胁迫下,各浓度组XOD活性显著高于对照组,并表现出一定的剂量效应,24 h后,XOD活性显著下调,可能是胁迫前期产生的尿酸使XOD活性受到抑制。不同处理组48 h XOD活性具有显著差异,在肝胰腺组织中尤为明显。高浓度组XOD活性呈逐渐下降状态,且显著低于对照组。可能是由于水体中氨氮浓度过大,肝细胞遭到破坏的缘故。张克俭(1993)发现,当氨氮浓度高于10.44 mg/L时,中国明对虾肝胰腺中的吸收细胞部分转化为分泌细胞,并逐渐解体,解体后的细胞碎片及大量的溶酶体等结构堆积于肝管部位。推测氨氮胁迫下锦绣龙虾会通过嘌呤核苷酸分解代谢途径将氨转化为尿酸。
GDH是一种需借助辅酶实现谷氨酸生物合成的线粒体酶,作为动物获得能量腺嘌呤核苷三磷酸(adenosinetriphosphate, ATP)的重要途径,GDH催化反应连接着三羧酸循环与谷氨酸,在氨氮代谢过程中发挥重要作用(王秋菊等, 2011)。GOT作为转氨反应的高效催化剂,主要通过辅酶在磷酸吡哆胺(pyrodoxamine photophate, PMP)和磷酸吡哆醛(pyridoxal phosphate, PLP)之间的相互转换实现氨基的转运(严明等, 2004)。本研究发现,氨氮胁迫下各浓度组与对照组目的基因表达量具有明显差异,高浓度组与低、中组相比,和基因的相对表达量后期下降明显,可能是由于长时间高浓度的胁迫打破了体内平衡,导致锦绣龙虾组织细胞受到损伤。研究结果显示,各处理组和基因表达量与酶活性的变化趋势有部分不同,考虑从基因表达到蛋白合成是一个复杂的修饰加工过程,蛋白活化会受到磷酸化等不定因素的影响,酶的活性也会受活性位点识别及激活因子浓度等多方面的影响,因此,表现出基因表达量与酶活性不一致的现象。这也说明基因的mRNA丰度与翻译产物的表达量不一定具有线性关系(Martin, 2008)。
3.2 氨氮胁迫对锦绣龙虾抗氧化系统的影响
当机体受到胁迫时,体内ROS含量迅速增加,未被抗氧化系统及时清除的ROS逐渐积累,促使细胞膜脂质过氧化物形成,从而造成氧化损伤(段亚飞等, 2014; Sun, 2011)。本研究中,氨氮胁迫初期,锦绣龙虾体内抗氧化酶活力显著升高。强俊等(2011)认为,抗氧化酶活力提升可视为生物体对ROS的适应,从而减轻脂质过氧化损伤。由于毒性效应,低、中浓度组T-AOC、SOD活性于胁迫12 h内呈短暂升高趋势,但随胁迫时间延长,6 h后逐渐受到抑制,高浓度组T-AOC、SOD活性在12 h后呈显著下降趋势。原因可能与氨氮胁迫过程中有毒物质(如LPO)积累量超过机体的耐受上限有关。胁迫初期,较低浓度的氨氮对机体抗氧化酶具有诱导作用,这种诱导作用是由于ROS增加引起的机体代偿。一定时间后,由于歧化反应产生超出了其承受量的H2O2,导致其活力受到抑制(王贞杰等, 2017)。洪美玲等(2007)认为,随着氨氮胁迫时间的延长氨氮的增益效应消失,导致机体抗氧化酶活性下降,与任海等(2014)报道的氨氮胁迫对脊尾白虾抗氧化系统酶活力的影响以及强俊等(2011)报道的氨氮与密度胁迫对罗非鱼幼鱼肝脏抗氧化指标的联合影响结果相似。结合本研究高浓度组鳃和肝胰腺T-AOC和SOD活力在48 h时显著低于对照组,也说明较高浓度的氨氮胁迫对机体产生了一定程度的毒害作用。
LPO作为脂质过氧化反应产生的细胞毒性物质,其含量一定程度反映机体脂质过氧化水平和细胞损伤程度,同时间接反映生物体内ROS含量(何吉祥等, 2016)。本研究发现,不同浓度氨氮胁迫后,肝胰腺LPO含量明显大于鳃组织,可能由于肝胰腺是锦绣龙虾主要的代谢组织。胁迫前期生物体内抗氧化系统被激活,但LPO含量仍在显著上升,说明机体仍然处于脂质过氧化状态。各浓度组鳃和肝胰腺LPO含量均有不同程度的升高,推测由于水中氨氮浓度的升高,导致脂质过氧化作用增强,也进一步提示氨氮胁迫下LPO积累可能是氨氮对锦绣龙虾产生毒害作用的主要原因之一。
ANDERSON P M, BRODERIUS M, FONG K C,. Glutamine synthetase expression in liver, muscle, stomach and intestine ofin response to a high exogeneous ammonia concentration. Journal of Experimental Biology, 2002, 205(14): 2053–2053
BERNASCONI C J, UGLOW R F. Purineolytic capacity response ofto prolonged emersion: An ammonia detoxification process. Aquatic Biology, 2011, 11(3): 263–270
BODHISATTWA B, DEBAPRASAD K, GITALEE B,. Differential expression of multiple glutamine synthetase genes in air-breathing magur catfish,and their induction under hyper-ammonia stress. Gene, 2018, 671: 85–95
CAI Z Z, ZHENG S H, WANG X. The relationship between NO3–-N, NH4+-N and environmental factors in coastal aquaculture water. Journal of Quanzhou Normal University, 2015, 33(6): 45–50 [蔡真珍, 郑盛华, 王宪. 近海养殖水体中NO3–-N、NH4+-N和环境因子的关系. 泉州师范学院学报, 2015, 33(6): 45–50]
CHEN J C, LIN C Y. Responses of oxygen consumption, ammonia-N excretion and urea-N excretion ofexposed to ambient ammonia at different salinity and pH levels. Aquaculture, 1995, 136(3/4): 243–255
CHEN J C, LIU P C, LIN Y T,. Super intensive culture of red- tailed shrimp. Journal of the World Aquaculture Society, 1988, 19(3): 127–131
CHENG W, CHEN J C. The virulence of enterococcus to freshwater prawnand its immune resistanceunder ammonia stress. Fish and Shellfish Immunology, 2002, 12(2): 97–109
CHEW S F, JIN Y, IP Y K. The loachreduces amino acid catabolism and accumulates alanine and glutamine during aerial exposure. Physiological and Biochemical Zoology, 2001, 74(2): 226– 237
DUAN Y F, ZHANG J S, DONG H B,. The non-specific immune response oftochallenge. Journal of Fisheries of China, 2014, 38(9): 1557–1564 [段亚飞, 张家松, 董宏标, 等. 副溶血弧菌对斑节对虾非特异性免疫酶活性的影响. 水产学报, 2014, 38(9): 1557–1564]
GENG Z, LIU Q, WANG T,. Changes in physiological parameters involved in glutamine and urea synthesis in Pacific white shrimp,, fedsp. meal and exposed to ammonia stress. Aquaculture Research, 2020, 51(7): 2725–2734
HE J X, PAN T S, JIANG Y Y,. Effects of dietary carbohydrate to protein ratios and feeding rate on growth and lipid metabolism index of. Journal of Shanghai Ocean University, 2016, 25(2): 198– 206 [何吉祥, 潘庭双, 蒋阳阳, 等. 饲料糖蛋白质比和投喂率对异育银鲫生长及脂质代谢指标的影响. 上海海洋大学学报, 2016, 25(2): 198–206]
HONG M L, CHEN L Q, GU S Z,. Effects of ammonia exposure on immunity indicators of haemolymph and histological structure of hepatopancreas in Chinese mitten crab (). Journal of Fishery Sciences of China, 2007, 14(3): 412–418 [洪美玲, 陈立侨, 顾顺樟, 等. 氨氮胁迫对中华绒螯蟹免疫指标及肝胰腺组织结构的影响. 中国水产科学, 2007, 14(3): 412–418]
KOO J G, KIM S G, JEE J H,. Effects of ammonia and nitrite on survival, growth and moulting in juvenile tiger crab,(Linnaeus). Aquaculture Research, 2005, 36(1): 79–85
LI S F, HE Y Y, LI J T,. Cloning and expression analysis of aspartate aminotransferase cDNA infollowing ambient ammonia stresses. Journal of Fishery Sciences of China, 2014, 21(6): 1125–1133 [李少飞, 何玉英, 李吉涛, 等. 中国明对虾天门冬氨酸转氨酶基因的克隆及氨氮胁迫对其时空表达的影响. 中国水产科学, 2014, 21(6): 1125–1133]
LIANG H F, HE J G. Growth model for one-year old. Journal of Fishery Sciences of China, 2012, 19(2): 364–370 [梁华芳, 何建国. 实验条件下1龄锦绣龙虾的生长特性. 中国水产科学, 2012, 19(2): 364–370]
LIANG H F, HE J G. Study on the artificial propagation and embryonic development of. Acta Hydrobiologica Sinica, 2012, 36(2): 236–245 [梁华芳, 何建国. 锦绣龙虾人工繁殖和胚胎发育的研究. 水生生物学报, 2012, 36(2): 236–245]
LIU L, YANG X L, LIU C W. Eleven novel polymorphic microsatelliteloci in the ornate spiny lobster(Decapoda: Palinuridae). Journal of Genetics, 2016, 93(2): 65–67
LIU S N, PAN L Q, LIU M Q. Effects of ammonia exposure on key detoxification metabolism associated genes expression in swimming crab. Transactions of Oceanology and Limnology, 2015(2): 97–104 [刘胜男, 潘鲁青, 刘茂琪. 氨氮胁迫对三疣梭子蟹解毒代谢关键基因表达的影响. 海洋湖沼通报, 2015(2): 97–104]
MARTIN R G, BARTLETT E S, ROSNER J L,. Activation of themarA/soxS/rob regulon in response to transcriptional activator concentration. Journal of Molecular Biology, 2008, 380(2): 278–284
MENG Z, ZHANG H L, LIU X F,. Toxic effects of acute ammonia stress on young turbot. Progress in Fishery Sciences, 2020, 41(2): 51–60 [孟振, 张鸿丽, 刘新富,等. 氨氮急性胁迫对大菱鲆幼鱼的毒性效应. 渔业科学进展, 2020, 41(2): 51–60]
QIANG J, XU P, HE J,. The combined effects of external ammonia and crowding stress on growth and biochemical activities in liver of (GIFT) Nile tilapia juvenile (). Journal of Fisheries of China, 2011, 35(12): 1837–1848 [强俊, 徐跑, 何杰, 等. 氨氮与拥挤胁迫对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化指标的联合影响. 水产学报, 2011, 35(12): 1837–1848]
QIU L, SHI X, YU S,. Changes of ammonia-metabolizing enzyme activity and gene expression of two strains in shrimpunder ammonia stress. Frontiers in Physiology, 2018, 9: 211
REINEHR R, GÖRG B, BECKER S,. Hypoosmotic swelling and ammonia increase oxidative stress by NADPH oxidase in cultured astrocytes and vital brain slices. Glia, 2007, 55(7): 758–771
REN H, LI J, LI J T,. Effects of acute ammonia stresses on antioxidant enzyme activities and GPx gene expression in. Journal of Agro-Environment Science, 2014, 33(4): 647–655 [任海, 李健, 李吉涛, 等. 急性氨氮胁迫对脊尾白虾()抗氧化系统酶活力及GPx基因表达的影响. 农业环境科学学报, 2014, 33(4): 647–655]
ROMANO N, ZENG C. Ontogenetic changes in tolerance to acute ammonia exposure and associated gill histological alterationsduring early juvenile development of the blue swimmer crab,. Aquaculture, 2007, 266(1/2/3/4): 246–254
ROUMIEH R, BARAKAT A, ABDELMEGUID N E,. Acute and chronic effects of aqueous ammonia on marbled spinefoot rabbitfish,(Forsskål 1775). Aquaculture Research, 2013, 44(11): 1777–1790
SUN H, YANG W, CHEN Y,. Effect of purified microcystin on oxidative stress of silver carplarvae under different ammonia concentrations. Biochemical Systematics and Ecology, 2011, 39(4/5/6): 536–543
WANG Q J, XU L, FAN M Z. Recent advances in transport systems of glutamate and glutamine. Chinese Journal of Animal Nutrition, 2011, 23(6): 901–907 [王秋菊, 许丽, 范明哲. 谷氨酸和谷氨酰胺转运系统的研究进展. 动物营养学报, 2011, 23(6): 901–907]
WANG Z J, CHEN S Q, CAO D Z,. Effects of acute ammonia nitrogen stress on histopathology of gill and liver and enzyme activities of juvenile. Progress in Fishery Sciences, 2017, 38(2): 59–69 [王贞杰, 陈四清, 曹栋正, 等. 急性氨氮胁迫对圆斑星鲽()幼鱼鳃和肝组织结构及相关酶活性的影响. 渔业科学进展, 2017, 38(2): 59–69]
WILKIE M P, STECYK J A W, COUTURIER C S,. Reversible brain swelling in crucian carp () and goldfish () in response to high external ammonia and anoxia. Comparative Biochemistry and Physiology, Part A Molecular and Integrative Physiology, 2015, 184: 65–75
XIONG D L, DUAN Y F, XU J M,. Physiological responses in gills ofexposed to the combined stress of temperature and ammonia. Journal of Southern Agriculture, 2020, 51(9): 2296–2303 [熊大林, 段亚飞, 徐敬明, 等. 凡纳滨对虾鳃组织对高温和氨氮胁迫的生理响应. 南方农业学报, 2020, 51(9): 2296–2303]
YAN M, XU W, CHEN F. Advances in structure and function ofAspAT. Chinese Journal of Bioprocess Engineering, 2004, 2(3): 14–18 [严明, 许伟, 陈菲.天冬氨酸转氨酶结构与功能关系的研究进展. 生物加工过程, 2004, 2(3): 14–18]
YANG Y, MENG F X, WANG R X. On the detoxification metabolic pathways ofexposed to acute ammonia-nitrogen stress. Biotechnology Bulletin, 2019, 35(11): 72–81 [杨洋, 孟繁星, 王日昕. 急性氨氮胁迫下大弹涂鱼解毒代谢途径的研究.生物技术通报, 2019, 35(11): 72–81]
ZHANG K J. Toxication of Zn2+and NH3-N on hepatopancreas of. Journal of Fisheries of China, 1993, 17(1): 52–59 [张克俭. 锌和氨氮对对虾肝胰脏的毒性作用. 水产学报, 1993, 17(1): 52–59]
ZHANG L, XU E G , LI Y,. Ecological risks posed by ammonia nitrogen (AN) and unionized ammonia (NH3) in seven major river systems of China. Chemosphere, 2018, 202(1): 136–144
ZHAO H T. Effects of ammonia on haematologieal and immune parameters of juvenile Southern catfish (Chen). Master´s Thesis of Southwest University, 2006 [赵海涛. 氨氮对南方鲶(Chen)幼鱼血液生理, 生化及非特异性免疫指标的影响. 西南大学硕士研究生学位论文, 2006]
ZHAO M M, YAO D F, LI S K,. Effects of ammonia on shrimp physiology and immunity: A review. Reviews in Aquaculture, 2020, 12(4): 2194–2211
ZHONG S L, CHEN Y Z, LIN K B,. Studies on variations of contents of NH4+-N, S2–and heterotrophic bacteria in substrate of shrimp ponds and their correlations. Journal of Applied Oceanography, 1997, 16(4): 449–454 [钟硕良, 陈月忠, 林克冰, 等. 虾池底质中NH4+-N、S2–和异养细菌含量的变化及其相关性研究. 台湾海峡, 1997, 16(4): 449– 454]
ZHOU F L, CHEN J S, HUANG J H,. Molecular cloning and expression analysis of glutamate dehydrogenase (GDH) inunder ammonia nitrogen stress. Journal of Fishery Sciences of China, 2016, 23(6): 1236–1246 [周发林, 陈劲松, 黄建华, 等. 斑节对虾谷氨酸脱氢酶基因克隆及氨氮胁迫对其时空表达的影响. 中国水产科学, 2016, 23(6): 1236–1246]
ZHOU P. The harm of ammonia nitrogen to aquaculture and its prevention measures. China Fisheries, 2013(8): 63–64 [周平.氨氮对水产养殖的危害及防治措施. 中国水产, 2013(8): 63–64]
Effects of Ammonia Stress on Metabolic and Antioxidant Enzyme Activities in
ZHOU Qiansen1,2, REN Xianyun2,3, XU Yao2,4, LIU Ping2,3, LI Jian2,3①
(1. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China; 2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Qingdao, Shandong 266071, China; 3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China; 4. Bioresources and Environment/Jiangsu Key Laboratory of Marine Biotechnology, Jiangsu Ocean University, Lianyungang, Jiangsu 222005, China)
In this study, in order to explore the effects of acute ammonia stress on the antioxidant and ammonia-nitrogen metabolism systems of, lobsters were exposed to different concentrations of ammonia (0.24±0.07, 1.04±0.08, 9.75±0.21, and 19.87±0.46 mg/L) for up to 48 h. The activity of antioxidant and ammonia-nitrogen metabolizing enzymes and related gene expression were assessed in the gills and hepatopancreas at 0, 6, 12, 24, and 48 h after ammonia stress. From 6 to 12 h, total antioxidant capacity (T-AOC) and superoxide dismutase (SOD) activity in the gills and hepatopancreas of.under ammonia nitrogen stress increased to varying degrees, and was significantly higher than that of the control group (<0.05). In the high-concentration group, T-AOC and SOD activity was inhibited for 48 h. The LPO content gradually increased with prolonged stress and was significantly higher than that of the control group (<0.05) at 48 h. The activities of the ammonia metabolism enzymes glutamine synthetase (GS), glutamate dehydrogenase (GDH), glutamic-oxalacetic transaminase (GOT), and xanthine oxidoreductase (XOD) were all up-regulated to varying degrees under ammonia stress compared with those of the control group, indicating that they are jointly involved in the metabolic transport of NH4+. Additionally, from 12 to 24 h, the expression of GDH and GOT genes in the hepatopancreas was significantly higher than that of the control group (<0.05); the same trend was identified in gill tissue. In brief, different concentrations of ammonia stress induce different levels of antioxidant enzyme activity.mainly synthesizes glutamine under the combined action of hepatopancreas GS, GDH, and other metabolic enzymes to avoid excessive ammonia in the body.
; Ammonia nitrogen stress; Antioxidant; Ammonia metabolic enzyme
LI Jian, E-mail: lijian@ysfri.ac.cn
S917.4
A
2095-9869(2022)02-0147-10
10.19663/j.issn2095-9869.20210125002
* 国家重点研发计划课题(2019YFD0900403)和中国水产科学研究院院级基本科研业务费(2020TD46)共同资助 [This work was supported by projects of the National Key R&D Program of China (2019YFD0900403), and Central Public-Interest Scientific Institution Basal Research Fund, CAFS (2020TD46)]. 周钱森,E-mail: qiansenzhou@126.com
李 健,研究员,E-mail: lijian@ysfri.ac.cn
2021-01-25,
2021-02-25
周钱森, 任宪云, 徐垚, 刘萍, 李健. 氨氮胁迫对锦绣龙虾代谢酶和抗氧化酶活力的影响. 渔业科学进展, 2022, 43(2): 147–156
ZHOU Q S, REN X Y, XU Y, LIU P, LI J. Effects of ammonia stress on metabolic and antioxidant enzyme activities in. Progress in Fishery Sciences, 2022, 43(2): 147–156
(编辑 冯小花)
