橘色双冠丽鱼体色相关基因mitf的结构及表达调控特性*
2022-04-11陈旭东邬国强宋红梅汪学杰牟希东胡隐昌
陈旭东 邬国强 宋红梅 汪学杰 牟希东 刘 奕 刘 超 胡隐昌
橘色双冠丽鱼体色相关基因的结构及表达调控特性*
陈旭东1,2邬国强1,2宋红梅2①汪学杰2牟希东2刘 奕2刘 超2胡隐昌2
(1. 上海海洋大学 水产科学国家级实验教学示范中心 上海 201306;2. 中国水产科学研究院珠江水产研究所农业农村部休闲渔业重点实验室 广东省水产动物免疫技术重点实验室 广东 广州 510380)
为了解小眼畸形相关转录因子基因在鱼类早期体色褪黑过程中的调控作用,本研究采用cDNA末端快速扩增(RACE)技术获得橘色双冠丽鱼()基因cDNA序列全长,利用实时荧光定量PCR (qRT-PCR)技术检测其在橘色双冠丽鱼胚胎不同发育时期、体色褪黑不同时期和各个组织中的表达规律。获得基因2个亚型,其中,的cDNA全长为1816 bp,包括5′非编码区(UTR) 158 bp、3′UTR 428 bp、开放阅读框(ORF) 1230 bp,共编码409个氨基酸;的cDNA全长为1638 bp,包括5´UTR 160 bp、3´UTR 428 bp和ORF 1050 bp,共编码349个氨基酸。同源性和系统进化分析显示,和聚在一小支,与慈鲷科(Cichlidae)鱼类同源性最高,与哺乳类动物同源性较低。qRT-PCR结果显示,在成鱼各个组织中,和均有不同程度表达,其中,眼部表达量最高且显著高于其他组织(<0.05),肌肉、脑和肾脏也有较高表达;和在胚胎各个发育时期均有表达,在受精卵时期表达量最高,显著高于其他胚胎期;随着橘色双冠丽鱼体色由黑色过渡到橘黄色,和在鱼皮肤、鳞片、尾鳍中的表达均呈逐渐下降的趋势,表明基因表达与鱼体色由黑到黄转变的表型间存在关联性,推测与鱼体色发育阶段色素细胞的分化和分布比例的动态变化相关。本研究通过了解鱼类体色发育和变异的分子基础,可为鱼类色素细胞发育和体色人工改良积累资料。
橘色双冠丽鱼;小眼畸形相关转录因子(MITF);qRT-PCR;黑色素细胞
MITF (microphthalmia-associated transcription factor)即小眼畸形相关转录因子,于放射诱导的突变小鼠中发现(Hertwig, 1942),突变体的后代会出现小眼畸形、早发性耳聋、皮毛和虹膜色素减退等症状。MITF是动物皮肤、眼睛和羽毛色素中黑色素细胞发育的关键调控因子(Lin, 2019),具有基本–螺旋–环–亮氨酸拉链(basic helix-loop-helix-leucine zipper, bHLHZip)结构,以二聚体的形式与酪氨酸家族启动子Mbox高度结合,通过直接调控、、、和等基因的表达,从而在黑色素细胞的发育、存活、迁移、增殖和分化过程中发挥重要作用(Steingrimsson, 2004)。在哺乳动物中,基因的突变或缺失可能会导致动物耳朵、眼睛、毛发、体色等表型发生改变,如鹌鹑()白色羽毛的产生(Minvielle, 2010)、马() (Hauswirth, 2019)和犬() (Korberg, 2014)皮毛白色斑点的出现等。在鱼类中,作为治疗黑色素瘤潜在的靶基因,已在斑马鱼()中开展了大量研究(Lister, 2014),在青鳉() (Li, 2013)、锦鲤() (Liu, 2015)、鲫鱼(, red var.) (Zhang, 2017)等鱼类中也开展了在胚胎和各个成鱼组织中表达情况的研究,初步探索了在鱼类体色形成过程中的作用,但其具体的调控机制及与其他体色相关基因的联级作用仍未被阐明。
橘色双冠丽鱼(),俗称红魔鬼,原产于中南美洲的尼加拉瓜、哥斯达黎加等地,是一种既可食用又可观赏的大型热带鱼类(Barluenga, 2010; Kautt, 2012)。通常1龄可达性成熟,成熟后的丽鱼体色为橘红色或橘色,生产上常将其作为父本与红头丽鱼()杂交,产生更具观赏性的子一代血鹦鹉鱼(♂♀)。橘色双冠丽鱼在发育过程中会出现体色过渡的现象,体色由最初黑色过渡至灰色,灰色再过渡至亮黄色,这一现象称为体色褪黑(蒋燕玲, 2016),主要是由于色素细胞的形成、增殖、迁移和分化所致。橘色双冠丽鱼含4种色素细胞,包括黑色素细胞、黄色素细胞、红色素细胞和虹彩细胞,其中,红色素细胞和虹彩细胞只在特定部位分布且数量较少,黑色素细胞和黄色素细胞在“黑色–灰色–黄色”3个时期均有分布,孵化后至体色由黑到黄的转变过程中,黑色素细胞数量呈逐渐增加而后又减少的趋势,黄色素细胞数量则呈一直增加趋势(韦敏侠等, 2015)。目前,国内外对鱼类早期体色褪黑这一复杂生物学过程的研究相对较少,其调控机制仍不明确。
鱼类体色的形成和分布主要是由其体表鳞片和皮肤中色素细胞的类型、分布和数量所决定(Shi, 2015; Yu, 2012),目前,已在鱼类中鉴定出6种色素细胞,包括黑色素细胞、黄色素细胞、红色素细胞、虹彩细胞、白色素细胞和蓝色素细胞(Volkening, 2018)。其中,黑色素细胞分布最为广泛,含有大量的黑色素颗粒,能够吸收特定波长的入射光,使鱼的颜色呈现黑色/灰色(Zhang, 2017)。黑色素细胞起源于外胚层神经嵴细胞,由神经嵴细胞经黑素母细胞、黑素干细胞发育成黑色素细胞(Cohen, 2016),黑色素细胞的形成受一系列通路和基因的严格调控(Hou, 2008),其中,MC1R/α-MSH信号通路(Newton, 2007)、PI3K/Akt信号通路(Khaled, 2002)、MAPK信号通路(Wang, 2017)、WNT/ β-catenin信号通路(Yamada, 2010)、NO信号通路(Park, 2009)为最常见的5条信号通路,作为这5条通路共有的靶向基因,直接关联黑色素细胞发育所必需的多个基因的表达,包括和等,对黑色素细胞存活、迁移、增殖和分化起着关键性作用(Steingrimsson, 2004)。本研究拟聚焦黑色素合成关键基因,检测其在橘色双冠丽鱼各组织、胚胎发育各时期和体色褪黑转换期的表达模式,了解其在鱼类体色褪黑调控中的作用规律。
1 材料与方法
1.1 实验材料
橘色双冠丽鱼取自中国水产科学研究院珠江水产研究所。选取性成熟且体色为橘色的健康双亲进行配对,获取不同发育时期的胚胎,包括受精卵、卵裂期、原肠期、神经期、视泡期、听泡期、心脏形成期、血液循环期等8个时期胚胎(蒋燕玲, 2016)。在体色发育的3个褪色阶段“黑色、灰白、黄色”各取3尾鱼,剥离鳞片、皮肤和尾鳍。同样选取性成熟且体色为淡黄色的橘色双冠丽鱼3尾,分离鳃、脑、肌肉、性腺、眼、肾和心脏7个组织,均用Trizol处理,于–80℃冰箱保存,用于RNA提取和荧光定量分析。
1.2 实验方法
1.2.1基因cDNA全长克隆 取性成熟橘色双冠丽鱼皮肤、鳞片、尾鳍于Trizol中,按Tissue RNA kit (OMEGA)操作步骤提取总RNA,通过1%琼脂糖凝胶电泳和SynergyTMNEO HTS多功能酶标仪检测RNA的完整性、纯度及浓度。利用Prime ScriptTMⅡ 1st strand cDNA synthesis kit (TaKaRa)反转录试剂盒合成cDNA第一链,置于–20℃冰箱保存。
根据已知慈鲷科(Cichlidae)鱼类保守序列,利用Primer 5.0软件设计扩增引物-F和-R (表1),以cDNA第一链为模板,扩增目的基因片段。25 μL扩增体系:16.75 μL ddH2O,4 μL dNTP mix,2.5 μL 10×Buffer,0.5 μL模板,上下游引物各0.5 μL,0.25μL r酶。反应条件:94℃预变性3 min,94℃变性30s,55℃退火60 s,72℃延伸60 s,35个循环,72℃后延伸5 min。PCR产物经1.0%琼脂糖凝胶电泳检测后,送广州艾基生物有限公司测序。根据测序结果设计5′race和3′race巢氏引物(表1),通过Smarter Race 5′/3′ kit components (TaKaRa)进行5′末端和3′末端序列扩增。扩增后PCR产物进行胶回收、连菌、37℃培养过夜,挑选阳性克隆进行测序。利用软件Vector NTI将5′端、3′端及其中间序列拼接,从而获得橘色双冠丽鱼完整cDNA序列(图1和图2)。
1.2.2 生物信息学分析 将拼接好的橘色双冠丽鱼基因在NCBI数据库中通过blast功能进行同源性分析,利用ORF finder查找开放阅读框;采用ExPASy ProtParam分析MITF蛋白的理化性质,包括蛋白质分子量、理论等电点、亲水系数等;借助Signal IP 4.1进行信号肽预测;利用TMHMM 2.0查找跨膜结构域;使用NetPhos 3.1工具进行磷酸化位点的查找;通过NetNGlyc 4.0查找糖基化位点,借助InterPro进行氨基酸结构域的分析;使用SOPAMA预测蛋白质二级结构;利用MEGA 7软件构建系统进化树。
1.2.3基因荧光定量分析 通过RNA提取试剂盒提取各胚胎、组织样品RNA,利用琼脂糖凝胶电泳和酶标仪检测其完整性及浓度。取1 ng RNA用EVOM-MLV反转录试剂盒合成cDNA第一链,存于–20℃冰箱待用。根据、基因全长设计特异性引物(表1),以β-actin为内参基因,采用Real-Time PCR方法在QuantStudio6 Flex仪器上对橘色双冠丽鱼各时期胚胎和不同组织进行荧光定量分析。20 μL反应体系:SYBR Green master mix 10 μL,ddH2O 8μL,cDNA 1 μL,上下游引物(10 μmol/L)各0.5 μL。反应条件:50℃ 2 min,95℃ 5 min;95℃变性15 s,55℃退火30 s,72℃延伸30 s,40个循环,每个样品3个重复。基因相对表达量的具体计算公式参考蒋燕玲等(2016)。利用SPSS 22.0软件进行单因素方差分析(one-way ANOVA)和Duncan多重比较。
2 结果
2.1 mitf基因cDNA全长和氨基酸序列分析
获得橘色双冠丽鱼基因2个亚型和,其中,cDNA全长为1816 bp,5′UTR长158 bp,3′UTR长428 bp,开放阅读框(ORF)为1230 bp,共编码409个氨基酸。预测其蛋白质分子量为39.1 kDa,理论等电点为5.23,亲水性系数为–0.603。TMHMM2.0查找发现无跨膜结构。磷酸化位点分析显示,该蛋白包含27个丝氨酸(S)磷酸化位点、9个苏氨酸(T)磷酸化位点、5个酪氨酸(Y)磷酸化位点。使用SOPAMA预测蛋白二级结构,其中,α螺旋结构131个(占37.01%),β折叠22个(占6.21%),无规则卷曲结构177个(占50%),延展链结构24个(占6.78%)。
表1 引物序列

Tab.1 Primer sequences

图1 橘色双冠丽鱼mitf1基因cDNA全长及氨基酸序列
方框为起始密码子ATG;*代表终止密码子;灰色阴影区域代表bHLHzip结构域。下同
Grey box is the initiation codon; “*” is the termination codon; Grey shade is bHLHzip domain. The same as below

图2 橘色双冠丽鱼mitf2基因cDNA全长及氨基酸序列

图3 橘色双冠丽鱼mitf1、mitf2基因的氨基酸序列比对
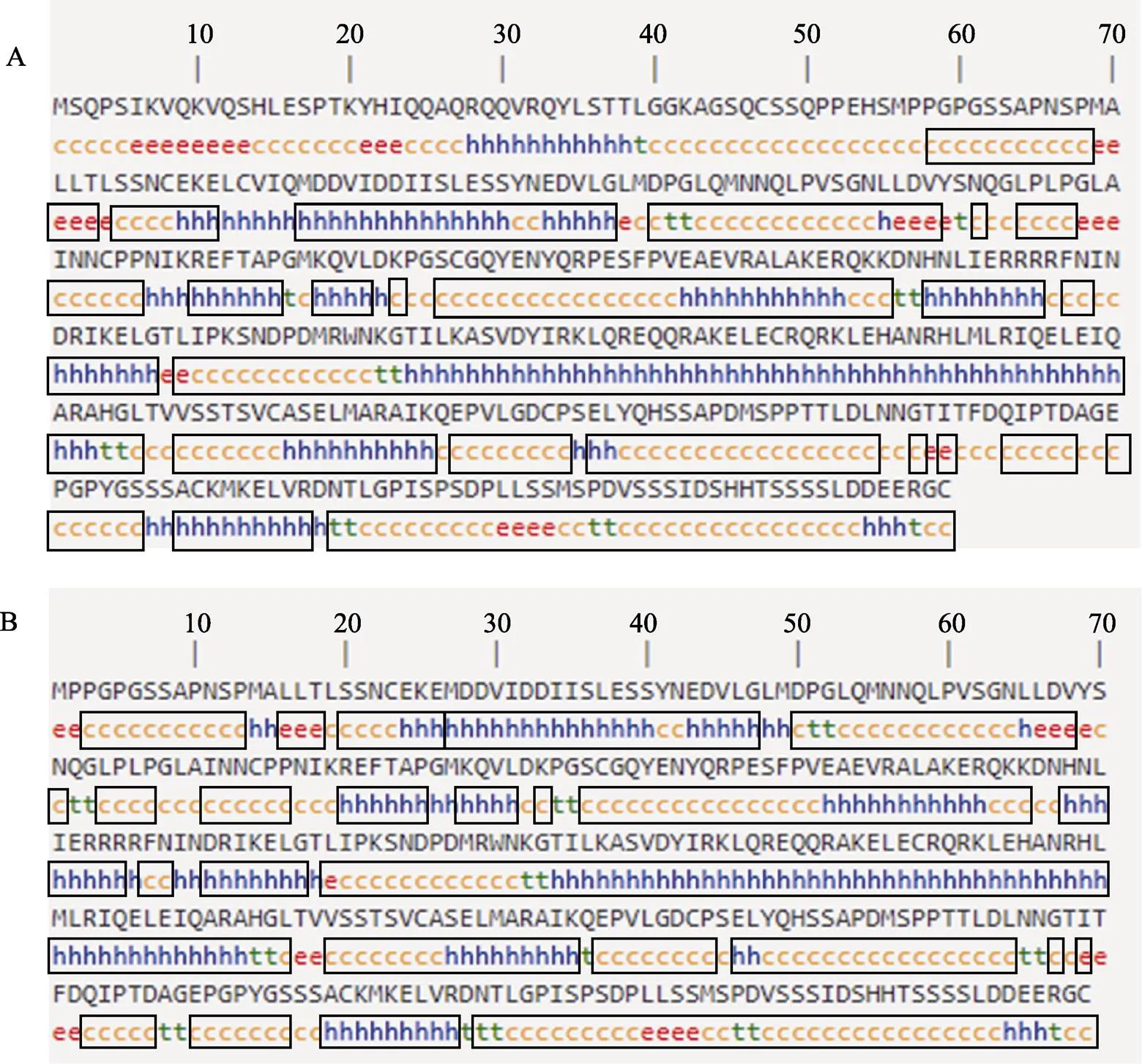
图4 橘色双冠丽鱼MITF1、MITF2蛋白二级结构预测
A:MITF1;B:MITF2;h:α螺旋;e:延展链;c:无规则卷曲;t:β折叠;灰色方框为MITF1、MITF2蛋白二级结构的相同部分
A: MITF1; B: MITF2; h: Alpha helix; e: Extended strand; c: Random coil; t: Beta turn; Grey boxed are the consensus of the secondary structure of MITF1 and MITF2 proteins
的cDNA全长为1638 bp,5′UTR长160 bp,3´UTR长428 bp,ORF为1050 bp,共编码349个氨基酸。预测其蛋白质分子量为38.5 kDa,理论等电点为5.23,亲水系数为–0.645和氨基酸序列比对结果显示(图3)亚型氨基酸序列与亚型相比,在0~53的位置多53个氨基酸,82~86的位置多5个氨基酸,其余位置完全相同。TMHMM 2.0查找发现无跨膜结构。磷酸化位点分析显示,该蛋白包含27丝氨酸(S)磷酸化位点、9个苏氨酸(T)磷酸化位点、5个酪氨酸(Y)磷酸化位点。使用SOPAMA预测蛋白二级结构(图4),其中,α螺旋结构142个(占40.69%),β折叠14个(占4.01%),无规则卷曲结构174个(占49.86%),延展链结构19个(占5.44%)。与蛋白二级结构相比,除0~53和82~86位置多出氨基酸及个别位点结构不同外,二级结构基本一致。
2.2 mitf基因同源比对和系统进化树分析
橘色双冠丽鱼2个亚型和的bHLHzip结构氨基酸序列与大多数物种高度一致,表明bHLHzip结构在进化过程中较为保守。利用MegAlign软件分析橘色双冠丽鱼mitf氨基酸序列与其他物种的同源性(表2),结果显示,橘色双冠丽鱼氨基酸序列与斑马拟丽鱼()、尼罗罗非鱼()和萨伊蓝六间()等鱼类同源性最高,分别为90.7%、91.9%和93%,与其他硬骨鱼类如大黄鱼()、斑鱼(s)和孔雀鱼()也有较高的同源性,分别达到了85.6%、87.4%和82.1%,而与人()、黑猩猩()、鸡()和非洲爪蟾()则相对较低,只有60%、60.9%、58.9%和63.1%。橘色双冠丽鱼氨基酸序列与人、黑猩猩、鸡和非洲爪蟾同源性同源也相对较低,分别为59.8%、60.9%、58.5%和64.4%,而与尼加拉瓜湖始丽鱼()、伯氏朴丽鱼()、布氏新亮丽鲷()和盲曹鱼()同源性则相对较高,都达到了90%以上。
表2氨基酸序列的同源性

Tab.2 GenBank accession number and the identity of mitf1 and mitf2
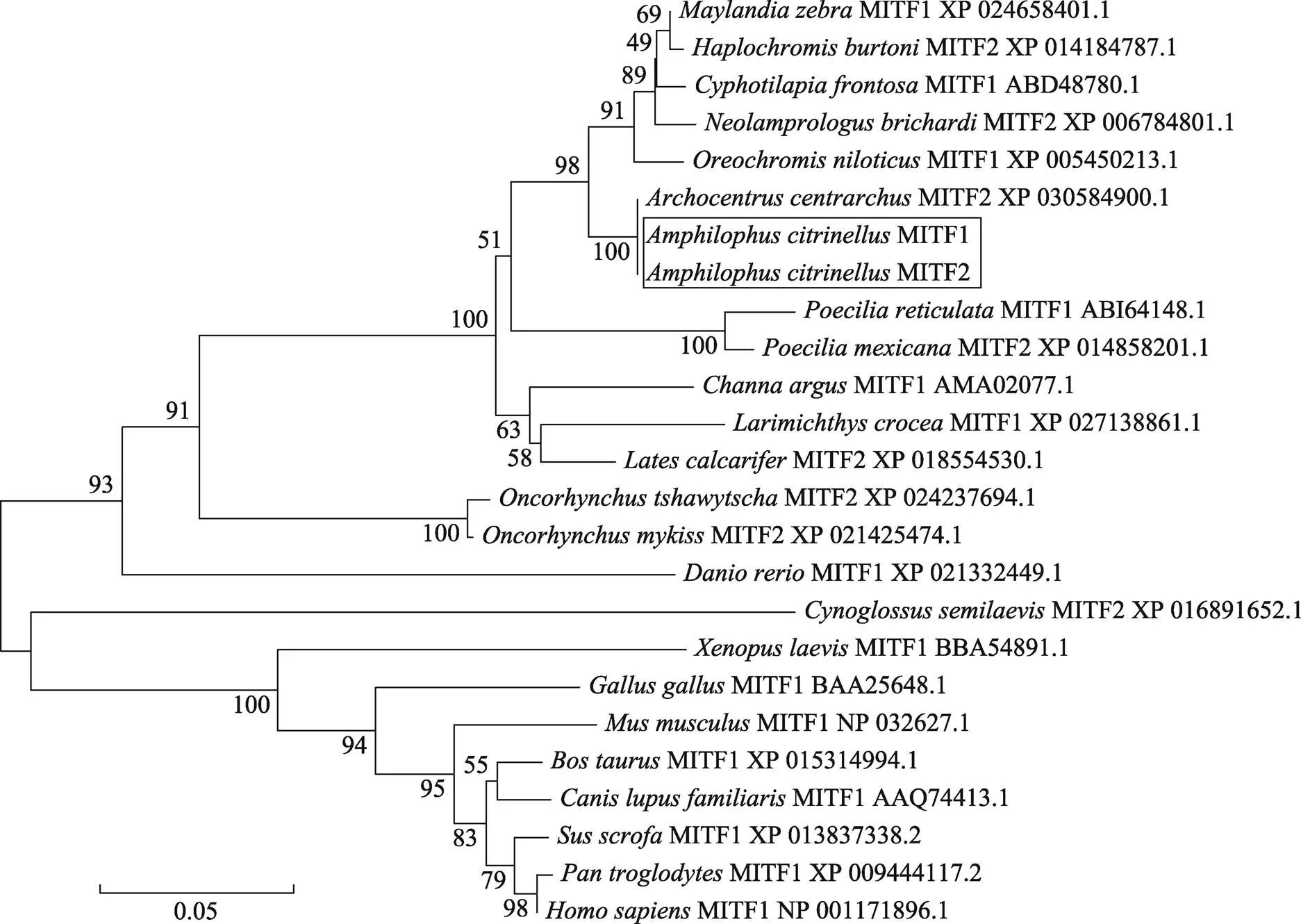
图5 MITF1、MITF2蛋白质序列系统进化树
以邻接法(Neighbor-joining)构建橘色双冠丽鱼MITF1、MITF2系统进化树(图5)。进化树分为两大支,哺乳类、鸟类、爬行类聚为一大支,橘色双冠丽鱼与其他慈鲷科、鲑科、鲤科鱼类聚为另一大支。其中,橘色双冠丽鱼MITF1、MITF2和尼加拉瓜湖始丽鱼聚为一小支,与斑马拟丽鱼、布氏新亮丽鲷、伯氏朴丽鱼、萨伊蓝六间、尼罗罗非鱼等鱼类亲缘关系最近;而与人、黑猩猩、小鼠、原鸡、非洲爪蟾等亲缘关系则相对较远。
2.3 mitf基因的表达差异分析
2.3.1 胚胎不同发育时期中的基因表达在8个胚胎发育时期均有不同程度的表达,其中,受精卵时期表达量最高,显著高于其他7个时期(<0.05),随着胚胎的发育,表达量逐渐下降,在神经期和视泡期只有微量表达。胚胎在发育至听泡期时表达量骤然上升(<0.05),随后在心脏形成期和血液循环期又呈现下降趋势(图6);在橘色双冠丽鱼胚胎发育的8个时期也均有表达,在受精卵时期表达量最高,显著高于其他发育时期(<0.05)。在卵裂期、原肠期表达量骤然降低,只有微量表达。发育至神经期时表达量升高,直至血液循环期均呈上升趋势,表达量不断增加(图7)。
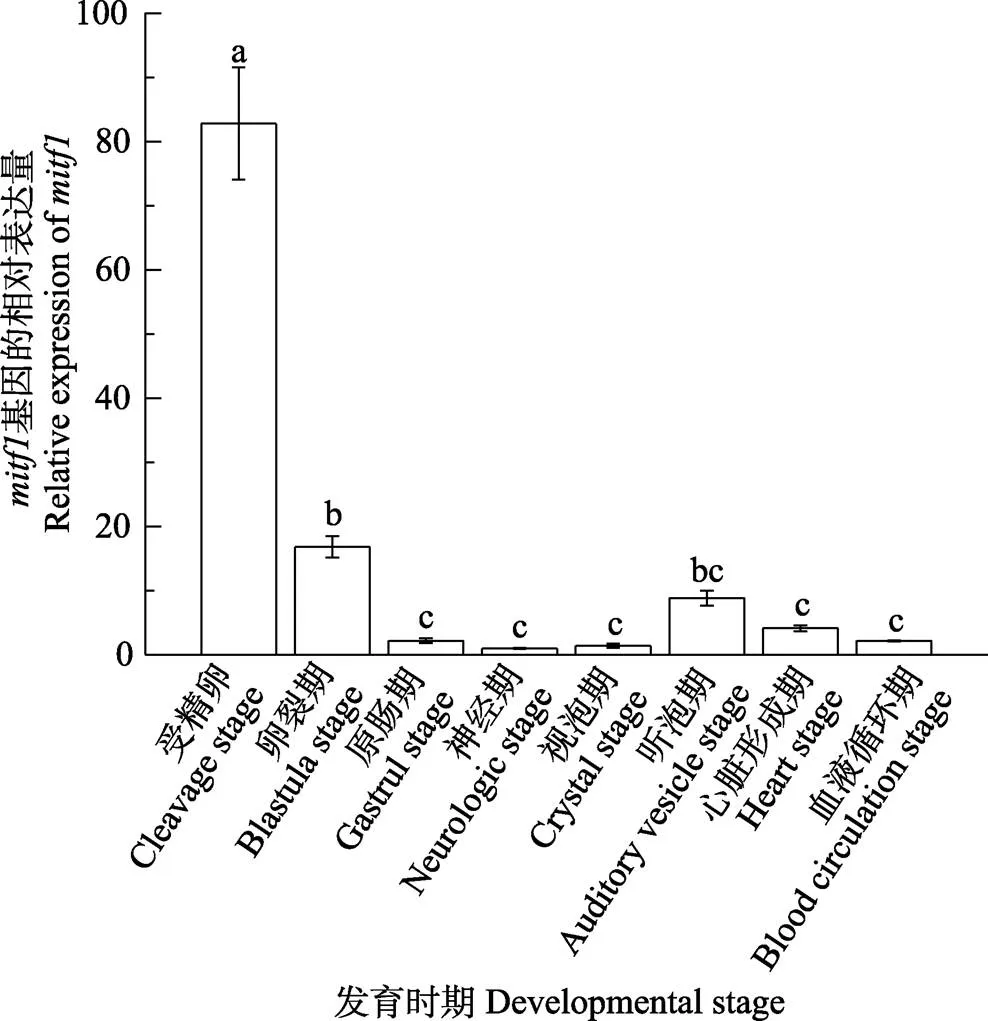
图6 mitf1在胚胎8个发育时期的表达差异分析
不同字母代表差异显著(<0.05)。下同
Different letters show significant difference (<0.05). The same as below

图7 mitf2在胚胎8个发育时期的表达差异分析
2.3.2 体色过渡3个时期基因的表达模式 橘色双冠丽鱼在“黑色–灰色–黄色”3个典型的体色过渡时期,在皮肤、鳞片、尾鳍,、均有不同程度的表达(图8和图9)。其中,在黑色过渡期皮肤中表达量最高,显著高于灰色和黄色过渡期(<0.05),灰色过渡期表达量略高于黑色过渡期,但无显著差异,整体呈逐渐下降的趋势,在鳞片和尾鳍中,的表达趋势与在皮肤中基本一致;在皮肤中,在黑色过渡期表达量最高,随着橘色双冠丽鱼发育,表达量逐渐降低,但无显著差异(>0.05),在鳞片和尾鳍中,在3个过渡时期的表达量同样呈现下降的趋势,黑色过渡期表达量最高,显著高于灰色过渡期和黄色过渡期(<0.05),灰色过渡期表达量高于黄色过渡期,但无显著差异(>0.05)。

图8 mitf1在不同体色过渡时期的表达差异分析
A:皮肤;B:鳞片;C:尾鳍
A: Skin; B: Scale; C: Tail fin
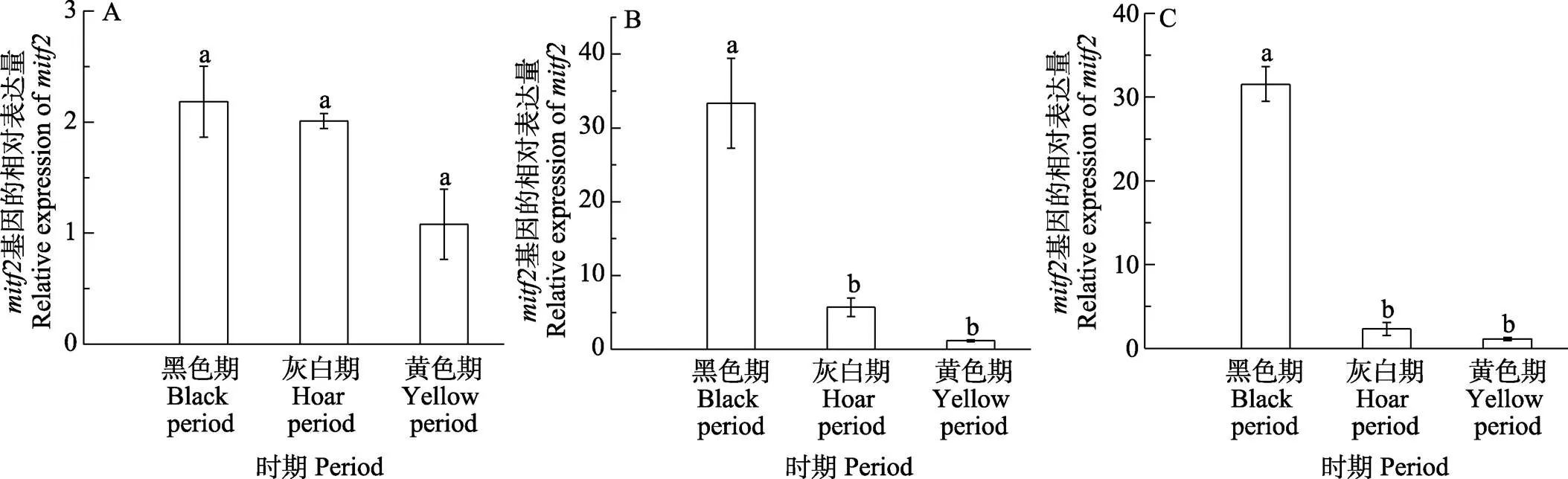
图9 mitf2在不同体色过渡时期的表达差异分析
A:皮肤;B:鳞片;C:尾鳍
A: Skin; B: Scale; C: Tail fin
2.3.3 成鱼不同组织中的基因表达差异 通过实时荧光定量PCR (qRT-PCR)检测和在橘色双冠丽鱼不同组织中的表达差异(图10)。结果显示,在各个组织中均有表达,眼部表达量最高,显著高于其他6个组织(<0.05),肌肉、肾、心脏、脑表达量也相对较高,性腺和鳃表达量则相对低一些。在7个组织中也均有表达,眼部表达量同样显著高于其他组织(<0.05),在鳃、脑、性腺、心脏组织中的表达量极低,只有微量的表达,肾和肌肉中的表达量也相对较低(图11)。
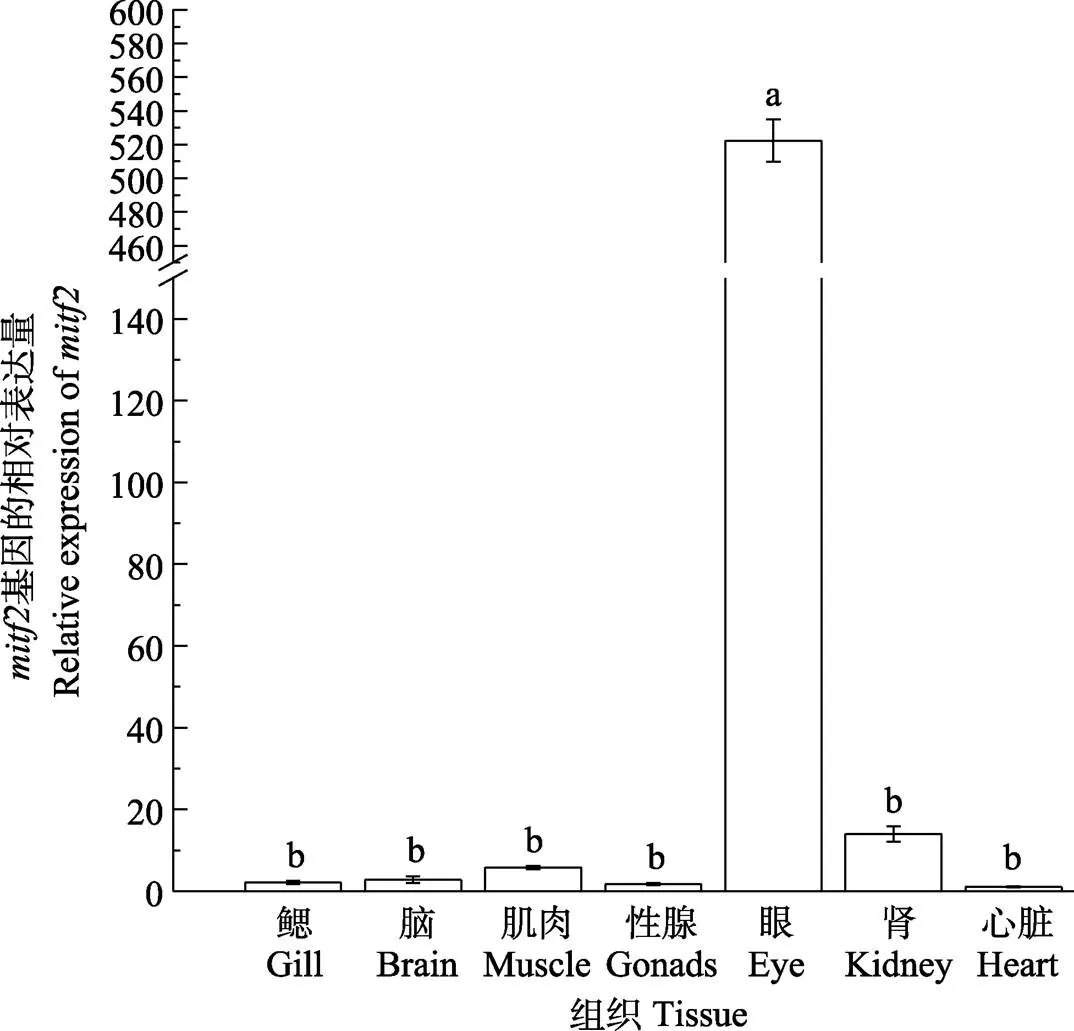
图11 mitf2在7种组织中的表达差异分析
3 讨论
3.1 mitf基因的cDNA全长和氨基酸序列分析
通过RACE技术获得橘色双冠丽鱼基因cDNA全长,2个亚型MITF1和MITF2均具有3个结构域:靠近N末端的MITF_TFEB_C_3_N结构域、bHLHZip结构域和一个未知功能结构域(DUF3371)。bHLHZip结构域作为MITF蛋白的功能区域,在进化过程中高度保守,其中,HLHZip区域能够与自身或转录因子TFEB (transcription factor EB)、TFEC、TFE3形成同源或异源二聚体,通过Basic区域与特异的DNA结合行使蛋白功能,特异性DNA指包含5′-CACGTG-3′或5′-TCATGTG-3′结构的DNA序列,即E-box或M-box (Bentley, 1994; Hemesath, 1994)。在哺乳动物中,受不同启动子调控,编码多个蛋白质异聚体,包括MITF-A、B、C、D、E、H、J、M、MC、CM等(Hershey, 2005; Shiohara, 2008),在鱼类中,从斑马鱼、青鳉分离得到的2种亚型和(Altschmied, 2002),这2种亚型在功能上发生了分化,对黑色素细胞的形成、增殖、迁移和分化起着重要的调控作用,而不参与黑色素细胞的发育,只在眼色素上皮细胞中表达,参与眼调控的发育(Lister, 2014),本研究克隆的和为基因2个亚型,均属于亚型,理化性质分析结果显示和的蛋白质二级结构极为相似,荧光定量结果显示和除了在胚胎期表达量有差异外,在各个组织和各转换时期表达量变化趋势基本一致,因此,推测和更多保留了基因功能,未出现明显基因功能分化。同源比对发现,橘色双冠丽鱼、与尼加拉瓜湖始丽鱼、萨伊蓝六间、斑鱼等鱼类具有较高的同源性,与哺乳类、鸟类、爬行类等同源性较低,符合橘色双冠丽鱼传统进化地位。
3.2 mitf基因表达差异分析
3.2.1基因在胚胎发育时期的表达和在橘色双冠丽鱼8个胚胎发育时期均有表达,其中,在受精卵时期表达量最高,显著高于其他发育期(<0.05),表现出明显的时期特异性。研究发现,基因也在其他动物胚胎发育期开始表达,但表达的时期较晚,如非洲爪蟾胚胎在21/22期开始表达(Kumasaka, 2010),鸡(Mochii, 1998)和鼠()(Nakayama, 1998)胚胎则在5日龄和9.5日龄开始表达。在青鳉中,基因在胚胎整个发育过程中最早表达于2细胞期(Li, 2013a、b),这与橘色双冠丽鱼表达模式相类似。蒋燕玲等(2016)对橘色双冠丽鱼胚胎组织学观察发现,黑色素细胞在血液循环期才开始出现,而在受精卵时期即出现高表达现象,结合前人报道,推测鱼类发育早期不仅调节黑色素细胞分化和发育,对视网膜色素上皮细胞、破骨细胞和肥大细胞也有不同程度的调控作用(Bauer, 2009)。在卵裂期,、基因表达量骤减,随胚胎发育表达量继续降低直至听泡期骤升后又继续下降,而随胚胎发育表达量逐渐升高直至血液循环期,仍呈现上升趋势,预示基因可能在黑色素细胞的发育过程中扮演着十分重要的角色。
3.2.2基因在不同褪色时期表达模式 在3个体色过渡时期中,皮肤、鳞片、尾鳍的和的表达量均呈逐渐下降的趋势,其中,黑色时期表达量最高,除皮肤的基因表达量在3个过渡时期无显著差异外,黑色时期鳞片和尾鳍中的表达量显著高于灰色期和黄色期,与下游基因在橘色双冠丽鱼不同褪黑时期逐渐降低的表达模式基本一致(蒋燕玲等, 2016)。这与鱼体表面各种色素细胞的比例与分布也存在对应关系,韦敏侠等(2015)研究发现,橘色双冠丽鱼在黄色时期皮肤中的黄色素细胞和红色素细胞数量和分布比例增多,黑色素细胞相对减少且处于凝集状态。在红鲫鱼发育过程中,基因也呈现相同的表达趋势,通过组织学观察发现,红鲫鱼黑色素细胞数量随着其发育的进行逐渐减少,体色由灰色逐渐过渡至红色,表达量随之降低(Zhang, 2017)。Liu等(2015)检测了不同品系锦鲤中基因表达量,发现含有黑色素细胞较多的,体色偏白或偏黑的锦鲤表达量较高,而含黑色素细胞较少的,体色呈红白或全黄的锦鲤皮肤的表达量偏低,表明表达量与黑色素细胞数量和分布比例呈正相关,印证了基因对黑色素细胞发育和分布的重要作用,本研究中和均属于,且也在黑色期表达量最高,与此结果相对应。而且黄色时期橘色双冠丽鱼皮肤中可检测到基因的表达(Liu, 2015),可见其可能还参与调控其他色素细胞形成。
3.2.3基因在成鱼不同组织间的表达差异、亚型在橘色双冠丽鱼各组织中均有表达,与在青鳉中的表达趋势相类似(Li, 2013a、b),其中,眼部表达量最高且显著高于其他组织,表明基因参与了橘色双冠丽鱼眼的发育调节。在哺乳动物中,大量研究表明,基因的突变可能导致眼畸形的发生,如小鼠眼畸形(Hertwig, 1942)、犬眼睛出现缺陷(Stritzel, 2009)、牛眼睛变小(Wiedemar, 2014)等均与缺失有着密切关系,基因在哺乳动物眼睛发育中有着不可或缺的作用。脉络膜裂(CF)的闭合是眼睛发育的一个关键步骤,研究显示,基因在颅神经嵴细胞中发挥作用,促进脉络膜裂的闭合,是眼睛正常发育必不可少的调节基因(Michael, 2018)。但Lane等(2012)研究发现,在具有基因突变的斑马鱼或、双基因突变的斑马鱼中,其眼部发育正常,与野生型斑马鱼无明显差异,这一结果说明了基因在斑马鱼眼睛发育过程中并非是必要的,这一结论具有颠覆性。因此,基因在动物眼睛发育过程中是否为必需基因值得探讨,但本研究中,和均表现为眼部表达量最高,仍然支持其在眼睛发育中起着必不可少的作用。
ALTSCHMIED J, DELFGAAUW J, WILDE B,. Subfunctionalization of duplicategenes associated with differential degeneration of alternative exons in fish. Genetics, 2002, 161(1): 259–267
BARLUENGA M, MEYER A. Phylogeography, colonization and population history of the Midas cichlid species complex (spp.) in the Nicaraguan crater lakes. BMC Evolutionary Biology, 2010, 10(1): 326–326
BAUER G L, PRAETORIUS C, BERGSTEINSDOTTIR K,. The role of MITF phosphorylation sites during coat color and eye development in mice analyzed by bacterial artificial chromosome transgene rescue. Genetics, 2009, 183(2): 581– 594
BENTLEY N J, EISEN T, GODING C R. Melanocyte-specific expression of the human tyrosinase promoter: Activation by the microphthalmia gene product and role of the initiator. Molecular and Cellular Biology, 1994, 14(12): 7996–8006
COHEN M A, WERT K J, GOLDMANN J,. Human neural crest cells contribute to coat pigmentation in interspecies chimeras after in utero injection into mouse embryos. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(6): 1570–1575
HAUSWIRTH R, HAASE B, BLATTER M,. Mutations in MITF and PAX3 cause “splashed white” and other white spotting phenotypes in horses. PLoS Genetics, 2019, 15(8): e1002653
HEMESATH T J, STEINGRIMSSON E, MCGILL G,. Microphthalmia, a critical factor in melanocyte development, defines a discrete transcription factor family. Genes and Development, 1994, 8(22): 2770–2780
HERSHEY C L, FISHER D E. Genomic analysis of the Microphthalmia locus and identification of the MITF-J/-J isoform. Gene, 2005, 347(1): 73–82
HERTWIG P. Neue Mutationen und Koppelungsgruppen bei der Hausmaus. Zeitschrift für Induktive Abstammungs- und Vererbungslehre, 1942, 80(1): 220–246
HOU L, PAVAN W J. Transcriptional and signaling regulation in neural crest stem cell-derived melanocyte development: Do all roads lead toCell Research, 2008, 18(12): 1163–1176
JIANG Y L, SONG H M, LIU Y,. Cloning and analysis of TYR gene and its development stages and tissue expression in. Chinese Journal of Agricultural Biotechnology, 2016, 24(5): 697–707 [蒋燕玲, 宋红梅, 刘奕, 等. 橘色双冠丽鱼TYR基因的克隆及其发育时序和组织表达分析. 农业生物技术学报, 2016, 24(5): 697–707]
JIANG Y L. The development of body color ofand the cloning and analysis of body color-related gene TYR expression. Master´s Thesis of Shanghai Ocean University, 2016 [蒋燕玲. 橘色双冠丽鱼体色发育变化及体色相关基因TYR的克隆与表达研究. 上海海洋大学硕士研究生学位论文, 2016]
KAUTT A F, ELMER K R, MEYER A. Genomic signatures of divergent selection and speciation patterns in a natural experiment, the young parallel radiations of Nicaraguan crater lake cichlid fishes. Molecular Ecology, 2012, 21(19): 4770–4786
KHALED M. Glycogen synthase kinase 3beta is activated by cAMP and plays an active role in the regulation of melanogenesis. Journal of Biological Chemistry, 2002, 277(37): 33690–33697
KORBERG I B, SUNDSTROM E, MEADOWS J R S,. A simple repeat polymorphism in the MITF-M promoter is a key regulator of white spotting in dogs. PLoS One, 2014, 9(8): e104363
KUMASAKA M, SATO H, SATO S,. Isolation and developmental expression ofin. Developmental Dynamics, 2010, 230(1): 107–113
LANE B M, LISTER J A. Otx but nottranscription factors are required for zebrafish retinal pigment epithelium development. PLoS One, 2012, 7(11): e49357
LI M, ZHU F, HONG N,. Alternative transcription generates multipleisoforms with different expression patterns and activities in medaka. Pigment Cell and Melanoma Research, 2013a, 27(1): 48–58
LI M, ZHU F, HONG Y. Differential evolution of duplicated medaka fishgenes. International Journal of Biological Sciences, 2013b, 9(5): 496–508
LIN R, LIN W, ZHOU S,. Integrated analysis of mRNA expression, CpG island methylation, and polymorphisms in the MITF gene in ducks (). BioMed Research International, 2019(3): 8512467
LISTER J A, CAPPER A, ZENG Z Q,. A conditional zebrafish MITF mutation reveals MITF levels are critical for melanoma promotion vs. regression. Journal of Investigative Dermatology, 2014, 134(1): 133–140
LISTER J A, ROBERTSON C P, LEPAGE T,. Nacre encodes a zebrafish microphthalmia-related protein that regulates neural-crest-derived pigment cell fate. Development, 1999, 126(17): 3757–3767
LIU J H, WEN S, LUO C,. Involvement of thegene in the development of pigment cell in Japanese ornamental (Koi) carp (L.). Genetics and Molecular Research, 2015, 14(1): 2775–2784
MICHAEL H T, GRAFF-CHERRY C, CHIN S,. Partial rescue of ocular pigment cells and structure by inducible ectopic expression of-M in MITF-deficient mice. Investigative Ophthalmology and Visual Science, 2018, 59(15): 6067–6073
MINVIELLE F, BED'HOM B, COVILLE J L,. The “silver” Japanese quail and the MITF gene: Causal mutation, associated traits and homology with the “blue” chicken plumage. BMC Genetics, 2010, 11: 15
MOCHII M, MAZAKI Y, MIZUNO N,. Role ofin differentiation and transdifferentiation of chicken pigmented epithelial cell. Developmental Biology, 1998, 193(1): 47–62
NAKAYAMA A, NGUYEN M T T, CHEN C C,. Mutations in microphthalmia, the mouse homolog of the human deafness gene MITF, affect neuroepithelial and neural crest-derived melanocytes differently. Mechanisms of Development, 1998, 70(1/2): 155–166
NEWTON R A, ROBERTS D W, LEONARD J H,. Human melanocytes expressing MC1R variant alleles show impaired activation of multiple signaling pathways. Peptides, 2007, 28(12): 2387–2396
PARK H Y, KOSMADAKI M, YAAR M,. Cellular mechanisms regulating human melanogenesis. Cellular and Molecular Life Sciences, 2009, 66(9): 1493–1506
SHI X Y, XU Y J, WU N N,. Preliminary studies on blind-side hypermelanosis of: Chromatophores observation and expression of proopiomelanocortin. Progress in Fishery Sciences, 2015, 36(2): 45–54 [史学营, 徐永江, 武宁宁, 等. 半滑舌鳎()体表色素细胞观察及POMC表达特性分析. 渔业科学进展, 2015, 36(2): 45–54]
SHIOHARA M, SHIGEMURA T, SUZUKI T,. MITF-CM, a newly identified isoform of microphthalmia-associated transcription factor, is expressed in cultured mast cells. International Journal of Laboratory Hematology, 2008, 31(2): 215–226
STEINGRIMSSON E, COPELAND N G, JENKINS N A. Melanocytes and the Microphthalmia transcription factor network. Annual Review of Genetics, 2004, 38(1): 365–411
STRITZEL S, FRITSCHE J, WOEHLKE A,. Multiple ocular malformations in two sheepdogs homozygous for the merle mutation. Mutation analysis of the SILV gene and association study using MITF-associated markers. Tieraerztliche Praxis Ausgabe Kleintiere Heimtiere, 2009, 37(4): 229–238
VOLKENING A, SANDSTEDE B. Iridophores as a source of robustness in zebrafish stripes and variability inpatterns. Nature Communications, 2018, 9(1): 3231
WANG Y, VIENNET C, ROBIN S,. Precise role of dermal fibroblasts on melanocyte pigmentation. Journal of Dermatological Science, 2017, 88(2): 159–166
WEI M X, SONG H M, QI B L,. Pigment cells development and body color variation of postembryonic development in. Journal of Shanghai Ocean University, 2015, 24(1): 28–35 [韦敏侠, 宋红梅, 祁宝伦, 等. 橘色双冠丽鱼胚后色素细胞发育与体色变化. 上海海洋大学学报, 2015, 24(1): 28–35]
WIEDEMAR N, DROEGEMUELLER C. A 19-Mb de novo deletion on BTA 22 including MITF leads to microphthalmia and the absence of pigmentation in a Holstein calf. Animal Genetics, 2014, 45(6): 868–870
YAMADA T, AKAMATSU H, HASEGAWA S,. Melanocyte stem cells express receptors for canonical-signaling pathway on their surface. Biochemical and Biophysical Research Communications, 2010, 396(4): 837–842
YU D D, LIU H J, GUAN J,. Early ontogeny of chromatophores and body color changes of. Progress in Fishery Sciences, 2012, 33(5): 1–7 [于道德, 刘洪军, 关健, 等. 黑棘鲷早期色素细胞发育与体色变化. 渔业科学进展, 2012, 33(5): 1–7]
ZHANG Y, LIU J, PENG L,. Comparative transcriptome analysis of molecular mechanism underlying gray-to-red body color formation in red crucian carp (, red var.). Fish Physiology and Biochemistry, 2017, 43(5): 1387–1398
Structure and Expression Analysis of Body Color-RelatedGene in
CHEN Xudong1,2, WU Guoqiang1,2, SONG Hongmei2①, WANG Xuejie2, MU Xidong2, LIU Yi2, LIU Chao2, HU Yinchang2
(1.201306,; 2510380,)
Microphthalmia-associated transcription factor (MITF) is a transcription factor with a typical basic helix-loop-helix-leucine zipper structure. It is a key transcription factor in the melanin synthesis pathway in animals by activating downstream genes to initiate melanin synthesis. In order to explore the regulatory action ofduring body color variation in, the full-length cDNA of thegene was cloned using the rapid amplification of cDNA ends technique, and the difference in gene expression in different developmental stages of embryos, different stages of body melatonin, and various tissues inwere analyzed through qRT-PCR. Two mutant sequences ofwere obtained. The full-length ofcDNA was 1816 bp, including a 158 bp 5′UTR, a 428 bp 3′UTR, and a 1230 bp ORF coding a polypeptide of 409 amino acids. The full-length ofcDNA was 1638 bp, including a 160 bp 5′ UTR, a 428 bp 3′UTR, and a 1050 bp ORF coding a polypeptide of 349 amino acids. The analysis of the homology and phylogenetic tree results showed thatandclustered into a small branch in the phylogenetic tree, which had the highest homology with Cichlidae fish and low homology with mammals. The results of the qRT-PCR showed thatandwere expressed to varying degrees in various tissues of adult fish, among which the expression in the eyes was the highest and was significantly higher than in other tissues (<0.05), and the expression in muscle, brain, and kidney tissue was also higher. Theandgenes were expressed in all stages of embryonic development, and the expression level was highest in the cleavage stage, which was significantly higher than the other embryonic stages. With the body color transition from black to orange, the expression ofandgenes decreased gradually in the fish skin, scales, and tail fins. It showed that the expression ofwas positively correlated with changes in body color from black to yellow in, which may be related to the dynamic change in the differentiation and distribution ratio of pigment cells in the body color development stage of fish. Through understanding the molecular basis of fish body color development and variation, this study accumulates data for fish pigment cell development and the artificial improvement of fish body color.
;; qRT-PCR; Melanocyte
SONG Hongmei, E-mail: shm1227@126.com
S91
A
2095-9869(2022)02-0107-12
10.19663/j.issn2095-9869.20201215004
* 广东省基础与应用基础研究基金项目(2020A1515010304)、中国东盟海上合作基金(CAMC-2020F)和国家水产种质资源共享服务平台(NFGR-2020)共同资助 [This work was supported by Basic and Applied Basic Research Foundation of Guangdong Province (2020A1515010304), China-ASEAN Maritime Cooperation Fund (CAMC-2020F), and National Freshwater Genetic Resource Center (NFGR-2020)].陈旭东,E-mail: 979926926@qq.com
宋红梅,副研究员,E-mail: shm1227@126.com
2020-12-15,
2021-01-26
陈旭东, 邬国强, 宋红梅, 汪学杰, 牟希东, 刘奕, 刘超, 胡隐昌. 橘色双冠丽鱼体色相关基因的结构及表达调控特性. 渔业科学进展, 2022, 43(2): 107–118
CHEN X D, WU G Q, SONG H M, WANG X J, MU X D, LIU Y, LIU C, HU Y C. Structure and expression analysis of body color-relatedgene in. Progress in Fishery Sciences, 2022, 43(2): 107–118
(编辑 冯小花)
