血清S100β联合IL-6在新生儿窒息后脑损伤的临床价值
2022-04-08赵悦悦蒋晓宏
赵悦悦,蒋晓宏
(安徽医科大学附属巢湖医院新生儿科,安徽 合肥 230000)
新生儿窒息(neonatal asphyxia)导致的缺氧缺血性脑病为新生儿期常见疾病,以足月儿较为常见,窒息缺氧会导致多脏器功能损伤,尤其是针对脑部的损伤更为明显,严重的会导致神经系统永久性后遗症、残疾,甚至死亡[1]。近年来,国内新生儿脑损伤的诊断和评估主要依据脑电图、头颅影像学检查、颅脑彩色超声等,但头颅影像学检查在不宜被移动、生命体征不平稳的患儿中无法及时进行。颅脑彩色超声对矢状旁区损伤的检查容易出现错漏。新生儿振幅整合脑电图在亚低温治疗时可能会受抑制[2]。因此,寻找与新生儿窒息后脑损伤相关联,且早期、有效的检测指标,具有重要的临床意义。既往报道显示,颅脑外科中颅脑损伤程度和预后情况与中枢神经特异蛋白β(central nervous system specific protein β,S100β)、白细胞介素-6(interleukin-6,IL-6)密切相关,且两项指标联合诊断效率高于单独检测。但目前国内外学者关于联合检测血清S100β 和IL-6 应用在不同程度新生儿窒息后脑损伤的研究报道尚少。由此,本研究旨在探讨血清S100β、IL-6 水平在新生儿窒息以及窒息后脑损伤诊疗中的应用价值,现报道如下。
1 资料与方法
1.1 一般资料 选取2020年7月-2021年8月安徽医科大学附属巢湖医院收治的61 例窒息新生儿为研究对象。将窒息新生儿分为轻度窒息组和重度窒息组。轻度窒息组43 例,胎龄37~41+6周,平均胎龄(38.80±1.17)周;出生体重3.05~3.84 kg,平均出生体重(3.55±0.35)kg;男婴26 例,女婴17 例;剖宫产15 例,顺产28 例。重度窒息组18 例,胎龄37~41+6周,平均胎龄(38.99±0.98)周;出生体重3.16~3.89 kg,平均出生体重(3.54±0.29)kg;男婴11 例,女婴7 例;剖宫产10 例,顺产8 例。对照组49 例,胎龄37~41+6周,平均胎龄(38.84±1.13)周;出生体重3.15~3.82 kg,平均出生体重(3.51±0.29)kg;男婴33 例,女婴16例;剖宫产16 例,顺产23 例。三组新生儿在胎龄、性别、出生体重、分娩方式比较,差异无统计学意义(P>0.05),有可比性。本研究符合伦理学标准并经医院伦理委员会审核通过,所有新生儿家属知情同意并签署知情同意书。
1.2 纳入和排除标准 纳入标准:①窒息诊断标准以及分度均参照2016年新生儿窒息诊断的专家共识[3];②经头颅核磁和振幅整合脑电图检查确定脑损伤情况。排除标准:①孕母在分娩前以及生产中接受过对自身或对胎儿中枢神经系统有影响的药物;②患儿存在感染、电解质紊乱情况、神经肌肉类疾病、先天性疾病等情况。
1.3 血清S100β、IL-6的检测 所有受试者生后6 h内取外周静脉血3~5 ml,采血时避免溶血,取血清保存至-20 ℃冰箱中备用。S100β 采用化学发光免疫夹心法检测,检测使用的全自动化学发光测定仪(型号:Maglumi 2000 Plus)和试剂盒(批号:048210111)由深圳市新产业生物医学工程股份有限公司提供;IL-6 采用化学发光免疫夹心法检测,检测的免疫测定分析仪(型号:cobas e 801)和试剂盒(批号:5008900)由罗氏公司提供。测定时严格按照试剂盒说明书操作。
1.4 新生儿脑损伤的检查 所有受试者于入院后行头颅MRI、振幅整合脑电图检查,其中发现颅内出血和(或)新生儿缺氧缺血性脑病即为窒息后脑损伤。振幅整合脑电图由两位熟练掌握相关评判知识的新生儿科医生采用足月儿改良aEEG 评分法从连续性、睡眠-觉醒周期、惊厥发作3 方面判读是否存在脑损伤。窒息患儿再根据头颅核磁和振幅整合脑电图检查分为脑损伤组(23 例)和非脑损伤组(38 例)。
1.5 统计学方法 采用SPSS 24.0 统计软件进行分析。正态分布的计量资料以(±s)表示,组间比较使用单因素方差分析;非正态分布的计量资料以[M(P25,P75)]表示,组间比较使用Kruskal-Wallis H或Mann-WhitneyU检验进行;计数资料以[n(%)]表示,组间比较用x2检验;影响因素的确定采用二元Logistic 回归分析;ROC 曲线分析用以评估S100β、IL-6 对新生儿脑损伤的诊断价值。P<0.05 为差异有统计学意义。
2 结果
2.1 各组新生儿血清S100β、IL-6 检测比较 轻度窒息组S100β 高于对照组(H=-7.447,P<0.001),重度窒息组S100β 高于对照组(H=-7.713,P<0.001)和轻度窒息组(H=-3.029,P=0.042),差异有统计学意义;轻度窒息组IL-6 高于对照组(H=-5.054,P<0.001);重度窒息组高于对照组(H=-7.805,P<0.001)和轻度窒息组(H=-3.901,P<0.001),差异有统计学意义,见表1。

表1 各组新生儿血清S100β、IL-6 水平比较[M(P25,P75)]
2.2 脑损伤组与非脑损伤组S100β、IL-6 水平比较脑损伤组S100β、IL-6 水平高于非脑损伤组,差异有统计学意义(P<0.05),见表2。

表2 脑损伤组与非脑损伤组S100β、IL-6 水平比较[M(P25,P75)]
2.3 Logistic 回归分析 以颅脑损伤(否=0,是=1)作为因变量,以S100β、IL-6 为自变量,行二元Logistic回归分析,结果显示S100β、IL-6 是窒息后脑损伤的影响因素(P<0.05),见表3。

表3 S100β、IL-6 对脑损伤影响的二元Logistic 回归分析
2.4 S100β、IL-6 对评估脑损伤的价值分析ROC 曲线分析 S100β 最佳截断值为995.000 ng/L,IL-6 最佳截断值是21.960 pg/ml,对新生儿窒息后脑损伤均具有一定的诊断价值(P<0.05),联合检测诊断窒息后脑损伤的特异度、敏感度高于单一指标检测(P<0.05),见表4、图1。

表4 S100β、IL-6 对评估脑损伤的价值分析
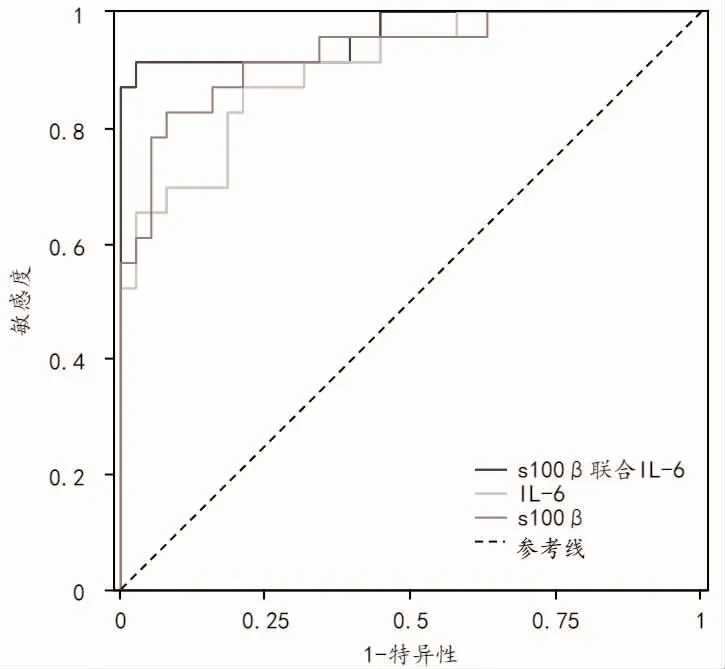
图1 ROC 曲线分析血清S100β、IL-6评估窒息后脑损伤新生儿的价值
3 讨论
新生儿窒息每年在全世界造成近百万婴儿死亡,约占新生儿死亡率的1/4[4,5]。目前,新生儿窒息对多脏器功能的损伤已受到国内外学者的广泛关注,尤其在脑损伤方面的研究日益受到重视。临床工作中习惯使用大脑特异性生物标记物来检测,但有许多异质因素会影响测试结果[6]。因此,结合两种或两种以上的生物标志物来建立一个优化方案,有助于更加全面地去了解新生儿脑损伤的病理状态。
S100β 是一种钙结合蛋白,是S100 家族中最具活性的成员,在脑中含量远高于其他组织,是神经系统特异性蛋白。它广泛分布于脑组织的神经胶质细胞中,与神经细胞的增殖、分化、凋亡过程有着密切联系[7,8]。相关研究发现[9],S100β 对神经元具有双向作用,低浓度的S100β 刺激轴突生长,但高浓度的S100β 损害神经元的生长发育。另有研究表明[10,11],当脑部受到重大损伤时,神经胶质细胞快速合成、分泌S100β,同时神经胶质细胞破裂增多,使得脑脊液S100β 水平升高,当血脑屏障被破坏时,再次入血,此时血液里的S100β 水平迅速上升。IL-6 是一种功能广泛的多效性细胞因子,主要由位于脑室边缘区域的星形胶质细胞产生,而在其他脑区,如下丘脑、海马、大脑皮层或某些脑干结构,IL-6 主要由神经元产生[12]。IL-6 是窒息发生后导致缺血缺氧性脑病发病时较为明确的细胞因子之一[13,14],脑组织一旦出现缺血缺氧情况,通过MEK/ERK 途径促进脑动脉壁上的单核巨噬细胞大量分泌核因子-κB、肿瘤坏死因子-α 等,这些因子可直接在多种细胞上发挥作用,促进IL-6的释放,且随着窒息程度的增加以及脑损伤的发生,其释放水平随之升高[15,16]。本研究显示,发生窒息的患儿血清S100β、IL-6 水平高于对照组,表明血清S100β、IL-6 均参与新生儿窒息病情的发展过程,且随着窒息程度的加重,患儿血清中S100β、IL-6 水平呈现升高趋势,其中重度窒息组S100β、IL-6 水平高于轻度窒息组,与既往报道一致[17,18]。本研究中脑损伤组新生儿S100β、IL-6 水平高于非脑损伤组。通过二元Logistic 回归分析显示,血清S100β、IL-6 是新生儿脑损伤的影响因素,与孙艳娟等[19],陈晓玲等[20]报道一致。通过绘制ROC曲线分析得出:S100β 预测脑损伤的AUC 为0.928,敏感度为82.60%,特异度为92.10%;IL-6的AUC为0.902,敏感度为87.00%,特异度为78.90%;且S100β 联合IL-6 水平预测新生儿窒息后脑损伤的AUC 最大,其敏感度和特异度均最高。这说明单独检测S100β 或IL-6 水平预测窒息患儿脑损伤的发生具有一定的局限性,当两项指标联合检测时有助于提高脑损伤评估的准确性。
综上所述,血清S100β、IL-6 水平有助于判断新生儿窒息程度以及窒息后的脑部进展,对于预测新生儿脑损伤具有重要的临床意义。但本研究样本量偏小,可能存在一定误差,需进一步扩大样本量进行研究。
