四株植物根际促生菌对农田土壤N2O排放的影响
2022-04-08申卫收杨思琪张欢欢李庆王铭科潘钰璟徐德红高南
申卫收 杨思琪 张欢欢 李庆 王铭科 潘钰璟 徐德红 高南
0 引言
氧化亚氮(N2O)是一种重要的温室气体,它在大气中滞留时间较长,不但会产生温室效应,还会破坏臭氧层[1-3].虽然N2O在大气中以痕量浓度存在,但是其在100年尺度上的增温潜势约为CO2的265倍[4].在过去的100年中,N2O对温室效应的贡献已经超过5%,全球的N2O排放速率约为11 Tg·a-1[4].农田土壤是全球人为活动产生N2O 的最主要排放源,其排放占全球N2O排放总量的 25%~39%[5-7].我国作为一个农业大国,农田土壤生态系统中N2O的排放问题不容忽视.

目前,减排农田土壤N2O的方法主要有施肥管理(含施肥时间与方式、施肥量、施肥类型等)、使用硝化抑制剂、科学耕作、添加生物质炭、接种具有N2O减排效应的微生物等[15-16].其中,接种具有N2O减排效应微生物的N2O减排技术刚刚兴起.植物根际促生菌,又称PGPR,能有效提高作物的抗逆性,抑制病原菌、降低染病率、改善作物的营养状况,从而提高作物的产量[17].具有N2O减排效应的植物根际促生菌在减排农田土壤N2O的同时,还可以增加作物产量,对减少化学氮肥用量及氮的环境负效应具有重要实际意义[18].例如:Itakura等[19]研究发现,在纯培养体系和大豆蛭石盆栽试验体系中,接种含有nosZ的大豆根瘤菌(Bradyrhizobium)可以有效减少土壤N2O的排放;Gao等[16]通过温室盆栽试验和土壤微宇宙培养试验发现,接种具有N2O还原功能的固氮螺菌属(Azospirillumsp.)和草螺菌属(Herbaspirillumsp.)的微生物到牧草地土壤,不仅可以减少土壤N2O的排放,同时还能促进红花苜蓿和梯牧草的生长.
本研究以四株植物根际促生菌为研究对象,采用温室盆栽试验、土壤微宇宙试验及田间原位试验等方法,探究接种植物根际促生菌对农田土壤N2O排放的影响,为农田土壤温室气体减排和农业碳中和提供实际指导.
1 材料和方法
1.1 供试菌株
供试用的植物根际促生菌菌株分离自广东省惠州市和江苏省无锡市宜兴市淹水水稻土,这些菌株对多种农作物具有促生效应,保藏在中国普通微生物菌种保藏中心(表1).开展盆栽试验和土壤微宇宙试验时,将菌株接种到改良的营养肉汤培养基(牛肉浸粉3.0 g/L、多聚蛋白胨5.0 g·L-1、硝酸钠0.3 mmol·L-1和琥珀酸钠 4.4 mmol·L-1,溶剂为蒸馏水,简称NBNS培养基)中,置于28 ℃摇床中在180 r·min-1振荡培养约24 h,用无菌的NBNS液体培养基调节菌液浓度至OD600 nm约为1.0备用.进行田间原位试验时,按照上述菌剂制备方法提前准备菌剂,施肥当天在每个试验小区中将菌液和水充分稀释后均匀施入田间.
1.2 温室盆栽试验
温室盆栽试验供试土壤采自江苏省无锡市宜兴市蔬菜地耕作层,土壤类型为黏质砂壤土,前茬作物为青菜.宜兴市地处江苏省西南端、太湖东岸,位于长三角中心地带,气候为亚热带湿润季风气候,四季分明、雨热同季.蔬菜地主要种植菠菜、青菜、番茄、黄瓜等.土壤采集后,自然风干,过2 mm筛,室温保存待用.供试土壤的理化性质如表2所示.
培养钵装土量(风干土)为750 g/盆,有机肥施用量为0.4 g·kg-1,化肥(N、P2O5和K2O的质量比为15∶15∶15)施用量为0.12 g·kg-1.番茄种子用无菌水浸泡10 min,接着用2%次氯酸钠溶液表面消毒5 min,然后用无菌水连续冲洗8~10次,再用无菌水浸泡30 min,然后再次用无菌水冲洗2~3次,最后用无菌滤纸吸去番茄种子表面水分.将种子播撒到土壤表面,随后将30 mL OD600 nm约为1.0的细菌悬浮液(107~108CFU·mL-1)接种于盆栽土壤中,未接种的对照浇灌等量的细菌液体培养基.每个处理重复4次.水肥管理按照常规管理进行.试验处理和所用植物根际促生菌的信息如表1所示.
1.3 土壤微宇宙试验
土壤微宇宙试验供试土壤采自江苏省南京市六合区水稻田耕作层土壤,土壤类型为马肝土或水耕人为土(Stagnic Anthrosols),种植制度为稻麦轮作,前茬作物为水稻.江苏省南京市六合区位于滁河支流皂河上游.该地区属于亚热带湿润季风气候,气候温和、四季分明,土壤类型以马肝土、岗黄土、黄白土为主.土壤采集后,自然风干,过2 mm筛,室温保存待用.供试土壤的理化性质见表2.
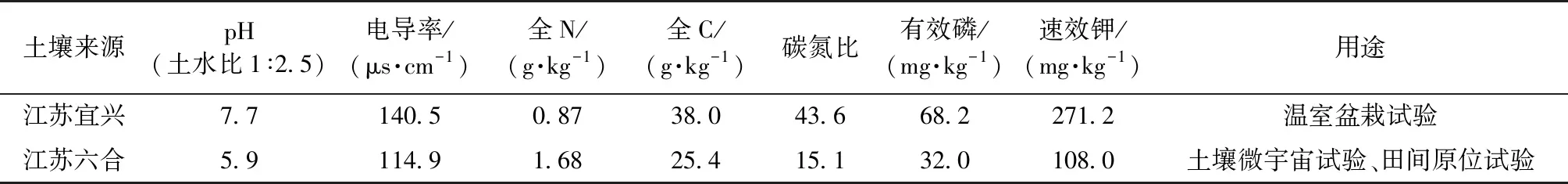
表2 供试土壤理化性质Table 2 Physicochemical properties of the tested soils
土壤微宇宙试验不栽培任何植物,其他步骤同1.2.试验所用植物根际促生菌的信息如表1所示.

表1 供试用植物根际促生菌菌株Table 1 Candidate strains of plant rhizosphere growth-promoting bacteria tested in this study
1.4 田间原位试验
试验地位于江苏省南京市六合区(32°34′27″N,118°41′23″E),为土壤微宇宙试验的土壤样品采集地点.土壤类型为马肝土,耕作制度为稻麦轮作,前茬作物为水稻,土壤理化性质如表2所示.
田间原位试验为无作物的小区试验,于2020年12月—2021年1月进行.田间原位试验处理的分布为随机区组设计,共3个处理,每个处理3个小区,每个小区4 m2,共9个小区.处理1(CK):施用复合肥(N-P2O5-K2O 15-15-15)3 kg/亩+NBNS液体培养基;处理2(NRCB010):施用复合肥(N-P2O5-K2O 15-15-15)3 kg/亩+NRCB010菌液;处理3(NRCB026):施用复合肥(N-P2O5-K2O 15-15-15)3 kg/亩+NRCB026菌液.菌液制备见1.1,每个小区菌液用量350 mL,用水稀释至2 000 mL后,均匀地喷施在土壤表面.
1.5 样品采集与分析
采用“静态箱-气相色谱法”进行气体样品采集与分析测定工作.采集温室盆栽试验和土壤微宇宙试验的气体样品时,将培养钵放置在气样采集容器内,于0、15和30 min 时各采集1次气体样品;在每次取样时测量气体采集容器内部的温度.在温室盆栽试验播种后的2、4、5、6、7、9、11、13、16、19、23 d采集气样,测定N2O通量;在土壤微宇宙试验接种后的2、5、7、9、12、15、18 d采集气样,测定N2O通量.田间原位试验的采气箱由不透光的PVC材质制成,箱体尺寸为50 cm×50 cm×60 cm.箱体顶部安装温度计用于测定箱体内部的空气温度,侧面设置采样口,并做密闭处理.底座尺寸为60 cm×60 cm×30 cm,采样前将底座下部埋入土中,保持水平,底座上部有凹槽.采样时,将采样箱放置在底座上,在底座与采气箱的交接处加水实现液封,使水没过交接处的缝隙,以保证采气环境整体的密闭性.在采气箱放置完成后的第0、15、30 min进行气体样品采集,并记录对应采气时的箱体温度.
采集的气体样品使用带有电子捕获检测器的气相色谱仪(Agilent 7890B)进行测量.气相色谱仪的相关参数:前检测器为火焰离子化检测器(FID),可测定CH4含量,工作温度250 ℃,高纯H2流量为60 mL·min-1,高纯空气流量为400 mL·min-1;后检测器为微池电子捕获检测器(ECD),可测定N2O含量,工作温度为300 ℃,含5%甲烷的氩气流量为2 mL·min-1.测量完成后,通过计算3个时间点N2O浓度的斜率,得到温室盆栽试验和土壤微宇宙试验的N2O通量;进一步计算N2O累积排放量.利用以下公式[20]计算田间原位试验的土壤N2O排放通量:

温室盆栽试验在播种12 d和24 d测量番茄的株高和茎粗,采集番茄地上部样品,称量植株鲜重和干重.
1.6 数据分析
所有试验数据用Excel 2010和Origin 2021软件进行处理和绘图,采用IBM SPSS Statistics软件对不同试验处理进行单因素方差分析和LSD显著性检验,不同处理间统计差异显著性(P<0.05)用不同的小写字母表示.
2 结果与分析
2.1 植物根际促生菌对番茄幼苗生长的影响
在温室盆栽条件下,接种四株植物根际促生菌相对于未接种对照均不同程度地促进了番茄的生长(图1).例如,在处理12 d时,与不接种植物根际促生菌的对照相比,接种菌株Lv5A、NRCB002、NRCB010和NRCB026对番茄幼苗的株高、茎粗、叶长和地上部干重均无显著影响.然而,在处理24 d时,与不接种植物根际促生菌的对照相比,接种Lv5A显著增加番茄幼苗的茎粗,茎粗增加了250%;显著减少番茄幼苗的叶长.接种NRCB002显著增加番茄幼苗的茎粗,增加了132%;显著增加了番茄幼苗地上部干重,增加了105%.接种NRCB010显著增加了番茄幼苗地上部干重,增加了31%.NRCB026对番茄幼苗的株高、茎粗、叶长和地上部干重均无显著影响.

图1 植物根际促生菌对番茄幼苗生长的影响Fig.1 Effects of plant rhizosphere-promoting bacteria on the growth of tomato seedling
2.2 温室盆栽条件下,植物根际促生菌对土壤N2O排放特征的影响
在温室盆栽条件下,接种四株植物根际促生菌相对于未接种对照土壤N2O排放特征各不相同(图2).在温室盆栽试验中,一共监测到2次主要的土壤N2O排放峰.第1次土壤N2O排放峰出现在施肥后2 d时,未接种对照处理的土壤N2O排放达到最大峰值为0.83 μg (N)·kg(土)-1·h-1,之后所有处理的N2O排放量呈现一定的下降趋势;在施肥9 d后,土壤N2O排放量逐渐上升,至第11 d达到第2次峰值.与未接种对照处理相比,在达到第2次峰值时,NRCB010和NRCB026处理的土壤N2O排放量明显降低,其中NRCB026处理的N2O排放量峰值最低,为0.11 μg(N)·kg(土)-1·h-1;而Lv5A和NRCB002处理的土壤N2O 排放量增多,其中NRCB002处理的土壤N2O排放量峰值最高,为0.69 μg(N)·kg(土)-1·h-1.试验处理13 d后,所有处理的N2O排放通量趋于平稳.

图2 植物根际促生菌对温室盆栽试验土壤N2O排放通量的影响Fig.2 Effects of plant rhizosphere-promoting bacteria on soil N2O flux in greenhouse pots
温室盆栽试验的番茄土壤N2O累积排放量如表3所示.各处理的土壤N2O累积排放量从高到低依次为CK>NRCB002>Lv5A>NRCB026>NRCB010.其中,Lv5A、NRCB010和NRCB026处理的土壤N2O累积排放量比未接种对照减少了30%以上.选取土壤N2O减排效应较为明显的菌株NRCB010和NRCB026用于土壤微宇宙试验和田间原位试验.
2.3 土壤微宇宙条件下,植物根际促生菌对土壤N2O排放特征的影响
在土壤微宇宙条件下,接种NRCB010和NRCB026均减少了土壤N2O排放通量(图3).土壤N2O排放峰出现在施肥后9 d时,未接种对照处理的土壤N2O排放达到最大峰值为21.66 μg(N)·kg(土)-1·h-1,NRCB010和NRCB026处理的土壤N2O排放峰值呈现下降趋势,其中NRCB026处理的土壤N2O排放峰值下降尤为明显.N2O峰值出现后,所有处理的土壤N2O排放通量趋于平稳,接近背景浓度.
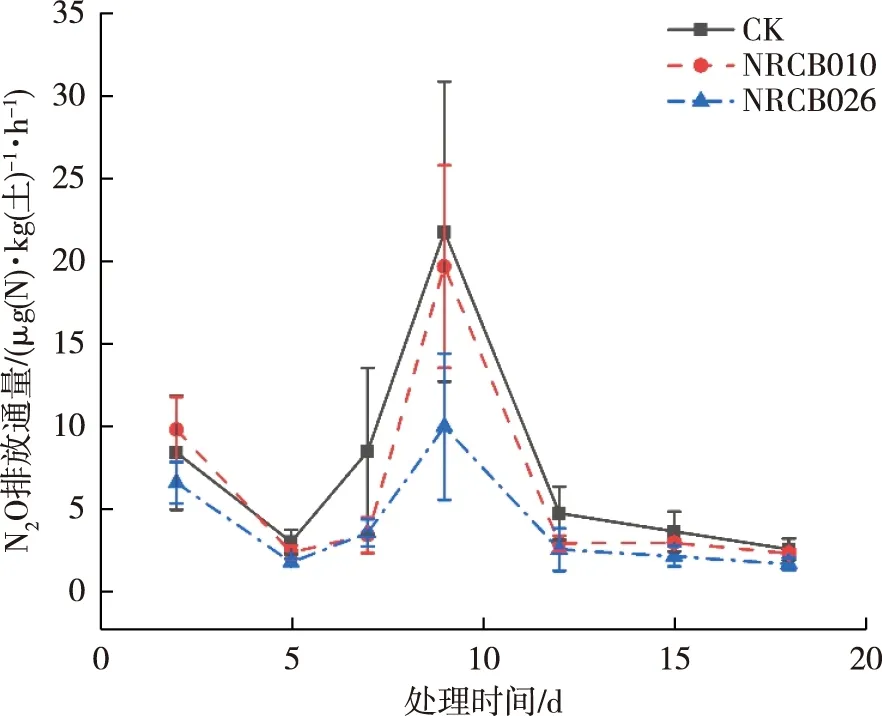
图3 植物根际促生菌对微宇宙试验土壤N2O排放通量的影响Fig.3 Effects of plant rhizosphere-promoting bacteria on soil N2O flux in soil microcosms
在土壤微宇宙条件下,接种NRCB010和NRCB026均减少了土壤N2O累积排放量(表3).各个处理的土壤N2O累积排放量从高到低依次为 CK>NRCB010>NRCB026.NRCB026和NRCB010处理的土壤N2O累积排放量比未接种对照分别减少了21%和48%.

表3 植物根际促生菌对土壤N2O累积排放量的影响Table 3 Effects of plant rhizosphere-promoting bacteria on cumulative N2O emissions from soils in greenhouse pots,soil microcosms,and field plots
2.4 田间原位条件下,植物根际促生菌对土壤N2O排放特征的影响
在田间原位条件下,NRCB026和NRCB010处理的土壤N2O排放通量下降,以NRCB026更为明显(图4).在观测期内,所有处理的土壤N2O排放通量均比较平稳,未观测到明显的土壤N2O脉冲峰.NRCB026处理在施肥后第20 d的N2O排放通量下降为负值.
图4 植物根际促生菌对田间小区试验土壤N2O排放通量的影响Fig.4 Effects of plant rhizosphere-promoting bacteria on soil N2O flux in field plots
NRCB026和NRCB010处理的土壤N2O累积排放量也明显降低(表3).各个处理的土壤N2O累积排放量从高到低依次为CK>NRCB010>NRCB026.NRCB026和NRCB010处理的土壤N2O累积排放量比未接种对照分别减少了44%和73%.与未接种对照相比,NRCB026处理的土壤N2O累积减排量达到显著水平(P<0.05).
3 讨论
农田土壤是温室气体N2O的重要排放源,目前关于农田N2O的减排措施多数是通过改进肥料的用量、类型以及农业管理措施等实现[21-29].最新的研究表明,在土壤、肥料或者植物根际接种具有N2O减排效应的微生物可以减少N2O的排放[30-32].例如,在大豆根部接种根瘤菌可以通过N2O还原酶(N2OR)将N2O还原为N2,从而减少大豆田土壤的N2O排放[19].通过接种具有N2O还原功能的固氮细菌到牧草地土壤,在减少土壤N2O排放的同时还能促进红花苜蓿和梯牧草的生长[16].本研究采用温室盆栽试验、土壤微宇宙试验及田间原位试验等方法,发现接种植物根际促生菌NRCB010和NRCB026能有效减少农田土壤N2O的排放(图2、3、4,表3).
农田土壤N2O排放受N2O产生过程和还原过程综合作用的影响,由多样的微生物群落通过硝化、反硝化和异化硝酸盐还原为铵等多种途径共同决定.利用微生物减少N2O排放主要分为直接途径和间接途径.直接途径是指接种具有编码N2OR的nosZ基因的N2O还原微生物,进而直接增加N2O还原微生物的丰度,从而促进N2O还原成N2,减少土壤N2O的排放.在本研究中,菌株NRCB010和Lv5A均含有nosZ基因,它们均有较好的农田土壤N2O减排的效果(图2,表3),其中NRCB010的减排效果略优于Lv5A.间接途径是指使用的植物根际促生菌并没有nosZ基因,即菌株不具备直接还原N2O的能力,但却能间接通过改变N2O还原微生物的群落丰度和组成,实现N2O减排的效果[33].在本研究中,NRCB002和NRCB026均不含有nosZ基因,NRCB026具有较好的农田土壤N2O减排的效果,而未检测到NRCB002减少农田土壤N2O排放的效应(图2、3、4,表3).这些结果意味着不同菌种对农田土壤N2O减排潜力明显不同,也为筛选高效菌株、发展具有促生和减排效应的生物肥料指明了方向.
农田土壤N2O排放还受土壤类型、作物和温度等因素影响.在本研究中,以江苏宜兴的蔬菜土为供试土壤的番茄温室盆栽试验中,减排效果最好的菌株为NRCB010(表3),而在土壤微宇宙和田间原位试验中的供试土壤为江苏六合的水稻田土壤,减排效果最好的菌株为NRCB026.这些结果说明应用植物根际促生菌减少农田土壤N2O排放同样可能受到供试土壤类型及作物的影响.在土壤微宇宙和田间原位试验中的供试土壤同为江苏六合的水稻土,但是在土壤微宇宙试验时培养温度恒定,而在田间原位试验中的温度为自然温度,NRCB026和NRCB010对同种土壤的N2O累积排放量的削减程度也不同(表3).这些结果也说明应用植物根际促生菌减少农田土壤N2O排放同样可能受到温度条件的影响.在实际田间应用时,应充分考虑土壤类型、作物种类和环境条件等因素,选用的具有促生和减排效应的微生物须与土壤-作物-环境相适宜,最大程度地发挥促生减排效应、提升菌剂或生物肥料的农学和生态环境效益.
4 结论
采用温室盆栽试验、土壤微宇宙试验及田间原位试验等方法,探究植物根际促生菌对农田土壤N2O 排放的影响.在温室盆栽条件下,接种四株植物根际促生菌的土壤N2O累积排放量从高到低依次为枯草芽孢杆菌枯草亚种NRCB002、白色芽孢杆菌Lv5A、暹罗芽孢杆菌NRCB026、施氏假单胞菌NRCB010,与未接种对照相比分别减少了2.3%、33.1%、34.2%和40.0%.在微宇宙条件下,接种NRCB010和NRCB026相对于未接种对照土壤N2O累积排放量分别减少了21%和48%.在田间原位条件下,接种NRCB010和NRCB026相对于未接种对照土壤N2O累积排放量分别减少了44%和73%.总之,NRCB010和NRCB026能有效减少农田土壤N2O的排放,研究结果将为减少农田土壤N2O排放提供重要科学依据,也将为发展具有促生和减排效应的生物肥料提供实际指导.NRCB010和NRCB026减少农田土壤N2O排放的机制还需要进一步研究.
