乳糖酰胺季铵盐与牛血清白蛋白的相互作用
2022-04-07智丽飞张二壮王秀文石秀芳
智丽飞 张二壮 王秀文 石秀芳
1.太原科技大学化学与生物工程学院,山西太原,030024;2.山西中医药大学中药与食品工程学院,山西太原,030619

自从2020年初新冠肺炎疫情暴发以来,人们对日常消毒杀菌的意识提高到了前所未有的高度,最近两年消杀产品的需求量和生产量快速增长,其中一类无色、无味、使用安全、不易挥发、不易燃的广谱高效季铵盐杀菌剂[1],与常用的酒精、过氧乙酸、有机醛、二氧化氯、84消毒液等杀菌剂相比,不论在运输、存储和使用安全等方面[2,3],还是应用功能方面(防腐蚀、抗静电、洗涤、柔软、吸附、絮凝等)[4]都更具有优势。因此,季铵盐表面活性剂最近两年在研究领域和生产方面都快速增长。但目前常用的季铵盐大多数细胞毒性较大,开发低毒、多功能的生物基季铵盐表面活性剂迫在眉睫。糖类物质由天然可再生资源淀粉制备而来,是生物质原料的典型代表[5],课题组以葡萄糖酸内酯或乳糖酸为原料开发了系列糖基季铵盐表面活性剂[6-8],其中N,N-二甲基-N[3-(乳糖酰胺基)]丙基-N-烷基溴化铵(C12DLPB)产品(结构式见式1)[9]具有无刺激、毒性低、与阴离子有较好的复配性能、对金黄色葡萄球菌和大肠埃希菌有较高的抑菌活性[10]。季铵盐表面活性剂可以与蛋白质相结合[11],且蛋白质与表面活性剂混合体系在生物技术过程、药物输送、化妆品系统、洗涤剂、食品和生物科学中具有广泛而重要的应用[12]。牛血清白蛋白(BSA)与人血清白蛋白(HSA)极为相似,且在水介质中有较好的稳定性和溶解性,因此BSA作为模型蛋白被广泛应用于研究蛋白质和两亲配体的相互作用[13,14]。研究C12DLPB与BSA的相互作用,能更好地了解其杀菌机制,且为开发其在洗涤剂、化妆品、生物科学和药物传输等方面的应用提供理论依据。
本文采用荧光光谱法研究了C12DLPB与BSA相互作用的适宜条件;通过动态猝灭常数、结合常数、结合位点数及热力学参数的计算,了解二者相互结合的作用;并通过三维荧光光谱考察了BSA在C12DLPB作用下的构象变化。

1 实验
1.1 主要试剂与仪器
C12DLPB,课题组自制,纯度>98%;牛血清白蛋白(BSA)和氯化钠(分析纯),上海阿拉丁生化科技股份有限公司,生物技术级96%;实验用水为娃哈哈纯净水。
F97pro荧光分光光度计,上海棱光技术有限公司;PHS-4C+智能酸度计,成都世纪方舟科技有限公司。
1.2 实验方法
1.2.1 荧光光谱
准确移取BSA储备液(1×10-4mol/L)1.0ml于10 ml容量瓶中,然后依次加入不同体积的C12DLPB储备液(2×10-3mol/L),定容至刻度。
激发狭缝宽度10 nm,发射狭缝宽度5 nm,激发波长283 nm,扫描速度1000转/min,扫描间隔1 nm。
1.2.2 三维荧光光谱
激发波长200~500 nm,发射光波长200~500 nm,激发和发射狭缝宽度5 nm,激发光波长扫描间隔5 nm,扫描间隔1 nm,扫描速度1 000 nm/min。
2 结果与讨论
2.1 荧光光谱
荧光发射光谱能精确地反映蛋白质发射荧光基团周围环境的构象和疏水性等的变化[15]。BSA属于内源性荧光物质,分子中含有的色氨酸、酪氨酸和苯丙氨酸残基能发射荧光。随着C12DLPB溶液浓度的增加(图1),BSA的内源性荧光强度降低,并发生了蓝移;荧光强度由408AU降低到了338AU,降低了17%;荧光峰由341 nm蓝移到了336 nm,表明C12DLPB引起BSA表面3个氨基酸残基周围的构象及疏水性能发生变化,因此BSA荧光发生了猝灭。当C12DLPB浓度为0.2×10-4mol/L时,荧光猝灭现象较强,说明此浓度下C12DLPB与BSA结合作用较强,因此选择该浓度为作用浓度。
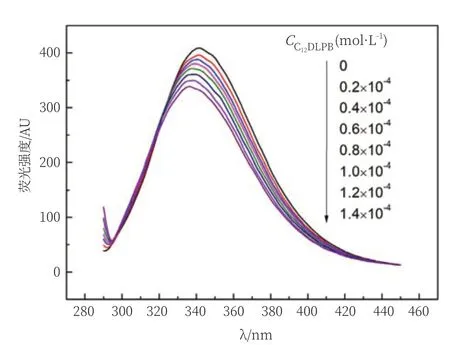
图1 不同浓度C12DLPB对BSA荧光强度的影响
2.2 作用时间
由图2可以看出,在0 min时,C12DLPB-BSA的荧光强度大大降低,从448AU降低到了441AU。在15~60 min作用时间内,BSA与C12DLPB-BSA荧光强度变化比较平稳,之后荧光强度又有所升高,变化较大,相对不稳定。总体来看,15~35 min荧光强度变化趋于稳定,因此选择15 min为最佳的作用时间。
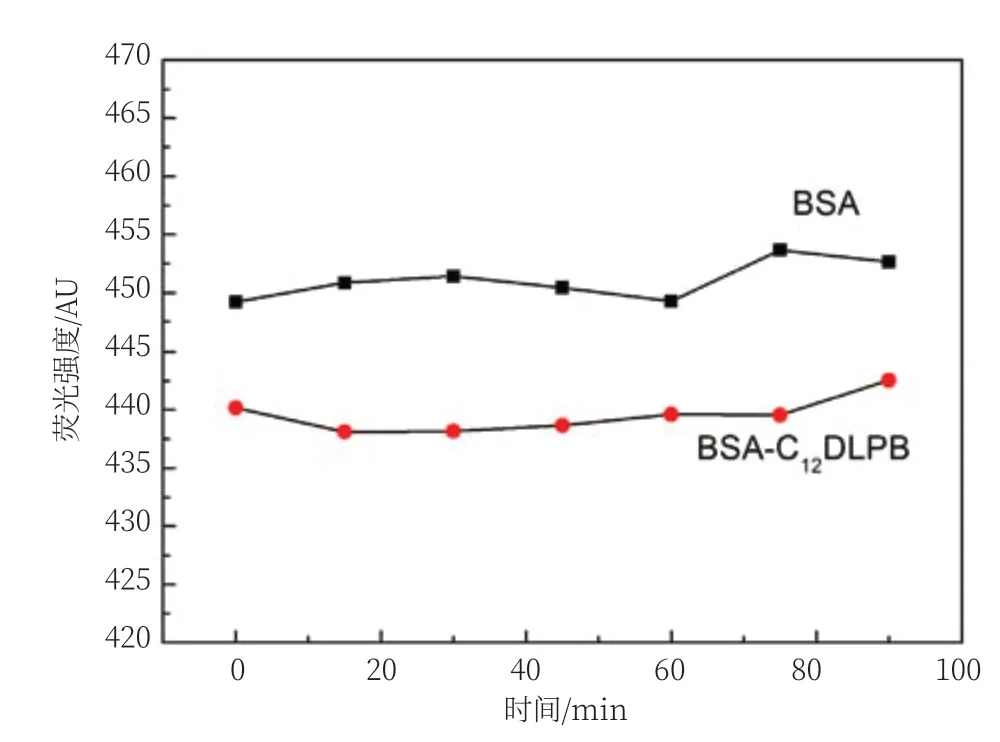
图2 不同时间下BSA和C12DLPB-BSA荧光强度变化曲线
2.3 离子强度
在实际使用过程中经常会有无机盐类等物质存在,因此离子强度是影响C12DLPB-BSA相互作用的重要因素[16,17],研究了当cC12DLPB为0.2×10-4mol/L,作用时间为15 min时,NaCl浓度对二者相互作用的影响。
由图3可以看出,从总体的变化趋势来看,体系荧光强度成上升趋势。这可能是因为NaCl溶液中的Na+离子能中和蛋白质骨架上的负电荷,使得BSA骨架间的静电斥力降低,BSA链紧缩,这样小分子很难嵌入BSA碱基对中,甚至可能将已经嵌插进入碱基对中的小分子重新排挤出来,导致体系荧光增强[18,19]。其中,当加入NaCl溶液的浓度为0.01~0.02 mol/L时,荧光强度比较稳定,此时两个体系中存在物质之间的相互作用比较稳定。当浓度继续增加后,荧光强度增强,因此选取0.02 mol/L为NaCl的最佳浓度。
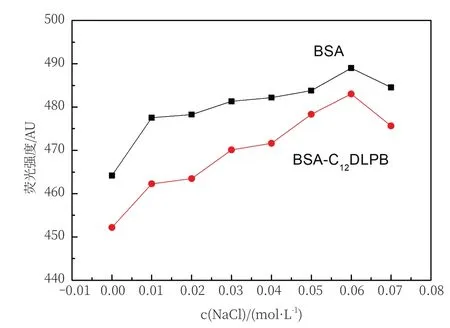
图3 NaCl浓度对BSA和C12DLPB-BSA荧光强度的影响
2.4 pH
在应用体系中pH的大小也是影响蛋白质与两亲配体间作用的重要因素之一。固定cNaCl为0.02 mol/L,作用时间15 min条件下,考察了不同pH对C12DLPB-BSA和BSA荧光强度的影响,溶液pH用0.01 mol/L的NaOH/HCl调节。图4中a~g表示C12DLPB的浓度分别为0、0.2×10-4mol/L、0.4×10-4mol/L、0.6×10-4mol/L、0.8×10-4mol/L、1.0×10-4mol/L、1.2×10-4mol/L。对于加入不同浓度的C12DLPB的BSA溶液,在pH为2.5~10.5时,体系的荧光强度都有先升高后降低的现象,且在原液(pH=6.5)系统中有最高的荧光值。当pH为2.5~4.5和6.5~10.5时体系的荧光强度变化较大,在碱性环境中荧光强度降低比酸性环境中更强。在pH为4.5~6.5时荧光值比较稳定,且在pH=6.5时(原液),有最高的荧光值,且随着样品浓度的增大有相对明显的猝灭现象,适宜的酸碱环境为原液系统。
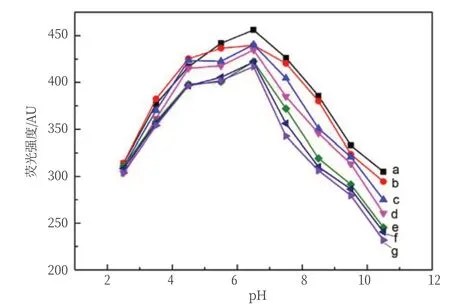
图4 pH对BSA和C12DLPB-BSA荧光强度的影响
2.5 荧光猝灭机制
小分子引起蛋白质荧光猝灭的原因一般有两种情况:①能量转移或电子转移,属于激发态分子之间的相互作用,不影响蛋白质的结构和生理活性,为静态猝灭。②小分子与蛋白质在基态时发生配合作用,生成不发荧光的配合物,使蛋白质的构象发生变化,从而影响蛋白质的生理活性,为动态猝灭[15]。在不同温度下测得C12DLPB与BSA相互作用的数据,运用Stern-Volmer[20]方程对其进行分析(式2)。
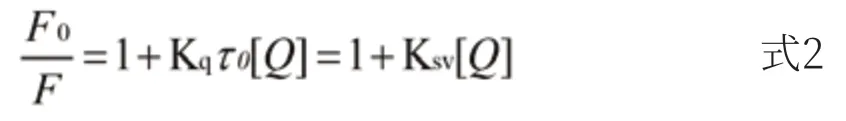
F0表示加入C12DLPB前BSA荧光强度;F表示加入C12DLPB后BSA荧光强度;Ksv表示动态猝灭常数;τ0表示猝灭体不存在时荧光分子平均寿命(s);[Q]表示C12DLPB浓度;Kq是双分子猝灭速率常数。以F0/F对[Q]浓度作图(图5),288.15K、294.15K、301.15K、308.15K温度下的数据都呈现出了良好的线性关系。且由表1可以看出,随着温度的升高,猝灭常数Ksv逐渐升高,此现象为动态猝灭的特征,但是Kq值大于各类猝灭剂与生物大分子的最大碰撞猝灭常数2.0×1010L/mol·s,该特征为静态猝灭的特征,因此判断C12DLPB对BSA荧光猝灭的类型为混合荧光猝灭。

表1 不同温度下C12DLPB对BSA荧光猝灭的Stern-Volmer方程及猝灭常数
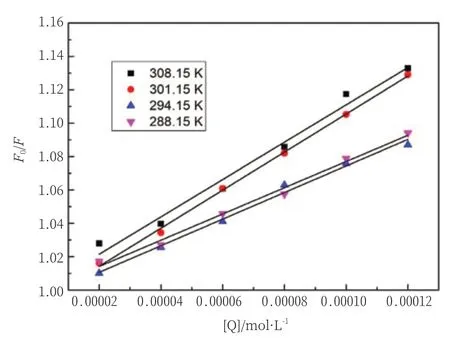
图5 C12DLPB对BSA作用的Stern-Volmer曲线
C12DLPB与BSA在猝灭过程中的结合常数(Ka)和结合位点数(n)可通过修正的Stern-Volmer方程式求得[20](式3)。
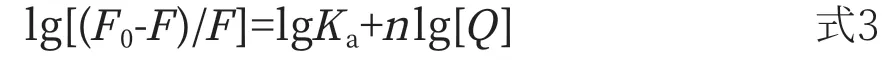
上式中Ka表示结合常数,n表示结合位点数。通过lg[(F0-F)/F]对lg[Q]作图得到直线斜率和截距能计算出结合位点数和结合常数,如图6和表2所示。当温度在288.15~294.15K时,Ka随着温度升高而增加,说明温度升高,C12DLPB-BSA形成的复合物稳定性增加。当温度继续增加时,Ka随着温度升高而减小,说明当温度在294.15~308.15K时,降低了C12DLPB-BSA复合物的稳定性。结合位点数n都接近1,证明复合物C12DLPB-BSA的摩尔比为1∶1。温度越高,n值呈现出先增大后减小的趋势;说明C12DGPB与BSA的结合程度表明温度的升高也呈现出先增大后降低的趋势。
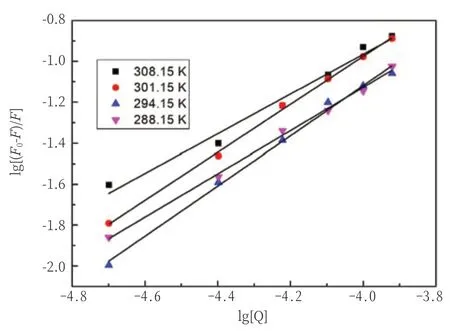
图6 C12DLPB对BSA作用的修正Stern-Volmer曲线
根据热力学参数间的关系式可以计算出各种热力学常数[21](式4、式5、式6)。
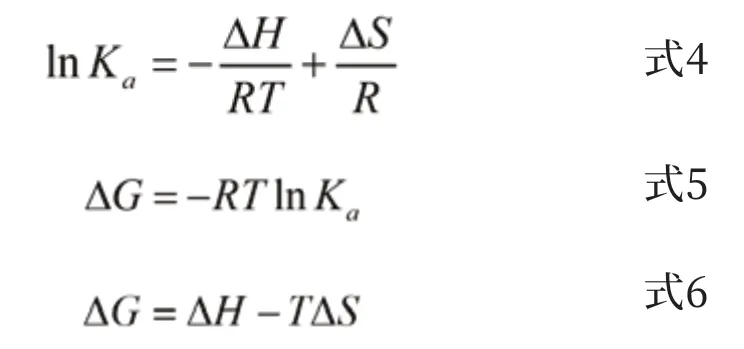
当温度变化较小时,反应的焓变(ΔH)能近似认为是常数。根据小分子与生物大分子反应的热力学参数的变化判断其作用力类型的规律[22],当ΔS和ΔH都<0时,主要作用力为氢键和范德华力;当ΔS和ΔH都>0时,主要作用力为疏水作用力;当ΔH<0,ΔS>0时,主要作用力为静电作用力[23,24]。从表2看出,ΔS和ΔH都>0,说明疏水作用力是C12DLPB-BSA之间结合的主要作用力[25,26],ΔG<0,说明二者之间的键合反应是一个自发过程。
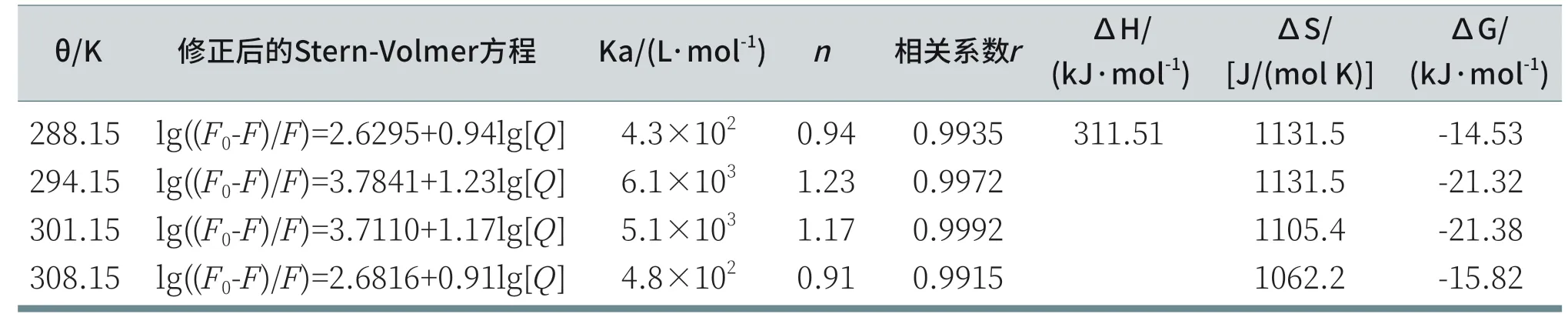
表2 不同温度下C12DLPB对BSA的结合参数和热力学参数
2.6 三维荧光光谱
三维荧光光谱以发射波长、激发波长和荧光强度为坐标的三维空间图谱,可用强度等高线描述组分的浓度和分布,是考察蛋白质二级结构变化的有效方法[27]。在两个10 ml容量瓶中分别准确加入1 ml BSA储备液和1 ml BSA储备液+7 ml C12DLPB储备液,相互作用15 min后,采用1.2.2实验条件,进行三维荧光光谱测定。BSA与C12DLPB-BSA体系的等高线光谱图如图7所示,可观察到明显的铅笔状条纹有一个峰,这个峰反映的是酪氨酸和色氨酸残基的疏水微环境[28,29]。从表3的特征参数可以看出,加入C12DLPB溶液后BSA的荧光峰产生蓝移,从341 nm蓝移到339 nm,荧光强度由511AU降至453AU,降低了11.5%,说明C12DLPB与BSA的结合引起了酪氨酸和色氨酸残基疏水微环境的变化,从而引起了猝灭现象。
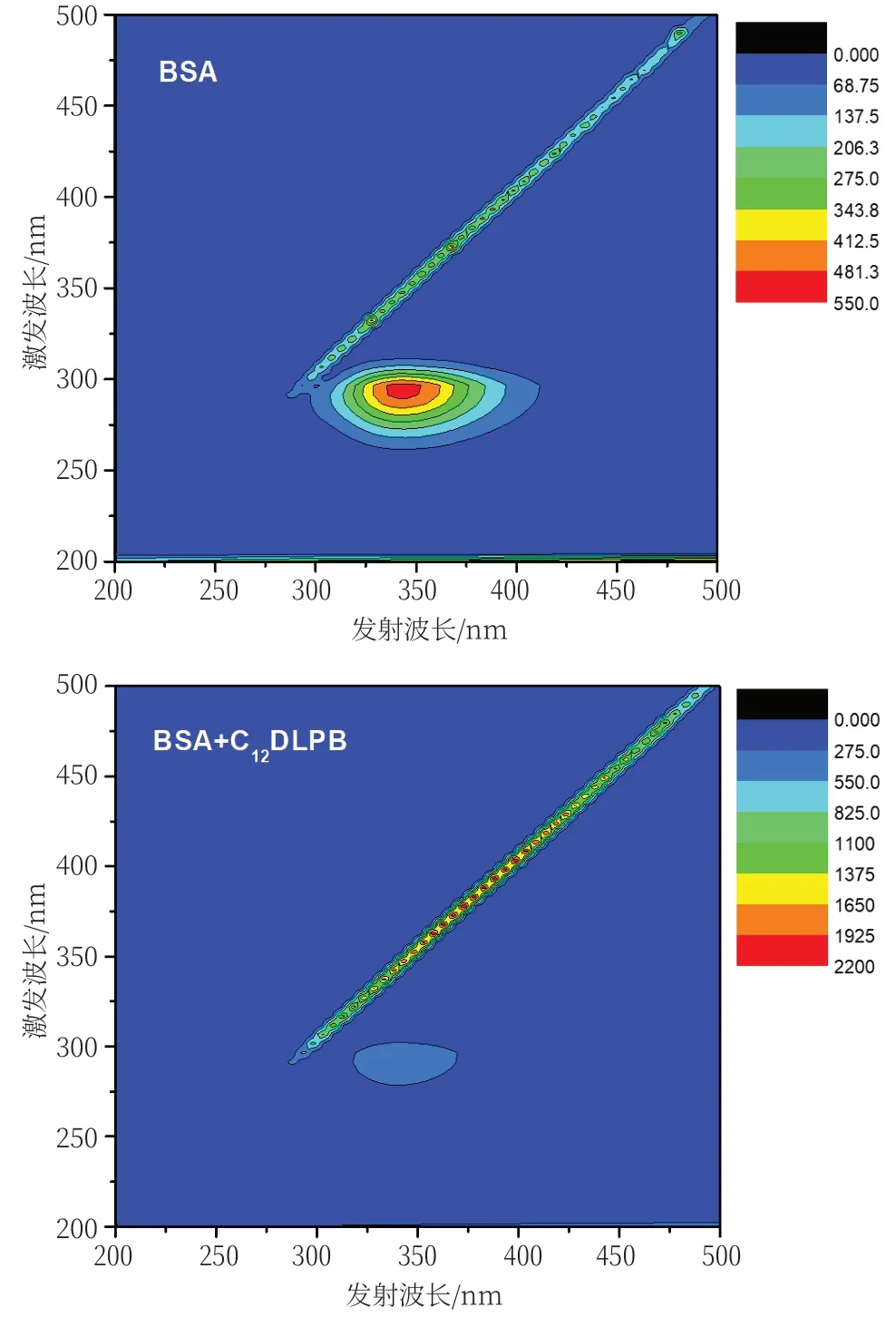
图7 BSA与C12DLPB-BSA体系的等高线图谱

表3 C12DLPB对 BSA三维荧光特征峰的影响
3 结论
C12DLPB能与BSA发生结合作用,使BSA的荧光发生猝灭;二者相互作用的适宜条件为作用时间15 min,pH为原液pH=6.5,NaCl浓度为0.02mol/L;C12DLPB对BSA荧光猝灭过程为混合荧光猝灭;结合常数Ka和结合位点数n随着温度升高先增大后减小,形成复合物稳定性随着温度的升高先增大后降低;C12DLPB与BSA相互作用力类型主要是疏水作用力,且二者的结合引起了酪氨酸和色氨酸残基疏水微环境的变化。
