藏药檀香清咽片对慢性支气管炎模型大鼠支气管肺MyD88/NF-κB/ICAM-1信号通路的影响
2022-04-07邵国强李跃辉达瓦桑珠扎西次仁
邵国强,杜 青,李跃辉,达瓦桑珠,扎西次仁
(1. 湖南省中医药研究院,湖南 长沙 410006;2. 西藏自治区山南市藏医医院,西藏 山南 856000)
慢性支气管炎(chronic bronchitis,CB)是临床上常见的以慢性咳嗽咳痰、伴随喘息为主要特征的呼吸系统疾病,可能通过环境暴露、遗传易感性或大量接触有害颗粒或气体(例如香烟烟雾)激活,具有高发性、易感性等[1]。CB的进展与气管、支气管黏膜和周围组织的慢性非特异性炎症有关,长时间可导致一系列支气管肺组织结构功能改变和代谢异常,严重者甚至引起阻塞性肺气肿、肺源性心血管疾病、肺癌等[2]。CB的治疗常采用吸氧、抗生素、祛痰药等联合应用的方法,会出现周期延长的特点,因此,探讨慢性支气管炎发生机制并筛选有效的预防或治疗的药物至关重要。藏药檀香清咽片由檀香、丛菔、紫花亚菊、唐古特乌头、秦艽花和青藏龙胆组成,具有“清热解毒、止咳化痰、润肺利咽”的功效,临床已经证实对咽喉炎、支气管炎等呼吸道感染引起的咳嗽、咳痰、气喘等症状有明显的的治疗效果。CB的发病机制极其复杂,支气管肺组织细胞内信号传导级联激活释放细胞因子(TNF-α、IL-10)和炎性介质(NF-κB)在其中发挥着重要作用[3-4]。因此,本研究通过观察檀香清咽片对脂多糖烟雾诱导慢性支气管炎模型大鼠支气管肺炎性浸润程度、炎性介质MyD88/NF-κB/ICAM-1信号通路的影响,以期为民族药的开发提供一定的理论基础。
1 材料
1.1 动物SD大鼠,70只,♂,SPF级,体质量(180~220) g;由湖南省斯莱克景达实验动物有限公司提供。实验动物许可证号:SCXK(湘)2019-0004,合格证编号:430727211100275116。实验程序根据湖南省中医药研究院实验动物中心SOP进行,所有程序均按照中国科学技术部制定的“实验动物护理和使用指导意见”进行,批准编号:2021-0007。允许大鼠在恒定温度、湿度和光暗循环[(20~26) ℃; 40%~70%;07 ∶00~19 ∶00光照循环]下自由饮水和进食。
1.2 仪器Envision2105型酶标仪(PE公司);RM2245型轮转式切片机(德国Leica公司);奥林巴斯BX53型生物显微镜(Olympus 公司);7DZ5-WS型低温低速离心机(湖南湘仪实验仪器公司);PANNORAMIC型全景切片扫描仪(匈牙利3DHISTECH公司);DYY-6C型电泳仪(北京六一);DYCP-31DN型水平琼脂糖电泳槽(北京六一);ChemiDocTMXRS+型凝胶成像系统(美国Bio-Rad公司)。
1.3 药物及试剂檀香清咽片(批号20201101),由檀香、丛菔、紫花亚菊、唐古特乌头、秦艽花、青藏龙胆6味药组成,比例为:37 ∶37 ∶37 ∶30 ∶30 ∶30,由湖南省中医药研究院中药研究所制剂室提供并制成超微粉,临床使用剂量为4 g生药·d-1,按照体表面积换算成大鼠等效剂量为0.36 g·kg-1,檀香清咽片高、中、低剂量即为临床等效剂量的4倍、2倍、1倍(1.44、0.72、0.36 g·kg-1);阳性药:桂龙瑞咳宁片(批号:200403,1 g·kg-1),江西药都仁和制药有限公司;脂多糖(LPS,Sigma公司,批号:L2880);TNF-α和IL-10 ELISA试剂盒(Elabscience公司,批号:E-EL-R2856c,E-EL-R0016c);MyD88一抗(ABclona公司,批号:A0786),NF-κB一抗(Proteintech公司,批号:66535-1-Ig),ICAM-1一抗(Proteintech公司,批号:10020-1-AP),肌动蛋白(actin,Proteintech公司,批号:66009-1-Ig);HRP标记山羊抗兔(Proteintech公司,批号:SA00001-2);HRP标记山羊抗大鼠(Proteintech公司,批号:SA00001-1);trizol(美国Sigma公司,批号:V900483);SuperECL Plus 超敏发光液(美国advansta公司,批号:K-12045-D50)。
2 方法
2.1 慢性支气管炎大鼠模型建立SD大鼠适应性喂养5 d后,按体重随机分为:正常组(n=8)、假手术组(n=8)和模型组(n=54),模型组造模方法:每天将大鼠置于烟熏箱内,进行两次烟熏,上下午各一次,每次熏1 h,每次烟熏量为10支香烟,两次烟熏之间间隔4 h(手术当天取消熏烟)。d 15,模型组大鼠采用1%戊巴比妥钠溶液(50 mg·kg-1)腹腔麻醉后,固定在板上,暴露声门,将200 μg(2 g·L-1)LPS溶液快速注入气管,然后将固定板垂直旋转,使脂多糖均匀分布于两肺,在造模后,大鼠禁食不禁水6 h。
2.2 分组与给药在熏烟15 d后,将上述模型组大鼠按体重随机分为模型组、阳性药(桂龙瑞咳宁片1 g·kg-1)组、檀香清咽片高、中、低剂量(1.44、0.72、0.36 g·kg-1)组,每组10只。继续烟熏造模的同时,药物干预组灌胃给予相应药物,正常组、假手术组和模型组给予等体积纯净水,连续给药15 d。
2.3 一般行为、体征与解剖观察实验过程过中每周称定动物体质量以调整用药剂量,并详细观察动物背毛、眼、耳、尾,精神状态和活动等情况。
2.4 样本采集和制备因为手术后每组动物有一定的死亡率,给药结束后次日,各组选取7只大鼠,采用1%戊巴比妥钠溶液(50 mg·kg-1)腹腔麻醉,腹主动脉取血,离心(3 000 r·min-1,15 min),取上清液,-80 ℃保存待用。然后,打开大鼠胸腔,完整取出全部支气管肺组织,右侧肺脏液氮冻存备用;左侧肺组织10%中性甲醛溶液固定备用。
2.5 血清炎症因子检测将冻存的血清样本梯度放入-20 ℃和4 ℃解冻后,试剂盒平衡到室温,配制洗涤液、标准工作液、生物素化抗体工作液、酶结合物工作液,按照Elisa试剂盒说明书步骤加样、温育、洗板、检测血清中TNF-α、IL-10含量变化。
2.6 支气管肺组织病理切片HE染色各组大鼠支气管和左侧部分肺组织制成石蜡切片。将脱蜡的切片放染色架上,苏木精染色,1%的盐酸内分色。水洗,温水或弱碱性水溶液反蓝,伊红染色,脱水,封片。通过光学显微镜观察肺组织形态学变化(400×)。实验动物造模成功的主要表现为支气管周围炎症细胞浸润状况,管腔内有无渗出物,肺泡壁间质炎及肺泡气肿改变等。支气管炎症浸润程度:观察切片中所有支气管炎症细胞浸润情况,计数炎细胞浸润支气管和非浸润支气管数目,进行统计学比较。
2.7 Western blot法定量检测MyD88/NF-κB/ICAM-1蛋白表达将支气管肺组织剪碎,在冰上匀浆,加入裂解液裂解30 min,12 000 r·min-14 ℃离心5 min,取上清液进行蛋白定量,调整蛋白量后,取等量裂解产物,加入上样缓冲液进行SDS-PAGE电泳,电泳后转移至PVDF膜上,加入脱脂牛奶中室温封闭2 h,加入一抗4 ℃孵育过夜,TBST洗涤,加入相应二抗室温孵育1 h,TBST洗涤,化学发光法显色,成像扫描分析系统保存图像。以actin蛋白表达水平作为内参,以各样本与相应内参灰度值比值为蛋白相对含量。
2.8 免疫组织化学法检测MyD88/NF-κB/ICAM-1蛋白表达取固定的肺组织进行石蜡包埋,自动切片机切取厚度为0.4 μm的组织切片。用二甲苯及系列乙醇脱蜡脱水;PBS冲洗,3% H2O2室温孵育10 min灭活内源性过氧化物酶;PBS冲洗;10%正常山羊血清(PBS稀释)封闭,室温孵育10 min;滴加1 ∶50兔抗大鼠一抗,4 ℃过夜;滴加生物素标记二抗,37 ℃孵育30 min;DAB显色;冲洗,终止显色;苏木精复染、脱水、封片,在光学显微镜(100×)下观察每张载玻片3个不重复视野并统计MyD88、NF-κB和ICAM-1的阳性细胞率。

3 结果
3.1 檀香清咽片对慢性支气管炎大鼠一般情况的影响造模后,模型组大鼠皮毛光泽逐渐丧失、活动量减少、情绪倦怠,饮水量和排尿量明显增加,可以听到气道哮鸣音和痰鸣音,体质量明显减轻(P<0.01);给予檀香清咽片药物干预后,气道哮鸣音明显缓解。体质量变化情况见Tab 1。
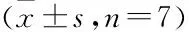
Tab 1 Effects of Tanxiang Qingyan Tablets on body mass of rats with chronic bronchitis
3.2 檀香清咽片对慢性支气管炎大鼠血清炎症因子的影响与假手术组比较,模型组大鼠血清中TNF-α含量明显升高,IL-10含量明显降低;与模型组比较,檀香清咽片高、中剂量组可明显降低血清TNF-α含量(P<0.05,P<0.01),但对IL-10含量改变差异无统计学意义。见Tab 2。
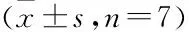
Tab 2 Effects of Tanxiang Qingyan Tablets on serum inflammatory factors in rats with chronic bronchitis
3.3 檀香清咽片对慢性支气管炎大鼠支气管肺组织病理形态的影响正常组大鼠支气管黏膜上皮细胞完整,无充血水肿现象,细胞排列整齐,肺组织结构肺泡无明显病理改变;模型组大鼠支气管黏膜上皮细胞受损严重,大量坏死脱落,杯状细胞增生,管壁大量纤维组织增生,管壁明显增厚,管腔狭窄,管腔内充满分泌物及渗出物,肺泡隔增宽,有不同程度的炎细胞浸润及毛细血管扩张充血,非浸润支气管数减少(P<0.01);与模型组比较,阳性药组大鼠肺组织损伤和炎性改变减轻较为明显,支气管黏膜上皮无严重受损,管腔和肺泡腔内少有坏死脱落细胞及渗出物,见少量纤维组织及炎细胞浸润,水肿、充血不明显。檀香清咽片组大鼠支气管黏膜上皮受损程度较轻,管腔和肺泡腔内有少量坏死脱落细胞及渗出物,肺组织损伤和炎性改变减轻,管壁增厚,肺泡隔增宽,见少量纤维组织及炎细胞浸润水肿(P<0.05,P<0.01)。见Fig 1,Tab 3。
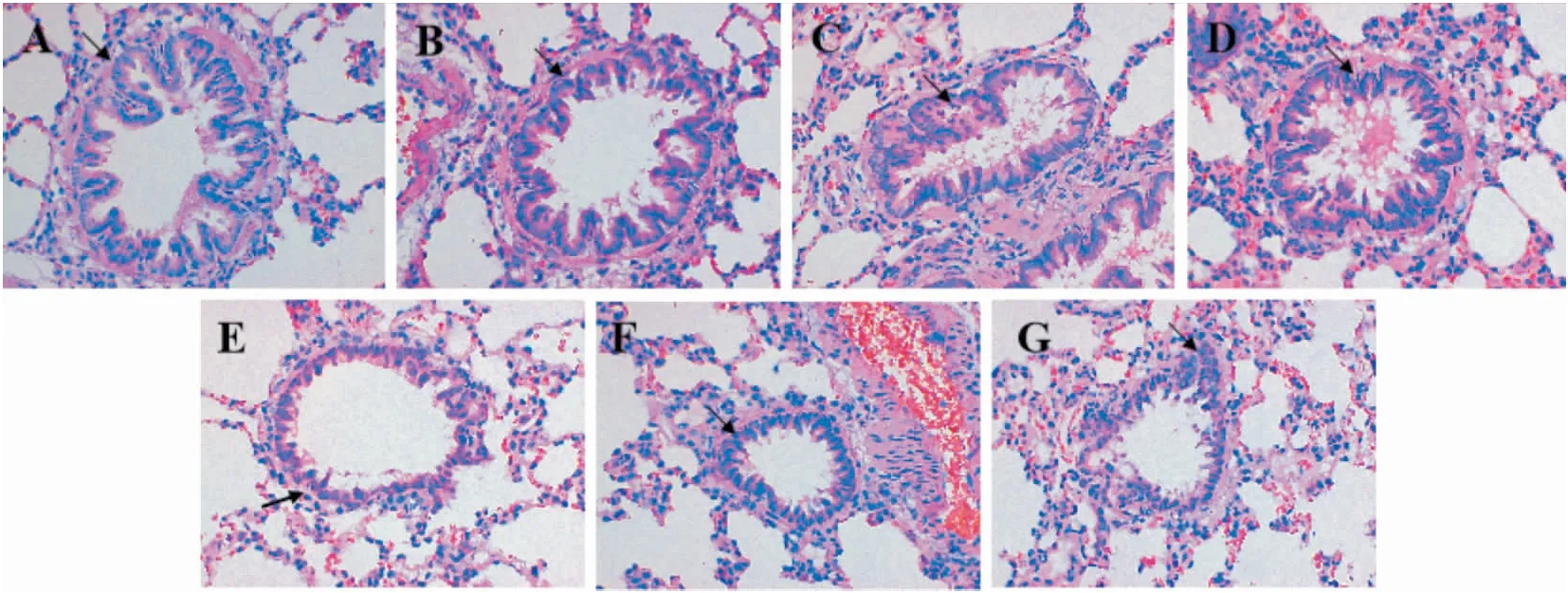
Fig 1 Effect of Tanxiang Qingyan Tablets on pathological morphology of bronchopulmonary tissues in rats with chronic bronchitis (HE×400)
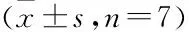
Tab 3 Effects of Tanxiang Qingyan Tablets on infiltration of bronchial inflammatory cells in rats with chronic bronchitis
3.4 檀香清咽片对慢性支气管炎大鼠支气管肺组织MyD88/NF-κB/ICAM-1蛋白表达的影响与假手术组比较,模型组大鼠支气管肺组织MyD88、NF-κB和ICAM-1蛋白灰度值和阳性表达率明显上升(P<0.05,P<0.01);与模型组比较,阳性药组和檀香清咽片组大鼠支气管肺组织MyD88、NF-κB和ICAM-1蛋白灰度值和阳性表达率阳性表达率明显下调,差异具有统计学意义(P<0.05,P<0.01)。见Fig 2,3,Tab 4,5。

Fig 2 Effect of Tanxiang Qingyan Tablets on MyD88/NF-κB/ICAM-1 protein bands in bronchopulmonary tissues of rats with chronic bronchitis
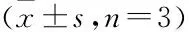
Tab 4 Effect of Tanxiang Qingyan Tablets on gray value of MyD88/NF-κB/ICAM-1 protein in bronchopulmonary tissues of rats with chronic bronchitis
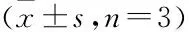
Tab 5 Effect of Tanxiang Qingyan Tablets on positive rate of MyD88/NF-κB/ICAM-1 protein expression in bronchopulmonary tissues of rats with chronic bronchitis
4 讨论
我国的慢性支气管炎发病率约为4.0%,老年患者约占6%~20%,严重影响人类的生活质量[5]。CB的生理病理过程主要是中央气道上皮受损、炎症细胞浸润、平滑肌细胞肥大等;炎症反应是CB发生发展的核心机制,多种炎症因子间相互作用,继发黏液高分泌、上皮免疫功能下降、气道表面脱水及气道重塑[6]。减少细胞因子和炎症介质等促炎因素的产生成为治疗CB的关键。

Fig 3 Results of immunohistochemical staining of MyD88,NF-κB and ICAM-1 proteins in bronchopulmonary tissues of rats in each group (×100)A: Control B: Sham C: Model D: Positive drug E: High F: Medium G: Low
本研究采用熏烟法联合脂多糖(LPS)诱导CB模型,LPS是重要的致炎因子,可引起气道上皮细胞损伤,诱发气道炎症。LPS与细胞膜上Toll受体结合可诱导一系列复杂炎症反应,髓样分化因子88(MyD88)是Toll信号的一种关键连接分子,很好的反应机体炎症损害程度[7-8]。NF-κB由p50/p65亚单位形成的异源二聚体存在于细胞浆中,可与多种细胞基因的增强子或启动子特异性结合,是调控炎症过程中的关键因子。MyD88依赖的Toll途径可促进炎症因子的产生,从而激活NF-κB信号通路,诱发多种炎症因子(如IL-1β、IL-6、TNF-α、ICAM-1等)的表达,导致巨噬细胞、中性粒细胞等免疫细胞在炎症部位的聚集和浸润[9-10]。以往研究发现,NF-κB在介导呼吸道炎症中发挥重要作用,已成为治疗CB的潜在靶点[11]。细胞间黏附分子1(ICAM-1)作为NF-κB的下游炎症递质,主要参与细胞识别、活化和信号传导,在免疫应答和炎症发生等方面具有重要作用[12]。机体正常情况下低水平表达,出现组织损伤后,可经NF-κB调控和白介素等炎性因子诱导活化,与白细胞表面淋巴细胞功能相关抗原相互作用,促使相关抗原阳性白细胞黏附于ICAM-1阳性内皮细胞表面,进一步到达炎症组织,促进炎症细胞的迁移和趋化[13-14]。
TNF-α是LPS介导CB发病过程中最早释放的主要前炎性细胞因子之一,也是NF-κB信号通路的下游分子,能够激活免疫细胞促进炎症因子的释放,进而介导肺组织炎症反应的过程,诱发或加重支气管炎症[15]。IL-10具有抑制促炎细胞因子合成与释放的抗炎作用,是一种多细胞源多功能细胞因子[16]。本研究ELISA检测CB模型大鼠外周血清中TNF-α和IL-10含量,发现檀香清咽片可有效调控促炎因子TNF-α的水平,但对IL-10的水平改变无显著性差异,针对抑炎因子是否有调控作用后续将采用多种方法进一步验证。
本研究另外采用Western blot法和免疫组织化学双重定量定性考察炎性介质MyD88、NF-κB和ICAM-1蛋白在CB模型大鼠支气管肺组织中的表达情况,发现檀香清咽片可明显抑制CB模型大鼠MyD88/NF-κB/ICAM-1信号通路的激活,减少支气管肺组织的炎性浸润,改善气道和肺部炎症状况。本研究HE染色结果也表明,檀香清咽片可有效改善CB模型大鼠支气管黏膜炎症细胞浸润程度,减少杯状细胞和管壁大量纤维增生,增加管腔内径,缓解支气管肺部炎症。檀香清咽片可有效改善支气管肺组织炎性浸润,可能与减少炎性介质TNF-α等的释放,可能与调控MyD88/NF-κB/ICAM-1信号通路表达有关。本研究从炎症介质调控方面探讨了檀香清咽片治疗慢性支气管炎作用和机制,其他作用机制需进一步研究证实。