细胞分裂素受体基因SlHK4突变对番茄抗旱性的影响
2022-04-06陈兆玉王永丁静李义
陈兆玉,王永,2,丁静*,李义
(1.南京农业大学作物遗传与种质创新国家重点实验室/园艺学院,江苏 南京 210095;2.河南农业大学园艺学院,河南 郑州 450002;3.康涅狄格大学植物科学与景观建筑系,斯托尔斯 美国 CT06269)
番茄(Solanumlycopersicum)是世界范围内广泛种植的茄果类蔬菜,其生长的最适土壤湿度为60%~70%[1],易受干旱胁迫等逆境伤害。干旱会引起番茄植株发生一系列生理生化变化,包括含水量降低、光合速率下降、细胞膜损伤以及活性氧(ROS)积聚等[2],从而导致其果实产量和品质的下降。
细胞分裂素是最重要的植物激素之一,广泛参与植物的生长发育过程[3],包括促进细胞分裂和芽分化,解除顶端优势,抑制侧根生长,延缓叶绿素分解和叶片衰老等[4]。细胞分裂素对植物生长发育的调控依赖于细胞分裂素受体(属于组氨酸激酶,histidine kinase,HK)。受体HK蛋白与细胞分裂素结合后,通过磷酸基团的传递,激活对下游响应基因的调控[5]。研究表明,HK基因的突变会阻断细胞分裂素的信号传递,使植株对细胞分裂素不敏感,并表现出细胞分裂素缺乏的表型,如植株生长停滞、叶片衰老提前及侧根数目增加等[5-6]。
研究表明,拟南芥中有3个细胞分裂素受体基因:AHK2、AHK3和AHK4[7]。其中,AHK2主要在叶和花中表达,在根中表达量很低;AHK3在各个组织中都有较高的表达;AHK4主要在根和花梗及其他维管束组织中表达,而在叶片中表达量很低[7-8]。对拟南芥不同细胞分裂素受体突变体的研究表明,AHK3主要调控地上部的生长发育,且是抑制叶片衰老的关键受体[9];AHK4主要调控根的生长发育、愈伤的形成和植株对磷酸的响应等[10-11];AHK2参与AHK3、AHK4的调控,其特定功能尚有待发现。不同细胞分裂素受体基因的功能既有特异性,又有一定的冗余。拟南芥单/双受体基因的突变对植物的生长没有影响或仅有很小的影响,只有当AHK2、AHK3和AHK4这3个基因同时突变,才明显抑制拟南芥植株的生长,使雌性和雄性器官发育异常[5,8,11]。
此外,已有研究显示,细胞分裂素受体在ABA信号传导和非生物胁迫反应中起负调控作用[12-13]。ahk2、ahk3单突变体和ahk2/ahk3双突变体比野生型(WT)具有更强的抗旱性和耐盐性。然而,ahk4突变体在干旱胁迫下的表型和复水后的植株存活率与WT没有显著差异;在外施细胞分裂素的条件下,ahk4突变体的耐盐性显著提高[13],因此认为受体基因AHK4对拟南芥非生物胁迫抗性的调控依赖于细胞分裂素的存在。
笔者所在课题组前期对番茄细胞分裂素受体基因进行了鉴定及CRISPR/Cas突变。本研究以拟南芥受体基因AHK4在番茄中的直系同源基因SlHK4的突变株系为材料,分析比较slhk4突变株系和WT在干旱胁迫下的表型、光合作用、抗氧化性等方面的差异,旨在为系统解析细胞分裂素及其受体基因在番茄抗逆性中的功能及其分子机制奠定基础。
1 材料与方法
1.1 载体构建、试验材料及干旱处理
本试验以刘耀光老师课题组的pYLCRISPRCas9Pubi-N载体[14]为基础,构建细胞分裂素受体基因SlHK4(Solyc04g008110)的CRISPR/Cas编辑载体。利用在线工具CRISPR-P 2.0(http://cbi.hzau.edu.cn/crispr/)在SlHK4基因的5′端分别设计2个sgRNA序列,即sgRNA1(CAAGCTTCCGGAAAACCCGA)和sgRNA2(TCTTAAGAGCTAGGGCCAGT);使用pYLgRNA中间载体[14]上的AtU3d、AtU3b启动子分别驱动sgRNA1和sgRNA2,同时连入pYLCRISPRCas9Pubi-N载体,获得编辑载体CRISPR-SlHK4。所有DNA片段合成由南京金斯瑞公司完成。采用农杆菌介导法,将CRISPR-SlHK4载体遗传转化番茄品种‘Micro-Tom’。使用PCR扩增CRISPR/Cas转基因及sgRNA靶定区域(引物序列见表1),并利用测序鉴定sgRNA靶定位点的突变。将具有突变的株系自交繁殖,获得不含有CRISPR/Cas外源基因的2个T3代独立纯合突变株系slhk4-4和slhk4-118。经测序检验,与WT相比,slhk4-4和slhk4-118突变株系均在sgRNA1靶定区域存在突变;从SlHK4基因起始密码子开始计算,slhk4-4和slhk4-118分别缺失了第700~704 bp的4个核苷酸和第600~703 bp的103个核苷酸(图1)。

表1 本试验所用的引物

图1 slhk4-4(A)和slhk4-118(B)突变株系靶定位点测序结果
选取饱满的slhk4-4、slhk4-118T3代种子和‘Micro-Tom’番茄(WT)种子,无菌水浸泡12 h后置于暗处催芽。待种子露白后,播种于盛有育苗基质的穴盘中,放置在昼/夜温度为25 ℃/20 ℃、昼/夜时间为 16 h/8 h、光照强度为200 μmol·m-2·s-1和相对湿度50%~55%的气候生长室中生长7 d。选取长势一致的slhk4-4、slhk4-118和WT幼苗各30株,移栽到盛有栽培基质的花盆(直径10 cm,高10 cm)中,于相同条件生长30 d。彻底灌水后停止浇水,进行干旱处理。停止浇水(干旱处理)30 d后对所有植株彻底浇灌复水,复水7 d后统计植株存活率。
1.2 生理生化指标的测定
根据预试验结果,干旱处理15 d以上,植株开始出现干旱表型。将干旱处理8 d作为番茄正常生长的对照组开始取样,每个参数测定3个重复,每个重复至少包含8株植株材料,尽量避免取萎蔫叶片。结果以平均值±标准误表示。
1.2.1 叶片相对含水量的测定取干旱处理8、20、24、27 d植株倒数第3片新鲜叶片,去除叶脉后测定叶片相对含水量(RWC)[15]。计算公式:RWC=(自然鲜重-干重)/(饱和鲜重-干重)×100%。
1.2.2 叶绿素荧光参数测定取干旱处理8、20、24、27 d植株倒数第5片新鲜叶片,暗处理15 min后,使用调制叶绿素荧光成像系统(Image-Pam)测定叶绿素荧光参数,包括:光系统Ⅱ最大光化学效率(Fv/Fm)、实际光化学效率(ΦPSⅡ)、光化学猝灭系数(qP)和电子传递相对速率(ETR)。
1.2.3 叶绿素含量的测定取干旱处理8、13、21、30 d植株倒数第5片叶片,使用手持叶绿素仪(SPAD-502 Plus)测定。
1.2.4 氧化胁迫相关参数的测定取干旱处理8、14、20、22 d植株倒数第4片叶片,立刻在液氮中冷冻并保存于-80 ℃超低温冰箱中备用。由于干旱处理22 d之后的WT叶片萎蔫严重,不适合取样,因此未对之后的叶片进行相关参数的检测。采用超氧化物歧化酶(SOD)活性检测试剂盒(碧云天生物技术有限公司)测定SOD活性,采用植物谷胱甘肽S转移酶(GST)酶联免疫分析试剂盒(南京菲亚生物公司)测定GST含量,采用丙二醛(MDA)测定试剂盒(南京迈博生物科技生物公司)测定MDA含量。
1.3 RNA提取和实时荧光定量PCR
取干旱处理8、16、20、22 d植株倒数第4片叶片,采用改良CTAB法[16]提取RNA。由于干旱处理22 d之后的WT叶片萎蔫严重,不适合取样,未对之后的叶片进行基因表达的检测。采用PrimeScriptTMRT reagent kit with gDNA Eraser(perfect real time)试剂盒(TaKaRa)将RNA反转录为cDNA,作为实时荧光定量PCR(RT-qPCR)反应的模板。RT-qPCR所用的荧光染料为DRR041A SYBR(TaKaRa)。应用CFX96荧光定量PCR仪(Bio-Rad)进行RT-qPCR反应,每个样品3个重复。扩增程序为:95 ℃ 1 min;95 ℃ 10 s,60 ℃ 30 s,40个循环。采用2-ΔΔCT法[17]将基因的表达值用番茄SlActin内参基因(引物序列见表1)进行归一化处理,计算基因的相对表达量。
1.4 数据分析
数据采用Excel 2007软件和SPSS 24软件进行分析和图表绘制。显著性检验使用One-way ANOVA方差检验和Duncan’s多重比较。
2 结果与分析
2.1 SlHK4基因突变对干旱胁迫下番茄表型及存活率的影响
选取野生型(WT)、slhk4-4和slhk4-118番茄幼苗各30株进行干旱处理,结果(图2)表明,干旱处理前,与WT相比,2个突变株系地上部较矮。正常生长25 d时,slhk4-4株系平均株高5.3 cm,略小于slhk4-118株系(5.5 cm),显著小于WT(8.0 cm)。此外,2个突变株系地上部冠幅较小,叶面积较小,但复叶数目与WT相同。干旱处理8 d,各株系番茄叶片均正常舒展,未发现可见的干旱表型变化。干旱处理16 d,有11株WT植株部分叶片尖端或边缘向上翻卷,出现轻微萎蔫现象;而slhk4株系的叶片均正常舒展,未萎蔫。干旱处理22 d,30株WT植株均出现叶片萎蔫下垂现象,其中13株全部叶片萎蔫,茎皱缩;slhk4株系中,仅一半植株出现轻微叶片萎蔫,slhk4-4和slhk4-118株系间无明显差异。干旱处理30 d,所有番茄植株均处于缺水萎蔫状态,WT多数植株整株枯萎且倒伏,2个slhk4株系叶片萎蔫程度比WT低且大多数未倒伏。干旱处理期番茄植株的表型变化显示,slhk4-4和slhk4-118株系的耐旱性很可能高于WT。

图2 干旱和复水条件下slhk4-4、slhk4-118及野生型(WT)的表型
干旱处理30 d后给所有植株复水,复水7 d后统计各株系的存活率,发现30株WT中存活3株,存活率仅为10.0%;而slhk4-4和slhk4-118分别存活18和19株,存活率为60.0%和63.3%,分别是WT的6.0和6.3倍。复水后植株存活率的统计表明,slhk4突变株系的抗旱能力显著高于WT。
干旱胁迫过程中各株系叶片相对含水量(RWC)结果(图3-A)显示,各株系叶片RWC随着干旱时间的延长均大幅降低,但WT下降幅度更大。干旱处理8 d,slhk4突变株系叶片RWC与WT无显著差异,均为90%左右;干旱处理20、24和27 d,slhk4株系的RWC显著高于WT。slhk4-4株系干旱处理24 d时叶片RWC(55.6%)与WT干旱处理20 d时(55.6%)相同;干旱处理27 d,slhk4-4和slhk4-118的RWC与WT差异最为显著,分别是WT的1.7和1.6倍。表明干旱胁迫下,slhk4突变株系叶片的持水能力更强。
由图3-B可以看出:干旱响应标记基因SlDREB1基因在干旱处理前16 d的各株系叶片中表达量极低且没有明显差异;干旱处理20 d,WT叶片中SlDREB1表达量大幅增加,而slhk4突变株系中SlDREB1基因的表达尚无显著变化。干旱处理22 d,slhk4和WT叶片中SlDREB1的表达均显著上调,且slhk4-4株系SlDREB1表达量上升的幅度高于WT。
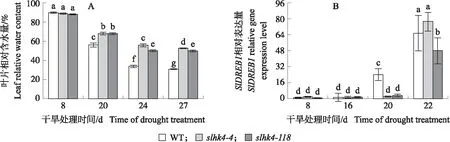
图3 干旱胁迫下slhk4-4、slhk4-118及WT叶片的相对含水量(A)和干旱响应标记基因SlDREB1的表达量(B)
综合以上结果可以得出:干旱处理8 d时,WT与slhk4突变株系均尚未受到干旱胁迫,该时间点可作为干旱处理的起始对照点;在相同干旱条件下,2个slhk4株系的持水能力比WT强,较晚受到干旱胁迫的影响;slhk4株系受到干旱胁迫后其在较短时间内的响应幅度可能比WT更剧烈。
2.2 SlHK4基因突变对干旱胁迫下番茄光合性能的影响
由图4-A可见:干旱处理13 d,2个slhk4株系叶片叶绿素含量与干旱处理8 d无显著差异,且显著高于WT。随着干旱程度增加,WT叶片叶绿素含量逐渐降低,干旱处理21、30 d,WT叶片叶绿素含量分别比干旱处理8 d减少7.5%和22.2%,而2个slhk4株系叶片的叶绿素含量均没有下降,slhk4-118叶片叶绿素含量甚至略有升高,说明本试验中的干旱处理对slhk4株系叶片的影响较小,并未引起slhk4株系叶片中叶绿素的大量降解。
干旱处理8 d,即无干旱胁迫条件下,2个slhk4突变株系和WT的光合作用没有显著差异(图4-B—E)。干旱处理24 d前,各株系间Fv/Fm差异不大,且均未出现显著下降;直至干旱处理27 d,WT的Fv/Fm大幅下降,而2个slhk4株系基本不变(图4-B)。WT和2个slhk4株系的ΦPSⅡ和qP均从干旱处理24 d开始下降;干旱处理27 d时,WT的ΦPSⅡ和qP大幅下降至极低的水平;而2个slhk4株系下降不明显(图4-C—E)。WT和2个slhk4株系的ETR在干旱处理8~20 d均发生大幅降低;WT的ETR在干旱处理27 d再次显著降低,而2个slhk4株系变化不大。与干旱处理8 d相比,干旱处理27 d时WT的Fv/Fm、ΦPSⅡ、qP和ETR分别下降21.2%、90.6%、92.9%和96.5%,说明在干旱胁迫后期,WT的光合作用受到严重影响;而此时2个slhk4株系的Fv/Fm并未显著下降,ΦPSⅡ、qP和ETR的下降幅度也显著小于WT,表明slhk4株系在相同干旱条件下的光合性能更强。
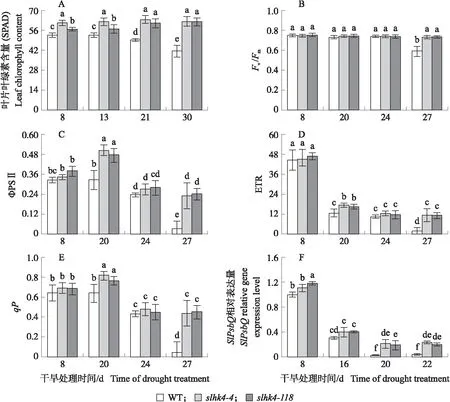
图4 干旱胁迫下slhk4-4、slhk4-118和WT叶片的光合作用相关参数
干旱处理8 d,2个slhk4株系的SlPsbQ基因表达量与WT差异不大;干旱处理16 d,2个slhk4株系和WT的SlPsbQ表达量大幅降低;干旱处理20 d,WT的SlPsbQ表达量下降到极低水平,与干旱处理8 d相比下调97.7%,slhk4-4和slhk4-118株系SlPsbQ表达量显著高于WT,分别是WT的8.2和7.3倍。说明干旱胁迫下,slhk4株系光合速率下降比WT慢,光合作用更强,slhk4突变株系抗旱性更强。
2.3 SlHK4基因突变对干旱胁迫下番茄活性氧(ROS)清除能力的影响
由图5可见:干旱处理8 d时,2个slhk4株系的MDA含量与WT无明显差异;干旱处理14和22 d,2个slhk4株系和WT叶片的MDA含量均显著升高,但2个slhk4株系的增幅小于WT;干旱处理22 d,slhk4-4、slhk4-118叶片的MDA含量分别比WT降低42.5%和18.6%,说明slhk4株系的膜系统氧化损伤程度较轻,即slhk4株系内部的ROS毒害作用可能较小。
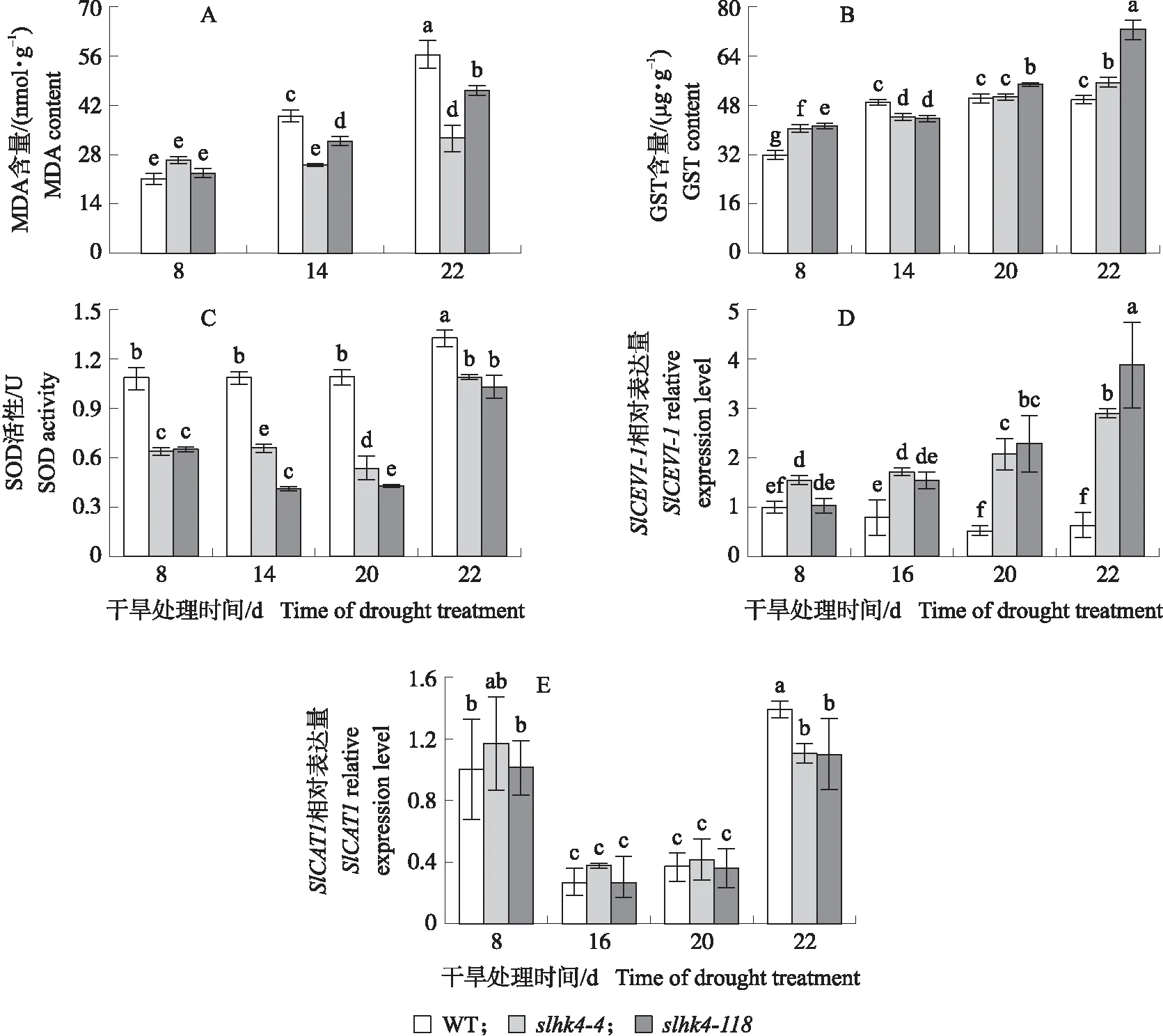
图5 干旱胁迫下slhk4-4、slhk4-118和WT叶片的氧化胁迫相关参数
干旱处理14 d,WT的GST含量比干旱处理8 d显著增加(55.8%),而slhk4-4、slhk4-118株系变化不大(分别增加8.2%、6.2%);干旱处理22 d,2个slhk4株系的GST含量显著升高,slhk4-4、slhk4-118的GST含量分别比WT高11.0%、45.2%。随着干旱程度增加,slhk4株系中编码POX的SlCEVI-1基因表达量在干旱处理20 d显著上升,而WT中略微下降。干旱处理22 d,slhk4-4、slhk4-118中SlCEVI-1表达量分别是WT中的3.7和5.2倍。因此,GST和SlCEVI-1可能参与slhk4株系中过量ROS的清除;slhk4株系可能通过提高干旱胁迫条件下的GST含量和SlCEVI-1基因的表达量,加速清除体内的过量ROS。
slhk4-4、slhk4-118株系在干旱处理期内SOD活性均显著低于WT,但在干旱处理22 d大幅上升(分别升高71.3%和55.8%),而WT升高较少(22.8%),说明SOD可能参与干旱胁迫中后期slhk4株系中ROS的加速清除。此外,2个slhk4株系与WT中SlCAT1基因表达量始终差异不大,表明CAT可能不是slhk4株系ROS清除能力提高的原因。SOD、GST和POX可能对slhk4株系抗氧化性的提高有所贡献。
3 讨论
植物可以通过调控光合作用、渗透调节、抗氧化代谢等生理生化过程响应干旱胁迫[18]。本研究结果表明,相同干旱条件下,相比于野生型番茄,2个slhk4突变株系存活率更高,叶片含水量更高,光合作用更强,清除ROS能力更强,说明slhk4株系比WT更抗旱。slhk4-4和slhk4-118株系的部分参数存在差异,但均显著优于WT,且两者总体抗旱性差异不大,表明细胞分裂素受体基因SlHK4在番茄抗旱性中具有负调控作用。而在拟南芥中,AHK4单基因的突变对植株抗旱性没有明显作用。在外施细胞分裂素的条件下,ahk4突变体的耐盐性才显著提高[13]。这说明不同植物的直系同源细胞分裂素受体在干旱等非生物胁迫中的功能及作用机制并不完全一致。
叶绿素和叶绿素荧光参数是衡量植物叶片光合性能的重要指标[19-20]。拟南芥AHK4单基因的突变不影响叶片叶绿素含量,AHK2和AHK4双基因突变使叶片叶绿素含量显著升高[5],说明AHK4很可能在依赖于细胞分裂素的叶绿素保持中不起主要作用。本试验结果表明,SlHK4单基因的突变即引起叶片叶绿素含量显著上升,并且对干旱条件下的叶绿素降解具有明显的抑制作用,说明SlHK4基因很可能负调控番茄叶片的叶绿素含量。干旱处理27 d,WT的ΦPSⅡ、qP和ETR均大幅下降至很低水平,说明其光合作用在干旱处理后期很可能受到严重影响,这与干旱胁迫致使生菜幼苗ΦPSⅡ、qP及ETR等指标降低的研究结果一致[21];而slhk4突变株系的叶绿素荧光参数均显著高于WT,说明slhk4光合性能虽然受到了影响但程度较轻。
叶绿体中的光合电子传递链是植物产生ROS的主要场所之一[22]。正常生长条件下,植株体内ROS的产生与清除处于动态平衡[23]。干旱条件下,气孔关闭,叶肉细胞内的二氧化碳浓度下降,使得光合作用减弱,光能相对过量,光合电子传递链中产生的ROS增加[22]。大量增加的ROS很可能引起叶绿素分子及其他光合组件被破坏,导致光合性能进一步降低。本研究结果显示,slhk4突变株系清除ROS的能力较强,叶片内的MDA含量较低,ROS毒害作用较小,所以相同干旱条件下,slhk4株系的叶绿体和光合组件受到的损害可能小于WT,因而能够保持更强的光合能力。这与在茶菊[24]和芍药[25]上的研究结果一致。
逆境胁迫条件下,植株可以通过提高抗氧化酶基因表达量,增加体内抗氧化酶活性,来清除多余的ROS[26],之前的研究发现,番茄幼苗的SOD、CAT等抗氧化酶的活性在干旱胁迫下会大幅提高[27-28]。本研究2个slhk4株系的GST含量、SOD活性以及SlCEVI-1的基因表达量大幅提高与之相一致。slhk4中SlCAT1的表达量与WT差异不大,推测GST、SOD、POX参与slhk4株系胁迫响应中ROS的清除,而CAT则可能对slhk4株系抗旱性的提高贡献不大。
本研究中,与WT相比,slhk4突变株系较矮,叶片面积较小,地上部长势较弱,因此叶片蒸腾速率可能较小,相同干旱条件下的水分散失较低。除了ROS清除能力,这些表型性状上的差异,也可能对slhk4突变株系抗旱性的提高有所贡献。综上,本研究为系统解析细胞分裂素受体基因SlHK4在番茄抗旱性中的功能奠定了基础,为培育抗旱性番茄提供了可利用的基因,但SlHK4基因突变提高番茄抗旱性的分子机制有待进一步研究。
