IrO2@MnO2纳米酶的制备及用于抗坏血酸的检测
2022-04-06杨俊松钟颖颖
杨俊松,钟颖颖,余 倩
(广东工业大学 轻工化工学院, 广东 广州 510006)
相比于价格昂贵、提纯困难、易失活变性的天然酶,近年来,高稳定性、高催化活性、低成本的纳米酶在食品、化工、环境、免疫分析、生物传感等领域引起了人们广泛的关注。特别是不需要使用H2O2的氧化酶样纳米酶越来越受到研究者们的关注,并被广泛应用于生物传感系统中以提高对分析物的检测灵敏度。例如,Zhang等[1]将具有氧化酶模拟活性的磁性多孔氧化石墨烯应用于高灵敏检测细胞裂解物中的谷胱甘肽。Jin等[2]制备了具有氧化酶样活性的PdPt双金属纳米线用于酸性介质中酸性磷酸酶的检测。Hayat等[3]开发了基于氧化酶样活性的纳米氧化铈比色传感策略用于高灵敏地检测多巴胺和儿茶酚。IrO2作为一种贵金属氧化物,因其独特的性能在检测、传感、燃料电池及催化等各个领域引起了广泛的关注[4-5]。例如,Quesada-González等[6]创建了基于IrO2NPs的电催化传感系统用于快速、灵敏地检测多溴联苯醚。文献[7-9]将IrO2NPs作为阳极催化剂用于氧气析出反应中。此外,基于深蓝色的IrO2NPs能与生物标记物缀合,Quesada-González等[10]成功创建侧向流动生物传感器用于灵敏地检测人体免疫球蛋白。然而,IrO2的酶活性几乎没有被探索过,特别是将IrO2和MnO2原位整合形成复合纳米酶还未见相关报道。
抗坏血酸(AA)是许多水果和蔬菜中天然存在的水溶性维生素,也是维持人类健康的必需营养素。摄取足够的抗坏血酸对保持人体的健康至关重要,但AA不能在人体内产生,只能从食品或药品中获得。长期缺乏抗坏血酸,会导致人体免疫系统功能降低,并引发坏血病等疾病,但过量摄入也会对身体有害,例如会导致尿结石、胃痉挛等。因此,通过简单、快速的方法分析食品和药物制剂中AA的含量至关重要。通过纳米酶催化反应来测定AA越来越受到人们的青睐[11-16]。
因此,本文首先通过原位整合法制备IrO2@MnO2纳米复合物。然后通过稳态动力学探究该复合物的氧化酶模拟催化能力,并与IrO2NPs和MnO2NPs进行比较以验证IrO2@MnO2纳米复合物具有协同提高的氧化酶模拟活性。接着优化IrO2@MnO2纳米复合物用于AA检测的条件。最后在最优检测条件下,通过测定AA的检测范围和检测限以探究IrO2@MnO2纳米复合物用于AA检测的潜力。
1 实验仪器与设备
1.1 实验材料
柠檬酸钠二元倍半水合物,六氯铱酸钾(K2IrCl6),五水合四甲基氢氧化铵(TMA·OH),四水合氯化锰(MnCl2·4H2O)购自阿拉丁(中国上海)。抗坏血酸(AA),3,3', 5,5'-四甲基联苯胺(TMB),氢氧化钠,硫酸,超纯水,氧气和其他试剂购自麦克林(中国上海)。
1.2 实验仪器
高速离心机(中科中佳,HC-2066,中国),酶标仪(Infinite 200,Tecan,奥地利)。透射电子显微镜(TEM,HT7700,日本日立),紫外可见分光光度计(UV2450,日本岛津市),Zeta电位分析仪(ZetasizerNanoZS,英国马尔文),X射线光电子能谱仪(XPS, Escalab 250Xi,美国赛默飞)。
2 实验方法
2.1 MnO2 NPs的制备
参考文献[17]制备了MnO2NPs。具体如下:在室温剧烈搅拌下将10 mL 0.3 mol/L的MnCl2·4H2O水溶液快速加入到20 mL由12 mL TMA·OH(0.6 mol/L)、2 mL H2O2(质量分数为30%)和6 mL H2O组成的混合溶液中;所得混合溶液悬浮液继续在室温下剧烈搅拌12 h,以8 000 r/min离心20 min,所得沉淀用无水乙醇和去离子水洗涤至中性,得到MnO2NPs。
2.2 IrO2@MnO2复合纳米酶的制备
参考文献[10]制备了IrO2@MnO2复合纳米酶。首先将制备所得的MnO2NPs分散于去离子水中配成质量浓度(ρ)为125,62.5,31.3和15.6 μg/mL的MnO2NPs溶液;然后将50 mg柠檬酸二钠盐倍半水合物和30 mg K2IrCl6加入到上述不同质量浓度的50 mL MnO2NPs溶液中,用0.25 mol/L NaOH调节pH至7.5;剧烈搅拌下将溶液加热至沸腾,直至颜色变成蓝灰色,保持溶液颜色继续加热30 min后室温冷却,检查溶液pH是否维持在7.5,若不是,则调节溶液pH至7.5,接着重复煮沸30 min,直至pH稳定在7.5;所得溶液在氧气鼓泡下煮沸2 h,得到深灰色的IrO2@MnO2复合纳米酶溶液[10,17]。
用去离子水代替上述IrO2@MnO2复合纳米酶制备方法中的MnO2NPs溶液制备得到IrO2NPs。
2.3 催化活性比较
通过稳态动力学探究了IrO2NPs、MnO2NPs和IrO2@MnO2复合纳米酶的催化活性,具体如下:往96孔板中加入150 μL不同浓度的TMB(208, 104, 52,26, 13, 6.5 μmol/L),接着加入50 μL IrO2NPs、MnO2NPs或IrO2@MnO2复合纳米酶,在37 ℃下反应15 min后测定体系的吸光值(650 nm),空白组不加TMB。根据朗伯比尔定律(式(1))可计算得到在总反应时间内产生oxTMB的浓度c(μmol/L)。

式中:A为体系吸光度值,ε为吸光物质的摩尔吸光系数(oxTMB的摩尔吸光系数为3.9 ×104mol−1·cm−1·L),c为吸光物质浓度,b为吸收层厚度(实验所用比色皿厚度为1 cm)。将c除以总反应时间得到单位时间内产生oxTMB的量v(μmol·L−1·min−1)。
最后根据式(2)以1/cTMB为横坐标,1/v为纵坐标作双倒数曲线,由曲线截距和斜率可计算得最大反应速度Vmax和米氏常数Km[2,18]。
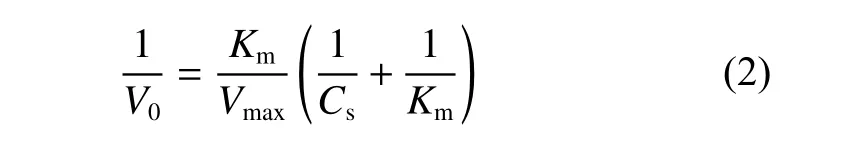
式中:V0为初始反应速率,Cs为底物浓度。
2.4 抗坏血酸检测条件的优化
为了实现对AA准确、灵敏的检测,本文优化了IrO2@MnO2复合纳米酶检测AA的条件,包括体系pH、反应温度、反应时间和IrO2@MnO2复合纳米酶浓度。具体步骤为:往96孔板中加入150 μL 416 μmol/L TMB和50 μL一定质量浓度的IrO2@MnO2复合纳米酶(16.67,32,46.15,59.26,71.43,82.76,93.33 μg/mL),在一定温度下(25,31,37,43,49,55,61 ℃)反应一定时间(5,10,15,20,25,30 min)后加入80 μL 2 mol/L H2SO4终止,最后在450 nm处测定体系吸光值。在此过程中,反应体系的pH维持在一定数值(2,3,4,5,6,7,8,9或10),另设置空白组(不加TMB)。最终将反应体系最大吸光度值设为100%相对活性,以相对活性为纵坐标,体系pH、反应温度、反应时间或IrO2@MnO2复合纳米酶质量浓度为横坐标作图。
2.5 抗坏血酸检测范围、定量限和检测限测定
往96孔板中加入50 μL 71.43 μg/mL的IrO2@MnO2复合纳米酶和不同浓度的AA(0~1 250 μmol/L),在37 ℃下反应10 min后加入150 μL 416 μmol/L TMB,37 ℃下反应5 min后加入80 μL 2 mol/L H2SO4,然后用酶标仪在450 nm处测定体系吸光值,反应体系的pH为4,空白对照组不加TMB。最后,以AA浓度为横坐标,以吸光度为纵坐标进行线性拟合。当信噪比(S /N)为3时,检测限(LOD)由式(3)得出。
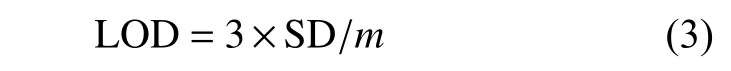
当信噪比(S / N)为10时,定量限(LOQ)由式(4)得出。
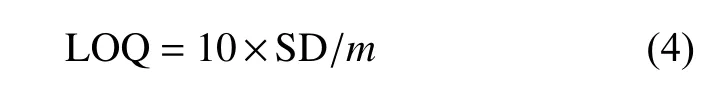
式中:SD代表空白组中多次测量的信号的标准偏差,m代表标准曲线的斜率。
3 结果与分析
3.1 IrO2@MnO2复合物制备条件的优化
为了获得具有最优氧化酶样活性的IrO2@MnO2复合物,通过稳态动力学探究了其催化活性,结果如表1所示。根据表1可得,当MnO2NPs质量浓度为31.3 μg/mL时所制备的IrO2@MnO2复合纳米酶的Km最小(6.50 × 10−3mmol/L),这表明其对底物TMB的亲和力最高。因此选择MnO2NPs质量浓度为31.3 μg/mL制备IrO2@MnO2复合物。
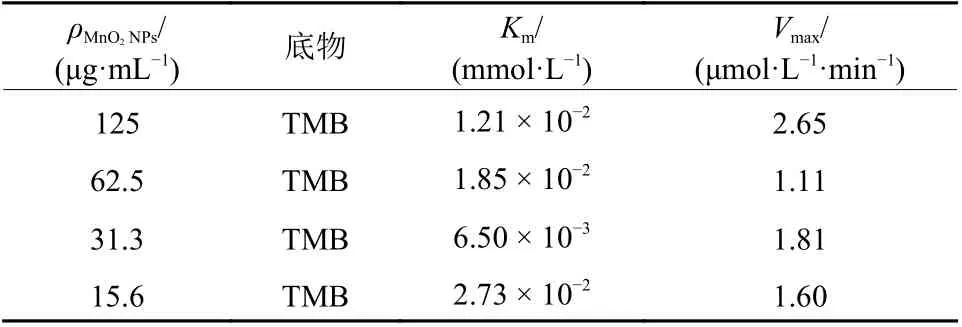
表1 不同MnO2 NPs质量浓度下制备的IrO2@MnO2复合纳米酶的Km和Vmax比较Table1 Comparison of Km and Vmax of IrO2@MnO2 composite prepared under different MnO2 NPs concentrations
3.2 IrO2@MnO2复合纳米酶表征
使用透射电镜(TEM)、Zeta电位分析仪和X射线光电子能谱(XPS)对实验制备的IrO2@MnO2复合纳米酶进行表征,通过ImageJ软件对所得TEM图进行统计得到纳米酶的平均粒径。图1(a)为MnO2NPs的TEM图,结果显示所制备的MnO2NPs为无规则纳米颗粒。在不同MnO2NPs质量浓度下制备的IrO2@MnO2复合物的TEM图像如图1(b~e)所示。可知,当MnO2NPs质量浓度为125,62.5,15.6 μg/mL时,可能由于MnO2NPs过量或不足,都不能很好地形成形态均一的IrO2@MnO2复合物。而当MnO2NPs质量浓度为31.3 μg/mL时能形成粒径约为136 nm、形态均一的方块状IrO2@MnO2纳米颗粒(图1(c)),这表明MnO2NPs质量浓度为31.3 μg/mL是制备IrO2@MnO2复合物的最佳浓度。
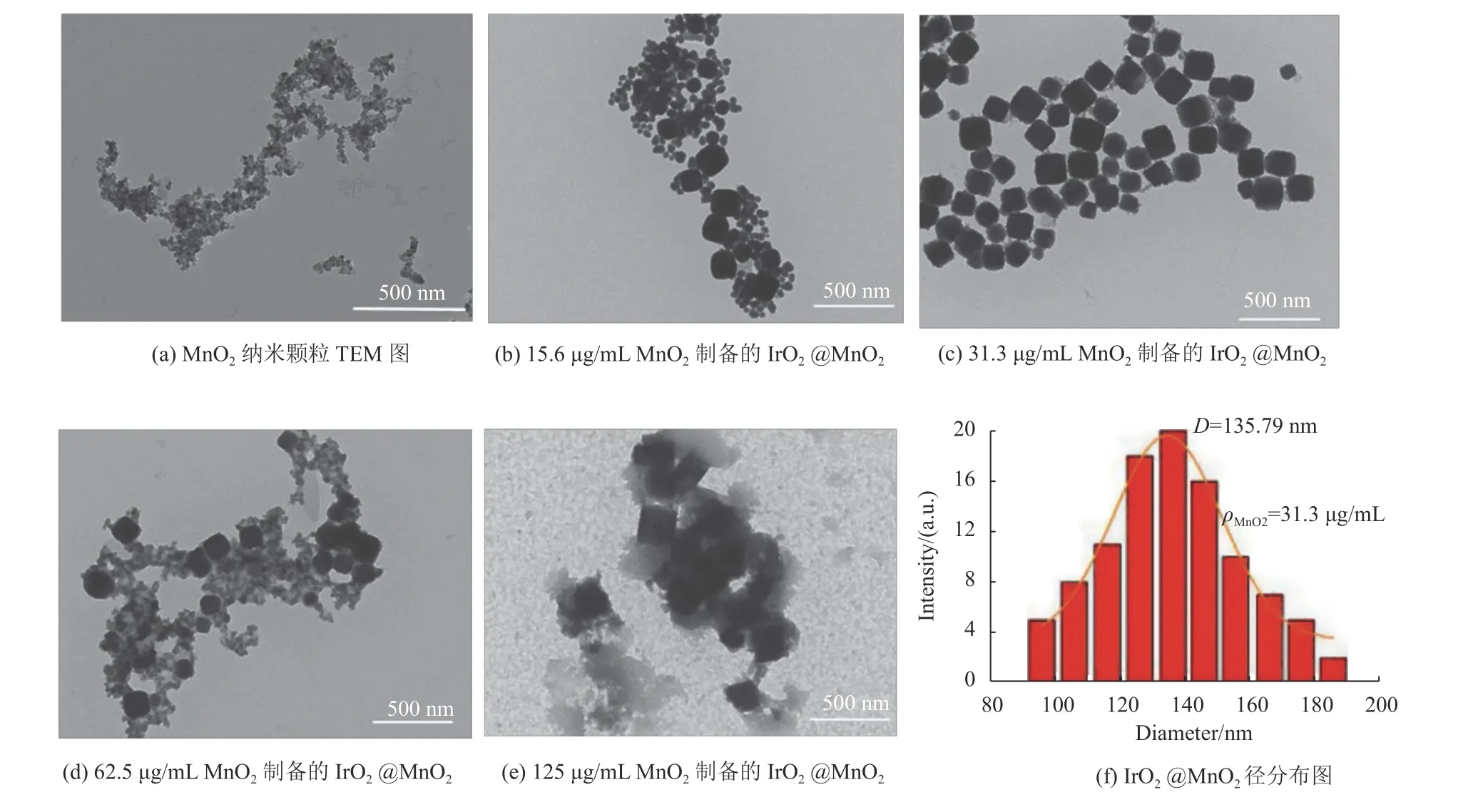
图1 不同质量浓度MnO2溶液制备的IrO2@MnO2复合纳米酶及IrO2@MnO2粒径分布图(ρMnO2=31.3 μg/mL)Fig.1 IrO2@MnO2 composite nanozyme prepared with different MnO2 solution concentration and partical size distribution of IrO2@MnO2(ρMnO2=31.3 μg/mL)
IrO2@MnO2复合纳米酶的XPS测试结果如图2(a~c)所示:图2(a)为XPS全谱图,IrO2@MnO2复合纳米酶中含有Ir、Mn和O元素。图2(b)结果显示Ir 4f在61.80 eV和64.83 eV处具有两个峰,这可归因于IrO2的Ir 4f5/2和Ir 4f7/2的结合能[19]。Mn 2p XPS窄谱(图2(c))显示在641.50 eV和653.20 eV处有两个峰,这分别属于Mn 2p3/2和Mn 2p1/2的结合能[20]。这些结果表明成功合成了IrO2@MnO2复合纳米酶。图2(d)为Zeta电位图,结果显示MnO2NPs和IrO2NPs的Zeta电位分别为−15.21 mV和−4.45 mV。而IrO2@MnO2复合纳米酶的Zeta电位为−16.38 mV,进一步证明了IrO2@MnO2的成功合成。
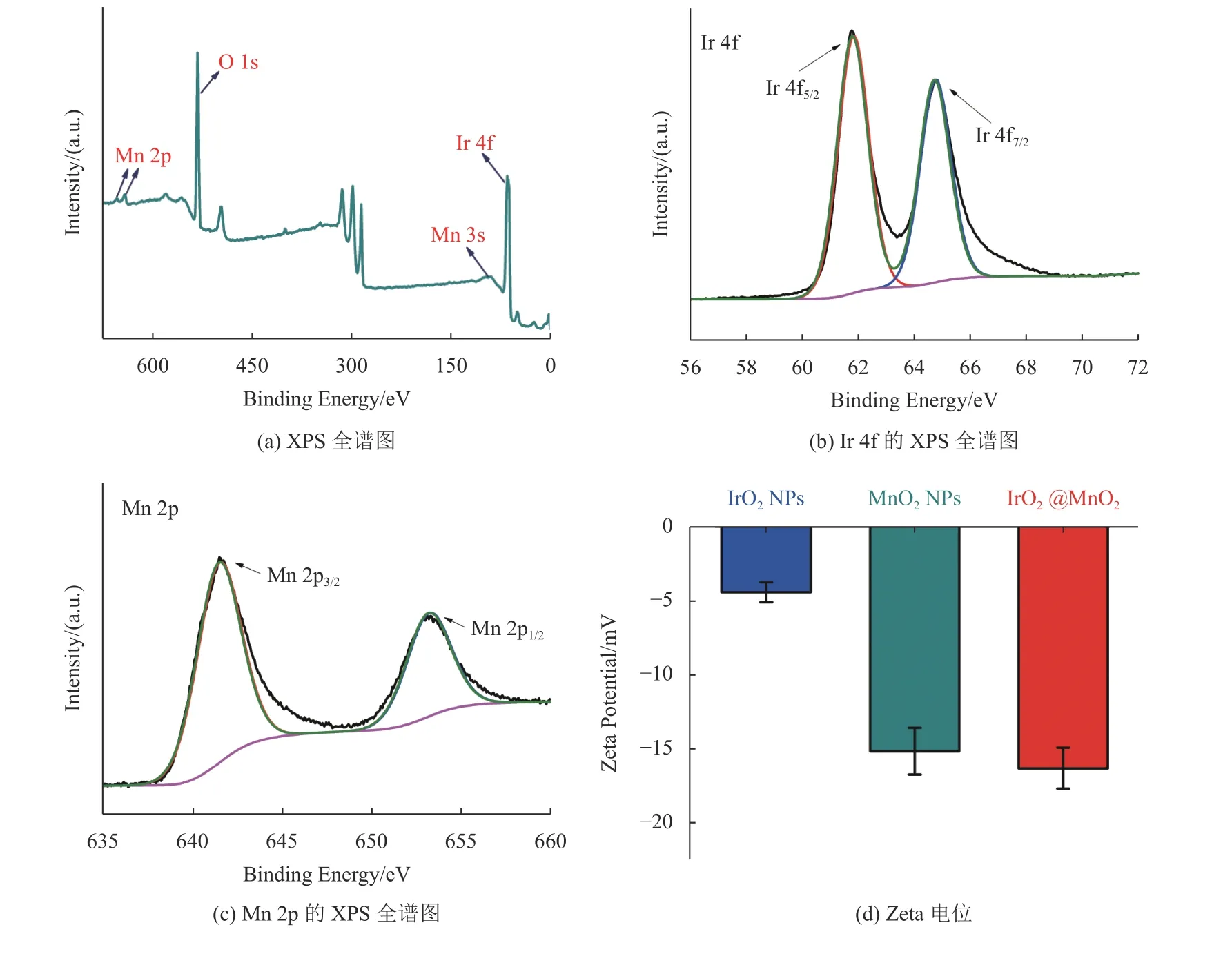
图2 IrO2@MnO2复合纳米酶的和XPS谱图(a,b,c),IrO2 NPs, MnO2 NPs 和 IrO2@MnO2 复合纳米酶的Zeta 电位(d)Fig.2 XPS spectra (a, b and c) of IrO2@MnO2 composite nanozyme, Zeta potentials (d) of IrO2 NPs, MnO2 NPs and IrO2@MnO2 composite nanozyme
3.3 IrO2@MnO2复合纳米酶的固有氧化酶样活性验证
为了验证IrO2@MnO2复合物的固有氧化酶样活性,本文用酶标仪测定了体系IrO2@MnO2+ TMB、IrO2@MnO2+ H2O、TMB + H2O在37 ℃下反应15 min后的紫外吸收光谱。结果如图3所示,只有IrO2@MnO2+TMB体系在650 nm附近有明显的吸收峰,而对照组体系IrO2@MnO2+ H2O和TMB + H2O均无明显吸收,这表明IrO2@MnO2复合纳米酶具有固有的氧化酶样活性。
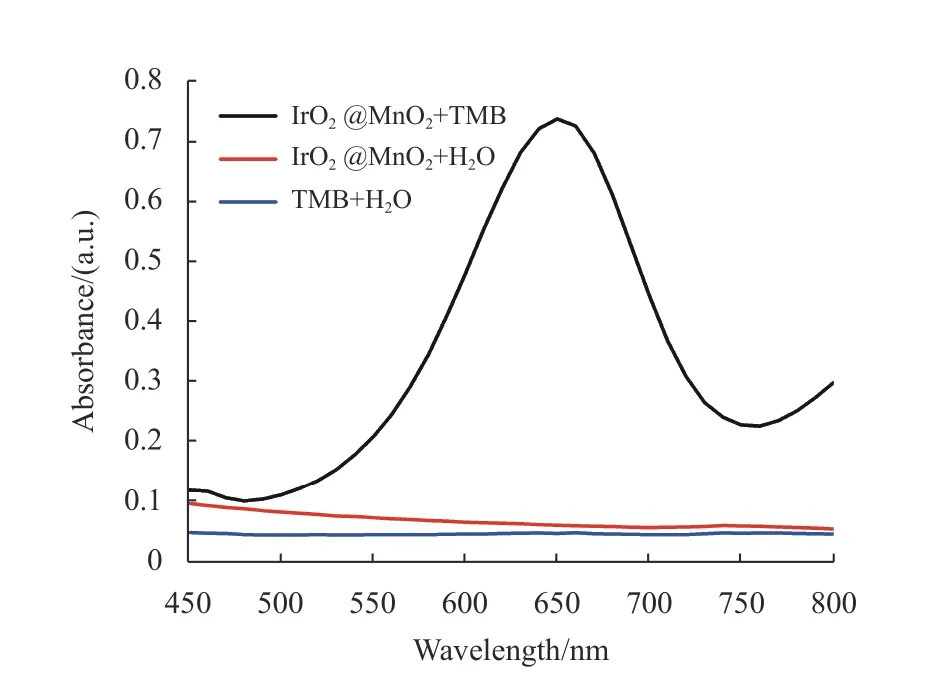
图3 IrO2@MnO2复合纳米酶的氧化酶样活性Fig.3 Oxidase-like activity of IrO2@MnO2 composite nanozyme
3.4 IrO2 NPs、MnO2 NPs和IrO2@MnO2复合纳米酶的催化活性比较
为了验证经过原位整合后能协同提高IrO2NPs和MnO2NPs的氧化酶样活性,本实验通过稳态动力学探究了IrO2NPs、MnO2NPs和IrO2@MnO2复合物的催化活性,结果如表2所示,其中Km值越小代表催化剂对底物的亲和力越大。从表2可得,经过IrO2NPs和MnO2NPs原位整合形成的IrO2@MnO2复合纳米酶的Km(6.50 × 10−3mmol/L)显著低于IrO2NPs(9.73 ×10−2mmol/L)和 MnO2NPs(2.41 × 10−1mmol/L),这表明通过原位整合能协同提高IrO2NPs和MnO2NPs的氧化酶样催化活性。

表2 IrO2@MnO2,IrO2 NPs和MnO2 NPs 的Km和Vmax比较Table2 Comparison of Km and Vmax of IrO2@MnO2, IrO2 NPs and MnO2 NPs
3.5 抗坏血酸(AA)检测条件的优化
为了实现对AA准确、灵敏的检测,本文对检测条件进行了优化,包括体系pH、反应温度、反应时间或IrO2@MnO2复合纳米酶浓度,结果如图4所示。从图4(a)可得,IrO2@MnO2复合物的酶催化活性受pH的影响较大,在pH为4时达到最佳。图4(b)显示在不同的反应温度下,IrO2@MnO2复合物的酶催化活无明显差异,这间接表明该复合物具有优异的热稳定性,最终选择检测温度为37 ℃。从图4(c)~(d)可得,当IrO2@MnO2复合物浓度达到71.43 μg/mL,反应时间达到5 min时,IrO2@MnO2复合物的酶催化活性即达到最大值,这表明5 min足够让所添加的IrO2@MnO2复合物充分氧化底物TMB,因此选择5 min为最佳反应时间,71.43 μg/mL为最佳复合物浓度。最终选定AA的检测条件为:反应体系pH为4、反应温度为37 ℃、反应时间为5 min、IrO2@MnO2复合纳米酶浓度为71.43 μg/mL。
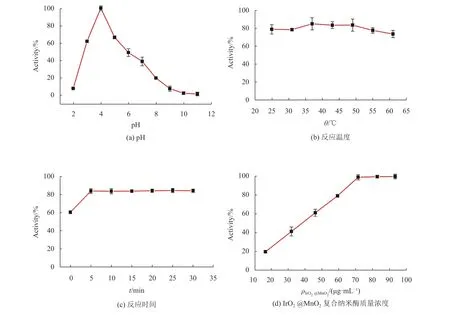
图4 AA检测条件优化结果Fig.4 detection condition optimization results
3.6 抗坏血酸检测范围和检测限的测定
在上述最优检测条件下,对AA的检测范围和检测限进行了测定,结果如图5所示。从图5中可以看出随着AA浓度的增加,体系的吸光值逐渐下降,其中在AA浓度为0~312.5 μmol/L内体现出良好的线性关系。线性方程为y= −0.002 01x+ 0.984 57(R2= 0.998 3)。另外经计算得AA的定量限为14.2 μmol/L,检测限为1.42 μmol/L,低于其他文献所报道(见表3),这表明该检测方法对AA检测具有高灵敏度。
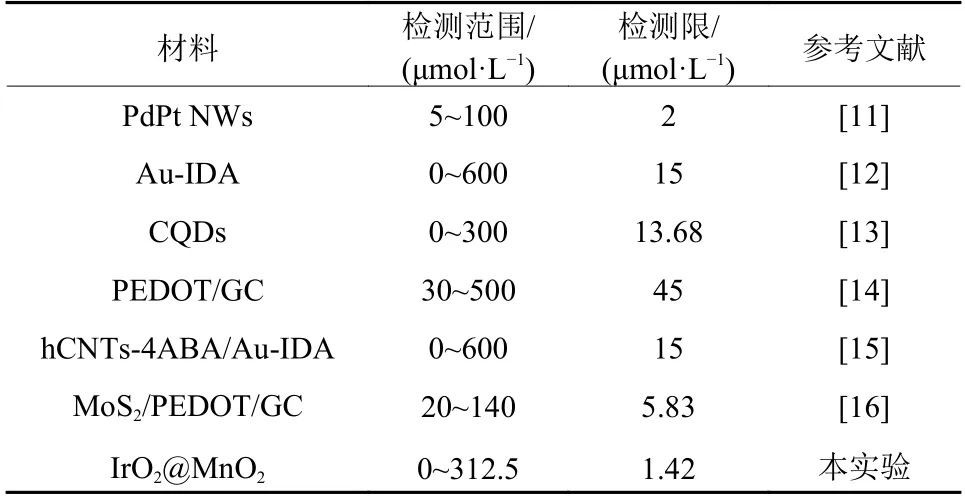
表3 不同材料检测AA检测限比较Table3 Comparison of AA detection limits of different materials
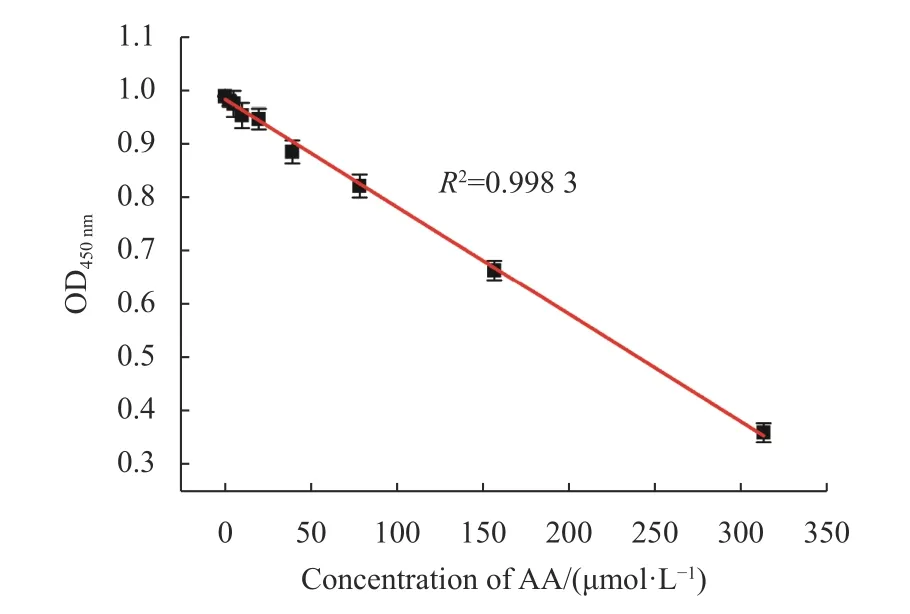
图5 AA的剂量响应曲线Fig.5 Dose response curve of AA
3.7 方法精确度和稳定性的测量
为了研究该检测方法对于AA检测在实际样品中的应用,首先将22.50 mgAA配置成10 mL水溶液,接着取10 μL 上述AA的浓溶液,加入到稀释20倍的4种含AA的饮料中。然后往96孔板中加入50 μL 71.43 μg/mL的IrO2@MnO2复合纳米酶,50 μL各组饮料稀释液或加标饮料稀释液,37 ℃下反应10 min后加入100 μL 416 μmol/L TMB,37 ℃下反应5 min后加入80 μL 2 mol/L H2SO4。最后用酶标仪在450 nm处测定体系吸光值,结果如表4所示。从表4中可得在不同加标浓度下,AA的加标回收率为93.95%~103.17%,相对标准偏差(Relative Standard Deviation, RSD,n=3)为2.87%~5.79%。此外,选取饮料1进行了日内和日间RSD的测定以考察方法的稳定性。结果表明,在同一天内对饮料1进行3次加标回收测量(AA的加标量为23.72 μmol/L)所得的日内RSD为3.14%,连续3天对饮料1进行加标回收测量(AA的加标量为23.72 μmol/L)所得的日间RSD为3.27%。以上结果表明IrO2@MnO2复合纳米酶用于食品中AA的检测具有良好的精确度和稳定性。
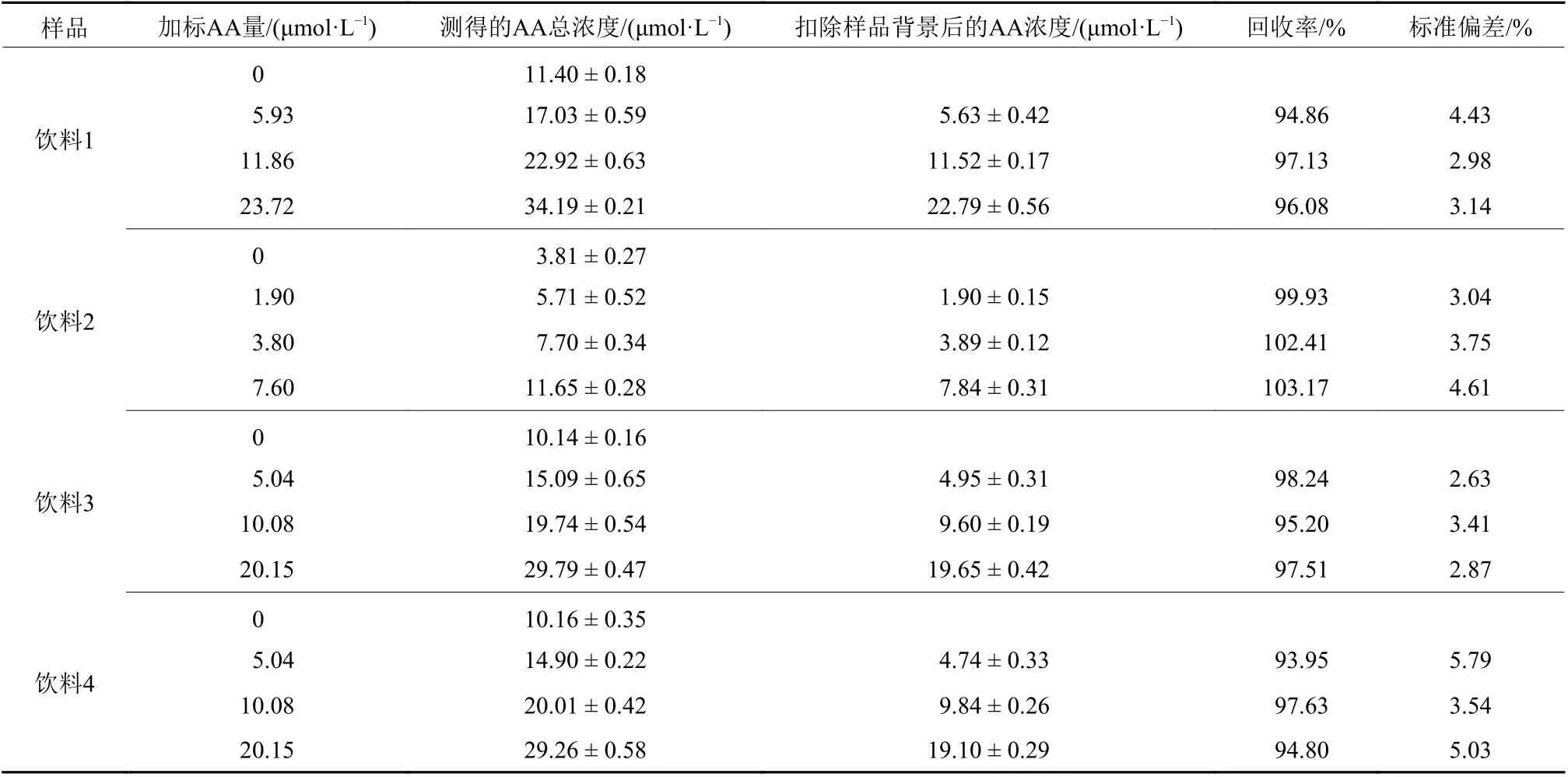
表4 从市售饮料样品中测定AA的回收率Table4 4Determination of AA recovery rate from commercial beverage samples
4 结论
本文通过原位整合法制备了具有协同提高氧化酶样活性的方块状IrO2@MnO2复合纳米酶,并将其用于抗坏血酸的灵敏检测,获得了较宽的检测范围(0~312.5 μmol/L)和较低的检测限(1.42 μmol/L)。因此其在食品监测、生物医药、临床诊断和免疫分析等领域具有较高的潜在应用价值。
