侧流免疫层析技术监控乳中致病因子的研究进展
2022-04-01高平娉任玉伟杨鑫焱王郑辉满朝新姜毓君
高平娉,任玉伟,杨鑫焱,杨 涛,王郑辉,宋 杨,满朝新,姜毓君
(东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
牛乳及乳制品作为膳食中钙和优质蛋白质的重要来源,越来越受到人们青睐。而近年来全球爆发的“拉克塔利斯婴儿配方奶粉沙门氏菌超标”“三鹿奶粉”等质量安全事件严重影响乳品行业发展,甚至引起社会恐慌。因此,现场快速监测乳中致病因子,对保证乳品安全、促进乳业发展以及维持社会稳定具有重要意义。引发乳品安全问题的因子主要分为大分子物质(如病原微生物)和小分子物质(如农药残留、兽药残留、真菌毒素、非法添加剂等[1])。
病原微生物可用平板计数、聚合酶链式反应(polymerase chain reaction,PCR)、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)等方法测定,但是这些方法需要专业人员操作,无法实现现场实时检测。采用气/液相色谱、毛细管电泳、液相色谱-质谱联用等方法检测乳中残留抗生素、非法添加剂等小分子物质具有良好重现性、准确性,但此类方法不能对未知待测物进行定性分析,并且程序复杂、费用高,对快速检测意义不大。
侧流免疫层析技术(lateral flow immunochromatographic assays,LFIA)是基于单克隆抗体技术、免疫标记技术及免疫层析技术发展起来的一种新型简化检测技术,用于病原体、药物和毒素等检测。LFIA以条状纤维层析材料为固相,借助毛细管吸附作用使样品在层析材料上移动,待测物与层析材料上一定区域的抗体结合,通过酶促显色反应或直接使用着色标记物在短时间获得直观结果[2]。LFIA因简便、特异、快速,且不依赖于专业技术人员及昂贵仪器设备的优势,被广泛应用于乳中各种致病因子检测。而近年来,对多分析物进行同时测定需求的不断增加,推动了高通量检测的发展。本文结合乳中致病因子的检测,论述LFIA的原理,阐述其不同的增敏方式,总结高通量检测的不同模式,以期为乳品企业高灵敏、快速现场监测提供理论支撑。
1 侧流免疫层析技术的组成及检测原理
LFIA又称试纸条技术,20世纪80年代,试纸条开始在临床上用于检测人绒毛膜促性腺激素(human chorionic gonadotropin,HCG),而后逐渐广泛应用于环境监控[3]、医疗诊断[4]、食品安全[5]等领域。如图1所示,LFIA的样品垫、共轭垫、吸收垫和硝酸纤维素(nitrocellulose,NC)膜依附在有一定硬度的支架上,同时NC膜上固化检测线(T线)和控制线(C线)。LFIA不需要外部支持设备或动力,样品随着毛细管作用和吸水作用从样品垫到达吸水垫,通过疏水键、静电作用、氢键在NC膜沉积[6-7]。其中,C线显色表示检测有效,T线显色指示阳/阴性。LFIA的结果可通过视觉观察或阅读器进行定性和半定量检测。LFIA主要有竞争法(图1A)和夹心法(图1B),一般使用竞争法检测如抗生素等仅有一个位点的小分子质量物质。竞争法有两种类型:其一是在T线上包埋待测抗原的抗体,在共轭垫固定待测抗原与标记物的复合物,样品垫上的待测抗原与共轭垫上的复合物共同竞争T线上抗体的结合位点;其二是在T线偶联待测抗原或其类似物,共轭垫为标记物与待测抗原对应抗体的偶联物,当有目标物存在时,待测抗原与共轭垫的抗体偶联,T线不显色。竞争法的响应值与目标物量成反比。
针对致病菌等表面具有多个抗原位点的生物大分子,一般采用夹心法进行检测,待测抗原的一个位点与共轭垫上的标记抗体1结合,另一位点与T线上的抗体2结合形成抗体标记物-待测抗原-抗体的三层夹心结构并显色,响应值与目标物含量成正比。
2 侧流免疫层析技术增敏方式
胶体金纳米颗粒(Au nanoparticles,AuNPs)具有良好的生物相容性和较高的摩尔吸光系数[8-9],表面因等离子体共振呈现红色[10],因此成为LFIA中应用最广泛的信号分子(表1)。但是传统LFIA所用AuNPs粒径一般为20~40 nm,信号强度相对较弱,灵敏度较低[11]。为使LFIA更灵敏、准确、适应现场检测,许多研究者致力于开发高灵敏检测方法,如显色增强策略、采用新型纳米材料增敏以及LFIA与其他技术联用等。
2.1 显色增强策略
2.1.1 纳米颗粒生长
研究表明,粒径较大的AuNPs具有更高的摩尔吸光系数和吸光度[21],因此在T线上积累大尺寸的AuNPs能够有效提高LFIA的灵敏度。其中,金、银生长是最常用的增大粒径的方法。该方法可将增强剂中的金/银离子还原为金/银聚积在AuNPs表面,最多可使其尺寸增加5 倍[22],从而增强AuNPs吸光度,进而增强LFIA灵敏度。1)Kaur等[23]于2007年首次提出通过金生长的方法,利用AuNPs作为催化剂,加快金增强剂(HAuCl4和NH2OH·HCl)中Au3+还原以增加AuNPs尺寸,从而提高灵敏度。这种方法需要通过洗涤减少非特异性结合,虽然可以有效地阻断背景信号干扰,但是耗时长。Wang Jingyun等[24]提出了一种简单的方法,在NC膜上添加金增强剂,当金标复合物经过T线时直接将Au3+还原,无需洗涤,对乳中大肠杆菌O157:H7(Escherichia coliO157:H7)的检测灵敏度提高10 倍。2)在银生长中,银盐和还原剂发生反应在AuNPs表面成核,随后还原的金属银在AuNPs表面逐层沉积,以增大尺寸。与AuNPs呈现的红色相比,生成黑色的金属银与NC膜的白色背景形成更强烈的对比。Horton等[25]于1991年首次报道使用银增强剂将基于AuNPs的LFIA灵敏度从100 ng/mL提高到100 pg/mL。Shyu等[26]通过将LFIA浸入银增强液中,使乳中葡萄球菌肠毒素B的灵敏度从100 ng/mL提高到10 pg/mL,且与SEA、SEC、SED、SEE等无交叉反应。
但是,金或银的生长反应并不可控,导致LFIA重复率差且易出现背景信号。因此,应在T线区域采用可控制的生长方法,以提高灵敏度、可重复性和可靠性。此外,Ag+/Au3+具有危险性,会对人体产生一定毒性作用。
2.1.2 纳米颗粒积累
在LFIA中,T线累积AuNPs的数量达到肉眼识别的色度阈值[27]才能产生检测信号。然而AuNPs尺寸一般为20~40 nm,比色亮度较低[28-29]。因此,除金、银生长外,还可以通过积累AuNPs产生由单位分析物引起的可检测红色带。AuNPs的积累可以使摩尔吸光系数增大,进一步放大AuNPs的比色信号强度,增强策略包括双AuNPs共轭、AuNPs聚集体。
利用一个(或多个)AuNPs作为检测探针,另一个AuNPs作为放大探针,可以实现基于双AuNPs共轭的信号增强。放大AuNPs探针可与检测AuNPs探针特异性结合,通过多种分子识别元件(包括抗原-抗体反应[30],核酸杂交[31]和生物素-链霉亲和素系统[31])被T线捕获。随着双AuNPs探针的积累,AuNPs的比色信号强度放大,检测灵敏度提高。Zhong Youhao等[14]通过用三聚氰胺抗体和牛血清白蛋白包被AuNPs表面来制备第一AuNPs-抗体复合物,通过将牛血清白蛋白抗体固定在AuNPs表面上获得第二AuNPs-抗体复合物,将第一和第二复合物分别喷涂在两个不同的结合物垫上,用于靶标检测和信号放大。结果表明,改进LFIA可在10 min内检测到1.4×10-9mol/L乳中三聚氰胺,与没有信号放大的LFIA相比提高了约100 倍。Pan Ruili等[32]将捕获抗体-AuNPs复合物固定在T线上,将检测抗体-AuNPs复合物固定在共轭垫上,通过在T线上形成检测抗体-AuNPs-靶细菌-捕获抗体-AuNPs的三层结构积累AuNPs,放大信号。增强型LFIA比未增强型检测灵敏度提高约100 倍。由于第二AuNPs结合取决于与第一AuNPs表面上的受体分子的分子间相互作用,因此,存在的位阻效应会导致第二AuNPs结合减少,这说明需要进一步优化两个AuNPs的粒径进而提高信号增强能力[33]。
AuNPs聚集体也可以在T线上积累AuNPs。通过多种分子自组装技术制备交联的AuNPs聚集体,或将多个AuNPs封装到纳米珠聚合物中,将复合物用作检测探针。Li Yu等[34]首次通过使用蒸发诱导自组装方法将许多小粒径的AuNPs封装到纳米珠聚合物中合成342 nm的金超粒子(gold superparticle,GSP)。结果表明,此方法対牛奶中E. coliO157:H7 的检出限(limit of detection,LOD)为6.0×102CFU/mL,与40 nm AuNPs相比,所得GSP的吸光度显著提高,灵敏度提高了32 倍。
2.1.3 酶介导显色信号增强
酶辅助信号放大也可以增强LFIA检测灵敏度。例如辣根过氧化物酶(horseradish peroxidase,HRP)催化3,3’,5,5’-四甲基联苯胺(tetramethylbenzidine,TMB)生成的不溶性有色产物沉积[35],增加AuNPs的信号强度,在T线上生成可见条带。但是天然酶的催化活性依赖于自身蛋白质构象,易受温度、pH值和离子强度等外部环境的影响,限制其在极端恶劣环境中广泛应用[36]。纳米酶被定义为具有天然酶活性的纳米材料[37-39],比天然酶稳定性高、成本低、易修饰、高效[40]。纳米酶被广泛用于模拟多种天然酶的催化活性,包括过氧化物酶,超氧化物氧化酶和过氧化氢酶等[39]。此外,新型有色纳米材料由于其固有的过氧化物酶活性,也被用于增强LFIA灵敏度。
2.1.3.1 天然酶增强
在天然酶增强中,一般通过制备酶-信号分子双标记探针,信号分子用于物理吸附/化学偶联缀合酶分子和生物识别元件的载体,酶发挥催化放大的作用。Cho等[41]在免疫磁珠上标记HRP和单核细胞增生李斯特菌(Listeria monocytogenes)抗体,富集样品置于LFIA,HRP催化T线的TMB生成有色物质,2 h内在牛奶中的检测限为(97.0±19.5)CFU/mL。虽然天然酶的高催化活性能显著提高LIFA的灵敏度,但是其环境耐受性差限制了长期存储和检测性能。
2.1.3.2 纳米酶增强
纳米酶一般具有过氧化物酶样活性,不仅能作为信号分子,也用于催化产生酶促信号。2007年,Gao Lizeng等[42]报道了第一个纳米酶-Fe3O4纳米颗粒(nanoparticles,NPs),它表现出固有的过氧化物酶活性,可作为HRP的替代物催化TMB、3,3’-二氨基联苯胺和邻苯二胺3 种底物并产生相应有色产物。Zhang Li等[43]以Fe3O4为纳米酶探针结合单叠丙酸丙啶(propidium monopropionate,PMA)、环介导等温扩增(loop mediated isothermal amplification,LAMP),超灵敏检测牛奶中的阪崎肠杆菌(Enterobacter sakazakii),1 h内婴儿配方乳粉中E. sakazakii的LOD为10.0 CFU/mL。
2.1.3.3 复合纳米酶增强
由于不同组分对催化性能的协同增强作用,杂化双金属NPs比直径相近的单金属纳米材料具有更高的催化活性[44]。因此研究人员合成了很多新型核-壳杂化双金属NPs,例如Au@Pt NPs[45]、Au@Pd NPs[43]、Pd@Pt NPs[38],用于提高LFIA灵敏度。Han Jiaojiao等[46]合成了Pd@Pt NPs作为纳米酶探针,可以提供更多的催化活性位点。通过双抗体夹心型LFIA检测牛奶中的E. coliO157:H7,T线的比色信号强度显著增强,灵敏度低至9.0×102CFU/mL,比AuNPs-LFIA高出约两个数量级。虽然纳米酶能够缓解天然酶的局限性,但是催化活性相对较低、底物特异性较差以及需要“裸露”或清洁的表面来保持较高的活性限制了其广泛应用。
通过金生长[24]、双金共轭[14]、复合纳米酶介导[46]进行显色增强LFIA如图2所示。

图2 显色增强型LFIAFig. 2 LFIA based on enhanced chromogenic reaction
2.2 新型纳米标记材料增敏
2.2.1 有色纳米颗粒
有色NPs直径在1~100 nm,具有比表面积大、光热敏感、尺寸效应小、易与抗体偶联、稳定性高、特异性好等特点,用于提高LFIA灵敏度[47]。表2总结了近年来用于乳中致病因子检测的新型有色NPs,包括胶体AgNPs、胶体硒NPs(SNPs)、胶体钯NPs(PdNPs)、Co3O4NPs,并将其灵敏度与AuNPs-LFIA进行比较。
郭树清是中国整体改革派理论的标志性人物。近三十年的仕途生涯中,其在山东从2013年到2017年的四年执政经历虽然占比不多,但具有重要意义。盘点郭树清在山东的改革举措,财税、金融、三农、国企、科技、教育、医疗、社保等领域改革都走在了全国前列,得到中央改革办的充分肯定,一些经验在全国推广。中小学去行政化、科研院所改革、公立医院综合改革,这些很难短时间见到效果的改革难点,在山东都有了重大突破。
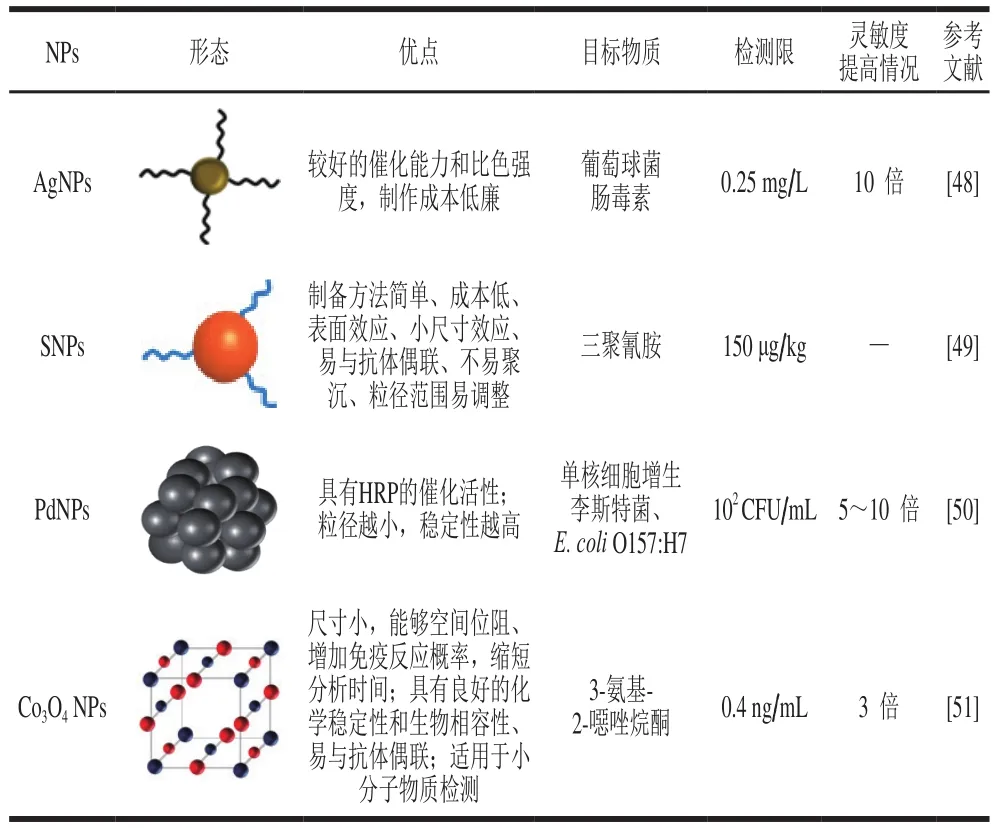
表2 有色NPs在LFIA中的应用Table 2 Applications of new colored nanoparticles in LFIA
2.2.2 荧光纳米材料
与比色法检测相比,基于荧光的检测使LFIA具有更高的信噪比,更高的灵敏度和更低的检测限[52-53]。近年来,有机荧光染料(organic fluorescent dyes,OFDs)、镧系元素螯合物、量子点(quantum dots,QDs)、荧光微球(fluorescent microspheres,FMs)、上转换NPs(upconversion NPs,UCNPs)等新型材料相继用于LFIA,实现高灵敏检测。各种荧光材料的优缺点及检测性能如表3所示。

表3 荧光纳米材料在LFIA中的性能Table 3 Performance of fluorescent nanomaterials in LFIA
2.2.2.1 有机荧光染料
OFDs指具有荧光特性的物质,分子质量一般很小,且不易产生空间位阻。最常见的是异硫氰酸荧光素(fluorescein isothiocyanate,FITC),它可吸收紫外线和蓝光而变得活跃,同时发出黄绿色的可见光。如图3A所示,Song Chunmei等[54]采用FITC标记抗原和抗体,细菌在与标记物孵育后可发出黄绿色荧光,此FITC-LFIA检测乳中E. coliO157:H7比传统的AuNPs-LFIA灵敏度高出10 倍。但FITC容易发生光漂白和荧光猝灭,有毒且生物相容性差,加之牛奶中某些氨基酸在一定波长下会产生背景荧光造成干扰,将直接影响结果的准确性与可靠性。
2.2.2.2 镧系元素
镧系元素(铕、钐和镝等)又称稀土元素,与普通荧光物质相比,镧系物会受到发光弱和光漂白限制,因此研究人员研制了以硅纳米为壳,稀土元素为内核的粒子,其具有以下优点:荧光寿命长,是普通物质荧光的103~106倍,同时Stokes位移高达290 nm,是普通物质荧光的几十倍;激发光谱带宽(300~500 nm),发射光谱带极窄(小于10 nm)[61]。与使用光学滤波器的技术相比,它能够通过波长差异将荧光从背景光中分离出来,几乎能消除所有背景荧光干扰,以提高荧光性能和检测灵敏度[47]。Eu螯合物掺杂在硅NPs中已被广泛用于时间分辨免疫荧光分析,Wang Quan等[55]将EuNPs偶联E. coliO157:H7单克隆抗体用作荧光报告分子,如图3B所示,15 min即可观察到荧光,将牛奶样品预富集6 h,灵敏度提高至1.0 CFU/mL。
2.2.2.3 量子点
QDs是粒径在1~10 nm三维半导体荧光材料,一般为核壳型,具有较高的发光效率。与镧系元素相同,QDs也具有光学稳定性高、吸收谱宽、发射带窄、Stokes位移大、不易光漂白和化学降解、生物相容性好和易修饰等优势,被称为LFIA中最有潜力的信号分子[62],但QDs制备困难[63]。Chen Rui等[56]对乳中金黄色葡萄球菌(Staphylococcus aureus)进行检测(图3C)并比较了QDs-LFIA和AuNPs-LFIA,检测限分别为3.0 CFU/mL和30 CFU/mL。虽然QDs能在很大程度上提高灵敏度,但自身带毒性,因此限制其广泛应用[64]
2.2.2.4 荧光微球
FMs是荧光物质经过化学键合、聚合包埋、自组装等方式制备的纳米材料。FMs内部包裹大量的染料分子能发出高强度荧光,外部涂层能有效防止光漂白;同时FMs可以在表面修饰配体,通过静电吸附、化学键合等方式偶联生物识别分子[65]。Chen Rui等[57]首次将FMs作为信号分子和单克隆抗体偶联检测牛乳中的兽药残留磺胺甲嗪,检测限为0.11 μg/L,比AuNPs高出约200 倍。
聚集诱导发射FMs(aggregation induced emission fluorescence microspheres,AIEFMs)材料能在致密的堆积状态下表现出优异的发光性能和良好的稳定性,有研究表明AIEFMs的最大荧光强度和相对量子产率分别是传统FMs的4.5、5 倍,与FM-LFIA相比,AIEFM-LFIA的灵敏度有所提高[66-67]。Hu Song等[68]建立了AIEFMs-LFIA并用于牛奶中诺氟沙星检测(图3D),LOD为0.04 ng/mL,线性范围为0.05~20.00 ng/mL,与在磷酸盐缓冲液中的范围基本相同,说明AIEFM基本没有基质效应并且具有强稳定性,非常适用于LFIA。
2.2.2.5 上转换纳米颗粒
与其他荧光标记材料相比,UCNPs具有低毒性,其显著的抗Stokes光致发光(photoluminescence,PL)特性能够消除生物样本中的背景荧光,提高目标物质的获取率,表现出优异的信噪比。此外,发射波长的调控可以通过改变稀土离子种类而实现。这些特点弥补了有机染料和QDs的不足,使稀土掺杂上转换荧光材料在生物荧光标记、分析检测、医学成像等领域具有巨大的应用潜力[69]。然而UCNPs发光效率低,且一般通过羧基偶联抗体,具有抗体修饰不良等缺点。Huang Zhen等[58]制备了具有5 倍增强PL强度的纳米级(80 nm)UCNPs,选择葫芦丝尿素作为UCNPs表面的配体交换试剂与1-金刚烷羧基修饰的抗体结合(图3E),以维持UCNPs的高稳定性且将PL强度再提高2 倍。利用此探针检测乳中达氟沙星,比传统基于羧基-氨基偶联的LFIA灵敏度提高40 倍。该方法继承了UCNPs出色的基质耐受性,还提高了LFIA的灵敏度,降低了成本。

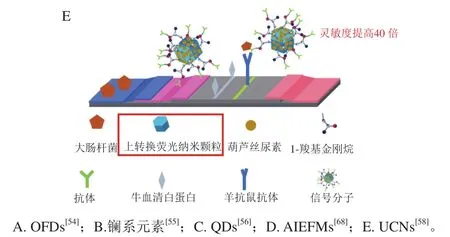
图3 不同荧光信号分子增强型侧流免疫层析Fig. 3 Enhanced LFIA based on different fluorescent signal molecules
2.2.3 染料掺杂纳米颗粒
2.2.3.1 乳胶珠
乳胶珠(latex beads,LBs)又称聚苯乙烯微球,成本低、易合成,可以通过在聚苯乙烯基质或表面结合不同发色基团制备各种彩色乳胶珠。与AuNPs不同的是,LBs通过表面修饰羧基与生物识别分子(如抗体)共价偶联,使抗体具有较高的生物活性和稳定性。Wang Cheng等[59]分别将LBs与AuNPs作为信号分子的LFIA检测牛乳中抗生素残留,结果表明,在偶联相同数量单克隆抗体的前提下,LBs的灵敏度高于AuNPs约4 倍。然而彩色乳胶珠极易发生染料泄漏,影响其广泛应用。
2.2.3.2 彩色二氧化硅纳米颗粒
彩色SiO2NPs由稳定性良好的有机反应性染料和改性SiO2NPs通过磺酸/碳酸-氨基硅烷键偶联制成,其光学性质取决于偶联染料分子的颜色和数量。与LBs不同的是,彩色SiO2NPs呈刚性,不易发生染料泄漏,具有稳定性强、亲水性高、在溶液中分散性好且易与生物分子结合等优点,在恶劣环境中不会褪色[70]。虽然染料掺入后会出现荧光猝灭现象,但与单个染料分子相比,荧光信号能大幅度提升。此外,SiO2NPs基体会产生有效的屏障,保护染料免受周围环境(如氧水平、pH值和离子浓度)的影响,传统染料的光漂白现象也被最小化。已有研究证明单分散的彩色SiO2NPs可作为免疫分析的信号分子,用于放大待测病原菌的响应信号[71-74]。Zhu Chunjie等[60]首次将彩色SiO2NPs应用于乳品中E. coliO157:H7的检测,20 min即可完成检测,灵敏度与AuNPs-LFIA相当。
2.3 磁性纳米颗粒增敏
磁性NPs(magnetic NPs,MNPs)由高分子材料包裹纳米级Fe3O4制备,能在磁场中迅速聚集,撤去磁场后均匀分散。MNPs外层修饰的多种配体(羧基、巯基、链霉亲和素等)可以与抗体、核酸等分子偶联,富集目标物质且不影响活性。与荧光材料不同,MNPs可以有效地降低基质效应[75-76],扩大线性范围,不易发生光漂白[77]。MNPs在LFIA中主要有以下作用。
2.3.1 富集
Qi Hui等[76]将MNPs偶联抗体对乳中E. coliO157:H7进行富集,以AuNPs为信号分子,富集前后LFIA的LOD分别为1.0×105CFU/mL和1.0×103CFU/mL,灵敏度提高2 倍。Chen Wenyao等[77]建立了一个集成级联信号转导系统的新型LFIA,如图4A所示,用于对乳中E. coliO157:H7敏感和无钩效应检测。该LFIA利用MNPs-E. coliO157:H7抗体复合物和AuNPs-E. coliO157:H7抗体-β-内酰胺酶复合物捕获靶细菌,形成夹层复合物;在夹层复合物上加入青霉素溶液,被β-内酰胺酶水解,将水解物转移至LFIA。该方法的灵敏度为1.37×102CFU/mL,较传统方法提高1 000 倍,同时消除了钩效应和假阴性。
2.3.2 富集和信号放大
MNPs呈棕色,可以在T线聚集形成有色条带。Huang Yanmei等[78]用MNPs富集黄曲霉毒素M1,并加至LFIA的样品垫进行检测。结果表明,此LFIA对原料奶中黄曲霉毒素M1的LOD为0.1 ng/mL,低于GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》标准(0.5 ng/mL)。Yan Lingzhi等[79]制备了MNPs双探针网络复合物,如图4B所示,检测乳中呋喃唑酮,LOD、灵敏度分别为0.044 ng/mL和0.88 ng/mL,灵敏度比AuNPs-LFIA提高10 倍。上述研究将MNPs用于富集和比色,但是存在复杂的洗涤步骤。Huang Zhen等[80]制备了核-壳卫星结构荧光磁性纳米管(fluorescent magnetic nanoparticles,FMNBs),并首次应用于LFIA检测乳中E. coliO157:H7,LOD为2.4×102CFU/mL。该方法无需多次洗涤,FMNBs表现出优异的磁性和荧光性能。
2.3.3 富集、比色、荧光猝灭
MNPs具有较宽的吸收带,可以抑制荧光。Fang Bolong等[81]将MNPs作为三功能材料,定量检测乳中磺胺甲嘧啶,如图4C所示,其功能一为富集目标;其次是比色;其三是猝灭FITC荧光微球的荧光。荧光LFIA的线性范围和LOD分别为0.033~33.000 ng/mL和0.026 ng/mL,比色LFIA的线性范围和LOD分别为1~100 ng/mL和0.71 ng/mL。该方法可用于牛奶中磺胺甲嘧啶的高灵敏快速定量检测,并且能消除内部过滤干扰。但是MNPs因为迁移率低会在经过NC膜时沉积,影响T线显色。

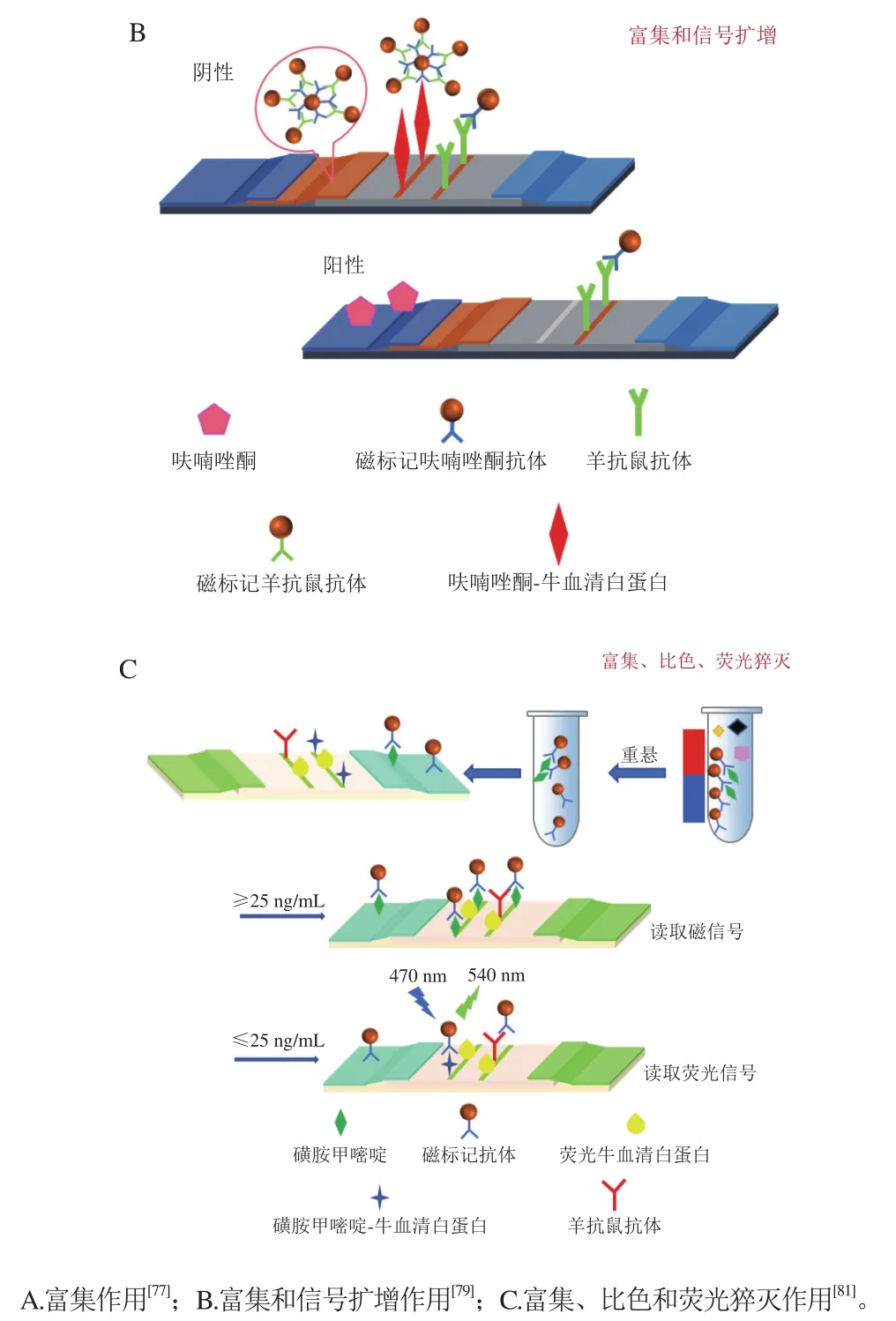
图4 MNPs在LFIA中的不同作用Fig. 4 Different roles of MNPs in LFIA
2.4 侧流免疫层析技术与其他技术联用实现增敏
2.4.1 表面增强拉曼散射-侧流免疫层析技术
表面增强拉曼散射(surface enhanced Raman scattering,SERS)是一种表面敏感的检测方法,可通过吸附在金属表面的分子增强拉曼散射,增强因子高达1010~1011,这意味着基于SERS的LFIA可以检测单个分子[82-84]。SERS-LFIA最重要的部分是拉曼标记探针,拉曼信号分子(4-巯基苯甲酸(4-methylthiobenzoic acid,4-MBA)、2,4-二硝基硫氰基苯)和生物活性分子(抗体、适配体等)偶联于NPs构成,标记探针会依据捕获目标物的数量产生相应的拉曼信号,在很大程度上决定了SERS-LFIA的灵敏度,AuNPs仍然目前应用最普遍的NPs。Li Yu等[85]创建了SERS-LFIA鉴定牛奶中的黏菌素,灵敏度提高了10~14 倍。Liu Haibin等[86]为了解决AuNPs-SERS-LFIA活性较弱的弊端,将拉曼分子4-MBA置于Au、Ag之间,制成AuMBA@Ag,利用Au和Ag间隙的强电磁场增强作用进一步提高信号强度,并首次应用于乳中E. coliO157:H7定量分析,灵敏度提高10 倍。
2.4.2 核酸扩增-侧流免疫层析技术
核酸扩增-LFIA现已成为传感器领域的流行趋势,通过核酸扩增获得大量半保留复制链,实现靶标放大,比传统方法更快速、准确、灵敏和稳定,推动了乳品安全检测的发展[86-88],传统的结合方式为变温扩增PCRLFIA[89-90],然而基于PCR的检测技术具有仪器笨重、热循环步骤耗时等局限性。随着等温扩增的发展,已经出现了更多结合方式,如LAMP-LFIA[91-92]、重组酶聚合酶扩增(recombinase polymerase amplification,RPA)-LFIA[93-94]、耐热解旋酶核酸等温扩增(thermostable helicase nucleic acid isothermal amplification,THDA)-LFIA[95]等应用于乳中致病因子检测。Zhao Yueming等[91]将LAMP-LFIA用于检测婴儿配方乳粉中的沙门氏菌,LOD为2.2 CFU/g,灵敏度提高10 倍。Hu Jinqiang等[96]建立了RPA-LFIA检测乳中E. coliO157:H7的新方法,LOD为4.4 CFU/mL。
2.4.3 适配体-侧流免疫层析技术
适配体是一种新型的生物识别分子,其本质是一段20~100 bp长的单链DNA,可以通过折叠形成一定的构象并与靶标进行特异性结合。适配体的筛选主要依赖指数富集的配体系统进化技术,从体外合成的随机文库中经过多轮筛选和指数富集得到。适配体被称为“人工抗体”,与抗体相比,具有亲和力高、制备方法简单、应用范围广、稳定性强、利于储存等优点。近年来,越来越多研究倾向于用适配体作为目标物识别分子,实现高灵敏、稳定检测。Zhang Lisha等[97]利用Fe3O4NPs修饰适配体,特异性识别L. monocytogenes,该方法在5.4×103~1×108CFU/mL呈线性,LOD为5.4×103CFU /mL。
SERS/适配体-LFIA[98]、核酸扩增-LFIA分别如图5A、B所示。
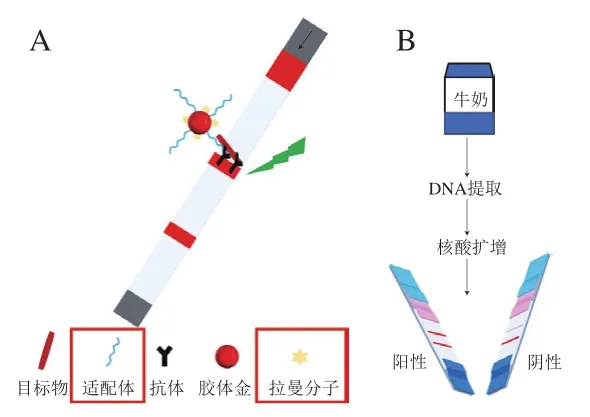
图5 SERS/适配体-LFIA(A)与核酸扩增-LFIA(B)示意图Fig. 5 Schematic diagram of surface enhanced Raman scattering/aptamer-LFIA (A) and nucleic acid amplification-LFIA (B)
2.4.4 智能手机-侧流免疫层析技术
智能手机已经成为日常生活的必需品。随着其规格的改进,大型随机存取存储器、高速中央处理器、高分辨率互补金属氧化物半导体(complementary metal oxide semiconductor,CMOS)传感器和无线保真网络等使智能手机成为与LFIA联用进行现场检测的基础[99]。并且智能手机可以拍摄并收集不同浓度样本所呈现的颜色,利用特定的应用程序及RGB、HSV和HSL等模型将颜色转换成分析信号,解决抗体-抗原关系被转导到NC膜产生的不确定性颜色变化问题,实现靶标物质的定量检测。Cheng Nan等[100]以智能手机设备对LFIA结果进行成像和记录,检测乳中肠炎沙门氏菌和E. coliO157:H7,LOD分别为20、34 CFU/mL。
3 高通量检测模式
多分析物同时检测可以提供丰富的样品信息,提高分析效率、减少样品体积、缩短分析时间和降低成本[101]。传统的分析技术侧重于单一的分析物,只能提供有限的样本信息,其结果在某些情况下不够准确和可靠[102-104],因此对单一样品中多个分析物快速、同步检测,已经成为LFIA的另一个发展方向。
3.1 多线型检测
多线型检测在传统LFIA基础上喷涂多条T线,实现多靶标物质检测。Le Tao等[105]提出一种多线型LFIA用来同时检测乳品中三聚氰胺和环丙嗪。该分析采用竞争法,两种物质的LOD分别为0.22、0.26 ng/mL,与高效液相色谱法的检测结果一致,证明了该方法在实际样品中的实用性。Chen Yiqiang等[106]开发了1 种同时检测乳中的内酰胺类、四环素类、喹诺酮类、磺胺类的四元LFIA,如图6A所示,制备了4 种待检测物质的特异性单克隆抗体和受体,形成4 个抗体/受体-AuNPs偶联物作为检测探针,四元免疫反应同时发生在4 条T线上。与传统LFIA相比,多T线设计减少了样品量和生产成本。然而,T线数量受到条带的空间、物理限制和Washburn理论[107]限制。此外,由于T线数量的增加,样品通过多个检测区时存在流量变化不确定性,设计的复杂性也随之增加,还需要考虑不同分析物和各T线之间的相互干扰。
3.2 多条型检测
如图6B所示,多条型检测一般呈“山”字型,能够避免多线型检测中,多线界面交叉反应造成污染。Cheng Nan等[100]创建了多条型LFIA,分别用于检测牛奶或冰淇淋中SalmonellaEnteritidis和E. coliO157:H7,LOD分别为20.0、34.0 CFU/mL,回收率为91.44%~117.00%。多条型LFIA是实现高通量检测最直接的方法,即将几条常规条带共享样品垫,但是无法确保样品溶液在每个条带上均匀分布,而样品量与灵敏度、准确性密切相关;并且随着待检物质的增多,耗费的成本和样品体积也增加。因此,如何精确地控制样品溶液的均匀分布和节约成本,是进一步推广其应用需要研究的问题。
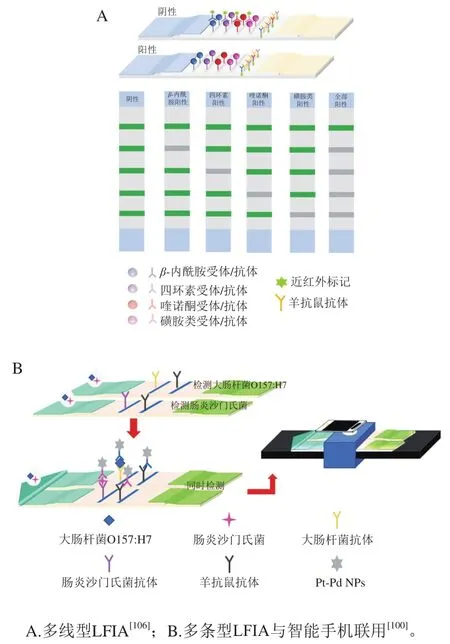
图6 高通量检测的两种模式Fig. 6 Two modes of high-throughput detection
4 结 语
LFIA提供了一个简单、快速、高通量的生化分析方法,但是该方法在灵敏度、检测限、高通量检测方面仍然需要进一步提升。本文从增敏和高通量检测两个方面论述了LFIA在乳品致病因子检测的研究现状。虽然这些方法能够在很大程度上提高灵敏度,但是在实际应用中还应解决以下问题:1)降低乳基质干扰。在乳品安全分析中,LFIA的灵敏度主要受到标记分子和乳基质(如蛋白质、脂肪)两方面因素的影响。目前提出的增敏方式主要集中在增强标记分子的光学性能,除了磁分离、样品预浓缩以外,降低乳基质干扰的方法少有报道。可以将LFIA与微流控通道相结合,通过在通道中包埋相应分子对干扰物质进行吸附以及分解,降低干扰。2)建立云数据平台。LFIA的增敏方式非常多样化,增敏效果也各有不同,但目前没有统一的云平台数据库将这些数据收录,也没有衡量各种信号分子增敏倍数的标准规范。3)设备小型化。诸如荧光、拉曼光谱等高灵敏度的检测方法只能通过大型、昂贵的设备检测。可以将LFIA与微电子系统、光电光源等相结合,例如超小型大功率激光二极管、CMOS图像传感器等可以提供可见光和红外光谱,使其能够在现场条件和资源有限的环境下进行使用。
