黑豆肽对高脂性肝损伤小鼠的保护作用
2022-04-01李思锦宋春丽王欣卉
李思锦,宋春丽,王欣卉,任 健,*
(1.齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔 161006;2.黑龙江省玉米主食工业化工程技术研究中心,黑龙江 齐齐哈尔 161006;3.黑龙江省玉米深加工理论与技术重点实验室,黑龙江 齐齐哈尔 161006)
近年来,随着人们生活水平的提高,非酒精性脂肪性肝病的发病率呈现逐年上升的趋势,严重威胁人类健康。该病的病理生理机制虽尚未完全阐明,但高糖高脂饮食习惯形成的肥胖、胰岛素耐受等问题被认为是造成非酒精性脂肪性肝病的重要因素[1]。非酒精性脂肪性肝病的发生是由胆固醇和甘油三酯含量的增加所引起的,促炎转录因子的表达和脂质代谢的改变也参与其病理过程。此外,多项研究已经证实氧化应激是促进非酒精性脂肪性肝病发展的主要因素。因此,减轻肝脏脂质代谢和氧化应激对于非酒精性脂肪性肝病的预防和治疗至关重要[2]。目前,对于调节脂质平衡相关的报道多集中在食源性活性肽方面。洋葱多肽能够起到降血糖作用[3],大豆肽具有明显的降血脂功能[4],玉米肽对高糖高脂诱导的大鼠具有保护作用[1]。
黑豆肽作为一种植物源活性肽,其体外抗炎活性和抗氧化活性的研究已取得一定进展[5-6]。例如,黑豆肽能降低血清和肝脏中丙二醛(malondialdehyde,MDA)的含量,显著提高肝脏中超氧化物歧化酶(superoxide dismutase,SOD)的活性以及血清和肝脏中谷胱甘肽超氧化物酶(glutathione peroxidase,GSH-Px)的活性[7]。黑豆肽疏水性较高的Leu残基表现出辅助降血脂的功效[8]。然而,黑豆肽能否修复高脂饮食造成的脂肪性肝损伤的研究鲜见报道。
本研究以雄性小鼠建立高脂性肝损伤模型,从生理生化指标和肝脏组织形态角度探究黑豆肽对小鼠高脂性肝损伤的修复作用,为拓展黑豆肽的功能特性和研发高效修复肝损伤的天然产品提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
ICR雄性小鼠80 只(SPF级),体质量(20±2)g,由长春市亿斯实验动物技术有限责任公司提供,动物生产许可证号为SCXK(吉)2018-0007。
黑豆购于黑龙江省齐齐哈尔市北大荒绿野食品有限公司。
谷丙转氨酶(cerealthirdtransaminase,ALT)试剂盒、谷草转氨酶(aspartate transaminase,AST)试剂盒、甘油三酯(triglyceride,TG)试剂盒、总胆固醇(total cholesterol,TC)试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)试剂盒、MDA试剂盒和微量还原性谷胱甘肽(glutathione,GSH)试剂盒 南京建成生物工程研究所;白细胞介素(interleukin,IL)-6试剂盒、IL-1β试剂盒、肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)试剂盒和核转录因子(nuclear transcription factor-κB,NF-κB)试剂盒 上海江莱生物科技有限公司;辛伐他汀 北京默飞生物科技有限公司;高血脂模型饲料II沈阳茂华生物科技有限公司。
1.2 仪器与设备
LXJ-2B型台式低速离心机 上海安亭科学仪器厂;Enspire型全波长多功能酶标仪 美国珀金埃尔默有限公司;DF-II型集热式磁力搅拌器 金坛市华峰仪器制造有限公司;UV5100型紫外分光光度计 上海美谱达仪器有限公司。
1.3 方法
1.3.1 黑豆蛋白的提取
黑豆湿法脱皮,烘干,100 目过筛。准确称取黑豆粉100 g,加入500 mL石油醚,磁力搅拌2.5 h后4 000 r/min离心10 min,取下层沉淀继续脱脂,重复3 次,在室温下晾干待用。取一定量黑豆粕,按1∶10(m/V)加入蒸馏水,调节pH值至8.5,50 ℃水浴搅拌2 h,4 000 r/min离心10 min,取上清液,沉淀复溶,重复上述操作,合并两次上清液,用1 mol/L HCl溶液调节上清液pH值为4.5,4 000 r/min下离心10 min,弃去上清液,保留沉淀。向沉淀中按1∶10(m/V)加入去离子水(pH 4.5),4 000 r/min离心10 min,弃去上清液,重复水洗3 次,沉淀即黑豆分离蛋白,于沉淀中加入少量去离子水,调其pH值为7,采用真空冷冻干燥法冻干黑豆分离蛋白,研磨成粉,密封保存。
1.3.2 黑豆肽的制备
将水与黑豆蛋白以9∶1(V/m)的比例均匀混合,调节pH值至(8.5±0.1),添加3%碱性蛋白酶(1 g/100 g蛋白质),在60 ℃条件下酶解70 min。酶解结束后,将酶解物置于90 ℃水中灭酶10 min,然后快速使其冷却至室温,4 000 r/min离心10 min,收集上清液,经喷雾干燥得黑豆肽[9]。
1.3.3 黑豆肽的氨基酸组成分析
称取60 mg黑豆肽粉置于容积为20 mL的安瓿管中,加入9 mL 6.67 mol/L HCl溶液进行酸水解,充氮封管后在110 ℃下水解24 h。用pH 2.2的柠檬酸缓冲液定容至100 mL并过水系膜,然后使用氨基酸自动分析仪进行分析[10]。
1.3.4 高脂性肝损伤小鼠模型的建立
雄性健康的ICR小鼠80 只,小鼠饲养于实验专用鼠笼,饲喂标准饲料,室温(24±2)℃,相对湿度(45±3)%,光照12 h/d,小鼠适应性喂养一周后,将80 只小鼠随机分为2 组,模型组(60 只)饲喂高脂饲料(每只5 g/d,定量添加)、对照组(20 只)饲喂普通饲料,自由摄食、饮水。连续喂养5 周后,正常对照组和脂肪肝模型组分别处死10 只小鼠,比较2 组小鼠的血清和肝脏生化指标,以及观察肝脏组织病理切片,判断高脂性肝损伤小鼠模型是否建立成功。
1.3.5 分组与给药
将50 只造模成功小鼠随机分为5 组,每组10 只,分别为模型组、阳性药物组(辛伐他汀100 mg/kgmb)、黑豆肽低、中、高剂量组(400、800、1 000 mg/kgmb)。连续给药5 周,空白对照组(10 只)和模型组分别给予等量生理盐水。给药期间,除空白对照组标准鼠料饲养外,其余各组继续给予高脂饲料,直到实验结束。所有小鼠在末次给药后,禁食不禁水12 h,小鼠眼球取血,分离血清,检测小鼠血清相应生化指标(AST、ALT、TG、TC、HDL-C、LDL-C、IL-6、IL-1β、TNF-α和NF-κB水平)。取血后处死小鼠,取出肝脏,左肝叶用体积分数4%多聚甲醛溶液固定,苏木精-伊红(hematoxylin-eosin,HE)染色,切片,供组织病理学检查;右肝叶制备成10%肝组织匀浆,测定相应生化指标(MDA和GSH水平)。
1.3.6 指标检测
1.3.6.1 小鼠体质量、肝脏指数的测定
小鼠取血前称质量,处死后完整取出肝脏,称其肝脏湿质量。按下式计算肝脏指数。

1.3.6.2 小鼠生化指标的测定
使用ELISA试剂盒测定血清ALT、AST、LDL-C、HDL-C、TG、TC、IL-6、IL-1β、TNF-α和NF-κB水平以及肝脏GSH和MDA水平,具体方法严格按照相应试剂盒说明书进行。
1.3.6.3 HE染色观察小鼠肝脏组织形态学变化
取肝组织于体积分数4%多聚甲醛浸泡固定,常规脱水、透明、包埋、切片处理,常规HE组织化学染色,在光学显微镜下观察肝组织的病理变化情况[11],采集倍数200×。
1.4 数据处理与分析
实验数据以平均值±标准偏差表示,采用Excel和SPSS 17.0软件进行数据处理,采用Duncan进行方差分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 黑豆肽的氨基酸组成分析
蛋白质的品质由其氨基酸的种类和含量决定[12]。黑豆肽的氨基酸种类齐全,必需氨基酸含量占34.62%,支链氨基酸含量占14.79%(表1),黑豆肽必需氨基酸和支链氨基酸含量高于大豆蛋白水解物[13]。已有研究提出支链氨基酸含量异常可以导致各种形式的肝损伤的发展和恶化,在慢性肝病,特别是肝硬化中支链氨基酸含量减少[14]。支链氨基酸为主再配以其他氨基酸组成常用于治疗肝硬化、慢性肝病等[15]。由此可推测黑豆肽具有保肝护肝的作用。
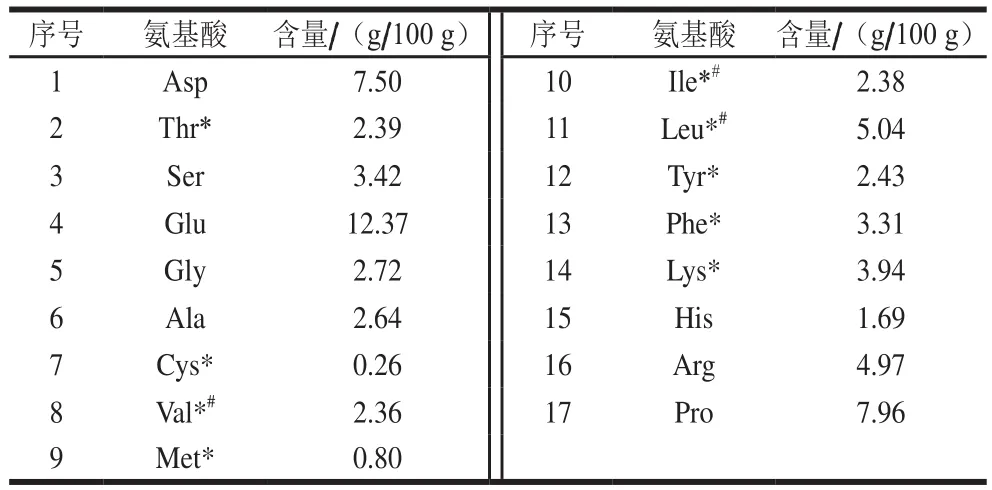
表1 黑豆肽氨基酸含量Table 1 Amino acid composition of black soybean peptides
2.2 高脂性肝损伤模型的建立
模型组小鼠经连续5 周饲喂高脂饲料后,小鼠的体质量、肝指数以及小鼠肝脏形态均发生改变。与对照组相比,模型组小鼠毛色欠鲜亮,毛发更为杂乱。随着饲喂时间的延长,模型组小鼠活动度减少,体质量、肝脏质量及肝脏指数增加(但无统计学意义),呈现体态肥胖的状态(表2)。对照组小鼠肝脏呈鲜红色,而模型组小鼠肝脏颜色弥散,肝脏明显呈脂肪肝化(图1),表明高脂性肝损伤小鼠模型建立成功。
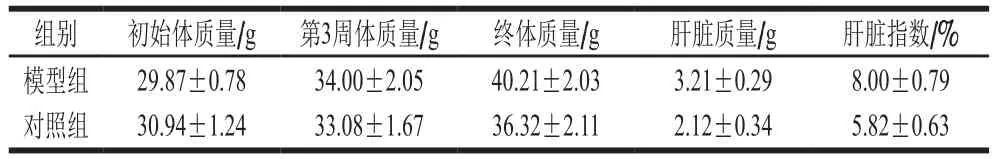
表2 高脂性肝损伤小鼠5 周后体质量及肝脏指数的变化(n=10)Table 2 Changes in body mass and liver index in mice induced by high-fat diet continuously for 5 weeks (n = 10)

图1 高脂性肝损伤小鼠肝脏的形态Fig. 1 Appearance of liver tissues in mice with liver injury induced by high-fat diet
本研究测定了小鼠血清生化指标,结果如表3所示。与对照组相比,高脂饲料饲喂的模型小鼠血清中TG、TC和LDL-C浓度均显著升高(P<0.05,P<0.01),其中TC和LDL-C浓度分别提高了238.4%和296.1%;血清中HDL-C浓度显著降低(P<0.05)。有研究表明,高脂饮食导致的非酒精脂肪肝损伤,能够增加体内TG的分泌,引起TC和LDL-C水平的升高,以及HDL-C水平降低[16]。本研究结果进一步表明高脂性肝损伤小鼠模型建立成功。

表3 高脂性肝损伤小鼠生化指标的影响(n=10)Table 3 Effect of high-fat diet on biochemical indexes in mice (n = 10)
2.3 黑豆肽对高脂性肝损伤小鼠肝脏组织形态学影响
经黑豆肽灌胃至第8周的小鼠肝脏组织形态学变化结果见图2。对照组小鼠肝组织结构和肝细胞间隙均未见明显异常,肝索走向正常;模型组小鼠肝细胞内存在大量脂滴,胞质内可见圆形空泡,炎细胞浸润,肝索紊乱,大部分细胞坏死;相比于模型组,黑豆肽组(400~1 000 mg/kgmb)及阳性药物组小鼠肝内空泡细胞明显减少,炎细胞浸润均较模型组有不同程度的改善;黑豆肽组(800~1 000 mg/kgmb)小鼠部分肝脏细胞保存完整,有突出的细胞核和脉络膜以及清晰的细胞边界。
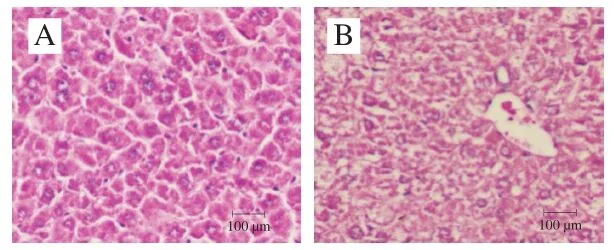
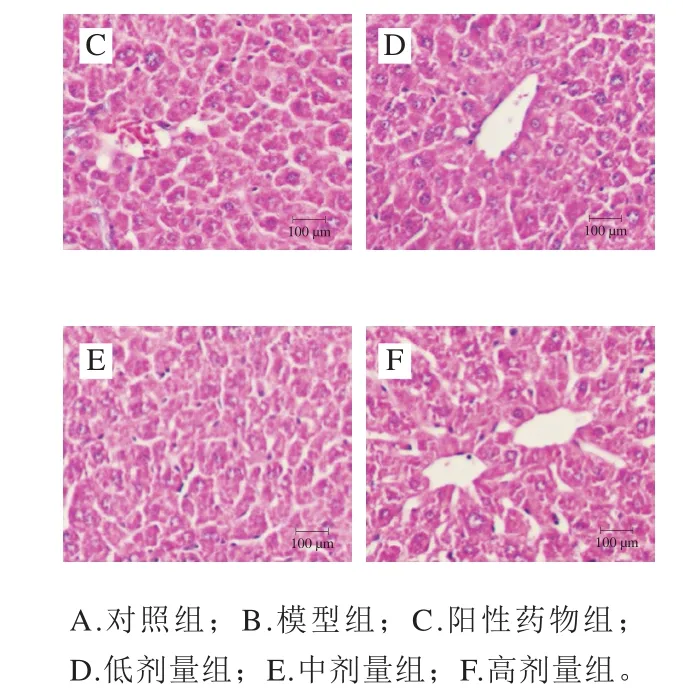
图2 黑豆肽对高脂性肝损伤小鼠肝脏组织形态学变化的影响Fig. 2 Effects of black soybean peptides on hepatic histomorphological changes in mice with liver injury induced by high-fat diet
2.4 黑豆肽对高脂性肝损伤小鼠生化指标的影响
高脂饮食诱导的非酒精性脂肪性肝病能够引起大量脂肪变性,造成脂质积累,导致血液中ALT与AST活力升高。而HDL是一种能够防止胆固醇积累的脂蛋白,LDL是一种氧化后易诱发脂肪性肝病的脂蛋白,生化指标(ALT、AST、TC、TG、LDL-C、HDL-C)水平的变化是反映肝脏损害与否的重要依据[17-18]。
持续灌胃黑豆肽4 周后小鼠血清生化指标分析结果见表4。与模型组相比,黑豆肽(800~1 000 mg/kgmb)能够显著降低小鼠AST、ALT、TG、TC和LDL-C的水平,并极显著升高HDL-C水平(P<0.01)。黑豆肽组(800~1 000 mg/kgmb)与阳性药物组相比,TG浓度极显著降低(P<0.01),对AST、ALT、TC、LDL-C和HDL-C水平的影响无显著性差异(P>0.05)。经黑豆肽干预后,肝细胞的通透性发生变化,导致血液中ALT与AST含量降低[17]。并且减缓了脂肪变性,减轻脂质积累,减少体内游离的脂肪酸[19],体现在TC、TG或LDL-C水平降低,HDL-C水平升高[20-21]。结果表明,黑豆肽通过提高抗氧化能力和降低脂质过氧化,起到良好的降脂保肝作用,能够减轻高脂饮食诱导的肝损伤。
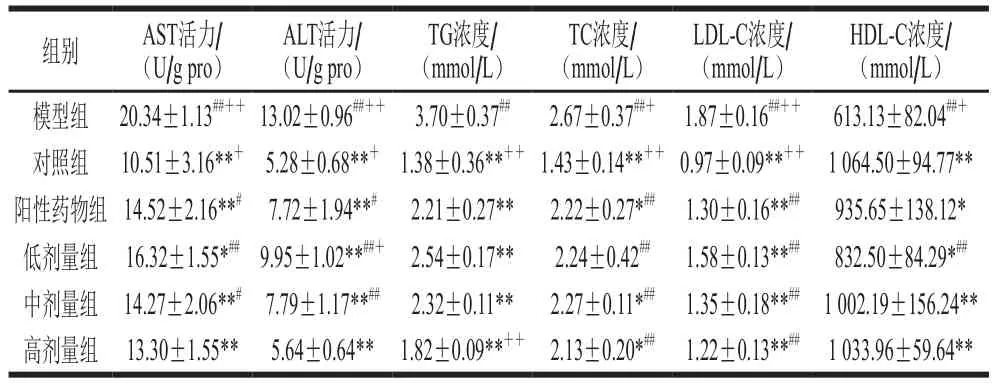
表4 黑豆肽对高脂性肝损伤小鼠生化指标的影响(n=10)Table 4 Effects of black soybean peptides on biochemical indices in mice with liver injury induced by high-fat diet (n = 10)
2.5 黑豆肽对高脂性肝损伤小鼠肝脏抗氧化指标的影响
氧化应激和脂质过氧化反应是目前公认的非酒精性脂肪性肝病发病病因[22],GSH和MDA是评价其损伤程度的指标[23]。经过持续灌胃黑豆肽4 周后小鼠体内抗氧化活性指标结果见表5。黑豆肽组(400~1 000 mg/kgmb)能够极显著降低小鼠MDA水平,并极显著升高GSH水平(P<0.01)。黑豆肽组(800~1 000 mg/kgmb)与阳性药物组相比GSH水平无显著性差异(P>0.05)。在黑豆肽的干预下,肝细胞内氧化应激和脂质过氧化反应程度均减轻,减轻了细胞膜的损伤[24-25]。降低MDA浓度、提高GSH浓度,能够对非酒精性脂肪肝病小鼠起到保护作用[26],结果表明黑豆肽可减轻脂质过氧化并具有良好的抗氧化能力。

表5 黑豆肽对高脂性肝损伤小鼠肝脏GSH和MDA含量的影响(n=10)Table 5 Effects of black soybean peptides on GSH and MDA contents in liver tissues of mice with liver injury induced by high-fat diet (n = 10)
2.6 黑豆肽对高脂性肝损伤小鼠血清中炎性因子和NF-κB水平的影响
当机体发生非酒精性肝损伤时,肝脏细胞功能异常,激活NF-κB的信号通路。NF-κB处于炎症反应的中心环节,通过调控各种急性反应蛋白、细胞黏附分子和细胞因子的转录过程,直接参与肝脏急、慢性炎症反应[27-28]。TNF-α是一种促炎因子,其能通过活化NF-κB信号通路,进一步引发多种炎性因子(如IL-6和IL-1β)的释放,造成肝脏炎性损伤,诱导肝细胞调亡,同时这些炎性介质反过来导致NF-κB的活化,造成炎症反应进一步加剧[29-31]。
经过持续灌胃黑豆肽4周后小鼠体内血清炎性因子和NF-κB水平结果见表6。黑豆肽组(400~1 000 mg/kgmb)能够极显著降低小鼠TNF-α、NF-κB、IL-6和IL-1β的水平(P<0.01),高剂量组(1 000 mg/kgmb)与阳性药物组相比,炎性因子(TNF-α、IL-6和IL-1β)含量无显著性差异(P>0.05),但能够显著降低核转录因子NF-κB含量(P<0.05)。当黑豆肽进入机体后,减轻了肝细胞的炎症损伤,降低了炎性因子TNF-α、IL-6和IL-1β的表达与释放,同时减弱了NF-κB的活化能力,促使炎症基因表达下调,从而抑制炎症反应[32]。以上结果表明,黑豆肽可抑制炎症因子释放,减轻高脂饮食诱导的肝损伤并改善肝功能。
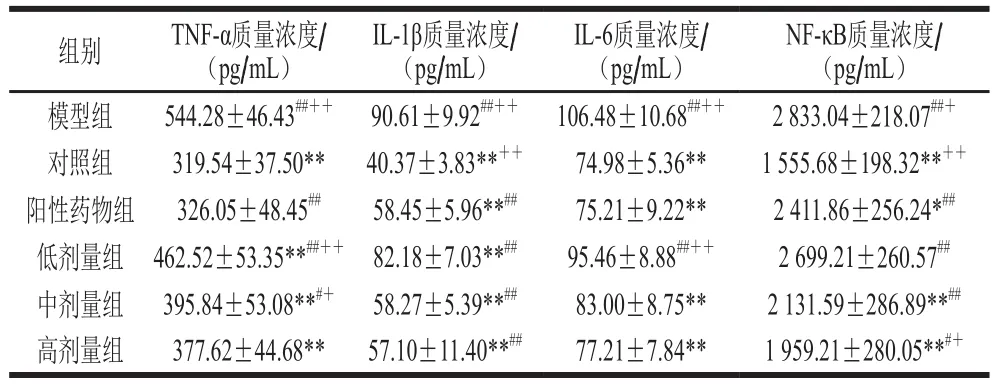
表6 黑豆肽对高脂性肝损伤小鼠血清炎性因子和核转录因子水平的影响(n=10)Table 6 Effects of black soybean peptides on serum levels of inflammatory factors and nuclear transcription factors in mice with liver injury induced by high-fat diet (n = 10)
3 结 论
黑豆肽能够通过提高体内的抗氧化能力(提高ALT、AST、GSH水平),减轻脂质过氧化水平(降低TC、TG、LDL-C、MDA水平)和体内炎症反应(降低TNF-α、NF-κB、IL-6、IL-1β水平),从而有效缓解高脂饮食诱导的肝损伤。黑豆肽有望在保健品或药品的研究领域中应用,但对于黑豆肽的护肝保肝效应仍需要进行更加深入的研究。
