肝动脉化疗栓塞联合微波消融术治疗原发性肝癌合并动静脉瘘的临床疗效
2022-04-01张东东张明顼孙立倩
张东东,张明顼,孙立倩
聊城市人民医院 超声科,山东 聊城 252000
引言
原发性肝细胞癌(Hepatocellular Carcinoma,HCC)是我国常见的恶性肿瘤之一,严重威胁人们的身体健康[1]。HCC起病隐匿,早期无症状,随着病程进展,肿瘤逐渐增大并直接侵犯肝门静脉或肝静脉的分支,导致肝动脉的高压血进入低压的静脉系统,形成动静脉瘘(Arteriovenous Shunt,AVS)[2-3],肝AVS使肝脏正常血流动力学发生改变,处理不当会发生肿瘤转移、门静脉高压、消化道出血、顽固性腹水等风险[4-5],严重影响患者的生存质量[6]。对不能手术的合并AVS的HCC患者,首选经导管肝动脉化疗栓塞术(Transcatheter Arterial Chemoembolization,TACE)治疗,但部分患者经TACE治疗后AVS仍然不能完全闭合,而微波消融(Microwave Ablation,MWA)作为一种局部热消融方法,现已普及应用,对早期HCC患者可达到与手术相当的疗效,对于肝肿瘤较大者同样具有一定延长生存期和提高生存质量的效果[7-9]。因此本研究采用TACE与MWA联合的方法治疗HCC合并AVS的患者,以期达到较为理想的疗效。
1 材料与方法
1.1 研究对象
选取2015年9月至2017年9月在山东省聊城市人民医院传染科首次接受治疗的HCC患者。入选标准:① 符合《原发性肝癌诊治规范》(2017版)[10]诊断标准;② 符合中国肝癌分期方案中的Ⅰb期、Ⅱa期、Ⅱb期患者[10],经数字剪影血管造影(Digital Subtract Angiography,DSA)或增强CT确诊HCC合并AVS,无血管侵犯和肝外转移;③ 无其他重要器质性疾病;④ 肝功能Child-Pugh分级为A或B级;⑤ 患者拒绝或不能耐受手术切除。排除标准:① 存在严重的肝、肾、心功能不全;② 有肝移植史或其他癌症肝转移;③ 无法纠正的凝血功能障碍;④ 恶液质或多器官衰竭者。本研究通过聊城市人民医院医学伦理委员会批准。按上述标准共纳入78例患者,肿瘤数目共计92个,其中肝动脉-门静脉瘘(Hepatic Arterial Portal Venous Shunt,HA-PVS)85个,肝动脉-肝静脉瘘(Hepatic Arterial Hepatic Venous Shunt,HA-HVS)7个。按照肿瘤大小配对设计分组,分为对照组和治疗组,其中对照组39例(46个肿瘤),男27例,女12例,平均年龄60(54~68)岁,肿瘤直径3.9~6.8 cm,平均直径(5.1±1.05)cm,平均体积(72.8±22.7)cm3;治疗组39例(46个肿瘤),男29例,女10例,平均年龄59(49~72)岁,肿瘤直径3.9~6.8 cm,平均直径(5.1±1.04)cm,平均体积(72.7±22.8)cm3。
1.2 方法
1.2.1 TACE治疗方法
对照组采用TACE治疗,采用先栓塞AVS再行化疗栓塞的方法,具体如下:Seldinger技术穿刺股动脉,微导管入腹腔动脉,超选择进入肝固有动脉、左右肝动脉,造影显示肿瘤部位、供血血管、AVS的类型及瘘口大小,先行瘘口栓塞再行肿瘤栓塞。① HA-PVS中央型:微导管至瘘口前,采用明胶海绵颗粒(条)或弹簧圈堵塞瘘口,再给予TACE治疗;② HA-PVS周围型:小范围或血液分流量小的HA-PVS可直接行TACE治疗,以碘油作为主要栓塞剂;对于较大的瘘口,用适量明胶海绵和丝线堵塞后再行TACE治疗;③ HA-HVS:根据瘘口大小选择明胶海绵颗粒(条)堵塞瘘口后再行TACE治疗。化疗栓塞均采用超液化碘油,常用药物为表柔比星20 mg(深圳万乐药业股份有限公司)、奥沙利铂50 mg(江苏恒瑞医药有限公司)与超液态碘化油2~3 mL(法国加柏股份有限公司)混合,根据患者的肝功能和血常规检查结果选择合适剂量。
1.2.2 MWA治疗方法
治疗组采用TACE联合MWA治疗,TACE治疗方法同对照组,MWA于TACE治疗1个月后实施,采用南京亿高微波消融治疗仪,频率2450 MHz,功率50~60 W。导引设备为GE E9型超声仪,探头频率3.5~5.5 MHz。治疗前结合增强MRI或CT全面扫查肝脏,确定肿瘤位置、大小以及与周围重要组织的关系和动静脉瘘情况。根据超声探测结果设计最佳穿刺点和进针路线,根据肿瘤大小选择微波消融针及消融时间。术中静脉镇痛采用舒芬太尼。
1.3 患者随访
术后1、3、6、12个月进行患者随访,包括彩色多普勒血流显像(Color Doppler Flow Imaging,CDFI)技术和增强MRI检查以及血清脱-γ-羧基凝血酶原、甲胎蛋白(Alpha-Fetoprotein,AFP)、甲胎蛋白异质体AFP-L3水平的测定,以评估患者AVS闭合情况、肿瘤治疗效果并及时监测有无残留和复发。
1.4 疗效评估
(1)评估联合治疗及单独TACE治疗后AVS闭合率:AVS的闭合程度分为3类,包括完全闭合(术后AVS完全闭合)、部分闭合(残留瘘口微小)和不完全闭合(残留较大的瘘口)。
(2)采用增强MRI评估联合治疗及单独TACE治疗的短期疗效:① 完全缓解(Complete Response,CR):增强MRI显示所有靶病灶肿瘤内三期无强化,无强化体积大于治疗前肿瘤体积;② 部分缓解(Partial Response,PR):MRI显示治疗后病灶无强化区域的体积达到术前体积的70%及以上;③ 疾病稳定(Stable Disease,SD):MRI显示治疗后病灶无强化体积既没有达到PR,病灶增大程度也未达到疾病进展的要求;④ 疾病进展(Progressive Disease,PD):MRI显示治疗后病灶强化体积较治疗前增加,并且增加至少10%,或出现新病灶。
(3)评估治疗后肿瘤体积的变化,计算消融后肿瘤体积缩小率[缩小率=(治疗前体积-治疗后体积)/治疗前体积×100%]。
(4)统计患者远期1、2、3年生存率。
1.5 统计学分析
采用统计软件SPSS 13.0进行统计学分析,正态分布计量资料用±s表示,两组间比较采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 治疗后AVS闭合率
治疗后,两组间完全闭合率比较差异有统计学意义(P<0.05),见表1。

表1 两组闭合率比较[n=46,n(%)]
2.2 治疗后短期疗效
治疗后1个月增强MRI显示,两组间总有效率差异有统计学意义(P<0.05),见表2。

表2 两组短期疗效比较[n=46,n(%)]
2.3 治疗后肿瘤体积变化
两组患者经治疗后3个月、6个月和12个月肿瘤体积逐渐缩小(图1~2),且两组患者6个月和12个月肿瘤体积的大小与治疗前体积比较差异均有统计学意义(P<0.05、P<0.01)。两组间治疗后肿瘤体积比较差异均无统计学意义(P>0.05)。治疗组肿瘤缩小率大于对照组,但组间差异无统计学意义(P>0.05),见表3。
表3 HCC患者治疗后肿瘤体积变化[n=46,(±s)]

表3 HCC患者治疗后肿瘤体积变化[n=46,(±s)]
注:与治疗前比较,aP<0.05,bP<0.01。
缩小率/%治疗前 治疗后3个月肿瘤体积/cm3组别治疗后12个月治疗组 72.7±22.8 63.1±19.4 50.2±16.9a 44.5±14.3b — 12.8±4.9 29.9±5.4 38.2±4.6对照组 72.8±22.7 64.4±20.4 54.6±19.8a 49.1±16.4b — 11.5±6.0 24.9±5.5 32.5±4.3 t值 0.021 0.313 1.146 1.433 — 1.138 4.399 6.139 P值 0.983 0.754 0.254 0.155 — 0.258 <0.001<0.001治疗后6个月治疗后12个月治疗前治疗后3个月治疗后6个月

图1 MWA前,肝右叶肿瘤合并HA-PVS
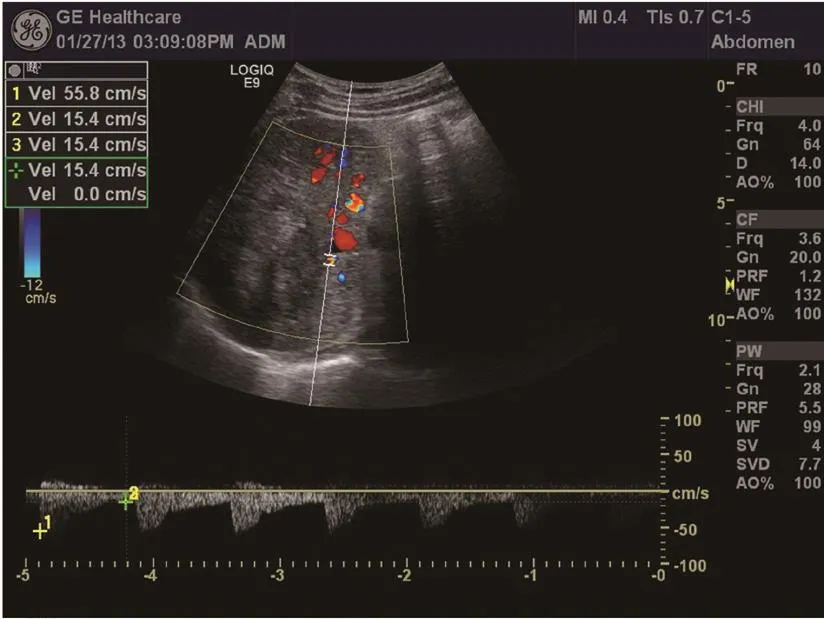
图2 MWA后6个月,肿瘤体积缩小,动静脉瘘消失
2.4 远期疗效
两组3年生存率比较,差异有统计学意义(P<0.05),见表4。
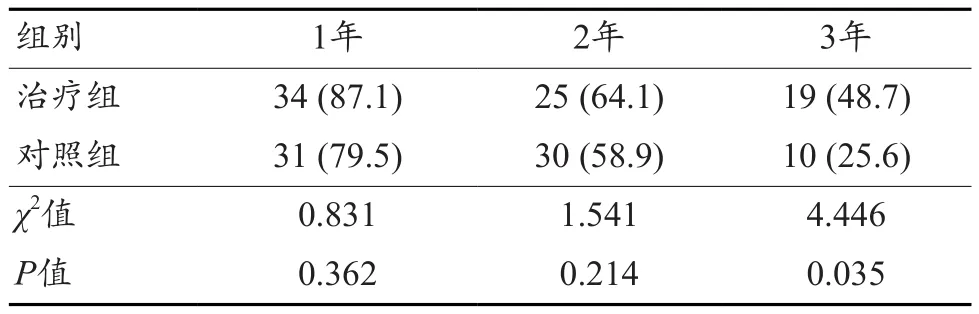
表4 两组远期生存率比较 [n=39,n (%)]
3 讨论与总结
国内外文献报道,HCC患者并发AVS的发生率为8.9%~18.9%,AVS发生机制为肿瘤组织侵蚀、破坏瘤体所在区域的动静脉管壁,使动、静脉之间形成瘘道,从而使高压力的肝动脉血通过瘘口直接进入压力低的门静脉或肝静脉内。HCC合并AVS可分为HA-PVS和HA-HVS。肝动脉与门静脉同属Glisson系统,在肝内相伴走行,所以HCC合并HA-PVS型的发生率明显高于HA-HVS型[2,4,6]。本研究中HCC合并AVS的两者比例基本与以往文献相符。HCC合并AVS的诊断多采用DSA,但增强CT以及CDFI对AVS的诊断亦具有较高的特异度和敏感度[11]。AVS的发生率与肿瘤的大小成正相关,因此AVS主要发生在体积较大的肿瘤中[2],本研究中病例肿瘤平均直径达到5.1 cm,平均体积达到72.8 cm3,与文献报道相符。
HCC合并肝AVS,尤其是HA-PVS,使得肝动脉血通过AVS进入门静脉,造成正常肝组织的血流灌注量减少,氧和营养供给亦随之减少,导致肝功能进一步损害。同时肝动脉与门静脉之间的连通,导致门静脉高压形成,进而造成食道胃底静脉曲张,易进一步导致上消化道出血[12-13]。肿瘤细胞还可以通过瘘口扩散转移导致肝内转移瘤或肝外其他器官、组织的转移瘤[7],AVS的出现使患者治愈率和生存期缩短。因此,此类患者的治疗,需要在治疗HCC的同时,阻断AVS的瘘口,一是为了改善正常肝脏的血液循环状况,提高肝脏合成营养物质的能力[14];二是消除门静脉高压所致临床并发症;三是可以进一步选择栓塞肿瘤的供血动脉,保护正常肝组织并减少肿瘤通过瘘口扩散的概率[15]。HCC合并AVS的标准治疗方法为TACE治疗[10],封堵AVS瘘口的常用有材料有弹簧圈、无水乙醇、明胶海绵、碘化油、微球等。本研究中病例多采用明胶海绵+碘化油的方法,明胶海绵具有廉价、取材方便、容易制备成各种形态的特点,对于大多数瘘口栓塞效果良好,之前有文献报道其用于较大的瘘口时可出现栓塞不全或再通的情况[16],本组病灶栓塞后AVS完全闭合率为63.0%,稍低于文献报道[15-18],可能与本研究病例肿瘤体积较大有关。
TACE治疗较大的肝肿瘤具有一定的局限性,临床治疗目的多为限制肿瘤生长和使肿瘤缩小,但难以实现一次性使病灶全部灭活,这是由肿瘤多中心性发生的生物学特征、肿瘤供血血管的复杂性及TACE后侧支循环重新建立导致的[19]。根据《原发性肝癌诊治规范》[10],在行TACE治疗时,给予MWA序贯治疗,可以明显提高临床疗效,并减轻肝功能损伤程度。本研究病例短期临床疗效中联合治疗总有效率明显高于单纯TACE治疗,进一步说明MWA联合TACE治疗效果优于单一TACE治疗,并且联合治疗AVS闭合率亦大于单纯TACE,考虑原因为MWA的高热能使肿瘤组织快速凝固坏死,肿瘤内血管因高热亦会产生血栓,进一步使AVS瘘口部血流速度降低,热量的累积亦使AVS瘘口部血管产生凝固,致使AVS闭塞。
冷循环微波消融术具有产热快、局部热效能大、消融时间短、受血液流动影响小等优势,对于肿瘤直径≤4 cm的HCC患者采用MWA治疗,其5年生存率与手术切除无明显差异,且MWA并发症的发生率更低[10,20-21]。随着研究的深入,目前临床所采用的频率更低的微波针具或用两根微波发射电极亦能显著提高MWA的消融面积,使肿瘤较大的HCC患者也能获得较好的消融疗效[12]。本研究中患者肿瘤体积较大,平均体积72.8 cm3(直径约5.1 cm),因此患者采用双针治疗进一步增大消融面积;联合治疗后3个月增强MRI显示,患者临床症状均得到不同程度改善,肿瘤体积逐渐缩小,治疗后6、12个月肿瘤体积与治疗前比较显著减小,两组患者的3年生存率间差异有统计学意义。上述结果与相关文献报道一致[10-12]。
通过总结本研究病例发现,MWA实际应用中应注意两点,一是根据HCC肿瘤的形态、大小和比邻关系来合理设计最佳穿刺点及进针路线,进针路径应避开肝内重要血管及胆管,并与瘤体最大径相平行,二是双微波针消融,对于中央型AVS,应将AVS夹在两针之间,两针间距1.5 cm,这样AVS瘘口及周围组织可达到较高温度,快速使肿瘤组织及AVS产生凝固坏死并能促进血栓形成,进而使AVS闭塞。
综上所述,采用TACE联合MWA治疗HCC合并AVS,能有效提高AVS的闭合率,增加肿瘤治疗总有效率,进一步提升患者的生存质量。由于病例较少,本研究对治疗中可能出现的并发症以及复发情况鲜有叙述,今后将进一步扩大样本量进行深入研究并加以总结。
