尖角突脐孢菌紫外光诱变及高致病力菌株的筛选
2022-04-01董朝霞钟锦俞雯雯洪鑫发陈勇
董朝霞,钟锦,俞雯雯,洪鑫发,陈勇*
(1.华南农业大学林学与风景园林学院,广东 广州 510642;2.华南农业大学农学院,广东 广州 510642;3.广东烟草韶关市有限公司乳源县局分公司,广东 韶关512700)
稗草(Echinochloacrusgalli)为世界十大恶性杂草之一[1]。目前在61个国家和地区均有发现,其对水稻的危害极其严重。如今防治稗草主要有农业防治、化学防控以及生物和物理等防控措施。尖角突脐孢菌(Exserohilummonoceras)属半知菌类(Deuteromycotina),是一种对稗草有较强致病性但对水稻(Oryzasativa)安全的一种生防潜力菌[2-5]。由于大田条件复杂多变,将尖角突脐孢菌直接使用到大田时,其防效远低于室内除稗防效[5-8]。因此,为了更好地利用尖角突脐孢菌,筛选出高致病力、产孢量高、抗紫外光线的优势菌株已经成为亟待解决的问题。
当前,主要通过物理诱变、化学诱变和生物诱变进行微生物育种[9-12]。微生物诱变育种是一项通过基因突变技术对微生物的遗传结构和功能进行改变的技术。通过改造,人们可以获得具有特定的且能稳定遗传的菌株[11]。在物理诱变中,紫外光诱变工作量低、定向强、效率高,故使用频率较高[13]。Lotfy等[14]用紫外光诱导黑曲霉中的柠檬酸过量产生,最终获得稳定正向突变体W5,柠檬酸产量为62.50%,与亲本野生型菌株相比增加约3.2倍。王博等[15]用低温和紫外诱变技术选育絮凝优异的絮凝菌,通过紫外诱变和低温胁迫处理得到一株对生活污水絮凝率达75.35%的诱变菌株FB-5,且该菌株遗传性状不变。本试验以尖角突脐孢菌X27为研究材料,采用紫外光照射该菌株分生孢子悬液获得一系列紫外突变菌株,以 2叶 1心的稗草为生测对象,筛选获得长势良好、菌落形态稳定、致病力强、抗紫外光的诱变株,主要从尖角突脐孢菌落生长速率、产孢量、紫外耐受力以及对作物安全性等方面筛选诱变株,为高致病力尖角突脐胞菌的选育提供参考。
1 材料与方法
1.1 供试材料
尖角突脐孢菌株X27采集于江西石城稗草叶上,分离纯化后保存于华南农业大学杂草实验室。稗草采集于广东省广州市增城区宁西街道华南农业大学试验基地。从野外采集的稗草种子晒干后,保存于 4 ℃冰箱中。
菌株培养和检测材料:吐温-80、琼脂、马铃薯葡萄糖琼脂培养基(PDA)、无水乙醇、新型基因组DNA提取试剂盒(北京天根生化科技有限公司)。
1.2 尖角突脐孢菌株的紫外光诱变
取尖角突脐孢菌X27的分生孢子配成1×104mL-1的孢子悬浮液。取2~3 mL孢子悬浮液于无菌培养皿中,紫外光灯光分别照射(功率15 W,距离为15 cm)1、3、5、10、30和60 min,然后均取出100 μL孢子悬浮液在红光下用涂布器接种于PDA培养基平板上,每个处理4次重复,未经紫外光照射的孢子悬浮液作对照。28 ℃黑暗条件下培养至少3 d,记录最终菌落的数量并计算致死率。致死率=(对照菌落数-诱变平板菌落数)/对照菌落数×100%。取尖角突脐孢菌X27的孢子悬浮液经紫外光分别照射5、10、15、20、25和30 min,确定尖角突脐孢菌紫外光诱变的最佳时间。
1.3 高致病力尖角突脐孢菌诱变株的筛选
1.3.1 诱变株产孢量测定根据1.2节的最佳时间对尖角突脐孢菌进行诱变选育,选育出300个菌株,分别编号并保存。在尖角突脐孢菌X27和诱变株菌丝生长均匀处,取直径为0.8 cm的菌丝块,放入新的PDA培养基平板上。14 d后,用10 mL 0.05%吐温-80水溶液把培养基上的孢子全部洗下,200 r·min-1振荡20 min后,4层纱布过滤并保存备用。在显微镜下用血球计数板测定孢子悬液产孢量,每个菌株重复4次。
1.3.2 稗草离体叶片法对诱变株致病力测定选取2叶1心期、同一叶位长势良好的叶片,去除稗草叶片的尖端和基部,保留叶中部5~6.5 cm。放入铺有湿润滤纸的培养皿中,加入适量的无菌蒸馏水,在叶片上针刺形成伤口,吸取5 μL孢子悬浮液点于伤口上。用菌株X27作为对照,置于28 ℃光照培养箱中,光、暗培养时间各12 h,湿度70%~90%。3 d后测量病斑直径,并计算菌株离体叶片致病力,每个处理均重复4次。
1.3.3 诱变株产孢量和致病力综合聚类分析按照系统聚类法中最长距离法,采用诱变株产孢量和致病力的相对值对诱变株进行聚类分析。在聚类水平D2=10.0 时可以划分为三大类群。
1.3.4 诱变株活体侵染致病力测定从300个诱变菌株里筛选产孢量和致病力较强的优势菌株作为活体侵染的材料。在PDA培养基上培养14 d后,将优势菌株配制成1.0×106mL-1的孢子悬浮液,并喷于2叶 1心期的活体稗草上,用X27菌种作为对照,将处理过的活体植株于28 ℃光照培养箱培养48 h(培养条件同1.3.2节),再移入温室中生长。1周后调查分级和发病情况,计算病情指数。每个处理重复4次。
稗草病害分级标准:0级:全株无病,叶片上无斑点;1级:仅有小的针尖大小的褐点;2级:全株叶片上有较大褐点,并有1~2 mm的典型或椭圆形坏死病斑均匀分布在叶片上,约占叶面积2%;3级:全株有典型病斑,侵染面积小于10%;4级:全株有典型病斑,侵染面积占10%~50%;5级:全株有典型病斑,侵染面积占51%~75%;6级:全株有典型病斑,全部叶片死亡。

式中:i表示病级;n表示植株发病为i级的株数;N表示调查总株数;6表示植株发病最高级。
1.4 诱变菌株ITS-PCR扩增
ITS序列的扩增采用真菌分子鉴定的通用引物ITS1和ITS4[16]。ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′,引物由苏州金唯智生物科技有限公司合成。扩增结束后对单一条带PCR产物进行ExoSAP-IT纯化,对有非特异条带的PCR产物进行切胶纯化。
1.5 尖角突脐孢菌诱变株的生物学特性研究
1.5.1 尖角突脐孢菌株的菌落生长速率测定在尖角突脐孢菌X27菌株和高致病力诱变株X27-UV148、X27-UV048、X27-UV045、X27-UV286的PDA培养基上的分生孢子中,取菌丝生长均匀处直径为0.8 cm的菌丝块接种到PDA培养基中间,置于28 ℃生化培养箱中培养。每2 d观察并记录菌落生长直径,共观察11 d,每个处理4次重复。
1.5.2 尖角突脐孢菌诱变株对紫外光耐受力测定将X-27菌株和高致病力诱变株X27-UV148、X27-UV048、X27-UV045、X27-UV286配制成1.0×104mL-1的悬浮液,200 r·min-1振荡培养20 min,分散孢子,分成2组,一组经紫外光照射25 min(紫外灯功率15 W,距离为15 cm),另一组不经紫外光照射作为对照组,然后将100 μL孢子悬液滴在灭菌的载玻片上,再把含孢子悬液的载玻片放入铺有湿润滤纸的无菌培养皿中,在28 ℃恒温培养箱中培养,分别于12、24、36和48 h时观察100个尖角突脐孢菌分生孢子萌发的情况。萌发标准以芽管长度超过孢子短轴为标准。以上操作均在红光下完成,每个处理4次重复。
1.5.3 尖角突脐孢菌诱变株耐热性测定将X-27菌株和高致病力诱变株X27-UV148、X27-UV048、X27-UV045、X27-UV286配制成1.0×104mL-1的悬浮液,然后取孢子悬浮液100 μL滴在灭菌的载玻片上,再把含孢子悬液的载玻片放入铺有湿润滤纸的无菌培养皿中,分别于10、15、20、25、28、30、32、37和40 ℃的恒温培养箱中培养,于8 h时观察100个尖角突脐孢菌分生孢子萌发的情况。萌发标准以芽管长度超过孢子短轴为标准。每个处理4次重复。
1.6 尖角突脐孢菌诱变株的安全性试验研究
选择稗草发生地的主要作物,主要包括水稻、小麦、高粱、大豆、苦瓜、菜心、花生、玉米。2叶1心期的稗草幼苗为对照。水稻、小麦、高粱每盆各4株,大豆、苦瓜每盆各2株,菜心每盆10株,花生和玉米各 1株,稗草每盆6株。每种作物和稗草4次重复。
以上各种植物均留有4盆对照,且与其他植物分开摆放。对照植株喷0.05%无菌吐温-80水溶液,处理株喷1.0×106mL-1孢子悬液(同1.3.4节),喷药量均为100 mL·m-2。施药后置于28 ℃、湿度为80%的人工气候箱中保湿培养48 h,最后再移到室外正常生长。2周后观察、记录测试结果。按处理后植株叶片病害程度的差异将病害分级赋值。植株不同病害程度分级参照陈勇等[17]的分级标准。
1.7 诱变菌株X27-045的遗传稳定性
将X27-045转接到斜面培养基上,菌株生长3~4 d后将其再转接到新的PDA培养基上培养,作为第1代;重复上述步骤直到第10代,测定每代菌株4 d菌落直径和14 d产孢量。
1.8 数据统计与分析
试验数据采用SPSS 20.0软件和Excel 2016进行统计分析,试验结果经方差分析后进行Duncan’s多重比较检验差异(P<0.05),用Turkey法进行单因素方差分析(ANOVA)。
2 结果与分析
2.1 紫外光诱变的尖角突脐孢菌株
从图1和图2可以看出:随着诱变时间的增加,孢子在PDA平板上的菌落数逐渐减少,致死率逐渐增加,未经紫外光照射的菌株X27菌落最多;当紫外光照射时间为60 min时,PDA平板上的菌落最少,致死率接近100%;当紫外光照射时间为30 min时,PDA平板上的菌落及其致死率次之。当照射时间长时,致死率高(98.41%),在单位存活的菌株中负突变菌株较多,正突变菌株较少。照射时间短时,致死率低(49.40%~77.69%),在单位存活的菌株中虽然正突变菌株较多,但数量多,筛选较困难。综合考虑,选择致死率为82.07%~96.81%的诱变时间作为最佳诱变时间范围,即5~30 min。

图1 紫外光照射72 h后X27的菌落图

图2 紫外光诱变时间与致死率的关系
从图2可以看出,在最佳诱变时间范围内,紫外光照射时间为30 min时,孢子在PDA平板上形成菌落数最少,致死率为97.34%,存活菌株中为负突变菌株的比例较大,故不考虑30 min作为最佳诱变时间。紫外光照射时间分别为10、15、20 min时,诱变后孢子在PDA平板上的菌落数相近,且其致死率也无显著差异;紫外光照射时间为5 min时,相比于其他处理差异显著,且PDA平板上菌落数较多;紫外光照射时间为25 min时,虽然致死率为95.82%,存活菌株可能存在负突变,但是相对于其他处理差异显著,且PDA平板上菌落数适中,易于筛选。综上所述,选择尖角突脐孢菌的最佳诱变时间为25 min。
2.2 尖角突脐孢菌诱变株的筛选
2.2.1 诱变株产孢量在紫外光照射25 min后,共筛选出300株诱变菌株,编码为:X27-UV001—X27-UV300,并筛选出45株产孢量较菌株X27显著增加的诱变株(表1)。

表1 菌株X27与诱变菌株14 d产孢量比较

续表1 Table 1 continued
2.2.2 稗草离体叶片法测定诱变株的致病力将300个诱变株侵染离体稗草叶片后,测定病斑直径,筛选出56株致病力较菌株X27显著增加的诱变株(表2)。
从表1和表2可知:产孢量和致病力均高于原始菌株X27的诱变株共有19株,分别为X27-UV020、X27-UV039、X27-UV040、X27-UV041、X27-UV042、X27-UV045、X27-UV050、X27-UV086、X27-UV098、X27-UV114、X27-UV184、X27-UV215、X27-UV247、X27-UV248、X27-UV250、X27-UV281、X27-UV284、X27-UV286、X27-UV290。

表2 菌株X27与诱变菌株对稗草致病力比较
2.2.3 诱变株产孢量和致病力综合聚类分析从图3可知:第Ⅰ类群有47个诱变株,第Ⅱ类群有11个诱变株,第Ⅲ类群有24个诱变株。进一步分析发现,产孢量高且致病力强的诱变株有17株,均分布于第Ⅰ类群中,仅有2株分布于第Ⅲ类群中,其他诱变菌株则属于产孢量高或致病力强的菌株。

图3 尖角突脐孢菌不同诱变株以产孢量和致病力观测值为指标的系统聚类(D2=10.0)
2.2.4 诱变株活体的侵染致病力从第Ⅰ类群中选出17株诱变菌株,然后从第Ⅱ、Ⅲ类群中分别选出 5株诱变菌株,最终作为侵染活体稗草的试验材料,并调查致病力。室内活体稗草致病性结果(表3)表明,X27经过诱变后对稗草的致病性明显加强。高致病力诱变菌株X27-UV148、X27-UV048、X27-UV045、X27-UV286的致病力较X27(CK)高(P<0.05),其他诱变菌株致病力与X27(CK)差异不显著。4株高致病力菌株对稗草的防治效果见图4。

图4 原始菌株与诱变菌株对稗草的防治效果(14 d)

表3 诱变菌株与菌株X27对活体稗草的致病性(室内测定)
2.3 诱变株ITS-PCR扩增
以ITS1和ITS4为引物,PCR扩增出1条约为600 bp的特异性条带(图5)。将纯化、回收的特异性条带进行测序,所得的序列与GenBank数据库中尖角突脐孢菌的ITS序列(登录号为DQ337380)比对,相似性高达98%,可以确定筛选出的4个诱变株均为尖角突脐孢菌。

图5 诱变菌株和菌株X27的ITS序列扩增片段电泳图
2.4 尖角突脐孢菌诱变株的生物学特性
2.4.1 菌落的形态特征与菌落直径从图6可知:在28 ℃、PDA培养条件下,随着培养时间的推移,菌株X27和诱变株X27-UV286、X27-UV045、X27-UV048、X27-UV148菌落直径不断增加。培养3、5、7、9和11 d时,诱变菌株X27-UV286、X27-UV045、X27-UV048、X27-UV148与菌株X27的菌落直径差异均不显著;从菌落形态上看,诱变菌株与菌株X27的菌落形态大体相同(图7)。

图6 诱变菌株和菌株X27菌落直径

图7 诱变菌株与对照菌株在28 ℃培养3 d时的菌落形态
2.4.2 尖角突脐孢菌诱变株的耐热性从图8可知:将菌株X27和诱变株X27-UV148、X27-UV048、X27-UV045、X27-UV286分别于10、15、20、25、28、30、32、37和40 ℃培养箱中培养,各菌株的孢子萌发率均在30 ℃时达最高,40 ℃时各菌株孢子萌发率均最低。在10、15、20、25、28、32、37和40 ℃培养,菌株X27和诱变株 X27-UV148 的孢子萌发率差异不显著。在10、20 ℃培养,菌株X27孢子萌发率显著低于诱变株X27-UV048。在10 ℃培养,菌株X27诱变株孢子萌发率显著低于X27-UV045。在10、20、37 ℃培养,菌株X27孢子萌发率显著低于诱变株 X27-UV286。表明紫外光照射菌株的耐热性发生了改变。相对于菌株X27来说,诱变株X27-UV148、X27-UV286对低温、高温的耐受能力均增强;X27-UV048、X27-UV045对低温耐受能力增强。

图8 不同温度下菌株X27和诱变菌株孢子萌发率
2.4.3 尖角突脐孢菌诱变株对紫外光的耐受力经紫外光照射25 min后,UV-X27菌株的孢子萌发率显著降低,而诱变株REX27-UV148和X27-UV148、REX27-UV048和X27-UV048、REX27-UV045和X27-UV045、REX27-UV286和X27-UV286的孢子萌发率差异均不显著,表明诱变株REX27-UV148、REX27-UV048、REX27-UV045、REX27-UV286的抗紫外光能力明显增强(图9)。

图9 不同培养时间菌株X27和诱变菌株紫外光照射25 min的孢子萌发率
2.5 尖角突脐孢菌诱变株的安全性
从表4可以看出:在供试的8种作物中,高粱对尖角突脐孢菌敏感,初期叶片上出现斑点,2周后病斑并没有扩大趋势,被侵染的高粱能恢复生长。其他7种作物对尖角突脐孢菌不敏感。处理后的2叶期稗草,植株枯萎死亡,说明尖角突脐孢菌的寄主范围相对专一。
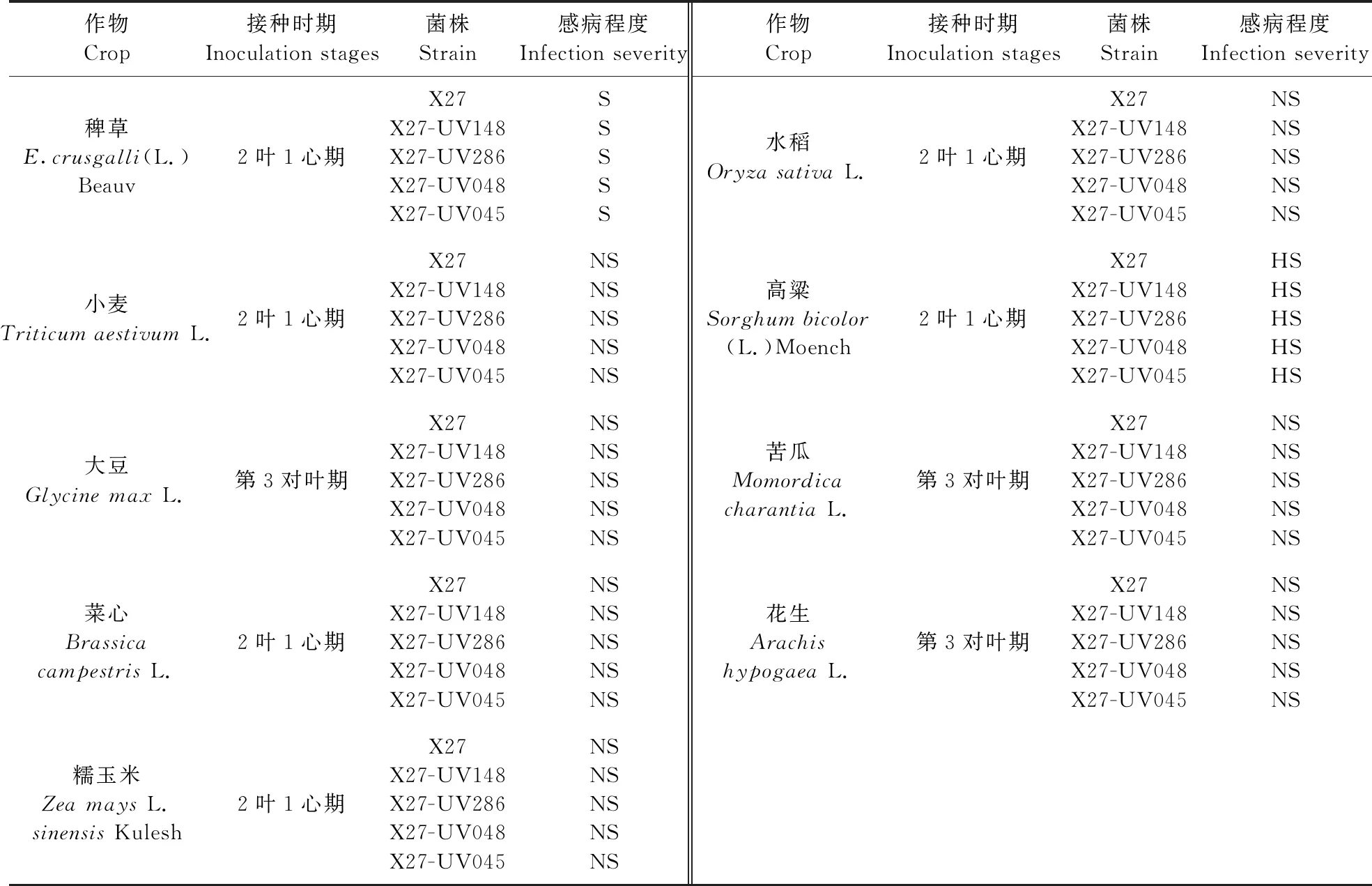
表4 高致病力诱变菌株对作物室内安全性测定
2.6 诱变菌株X27-UV045的遗传稳定性
从表5可知:诱变菌株X27-UV045连续10代培养后,第10代与第1代培养3 d的菌落直径差异不显著,每代菌株菌落直径基本稳定,均值为2.30 cm;第10代与第1代菌株培养14 d的分生孢子产量无显著差异,各代孢子产量保持稳定,产孢量均值为3.54×106mL-1。菌株X27-UV0450经过10代传代培养后,菌丝生长速率无明显下降,分生孢子产量没有出现退化。表明诱变菌株X27-UV045具有很好的遗传稳定性。

表5 诱变菌株X27-UV045连续10次的传代培养
3 讨论
在筛选诱变菌株时,主要考虑的因素是筛选使目标生物死亡率为50%左右的菌株,这可以在很大程度上得到正向突变的菌株[18]。本研究中,在设定最佳诱变时间范围时,以间隔大的时间段和菌株的死亡率来确定。试验结果显示,在紫外光照射60 min后,菌株死亡率接近100%,菌株负突变比较大,不利于筛选;当紫外光照射时间为1、3、5 min时,存活菌株较多,不易筛选,故最佳诱变时间为5~30 min。采用确定最佳诱变时间范围的方法,以5~30 min为最佳诱变时间。当紫外光诱变菌株的死亡率为95%时,可作为筛选的依据[19-21]。因此可以确定本次诱变的最佳时间为25 min。
菌株的优良可以以产孢量和病情指数来判断[22-23]。本研究以室内产孢量、离体稗草叶片病斑测定以及活体稗草病情指数测定结果作为筛选依据,最终从300个诱变菌株中,筛选出4株对稗草有强致病力的菌株,分别为X27-UV148、X27-UV286、X27-UV048、X27-UV045。筛选出的菌株病情指数显著高于对照菌株X27,要想利用诱变株开发成稗草生防制剂,还需要对诱变株进行亲缘关系的测定,鉴定诱变后的优势菌株和菌株X27是同属种的尖角突脐孢菌,确保生防制剂的有效活性成分能起特异性作用。ITS(内转录间隔区)是真菌rRNA基因非转录区的一部分,为高度可变区,进化速度较快,在真菌的属间和种间变异丰富,真菌属、种鉴定通常对该序列进行测序[24]。ITS介于18S rDNA、5.8S rDNA和28S rDNA之间,其在亲缘关系近的物种之间长度差异不大,而且序列在进化过程中速度较快,因此被应用于真菌系统分类及发育的研究[25-26]。在本研究中,4个诱变株和菌株X27的分子鉴定结果表明,菌株ITS序列的长度约 600 bp,菌株之间相似度为98%,由此可以确定筛选出的4个诱变株均为尖角突脐孢菌。
真菌除草制剂是由活的孢子和活菌丝发挥作用,其常常受到各种非生物胁迫的阻碍,主要包括相对湿度、紫外光照射以及高温[27-28]。筛选出的X27-UV148、X27-UV286、X27-UV048、X27-UV045诱变株产孢量、孢子萌发率都比菌株X27要高,在PDA培养基上,诱变株X27-UV148、X27-UV286、X27-UV048、X27-UV045 和菌株X27的菌落差异不显著,说明紫外光并不会对诱变株的菌落直径以及菌落形态造成影响。
开发植物病原体作为微生物除草剂,大都是利用它们的专性寄生的特性,在应用时首先应该考虑的是对农作物不致病[29]。本研究中,从对8种作物安全性测试的结果看,诱变后的尖角突脐孢菌与菌株X27均寄主单一,对其中7种作物均安全,对高粱仅仅是轻微侵染,这一结果和陈勇等[17]测定尖角突脐孢菌安全性的试验结果相同,但是对于玉米的结果却相反,可能是因为玉米品种或玉米叶片蜡质的原因而导致的,具体原因还需要进一步研究。
微生物菌株的遗传稳定性在实际生产中非常重要,诱变菌株在传代生产时可能伴随突变或者退化的现象,从而导致已筛选出的诱变菌株出现性能衰退,因此有必要对诱变菌株进行连续的传代培养,以观察其遗传稳定性[30]。本试验对X27-UV045进行10代的传代培养,每1代的菌落直径、产孢量基本保持稳定,说明诱变获得的菌株X27-UV045具有良好的遗传稳定性。
综上所述,4株诱变菌株具有开发为微生物生防制剂的潜力,相比原始菌株,更适合大规模工业化生产。然而本试验仍有不足之处:诱变菌株室外稗草防效是否与室内防效结果一样;原始菌株紫外光诱变后致病力提高的分子机制;开发适宜于尖角突脐孢菌的剂型应用于田间试验。
