老年帕金森病病人呼吸暂停低通气与认知损伤的相关性
2022-04-01朱骏张丽徐淑兰阎俊张娟朱颍陈曙
朱骏 张丽 徐淑兰 阎俊 张娟 朱颍 陈曙
PD是仅次于AD的第二常见神经变性疾病,老年人 PD 的患病率约为1%,全世界大概500万人患PD[1]。大约 90% 的 PD 病人会并发非运动症状(non-motor symptoms,NMS),主要包括神经精神症状、自主神经功能异常、睡眠障碍、感觉障碍等,这些症状可以发生在 PD的任何时期[2]。
呼吸暂停低通气综合征作为一种常见综合征,好发于老年人,通常会给老年病人的身心健康带来严重影响。既往有研究表明,呼吸暂停低通气与认知功能密切相关[3]。而认知障碍为帕金森病最常见的非运动症状之一。
然而目前呼吸暂停低通气与PD认知损伤的关系尚不明确,尤其是在老年病人中。本研究采用多导睡眠监测(PSG)及PD相关量表评估来探讨呼吸暂停低通气与老年PD病人认知功能的关系,现报道如下。
1 资料与方法
1.1 对象 本研究纳入2015年12月至 2020年8月在南京医科大学附属脑科医院帕金森病门诊就诊的 PD 病人425例,年龄60~78岁。纳入标准:根据国际运动障碍协会(MDS) 2015 年公布的修订版的诊断标准,所有入组 PD 病人均符合临床确诊型标准。排除标准:(1)帕金森综合征、遗传性帕金森综合征和帕金森叠加综合征;(2)严重构音障碍影响情感表达者;(3)患有恶性肿瘤、残疾及其他严重疾病;(4)患有其他精神疾病或者长期口服抗抑郁药、抗焦虑及改善认知等药物;(5)患有颅内疾病,包括:严重的脑梗死、中重度脑萎缩、颅内占位等;(6)甲状腺疾病,严重肝肾功能障碍等。所有病人均经两位以上神经专科医生确诊,并同意接受神经心理评估、PSG等。
1.2 研究方法
1.2.1 一般资料及量表评估:收集所有入组的研究对象的一般资料,包括年龄、性别、教育年限、病程等。采用汉密尔顿抑郁量表(HAMD)(24项版本)评价抑郁状况,此量表由焦虑/躯体化、体质量减轻、认知损伤、日夜变化、迟缓、睡眠障碍、绝望感7个部分组成。采用汉密尔顿焦虑量表(HAMA)(14项版本) 评价焦虑症状。采用MoCA评估认知功能,包括视空间与执行、命名、注意力、语言、抽象、延迟回忆、定向力,<26分为存在认知障碍[4]。采用 30 项非运动症状问卷(NMS-Quest) 评价病人非运动症状。采用帕金森病统一评分量表(Unified Parkinson’s disease Rating Scale, UPDRS)评估运动症状,采用Hoehn-Yahr(H-Y)分期对病人进行分级(1~5级),计算每日等效美多巴剂量(LED)[5]。
1.2.2 PSG:所有研究对象均在我院睡眠中心行夜间PSG,监测时间>8 h。监测内容包括脑电图(EEG)、眼电图(EOG)、下颏肌电(EMG)、心电图(ECG)、鼾声、口鼻气流(压力感受式和热敏感受式)、胸部运动和腹部运动、体位、双下肢肌电图及指端SpO2。呼吸暂停低通气综合征标准:轻度:睡眠呼吸暂停低通气指数(AHI)为5~15次/h;中度:AHI为15~30次/h; 重度:AHI>30次/h[6]。
2 结果
2.1 伴或不伴认知损伤病人临床资料及非运动症状比较 共182例PD 病人存在认知损伤 (42.8%)。伴及不伴认知障碍病人年龄、性别、BMI、PD病程、PD起病年龄、教育年限、UPDRS-Ⅲ评分、H-Y分期及LED差异均无统计学意义。伴认知损伤病人HAMA、NMS、HAMD 评分及焦虑/躯体化、体质量改变、认知损伤迟缓症状分项评分均较高,PDSS评分较低,提示伴认知损伤病人存在较重的非运动症状(P<0.05或P<0.01)。见表1。
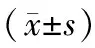
表1 一般人口学特征及临床资料比较
2.2 PSG睡眠参数比较 伴认知损伤病人睡眠效率下降,睡眠潜伏期延迟,一期睡眠比例升高,深睡眠比例下降,并且AHI指数明显增高,微觉醒指数明显增高,睡眠期平均血氧明显下降(P均<0.05)。见表2。
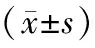
表2 各组间睡眠参数之间的比较
2.3 Logistic 回归分析 以是否伴有认知损伤为因变量,以2组间存在统计学差异的指标为自变量,分析PD病人认知损伤的影响因素。结果表明,较高的AHI指数为认知损伤的危险因素,较高的PDSS评分、睡眠效率及睡眠中平均血氧饱和度为认知功能的保护因素。见表3。

表3 多因素二元logistics回归分析结果
3 讨论
PD认知损伤为最常见的NMS之一,既往研究表明PD病人认知损伤发生率为10%~50%[7-9]。Pedersen等[10]一项纳入150例PD病人随访5年的研究显示,PD合并轻度认知障碍初始比例为20.2%,认知正常病人随访1年后,9.9%进展为轻度认知障碍,随访3年进展率为23.2%,随访5年进展率为28.9%,在5年随访期内有39.1%初始或后期发展为轻度认知障碍的病人进展为帕金森病痴呆。PD认知障碍发病机制目前尚未完全明确,除了α-Syn异常沉积,神经递质传递障碍在发病机制中也起到重要作用,如脑皮层、Meynert基底核乙酰胆碱能、中脑-皮层通路的多巴胺能及中缝核 5-羟色胺能等相关递质,分别影响病人视空间功能障碍、执行功能障碍及情绪障碍、幻觉等[11]。此外,遗传、炎症及线粒体损伤也与之相关[12-13]。本研究首次纳入≥60岁的老年PD病人为研究对象,其认知损伤的发生率为42.8%,与本课题组前期一项研究结果相符[14]。
PD病人认知障碍的危险因素不明确,既往的研究表明,高龄、较重的运动症状、文化水平低下及性别(女性)均与PD认知障碍相关。而本研究发现,PD认知损伤与年龄、性别、BMI、PD病程、PD起病年龄、教育年限、UPDRS-Ⅲ、H-Y分期、LED无明显相关性,可能与纳入的都是老年人有关,同时可能与认知评估方法差异有关。
既往研究表明,影响PD病人睡眠的NMS包括快速眼球运动睡眠期行为障碍、辨色障碍、自主神经功能障碍、抑郁、疲劳及焦虑是认知障碍的危险因素[15-16]。本研究同样表明,存在认知损伤的病人存在较重的NMS、抑郁症状、焦虑症状,但是抑郁及焦虑等并非为认知损伤的独立危险因素。
既往夜间睡眠与呼吸事件与PD认知的关联研究较少。本研究表明,高龄PD病人呼吸暂停发生率高达42.4%,且认知障碍病人发生率显著高于不伴认知障碍病人。PD病人AHI指数、睡眠期平均血氧饱和度为影响病人认知的独立危险因素。同样,较高的睡眠效率及睡眠评分为独立保护因素。上述结果表明,睡眠障碍,尤其是呼吸暂停低通气,与PD认知障碍密切相关。目前其机制尚不明确,可能为阻塞性呼吸暂停病人睡眠过程中存在反复的上呼吸道塌陷,导致大脑供氧反复减少,造成间歇性低氧血症,引起低灌注、内皮功能障碍、神经炎症及血脑屏障功能障碍,从而导致认知损伤。此外PSG提示呼吸暂停低通气可引起明显的夜间睡眠结构紊乱,表现为睡眠剥夺、睡眠片段化。碎片化睡眠与病人的注意力、记忆力障碍相关[17]。
本研究通过对 PD 病人认知障碍的发生率和一般情况进行分析,初步阐述了认知障碍的可能诱发因素,为今后深入研究PD病人认知障碍的发生提供参考。
