Hg2+ 调控氮磷共掺杂碳纳米点在半胱氨酸/同型半胱氨酸荧光检测中的应用
2022-04-01周小红余乐平
路 露 徐 律 张 鑫 周小红 余乐平
(1.无锡商业职业技术学院 汽车技术学院,江苏 无锡 214153;2.盐城工学院 材料科学与工程学院,江苏 盐城 224002)
1 引 言
半胱氨酸(Cys)作为一种代表性的小分子生物硫醇,可参与细胞内的许多氧化还原过程和肝脏内的磷脂代谢。Cys 具有保护肝细胞免受损伤、促进肝功能恢复的药理作用[1]。正常细胞间Cys 量在30~200 μmol/L 范围内[2]。生物体内Cys 的含量过多或过少都会增加疾病的发生几率,包括肝损伤、胱氨酸病、心血管疾病甚至癌症。同型半胱氨酸(Hcy)是另一种重要的含硫醇氨基酸,与Cys 相比,它多含一个亚甲基。Hcy 可直接或间接诱导血管内皮细胞损伤,引起血管平滑肌细胞增殖,影响低密度脂蛋白氧化,增强血小板功能,引起血栓形成。血清中正常Hcy 含量约为5~12 μmol/L[3]。如果浓度超出这个平衡范围,可能会发生动脉损伤、激素问题和血栓的形成[4]。由于Cys 和Hcy 不可或缺的作用,制备灵敏、简单且廉价的探针来准确测定生物系统中的Cys/Hcy 至关重要。
迄今为止,已有大量分析仪器,包括高效液相色谱、毛细管电泳、比色荧光法等被报道用于Cys检测[5-7]。其中,荧光法因其操作快捷、无创、灵敏度高而被广泛选用。近年来,贵金属纳米团簇、有机分子化合物和半导体量子点已被广泛研究用于Cys 检测[8-10]。但一些探针由于其生物毒性差、溶解度不理想以及对细胞膜的渗透性低等并不适用于细胞内Cys 检测。此外,有机探针通常涉及繁琐的合成程序。而“信号关闭”型传感器往往会限制灵敏度。因此,迫切需要开发一种用于Cys/Hcy 检测的、具有可忽略不计细胞毒性的环保型传感器。
光致发光碳基纳米点(CDs)由于其独特的光学性质、超低细胞毒性、优异的光稳定性、绿色和简便的合成路线而受到广泛关注[11-12]。但单一的碳纳米点往往荧光量子产率不高,且在干扰离子共存过程中对特定目标离子的选择性较差,不利于实际应用。众所周知,用杂原子掺杂CDs 可能对物理化学性质产生重大影响,例如,电子分布、表面悬键和化学反应性[13]。CDs 骨架中丰富的N 含量与高荧光量子产率有关。N 和P 都具有5 个价电子和类似的原子结构,更容易与C 原子键合。因此,N、P掺杂的碳量子点具有更加优异的光学性质。通常用作N、P掺杂的前驱体主要有三溴化磷、磷酸一钠、磷酸、柠檬酸、尿素、多巴胺和邻苯二胺等,然而它们存在掺杂量低、合成工艺复杂、灵敏度低和光稳定性低等问题,限制了它们的实际应用[14]。而叶酸(FA)和N-(膦酰基甲基)亚氨基二乙酸(PMIDA)无毒性,对环境友好,且FA 的富氮分子结构为提高N 的掺杂量提供了更多机会,PMIDA 分子中的羧基和磷酸基团很容易与FA 反应,而且PMIDA 的支链结构可能有利于碳化过程中碳骨架的形成。此外,FA 对癌细胞上的叶酸受体(FR)具有良好的亲和力,具有很好的生物相容性。因此,FA 和PMIDA 作为N/P掺杂前驱体,可获得高荧光量子产率、低细胞毒性和高细胞渗透性的N/P掺杂碳点,进而在Cys/Hcy 的荧光检测中发挥重要作用。
鉴于此,本文采用叶酸(FA)和N-(膦酰基甲基)亚氨基二乙酸(PMIDA),通过简便且环保的水热法制备新型N、P 共掺杂碳纳米点(N,PCDs),详细探讨了该碳纳米点的元素组成、表面官能团和光学性质,并在不同条件下进行Cys 和Hcy 测定。此外,该体系已成功应用于BEL7402细胞和尿液样本中的Cys 识别,通过细胞成像实验探索了N,P-CDs 对于活细胞内的Cys 的识别能力,获得了满意的实验结果,并探讨了可能的传感机理。
2 实 验
2.1 药品和仪器
FA(≥99.0%)、PMIDA(≥98.5%)和3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)购买于Sigma-Aldrich。Hg(NO3)2·H2O、Cys、Hcy 和其他氨基酸(Gly、Ser、Val、Glu、His、Lys、Tyr 等)购买于国药化学试剂有限公司。人肝癌细胞BEL 7402 来自中国科学院典型培养物保藏中心。含有青霉素和链霉素的细胞培养基(RPMI-1640)、生理PBS(pH =7.4)购自KeyGEN生物科技有限公司。胎牛血清(FBS)和胰蛋白酶购自碧瑶生物科技有限公司。
样品的透射电镜(TEM)照片采用JEM-2100F型号设备测定;样品的X 射线衍射光谱(XRD)采用Bruker D8 型号设备测定;样品的傅里叶红外变换光谱(FT-IR)采用Nicolet 5700 型号设备测定;样品的拉曼光谱采用赛默飞公司设备测定,激发波长为532 nm;样品的X 射线光电子能谱(XPS)采ESCALAB 250 型号设备测定;样品的紫外-可见吸收光谱(UV-Vis)和荧光光谱(FL)采用UV-2450 和F-7000 型号设备测定;样品的荧光寿命和绝对荧光量子产率(PLQY)由FluoroLog3-TSCPC 型号设备测定;样品的MTT 测定使用Multiskan GO 微孔板分光光度计(Thermo Fisher Scientific)进行;样品的共聚焦荧光图像由LSM 800(ZEISS)设备记录。
2.2 样品制备
将0.103 g FA 和0.075 g PMIDA 溶解在15 mL 水中以形成均匀的溶液。之后,将前体溶液移入25 mL 高压反应釜中,然后在180 ℃下加热2 h。冷却后,将上清液以8 000 r/min 的速度离心20 min,使用去离子水进行透析(1000 u MWCO)24 h 以进行纯化。60 ℃下真空干燥得到表征用固体产物。
2.3 实验条件优化
在合成过程中,优化了FA 和PMIDA 的质量比(2∶1~2∶3)和反应时间(1~6 h)以获得最佳光致发光效率。在测定过程中,在定量检测前优化了激发波长(330~420 nm)和pH(3~12)。N,P-CDs 溶液用水或相应的缓冲液稀释10 倍,然后加入微型比色皿中以测量荧光发射光谱。光电倍增管电压为500 V,狭缝宽度为5 nm。
2.4 Hg2+和Cys/Hcy 测定
在测定过程中,将100 μL N,P-CDs 溶液(1.5 mg/mL)和50 μL 磷酸盐缓冲液加入离心管中,然后吸取不同浓度的Hg2+溶液,最终体积控制在500 μL。在370 nm 激发下测试溶液的荧光发射光谱。Cys/Hcy 检测:将100 μLN,P-CDs 溶液、50 μL 缓冲液和100 μL Hg2+溶液(625 μmol/L)加入离心管中,然后加入不同浓度的Cys/Hcy 溶液,加入去离子水,最终体积控制在500 μL,进行FL测定。在选择性研究中,将100 μL N,P-CDs 溶液、50 μL 缓冲液、100 μL Hg2+(625 μmol/L)、其他干扰氨基酸(5 mmol/L)和适当的水混合均匀。通过计算F/F0值,评估了N,P-CDs 对Cys/Hcy的敏感性和选择性。
2.5 真实样品测定
采用标准添加方法,以自来水和尿液为真实样品。将不同Hg2+含量(2,10,50 μmol/L)添加到去离子水中,并且在添加前后测量FL,根据线性方程评估个体浓度。对尿样中的Cys(100 nmol/L、60 μmol/L、100 μmol/L)进行了类似的程序以评估回收率。
2.6 细胞毒性试验
将BEL 7402 细胞转移到96 孔板中。每个孔包含大约5×103个细胞。将细胞用RPMI-1640培养基和10% FBS 培养24 h 以实现细胞贴壁生长。然后每个孔用PBS 冲洗3 次,并加入新制备的培养基,其中包含不同浓度(0~400 μg/mL)的N,P-CDs。孵育一天后,冲洗孔并单独加入含有600 μg/mL MTT 的新鲜培养基。培养4 h 后,用100 μL DMSO 代替原MTT 溶液,振荡10 min,然后用微孔板分光光度计记录570 nm 处的吸光度。细胞活力根据如下公式计算:
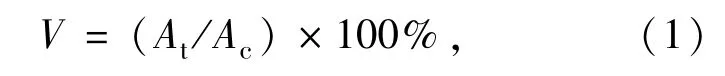
其中,V代表细胞活力,At为经N,P-CDs 处理后细胞的吸光度,Ac为对照细胞的吸光度。
2.7 细胞成像
将BEL 7402 细胞加入共聚焦培养皿中,培养24 h 以实现贴壁生长。然后丢弃漂浮的细胞,用PBS 冲洗粘附的细胞。随后,补充N,P-CDs (150 μg/mL)并再孵育30 min。去除多余的N,PCDs,再次冲洗培养皿,用共聚焦激光扫描显微镜记录细胞图像,再将N,P-CDs 处理的细胞加入Hg2+(125 μmol/L)中10 min,冲洗并拍照。对于Cys 识别体系,将N,P-CDs/Hg2+加载的细胞与外源性Cys(150 μmol/L)孵育30 min。
3 结果与讨论
3.1 材料选择与实验优化
选择FA 和PMIDA 作为前体主要基于以下因素:(1)FA 和PMIDA 都没有毒性,这确保了合成过程对环境友好。(2)将N、P 杂原子掺杂到CDs 的骨架中可以带来大量的活性位点,从而带来更高的量子产率[15]。FA 的富氮分子结构为提高N 的掺杂量提供了更多机会,无论是边缘的氨基形式还是碳框架内的杂芳环形式。(3)FA对癌细胞上的叶酸受体(FR)具有良好的亲和力,可以被内化到细胞中。CDs 骨架中的FA 片段可能有利于活细胞中的进一步FL 检测。(4)作为另一种电子供体,P 元素通常与N 结合制备CDs,以促进电子离域用作传感位点。此外,PMIDA 分子中的羧基和磷酸基团很容易与FA 反应,而且PMIDA 的支链结构可能有利于碳化过程中碳骨架的形成。为了获得最佳的荧光性能,我们对反应前驱体的质量比和反应时间进行了优化,如图1 所示。结果表明,N,P-CDs 制备的最佳质量比为4∶3,最佳反应时间为2 h。

图1 前驱体质量比(a)和反应时间(b)对N,P-CDs 荧光强度(λex =370 nm,λem =446 nm)的影响Fig.1 Influence of mass ratio of precursor(a) and reaction time(b) on the FL intensity of N,P-CDs(λex =370 nm, λem =446 nm)
3.2 N,P-CDs 表征
图2(a)为样品N,P-CDs 的TEM 照片,从图中可以看出,碳点均匀地分散在支持膜上,形状接近圆形,直径约为5 nm。插图为N,P-CDs 的粒径分布图,从图中可知N,P-CDs 的粒径呈现正态分布,其平均直径为(4.3 ± 1.3) nm。从样品的EDS 光谱(图2(b))中可以看出,位于0.27,0.40,0.52,2.02 eV 的特征峰分别对应于碳、氮、氧和磷元素。图2(c)为元素含量结果图,值得注意的是氮的原子百分比为10.0%,高于其他相关文献报道的CDs[16-17],磷的原子百分比为1.12%。样品的XRD 谱图(图2(d))显示在22.8°处出现较宽衍射峰,表明碳点的形成[18]。
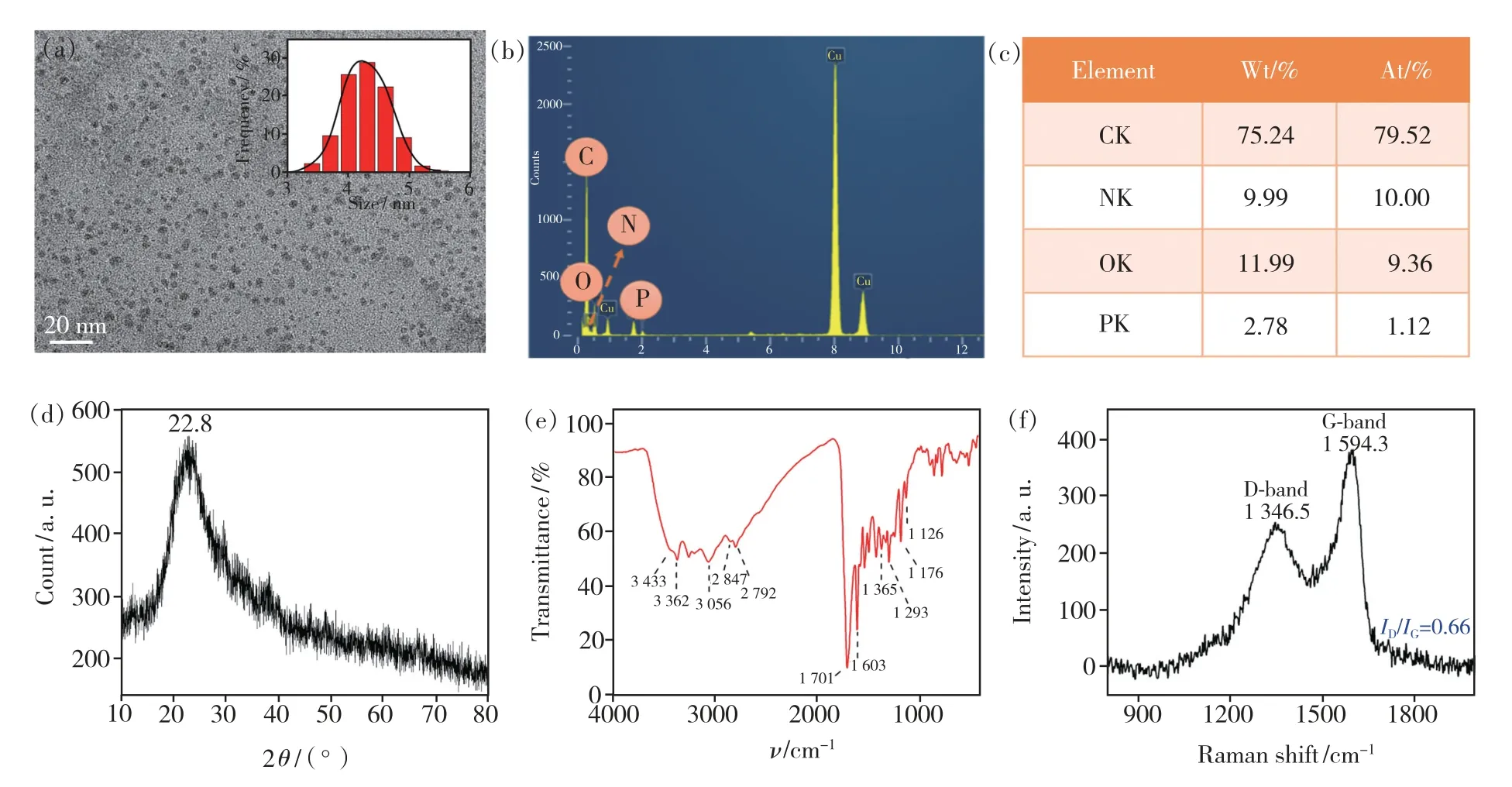
图2 N,P-CDs 的TEM(a)、EDS(b)、元素含量(c)、XRD(d)、FT-IR(e)和拉曼光谱(f)。(a)中插图为N,P-CDs 粒径分布图。Fig.2 TEM(a),EDS(b),elemental content(c),XRD(d),FT-IR(e) and Raman spectrum(f) of N,P-CD.The inset of Fig.2(a) is the size distribution of N,P-CDs.
为了进一步研究样品的化学键和官能团,进行了红外和拉曼表征。如图2(e)所示,位于3 433,3 362,3 056 cm-1处的3 个吸收峰分别对应于O—H、N—H 和Ar—H 的不对称伸缩振动;位于2 827 cm-1和2 792 cm-1处的相邻峰与—CH2—和—CHO—(C—H)的振动有关;位于1 701 cm-1和1 603 cm-1处的两个尖锐而强烈的峰与—C==O 和C==N 的伸缩振动一致;位于1 365,1 293,1 176,1126 cm-1的4 个峰与C—N、C—O、P==O和P—O 的振动相关[19]。这些结果表明,除了如羟基、氨基和其他共轭基团这些大多数CDs 中常见的化学基团外,本文所制备样品中有磷酸基团的存在。拉曼光谱用于检测分析N,P-CDs 的骨架结构。如图2(f)所示,位于1 346 cm-1和1 594 cm-1的两个特征吸收带,前者属于D 带,后者属于G 带,分别对应于sp3杂化碳原子和面内sp2杂化碳原子。另外,ID/IG比值为0.66,证实样品中存在大量由碳化过程和氮、磷掺杂引起的悬空键。
XPS 表征用于分析N,P-CDs 化学组成与元素价态。图3(a)为C 1s 的XPS 光谱,位于284.4,285.1,286.1,288.2 eV 处存在4 个拟合成峰,分别对应于C—C/C==C、C—N/C—P、C—O 和C==O/C==N,这意味着主要的共轭结构为芳环和杂原子环以及表面的不饱和基团等[20]。图3(b)为N 1s 的XPS 光谱,图中显示了三种氮组成:吡啶N、吡咯N 和N—H,进一步证实了氨基和酰胺基团分散在表面。图3(c)为O 1s 的XPS 光谱,位于531.3,532.7,534.0,535.2 eV 处的特征吸收峰分别对应于C==O、C—OH/P—OH、P==O 和C—O—C 中的O[21]。图3(d)为P 2p 的XPS 光谱,两个特征吸收峰对应于P—C 和P—O,进一步表明了磷、磷酸盐和亚磷酸的掺杂形式[22]。
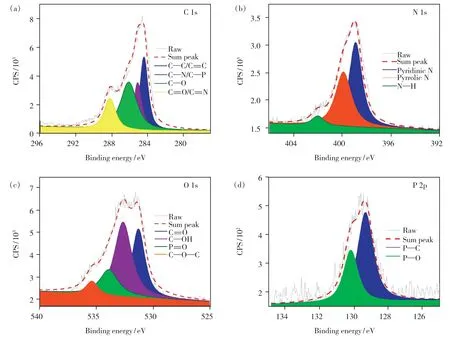
图3 N,P-CDs 的C 1s(a)、N 1s(b)、O 1s(c)和P 2p(d)XPS 光谱。Fig.3 C 1s(a),N 1s(b),O 1s(c) and P 2p(d) XPS spectra of N,P-CDs.
3.3 N,P-CDs 光学性质
图4(a)为N,P-CDs 的UV-Vis 吸收光谱,最大吸收波长位于370 nm 处,在日光下显示淡黄色,在370 nm 紫外光激发下,溶液发出一束蓝光(如图4(a)插图所示),最大吸收波长为446 nm,绝对FL 量子产率为23.64%。图4(b)为330~420 nm 不同激发波长下的FL 性能结果图。如图4(b)所示,当溶液在370 nm 光源下激发时,最大发射波长位于446 nm,该波长被选为最佳测量波长。这种依赖于激发的行为与之前报道的光致发光碳点相似[17]。图4(c)~(e)为pH、盐浓度和储存时间对最大发射波长下FL强度的影响。如图4(c)所示,FL 强度在pH 值为5~10 中保持稳定。在极酸性和碱性环境下强度较低,主要是由于悬空键会受到质子化/去质子化过程的影响。从图4(d)可知,即使NaCl浓度高达200 μmol/L 时,FL 强度仍保持不变,表明样品具有优异的耐盐性。图4(e)表明样品储存30 d 后,FL 强度仅下降了5.8%,显示出优异的稳定性。

图4 (a)N,P-CDs 在370 nm 激发下的UV-Vis(曲线a)和荧光发射(曲线b)光谱,插图为日光和370 nm 激发下的水溶液;(b)不同激发波长下的荧光发射光谱;pH(c)、离子强度(d)和储存时间(e)对N,P-CDs 在446 nm(λex =370 nm)的FL 强度的影响(激发和发射狭缝宽度均设置为5 nm)。Fig.4 (a)UV-Vis(curve a) and fluorescence emission(curve b) spectra of N,P-CDs under 370 nm excitation,insets:aqueous solution under daylight and excitation of 370 nm.(b)Fluorescence emission spectra under different excitation wavelengths.Effects of pH(c),ionic strength(d) and storage time(e) on FL intensity of N,P-CDs at 446 nm(λex =370 nm).Both excitation and emission slit widths were set at 5 nm.
3.4 Cys 和Hcy 的FL 检测
图5(a)为N,P-CDs(曲线a)和添加Hg2+(曲线b)、半胱氨酸(曲线c)或同型半胱氨酸(曲线d)的FL 光谱。在暴露于Hg2+后FL 急剧下降,在加入Cys 或Hcy 后,FL 发射从6.2%分别恢复到90.2% 和80.4%,插图为相应的FL照片。随后,通过添加不同浓度的Hg2+来评估检测性能。从图5(b)可以看出,当添加的Hg2+浓度增加到125 μmol/L 时,FL 逐渐猝灭,并且在很宽的范围内(0.05~125 μmol/L)建立了线性关系(图5(b)的插图)。根据3σ/k计算,检测限为20 nmol/L。如表1 所示,与其他Hg2+的FL 探针相比,该检测性能具有较为明显的竞争力。如图5(c)及其插图所示,当在N,P-CDs/Hg2+复合溶液(0~200 μmol/L)中加入适量Cys 时,FL 相应升高,Cys 浓度和F/F0在很宽的范围内也获得了良好的线性关系(0.1~150 μmol/L,F0代表初始FL 强度)。经计算,其检测限为30 nmol/L,如表2 所示,与其他Cys 探针相比,显示出相对出色的检测能力。Hcy 具有与Cys 相似的分子结构,仅亚甲基不同。如图5(d)所示,该纳米探针也具有很好的灵敏度识别该分子(线性范围:0.1~100 μmol/L,检测限:50 nmol/L)。

表1 各种Hg2+荧光探针的比较Tab.1 Comparison of various Hg2+fluorescent probes

表2 不同Cys 探针的比较Tab.2 Comparison of different Cys probes

图5 (a)N,P-CDs(曲线a)和添加Hg2+(曲线b)、半胱氨酸(曲线c)或同型半胱氨酸(曲线d)的FL 光谱,插图为对应的FL 照片;(b)N,P-CDs 的FL 光谱;Hg2+浓度增加时,N,P-CDs/Hg2+与不同浓度的半胱氨酸(c)和同型半胱氨酸(d)。 λex =370 nm,激发/发射狭缝宽度为5 nm。Fig.5 (a)FL spectra of N,P-CDs(curve a) with successive addition of Hg2+(curve b),cysteine(curve c) or homocysteine(curve d).Insets:corresponding FL photographs.(b)FL spectra of N,P-CDs with increasing concentrations of Hg2+.N,P-CDs/Hg2+with different concentrations of cysteine(c) and homocysteine(d). λex =370 nm,excitation/emission slit width is 5 nm.
3.5 可能的传感机理
为了进一步探究传感机理,针对Hg2+加入和不加入的情况,探究了N,P-CDs 的FL 衰减和FL寿命,结果如图6(a)~(b)所示。时间分辨谱使用双指数函数拟合,N,P-CDs 的平均寿命为9.96 ns,而N,P-CDs/Hg2+复合溶液的平均寿命为12.46 ns。两个时间分辨衰变寿命τ1和τ2的贡献分数显示在图6(b)中。FL 寿命的差异意味着Hg2+引发N,P-CDs 的荧光猝灭可能更倾向于遵循动态猝灭机制[38-39]。鉴于此,我们推测了可能的传感机理,图6(c)为本文所制备N,P-CDs 的制备过程及传感机理图。本文以FA 和PMIDA 为原料制备了N,P-CDs。由于Hg2+与N,P-CDs 表面的活性基团结合,处于激发态的N,P-CDs 通过电荷转移将电子给了Hg2+,使N,P-CDs 的荧光猝灭[40-41]。而当体系中加入半胱氨酸/同型半胱氨酸(Cys/Hcy)时,由于Hg2+和硫醇基团之间更强的相互作用,诱导了Hg2+离子的释放,因此荧光猝灭的N,P-CDs/Hg2+体系显示出off-on 趋势。这种“开-关-开”过程中的形态变化可通过TEM来进行分析,结果如图7 所示。与N,P-CDs 的良好分散状态(图7(a))相比,N,P-CDs/Hg2+系统表现出聚集状态(图7(b))。然而,当将Cys 添加到该系统中时,形态又恢复到良好的分散状态(图7(c)),与上述推测的机理一致。

图6 (a)FL 衰减(黑点:N,P-CDs,红点:N,P-CDs/Hg2+);(b)N,P-CDs 中加入和没加入Hg2+的FL 寿命;(c)N,P-CDs制备过程及对Hg2+和Cys/Hcy 的传感特性示意图。Fig.6 (a)FL decay(black dots:N,P-CDs,red dots:N,P-CDs/ Hg2+).(b)FL lifetime of N,P-CDs with or without Hg2+.(c)Schematic diagram of the preparation process of N,P-CDs and sensing property towards Hg2+and Cys/Hcy.
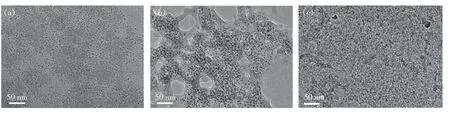
图7 N,P-CDs(a)、N,P-CDs/Hg2+(b)和N,P-CDs/Hg2+-Cys(c)的TEM 照片。Fig.7 TEM of N,P-CDs(a),N,P-CDs/Hg2+(b) and N,P-CDs/Hg2+-Cys(c).
3.6 选择性研究
Cys/Hcy 的选择性是通过比较Cys/Hcy(100 μmol/L)与其他干扰氨基酸的FL 性能来评估的(5 mmol/L)。结果如图8 所示,从图中可以发现只有Cys 和Hcy 可以恢复N,P-CDs/Hg2+的FL强度,其他氨基酸不会触发FL 增强。主要是源于Cys/Hcy 具有—SH,与荧光猝灭的N,P-CDs/Hg2+中的Hg2+有更强的相互作用,进而恢复荧光,因此可选择性的实现对Cys/Hcy 的灵敏测定,而对所述其他干扰氨基酸并不响应。这些结果可满足体外测定和实际应用的选择性要求。
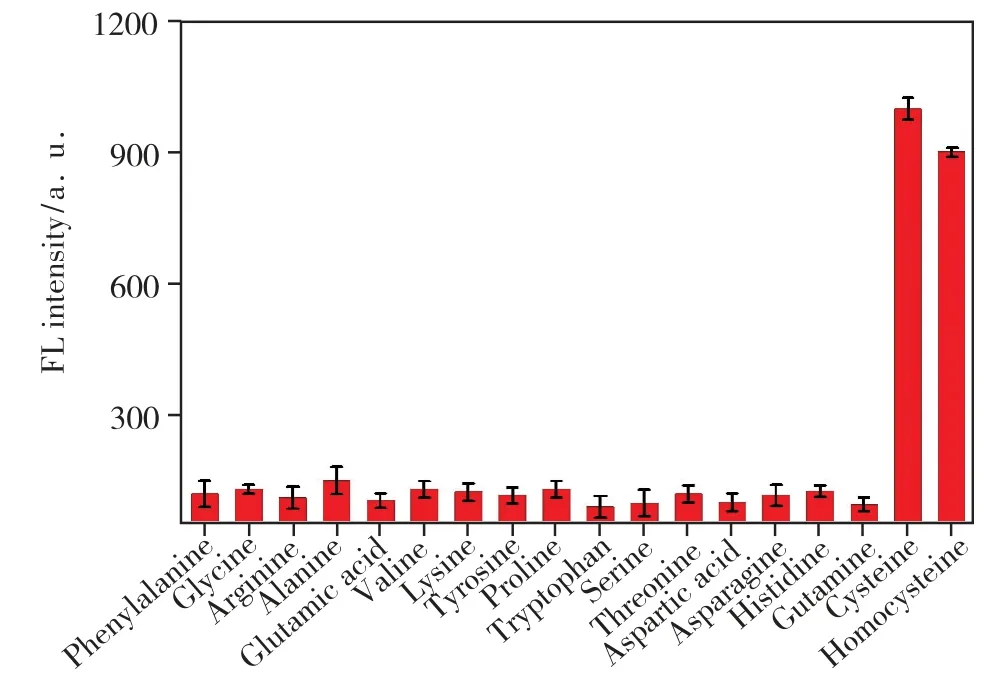
图8 N,P-CDs 对Cys/Hcy 及其他样品选择性研究结果图Fig.8 Selectivity of N,P-CDs for Cys/Hcy over other species
3.7 真实样品
鉴于实际应用的需求,本文采用自来水和尿液验证实际样品中N,P-CDs 检测Hg2+和Cys的可行性,并采用加标法计算回收率。如表3 所示,Hg2+测定的回收率在96.69%~104.50%范围内,测量RSD 低于4.36%。如表4 所示,尿液中Cys 的测定回收率在96.81%~104.61%之间,RSD 低于5.39%。这些结果表明基质可能的干扰可以忽略不计,具有较为广阔的实际应用潜力。

表3 自来水中Hg2+的测定Tab.3 Determination of Hg2+in tap water

表4 尿样中Cys 的测定Tab.4 Determination of Cys in urine sample
3.8 N,P-CDs 的细胞毒性
由于细胞成像具有敏感的传感特性,有望用于N,P-CDs 的Cys 测定。为此我们进行了MTT 测试以分析不同剂量N,P-CDs 下BEL 7402 的存活率。如图9 所示,随着N,P-CDs 浓度的增加,细胞活力虽呈下降趋势,但即使添加的N,P-CDs 浓度高达150 μg/mL 时,BEL 7402 的存活率仍保持在80.4%,因此,选择该浓度用于随后在BEL 7402 细胞中的FL 测定。

图9 BEL 7402 细胞在不同浓度的N,P-CDs 下孵育24 h的存活率Fig.9 Viability of BEL 7402 cells after incubation with different concentrations of N,P-CDs for 24 h
3.9 细胞成像
如图10 所示,在与N,P-CDs 孵育30 min 后,可以在明场中观察到梭形细胞。基于上述“激发依赖”行为,细胞在不同的激发下发出蓝光、绿光和红光。叠加图像显示,这些FL 发射位于细胞中,表明N,P-CDs 已内化到细胞中。随后,细胞用Hg2+(125 μmol/L)处理,FL 在短时间内(10 min)猝灭。与外源性Cys(150 μmol/L)再孵育30 min 后,FL 再次恢复。这些结果证实N,P-CDs 能够感知活细胞中的Cys。
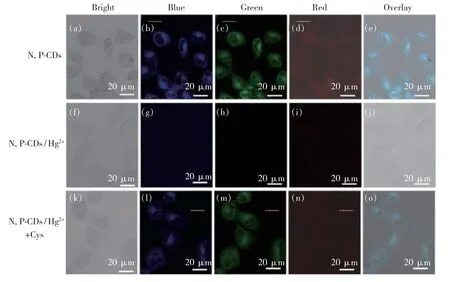
图10 (a)~(e)N,P-CDs 处理的BEL 7402 细胞的共聚焦荧光图像;BEL 7402 细胞与N,P-CDs 和Hg2+(125 μmol/L,(f)~(j))一起孵育、细胞与N,P-CDs/Hg2+和Cys 一起孵育((k)~(o))的共聚焦荧光图像。Fig.10 Confocal fluorescence images of N,P-CDs-treated BEL 7402 cells((a)-(e)),BEL 7402 cells incubated with N,PCDs and Hg2+(125 μmol/L,(f)-(j)),cells incubated with N,P-CDs/Hg2+and Cys((k)-(o)).
4 结 论
本文以叶酸和N-(膦酰基甲基)亚氨基二乙酸为前驱体,成功制备了一种具有丰富氮含量(10.0%)和适当磷掺杂的新型N,P-CDs。N,PCDs 对Hg2+表现出荧光猝灭,可能是由于N,PCDs 和Hg2+之间的电子转移。更重要的是,基于N,P-CDs/Hg2+的猝灭荧光,构建了Cys/Hcy 增强型纳米探针。利用Hg-SH 更强的亲和力来实现对Cys/Hcy 的灵敏测定,检测限低至30 nmol/L,优于目前大多数用于Cys 分析的FL 探针。对于自来水和尿液等真实样品检测也获得了满意的实验结果,证明样品抗基质干扰能力强。通过细胞成像实验也证实了N,P-CDs 能够感知活细胞内的Cys。本文所制备的N,P-CDs 因其超低的细胞毒性和出色的细胞渗透性,使得该探针在生物传感和其他分析领域具有巨大的应用潜力。本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20210389.
