纳米氧化物对美托洛尔生物富集的影响研究
2022-04-01卢媛宋琪许佳瑶孙红文
卢媛,宋琪,许佳瑶,孙红文*
(1.南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津 300350;2.大连理工大学外国语学院盘锦分院,辽宁 盘锦 124221;3.沈阳大学环境学院,沈阳 110044)
纳米颗粒(Nanoparticles,NPs)由于其特殊的理化性质而被广泛应用于医药、制造、催化、传感器等领域,目前NPs全球年产量已接近100万t。NPs在生产、运输、使用及废弃过程中不可避免地进入水环境,且由于很多纳米材料具备良好的吸附性能和穿过细胞膜的运输能力,从而给水生生物带来了潜在的风险。因此,NPs对污染物环境行为,尤其是对污染物生物可利用性及生物富集的影响,非常值得关注。
无机纳米氧化物作为广泛应用的纳米材料,由于其表面的亲水性质,而能与重金属离子发生较强的相互作用。此外,纳米氧化物自身可能会释放金属离子产生直接毒性效应,或与环境中的金属离子发生竞争,因而,与纳米氧化物对重金属离子环境行为和生物富集影响相关的研究较多。一般认为无机纳米氧化物对传统疏水性有机污染物的吸附能力较弱,但近年来的相关报道表明,纳米氧化物与有机污染物,尤其是与带有极性官能团的离子型有机物共暴露时,其对污染物生物可利用性的影响不容忽视。纳米氧化物能被水生生物摄入并在体内富集,GAO等研究了6种纳米氧化物在斑马鱼体内的富集情况,发现生物浓缩因子的对数值(lg)在1.5~3.0之间,纳米颗粒的摄入和排出速率主要与其粒径和表面电位相关。有机污染物在生物体内的富集主要受自身化学性质影响,值与污染物辛醇-水分配系数()呈正相关,与传统疏水性有机污染物相比,离子型有机物在生物体内的富集风险相对较低。但纳米氧化物与离子型有机物能通过静电吸附或配体交换发生更强的相互作用,进而影响污染物的环境行为。FANG等研究发现纳米二氧化钛(TiONPs)通过载带作用增加了双酚A的生物可利用性。全氟辛烷磺酸类物质与纳米氧化锌(ZnONPs)复合暴露时,也表现出更强的毒性。近年来,新污染物逐渐进入科学家研究视野,而药物是其中一类重要物质。-肾上腺素拮抗剂(-阻断剂)是一类重要的药物,主要用于治疗心律不齐、高血压和心绞痛。由于人体利用率低,-阻断剂大部分被排出体外,同时传统的污水处理系统不能将其完全清除,因此在医疗废水、污水处理厂进出水和地表水中-阻断剂都有检出。低浓度的-阻断剂也会对藻类、无脊椎动物和鱼类等水生生物产生有害的影响。作为一种可电离的弱碱性化合物,-阻断剂在中性条件下带正电荷,因此能与无机纳米氧化物发生强烈的相互作用,其环境行为与传统的憎水性有机污染物差别很大。然而,目前对于纳米氧化物对-阻断剂在生物体内富集、净化和分布的影响研究还鲜有报道。
本研究选取目前被广泛应用的TiONPs和SiONPs作为纳米氧化物颗粒的代表,以典型的-阻断剂美托洛尔作为目标污染物,研究了纳米氧化物对锦鲤富集美托洛尔的影响,并考察了美托洛尔在鱼体内各部位的分布情况,以期为全面评价纳米氧化物对β-阻断剂生物有效性的影响提供科学依据。
1 材料与方法
1.1 实验材料
美托洛尔(Metoprolol tartrate salt,纯度≥98%)购自美国Sigma公司。甲醇和乙腈为色谱纯,购自天津市康科德科技有限公司,其他试剂均为分析纯。TiONPs和SiONPs购自浙江弘晟材料科技公司。由于孔状SiONPs表面由硅烷偶联剂KH570修饰,故使用前在600℃下灼烧5 h以去除其表面的硅烷偶联剂。
本实验采用的锦鲤()购自市场,为当年生鱼种,平均体质量(4.2±0.5)g,平均体长(5.3±0.9)cm,实验前在水族箱中驯养2周以上。实验用水为曝气24 h以上的自来水,pH为6.5~7.5。
1.2 纳米氧化物的结构性质表征
纳米氧化物比表面积和孔体积使用AutoSorb-1-MP吸附仪测定(Quantachrome,美国)。在77 K下,由N的吸附-脱附法测定,样品分析前在105℃下真空脱气15 h以去除可能阻塞孔结构的杂质。
透射电镜图像(TEM)使用Tecnai G20 S-Twin观测(飞利浦,荷兰)。取10 mg·LNPs悬浊液滴加到铜网上,观察NPs的形貌。为观察NPs在水中的实际存在状态,NPs悬浊液未经超声处理,未添加分散剂。
Zeta电位和NPs粒径使用ZETAPALS/BI-200SM型Zeta电位与广角激光散射仪(BROOKHAVEN,美国)测得。
1.3 生物富集与净化
在两个盛有45 L曝气自来水的鱼缸中分别加入450 mg SiONPs和TiONPs,然后分别加入美托洛尔储备液,使鱼缸中美托洛尔浓度为500μg·L,平衡1 d后各投入50条鲤鱼。为了保证鱼呼吸所需要的空气并保持NPs的悬浮状态,鱼缸内昼夜微弱曝气,每日换水1次,每次换水重新染毒,每日换水前1 h喂食,实验期间水温保持在27℃左右,自然光照。第2、5、10、17、25、30 d时各取3条鱼,测定其体内美托洛尔的浓度。为分析美托洛尔在鱼体内的分布情况,于第25 d时另取5条鱼,经多次冲洗后,擦干表面、解剖,将皮鳞、肌肉、鳃、内脏分开,测定各部位美托洛尔的浓度。同时进行对照实验,对照组不加NPs,其他条件与实验组相同。
富集实验之后,利用每个鱼缸中剩余的鱼进行净化实验。实验组和对照组均每日换干净的水,其他条件与富集实验相同。第32、37、45、55、60 d时各取3条鱼,测定其体内美托洛尔的浓度。
1.4 鱼样的处理
鱼样处理参考VALESKA等报道的方法:鲤鱼取样后冷冻干燥,粉碎,然后称取100 mg粉碎样加入到15 mL PP管中,加入1 mL 0.1%的甲酸,30μL 1 mol·LHCl,使样品的pH<2;向样品中加入2 mL乙醚,振荡混合5 min,4 000 r·min转速下离心10 min;弃去有机相,向样品中加入100μL 1 mol·LNaOH,使样品的pH>12;为了促进目标物的析出,加入5 mg NaCl,然后加入3 mL乙酸乙酯,振荡混合10 min,在4 000 r·min转速下离心10 min,取出有机相,保留;重复萃取步骤,合并萃取液,氮吹至近干,最后用0.1%的甲酸定容至2 mL。回收率实验结果表明本方法回收率大于81.2%。
1.5 纳米氧化物对美托洛尔的吸附与解吸
称取100 mg TiONPs和100 mg SiONPs分别置于22 mL EPA样品瓶中,再加入20 mL背景溶液(200 mg·LNaN水溶液),然后分别加入一定量的美托洛尔储备液,迅速用带聚四氟乙烯隔垫的盖子旋紧,使美托洛尔在水中的平衡浓度为20~800μg·L。保持体系中甲醇含量少于0.1%,以避免共溶剂效应。在(20±1)℃下避光恒温振荡5 d(前期动力学实验表明,美托洛尔在4 d内即可达到表观吸附平衡)。平衡后在4 000 r·min转速下离心20 min,分离上清液,测定上清液中美托洛尔的浓度,每组实验设2个平行。解吸实验在500μg·L吸附实验的基础上进行,吸附平衡后,离心弃去上清液,然后在样品瓶中分别加入20 mL的模拟鱼体消化液[0.12 mol·LNaCl、0.02 mol·LNaCO、200 mg·LNaN、5 g·L胆盐(胆酸钠∶脱氧胆酸钠=1∶1)、1 mg·LDTAC,pH 7.5]或200 mg·L的NaN溶液,避光恒温振荡5 d,在4 000 r·min转速下离心20 min,分离上清液,测定上清液中美托洛尔的浓度。空白实验表明,由于瓶壁吸附和挥发造成美托洛尔的损失量小于0.5%,可忽略不计,因此可根据质量平衡计算吸附剂吸附美托洛尔的量。
1.6 美托洛尔检测方法
采用高效液相色谱仪(Agilent 1200,美国),C18色谱柱(Symmetry shield C18,5μm,3.9 mm×150 mm,Waters,美国)测定液相中美托洛尔的浓度。流动相为pH 4.5的醋酸缓冲液和乙腈,体积比80∶20,流速0.6 mL·min,进样量100μL,检测器为荧光检测器,激发和发射波长分别为230 nm和316 nm。
1.7 模型拟合
富集阶段的一级动力学方程:

净化阶段的一级衰减方程:

净化阶段的半衰期:

生物对污染物累积的程度用生物浓缩因子(,L·kg)表示:

式中:C为时刻鱼体内目标物的浓度,μg·g;为平衡时鱼体内目标物的浓度,μg·g;为富集速率常数,d;为暴露时间,d;为净化初始时鱼体内目标物的浓度,μg·g;为净化速率常数,d;C为污染物在水中的浓度,μg·L。
本研究使用Origin 2016软件进行曲线拟合,SPSS17.0进行统计分析。
2 结果与讨论
2.1 纳米氧化物对美托洛尔在鱼体内富集及净化的影响
鲤鱼对美托洛尔的富集曲线如图1所示,使用式(1)对富集过程的数据进行拟合,相关拟合参数列于表1,相关系数均在0.96以上,拟合度较好。从图1(a)可以看出,在美托洛尔单独暴露的情况下,最初的10 d内,鱼体内的美托洛尔浓度迅速增加,然后增速趋于平缓,富集进入稳态。30 d时,鱼体内的美托洛尔达到1.52μg·g,为2.95 L·kg,使用脂肪含量(测得鱼体脂肪含量为1.16%)标化后的为254 L·kg。
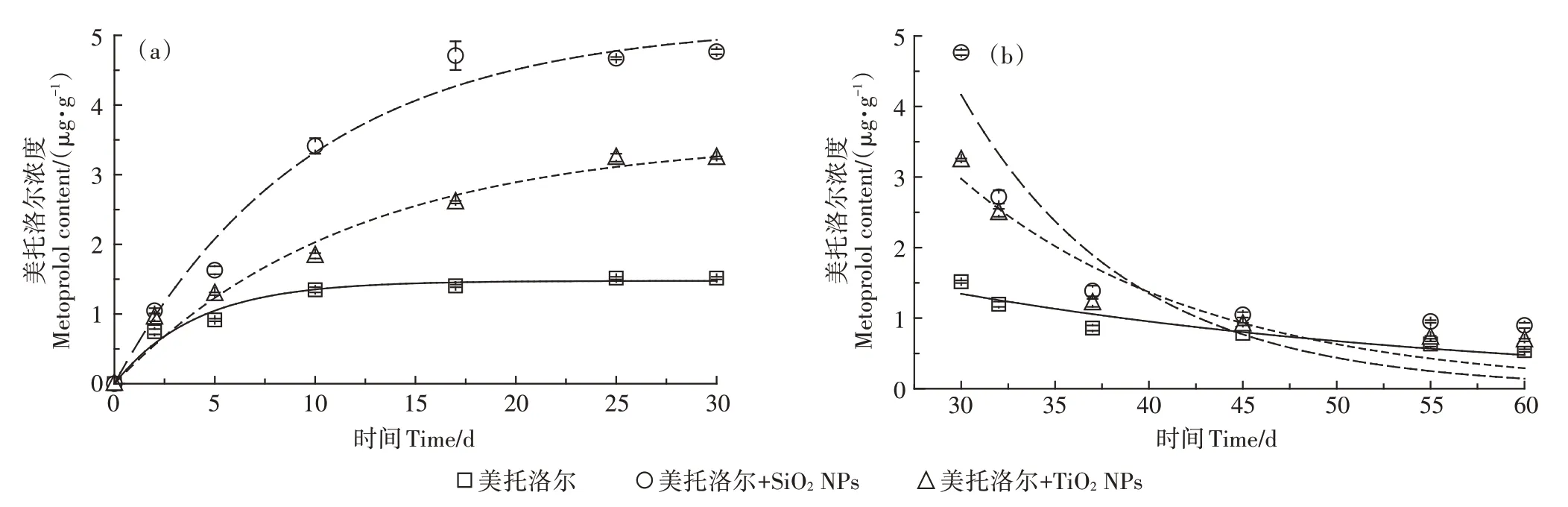
图1 鲤鱼对美托洛尔富集摄取阶段的一级动力学方程拟合(a)和净化阶段的一级衰减方程拟合(b)Figure 1 First-order uptake phase of accumulation(a)and First-order depuration phase of metoprolol(b)
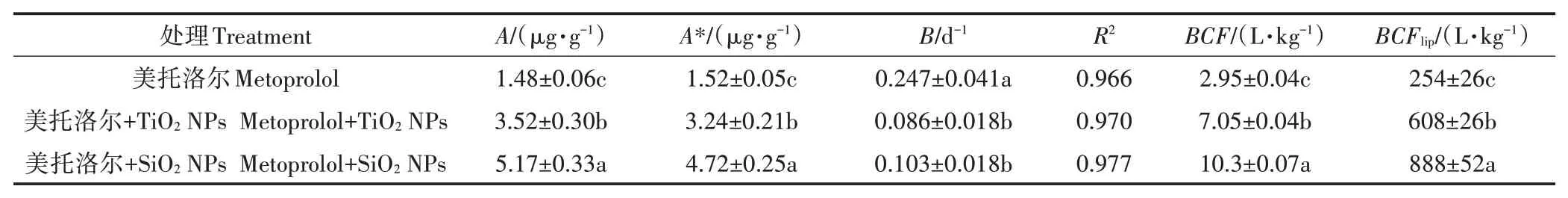
表1 鲤鱼对美托洛尔富集摄取阶段的一级动力学方程拟合参数Table 1 First-order uptake phase of accumulation parametersof metoprolol
当高于5 000 L·kg时,认为该污染物具有生物富集效应,在2 000~5 000 L·kg时,则污染物具有潜在的生物富集效应。美托洛尔(相对分子质量为267.4 g·mol,lg为1.88)的远小于分子量相近的传统疏水性有机污染物苯并(a)芘(相对分子质量为252.3 g·mol,lg为6.50,约为10L·kg),这主要是因为美托洛尔的lg较低,其具有更加亲水的分子结构。此外,美托洛尔在生物体内的半衰期约为1~5 h,能够较快地通过肝脏代谢为O-去甲基美托洛尔和美托洛尔酸等物质。
NPs增强了鱼体对美托洛尔的富集程度,SiONPs和TiONPs使鱼体内富集的一级动力学方程拟合值从1.48μg·g分别增加到5.17μg·g和3.52 μg·g。值与富集实验平衡后测得的鱼体内美托洛尔的实测值*非常吻合,相对偏差分别为4.14%和4.55%。鱼体内的美托洛尔浓度分别在第25 d和第17 d达到平衡,从0.247 d分别缩短到0.103 d和0.086 d,说明NPs的存在促进了美托洛尔在鱼体内的富集,增加了美托洛尔的生物可利用性,但是降低了鱼体对美托洛尔的富集速率。本实验室前期在TiONPs对Cd在鱼体内富集影响的相关研究中也得到了类似的结果,TiONPs虽然促进Cd在鱼体内的富集,但却降低了Cd富集的速率常数。
图1(b)为一级衰减方程对净化阶段的拟合结果(>0.774),和值、基于平衡浓度的以及见表2。由30 d后的净化曲线可以看出,在净化的初始阶段(净化的前7 d),美托洛尔从鱼体中去除较快,而后下降幅度减慢,在净化阶段的第30 d时,鱼体内的美托洛尔浓度降低到0.54μg·g,为1.08 L·kg。在摄取阶段存在TiONPs和SiONPs的条件下,同样在净化的前7 d,美托洛尔从鱼体中去除得较快,而后下降幅度减慢,在净化的第30 d时,鱼体内的美托洛尔浓度分别降低到0.69μg·g和0.90μg·g,分别为1.38 L·kg和1.80 L·kg,比未添加NPs时显著升高(<0.05)。摄取阶段TiONPs和SiONPs的存在,使美托洛尔在净化阶段的值从0.035 d分别提高到0.078 d和0.113 d,对美托洛尔富集浓度高的处理在净化阶段的去除速率也相对较高,最后稳定阶段残留在鱼体内的浓度也较高(<0.05)。美托洛尔在鱼体内净化的为20.09 d,摄取阶段存在TiONPs和SiONPs的条件下,分别缩短到8.39 d和6.13 d。
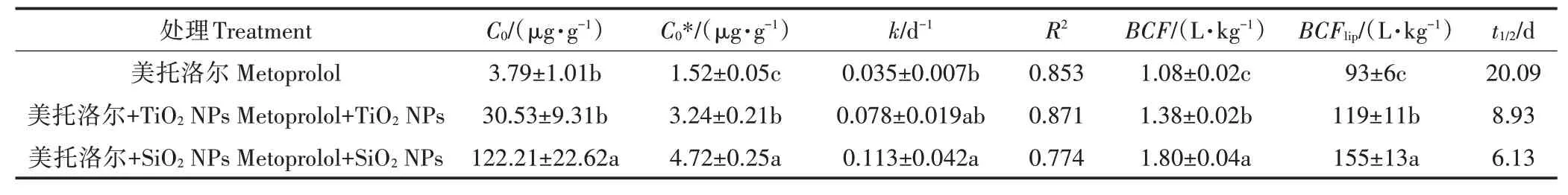
表2 鲤鱼对美托洛尔净化阶段的一级衰减方程拟合参数Table 2 First-order decay curve parameters of metoprolol
2.2 鱼体内美托洛尔的分布
为了研究美托洛尔在鱼体内富集的途径,在第25 d时取5条鱼,将皮鳞、肉、鳃、内脏分开,测定美托洛尔在各个部位的浓度,结果见图2。无论是否有NPs存在,美托洛尔在鱼体内的富集顺序均为内脏>鳃>肌肉、皮和鳞,其中肌肉中的美托洛尔的浓度与皮和鳞中的浓度没有显著差异(>0.05)。
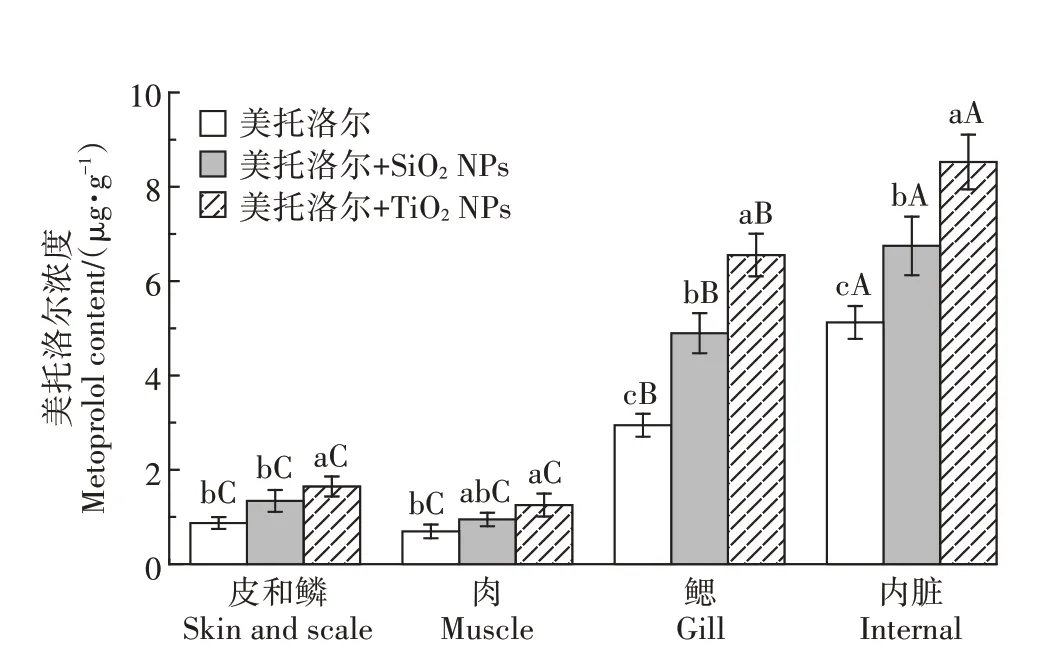
图2 美托洛尔在鱼体各部位的浓度Figure 2 Concentration of metoprolol in various tissues of carp
PEDLAR等的研究表明,鱼体对污染物的吸收主要包括进食摄取、皮肤体表吸收和呼吸器官鳃的吸收3种途径。鱼通过摄食作用使美托洛尔进入到内脏中,再通过血液循环进入到鱼体其他组织,内脏中美托洛尔浓度最高,表明进食摄取是鱼体吸收美托洛尔最重要的途径。鱼鳃直接与污染物接触,是吸收污染物的重要器官之一,鱼在呼吸过程中将污染物带到鱼鳃中,然后分配到肌肉中,因此鱼鳃中美托洛尔的浓度高于肌肉。鱼的皮和鳞直接与水相中的污染物接触,主要是污染物在皮和鳞与水相之间的分配作用,该作用的强弱通常与污染物的lg相关,美托洛尔的lg相对较低,难以通过分配作用进入鱼体,因此皮和鳞中美托洛尔的浓度较低。PEDERSEN等的研究也发现了类似的规律,暴露10 d后,苯酚在鳟鱼体内各部位的浓度排序为肝和胆汁>鳃>肌肉。
摄食阶段存在NPs时,美托洛尔在鱼体各部位的浓度顺序未发生变化,表明NPs并未改变鲤鱼吸收污染物的途径。与SiONPs共暴露时,鲤鱼肌肉及皮和鳞中美托洛尔的浓度(<0.05)增加,TiONPs存在时,鲤鱼肌肉及皮和鳞中的美托洛尔浓度与仅暴露美托洛尔的情况相比,也略有增加,但是没有显著差异(>0.05),而TiONPs和SiONPs的存在都显著促进了美托洛尔在鳃和肝脏中的富集(<0.05)。
2.3 纳米氧化物对美托洛尔的吸附和解吸
为了进一步阐明NPs对美托洛尔在鱼体内富集的影响机制,通过批平衡实验考察了两种NPs对美托洛尔的吸附能力,以及在水和鱼消化道模拟液中的解吸情况。
SiONPs和TiONPs对美托洛尔的吸附等温线见图3,使用Freundlich模型对吸附数据进行拟合,并计算了不同初始浓度下的值,吸附模型参数列于表3,相关系数在0.97以上,拟合度较好。SiONPs和TiONPs吸附美托洛尔的lg分别为4.47和2.11。
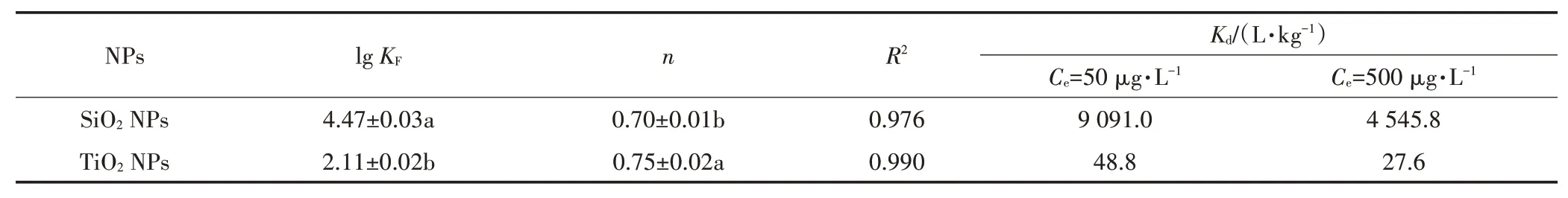
表3 纳米氧化物对美托洛尔的吸附等温线拟合参数Table 3 Freundlich parameters of metoprolol sorption on NPs
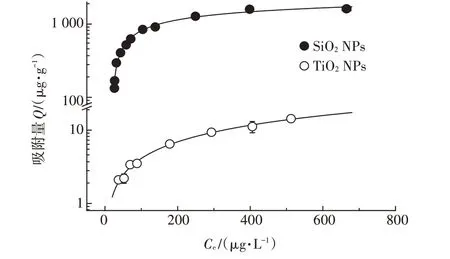
图3 SiO2 NPs和TiO2 NPs对美托洛尔的吸附等温线Figure 3 Sorption isotherms of metoprolol on SiO2 and TiO2
-阻断剂美托洛尔是一种有机碱,p为9.7,在本研究实验条件下(pH 7.5),99.4%的美托洛尔以阳离子形态存在,此时,测得SiONPs和TiONPs的Zeta电位分别为-33 mV和-14.5 mV,颗粒物表面带有负电,静电吸引成为影响吸附行为的重要机制,而带有更多负电荷的SiONPs也表现出与美托洛尔更强的结合能力。两种NPs的比表面积和孔体积见表4,使用比表面积标化后,SiONPs的吸附能力仍远大于TiONPs。TiONPs不含微孔,而SiONPs具有丰富的微孔结构,在总孔体积和介孔体积相差较小的情况下,两种NPs对美托洛尔的吸附能力表现出数量级的差异,表明微孔结构可能在吸附中发挥了重要作用。
解吸实验表明,在水中SiONPs对美托洛尔不解吸,而TiONPs的解吸率为91.6%。消化液中由于胆盐的分散和增溶效应,以及与污染物的络合作用,使污染物表现出与水中不同的解吸行为。在消化液模拟液中,SiONPs和TiONPs对美托洛尔的解吸率分别为4.87%和95.35%,即与TiONPs结合的美托洛尔更易释放到环境或消化道中,而SiONPs吸附态美托洛尔虽然可以在消化道中发生解吸,但大部分仍以吸附态存在。两种NPs吸附态美托洛尔解吸行为的差异可能与吸附机制不同有关。吴艳华等在研究邻苯二甲酸酯(PAEs)在黏土矿物上吸附解吸行为时发现,进入黏土中间层的PAEs难以解吸,因此推测进入微孔结构中的美托洛尔分子解吸也更加困难。SiONPs在水中的平均粒径为844.9 nm,大于TiONPs,TEM图像也显示(图4),SiONPs在水中会形成比TiONPs更大尺寸的团聚体,美托洛尔分子可能被夹裹进入团聚体中而增加了解吸的难度。
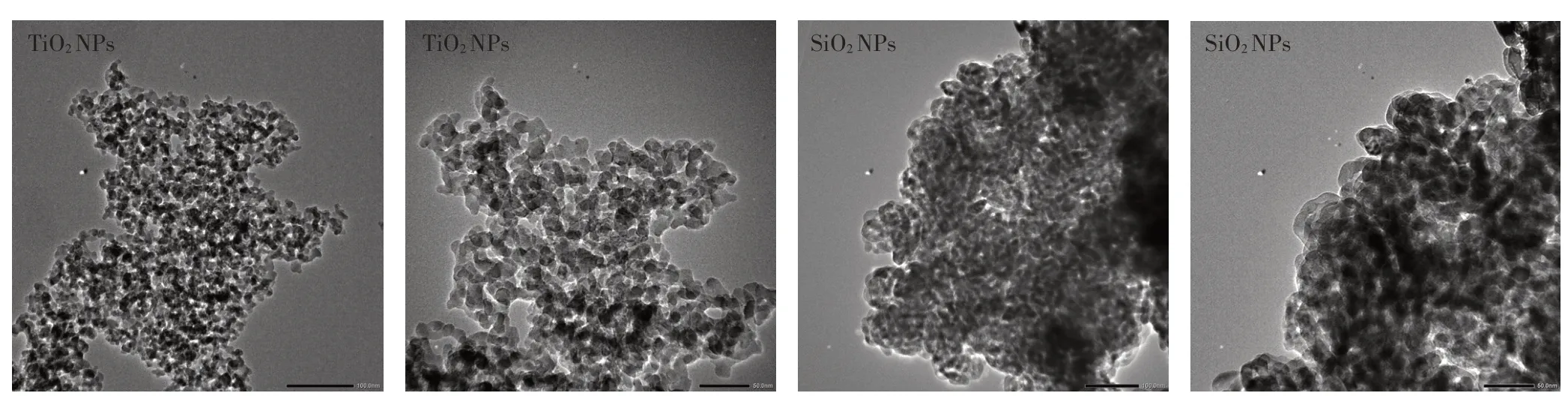
图4 水溶液中TiO2 NPs和SiO2 NPs的TEM图像(×1 000 000倍/×1 500 000倍)Figure 4 TEMimages of TiO2 NPs and SiO2 NPs in water(×1 000 000 times/×1 500 000 times)
2.4 纳米氧化物吸附解吸对鱼体富集净化美托洛尔的影响机制
吸附和解吸是影响环境中有机污染物生物有效性的关键过程,而NPs对美托洛尔的吸附可能带来两方面的影响:一方面,NPs的吸附作用使溶解态的污染物浓度下降,从而导致污染物的生物有效性降低;另一方面,在NPs的载带作用下,污染物在环境介质中的迁移过程更加便利,能穿透生物膜进入到生物体中,从而增加生物有效性。
纳米材料通过吸附作用可提高或降低污染物的生物可利用性。FU等在对斑马鱼幼体的研究中发现,TiONPs的存在会增强水体中共暴露有机污染物的生物可利用性和毒性;KIM等的研究则发现柠檬酸包覆的AgONPs减少了As和Cu在大型溞体内的生物累积,但却增加了Cd的生物累积。在本课题组的前期工作中,发现NPs可以在鲤鱼体内富集,在最初的10 d内,NPs在鱼体内的浓度迅速增加,然后增速趋于平缓,平衡时的为595.7~675.5 L·kg。本研究中,NPs的存在促进了鱼体对美托洛尔的富集,吸附能力更强的SiONPs也表现出比TiONPs更强的促进作用,这可能是由NPs的吸附载带作用造成的。但是SiONPs对美托洛尔吸附容量远大于TiONPs,相差约两个数量级,而两种NPs对鱼体富集美托洛尔的促进程度分别为3.49倍和2.39倍,并未展现出数量级的差异。由于SiONPs在水中形成了更大尺寸的团聚体(表4),而较大的NPs团聚体难以被生物肠道上皮组织吸收,导致NPs载带的美托洛尔不能完全被鱼体利用。GAO等使用迭代数值积分法计算了斑马鱼体内6种纳米氧化物的毒代动力学参数,发现在净化阶段大部分纳米氧化物都可在较短时间内排出体外。本研究解吸实验的结果表明,与NPs结合的美托洛尔并不能完全解吸,尤其与SiONPs结合的美托洛尔更难释放,即使在鱼的消化液模拟液中,大部分美托洛尔仍以吸附态存在,可能并未被鱼体吸收而随颗粒物排出体外。摄食阶段有NPs存在时,净化阶段虽然最终残余在鱼体内的美托洛尔更多,但净化速率更快,半衰期更短,也说明了有部分NPs吸附态美托洛尔被直接排出了鱼体外。
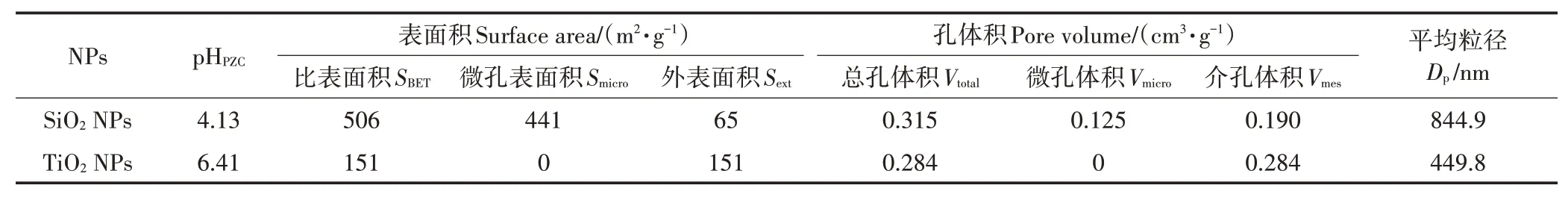
表4 纳米氧化物的特征参数Table 4 Structural parameters of the nano-oxides
本课题组前期工作和多个研究都表明,摄食和鳃的呼吸作用是NPs进入鱼体的主要途径,且NPs可以穿透鱼肠道上皮屏障,进入其他组织,因此肠道、肝脏和鳃成为鱼体富集NPs最多的器官。本研究中摄食阶段两种NPs与美托洛尔共同暴露都显著增加了鱼鳃和内脏中美托洛尔的浓度,与NPs在鱼体内的富集器官一致,进一步证明NPs可以通过吸附载带增强美托洛尔的生物富集。虽然肌肉及皮和鳞不是NPs在鱼体中富集的主要部位,但吸附能力更强的SiONPs也提高了这些部位中的美托洛尔浓度,因此,对于能对污染物产生强烈吸附作用的NPs,我们需要进行更加全面的生态风险评估。
3 结论
(1)NPs对水体中美托洛尔有明显的吸附作用,可载带美托洛尔进入鲤鱼体内,促进其生物富集,吸附能力更强的SiONPs对美托洛尔在鱼体内富集的促进作用强于TiONPs。
(2)摄食阶段存在NPs时,净化阶段美托洛尔在鱼体内的半衰期更短,但最后稳定阶段,美托洛尔在鱼体内残留的浓度略高。
(3)SiONPs对美托洛尔存在较强的、不可逆的吸附;而TiONPs对美托洛尔存在相对较弱的、可逆的吸附。
(4)鱼体主要通过摄食和鳃的呼吸作用富集美托洛尔,NPs也主要通过这两条途径促进鱼体对污染物的富集。
