土壤渗滤系统处理农村黑灰水对庭院菜地土壤环境的影响
2022-03-31王淞民刘丽媛魏孝承彭皓张春雪柳博郑向群
王淞民,刘丽媛,魏孝承,彭皓,张春雪,柳博,郑向群
(农业农村部环境保护科研监测所,天津 300191)
三格式化粪池具有原理简单、建造速度快、无害化效果好、产物肥效高、造价低廉等优势,在我国农村“厕所革命”推进过程中发挥着重要作用[1],但三格化粪池出水处理不当会对周边环境造成危害[2]。目前,常见的三格化粪池出水处理方式主要有两种:一是直接还田,就地肥料化;二是集中清掏,统一转运。三格化粪池出水虽经无害化处理,但其中的致病微生物、蛔虫卵和大肠菌群等并未被完全杀灭,若将三格化粪池出水直接进行农田灌溉,尾水中的致病菌会造成土壤环境污染[3]。集中清掏、统一转运主要用于城郊附近或经济条件较好的农村地区,局限性较高。新型三格化粪池出水处理方式——土壤渗滤系统[4],由于其低耗高效、运行简易、对尾水中污染物无害化处理效果好等优点[5-6]在我国农村地区广泛使用。
土壤渗滤系统具体用法是将三格化粪池出水有控制地投配到土壤渗滤系统中,利用土壤-微生物-植物系统的自净和自我调节能力,通过一系列物理、化学、生物等过程[7],去除三格化粪池出水中污染物[8]。但土壤渗滤系统未能对三格化粪池出水中氮、磷等营养物质进行资源化利用,造成氮、磷等营养元素的浪费。而在土壤渗滤系统上方种植作物,不仅可以通过作物吸收三格化粪池中的氮、磷等营养元素[9],降低土壤渗滤系统的处理负荷,还能提高经济效益[10]。
基于此,本研究将三格化粪池与土壤渗滤系统联用,并在土壤渗滤系统上方种植3 种不种类型蔬菜,通过化粪池+渗滤沟式土壤渗滤系统这一模式,探究土壤渗滤系统处理农村黑灰水对庭院菜园土壤环境的影响,以及在土壤渗滤系统上方种植蔬菜的合理性及安全性,为土壤渗滤系统工艺模式优化提供科学依据。
1 材料与方法
1.1 试验区域概况
本研究选择天津市宁河区东棘坨镇张老仁村作为试验区域,该村位于天津市东北部(北纬39°44′,东经117°49′),年平均气温11.6 ℃,年平均降水量580.7 mm,相对湿度66%。该村缺少三格化粪池尾水处理设施,尾水就地还田,易导致周围水体污染[11]。该村土壤理化指标、卫生指标背景值(BJ)和三格化粪池第三格出水水质指标分别如表1、表2所示,土壤渗滤系统中各污染物单位面积每日负荷量如表3所示。
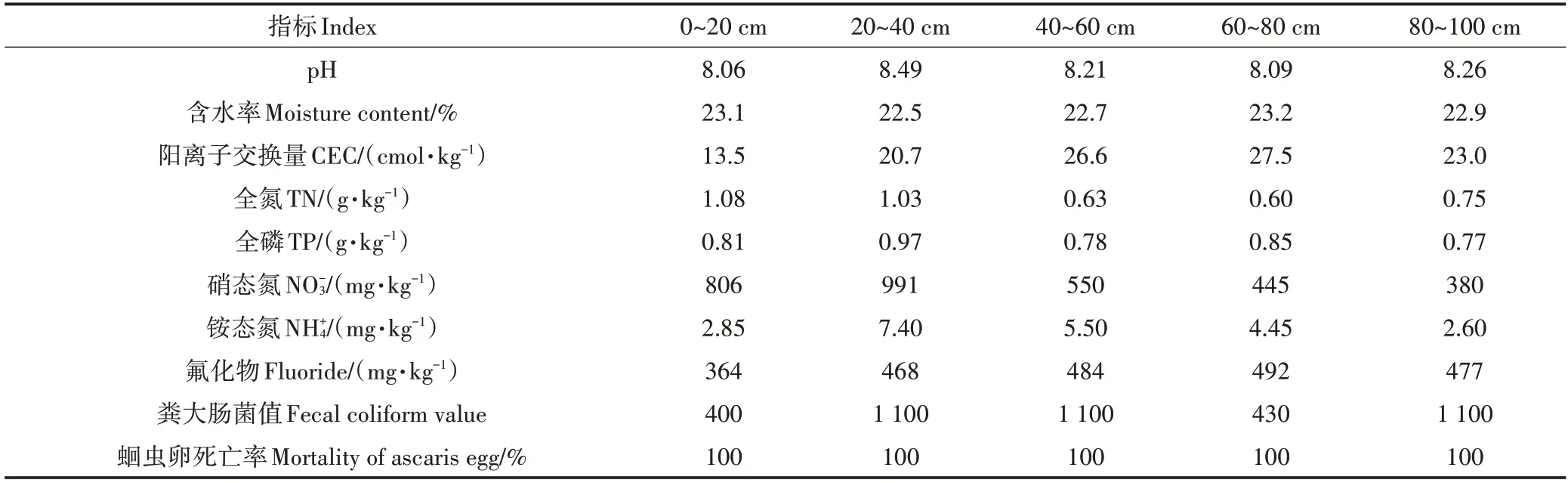
表1 施工前各土层土壤理化指标和卫生指标背景值Table 1 Background values of soil physicochemical and sanitary indexes in the different soil layer before construction

表2 三格化粪池第三格出水水质指标Table 2 The effluent water quality index of the third compartment of three septic tanks

表3 土壤渗滤系统中各污染物单位面积日负荷(mg·m-2·d-1)Table 3 Daily load per unit area of pollutants in soil infiltration system(mg·m-2·d-1)
1.2 试验设计
依据张老仁村的地势条件,设计了“化粪池+土壤渗滤系统”技术模式,其设计思路(图1)如下:
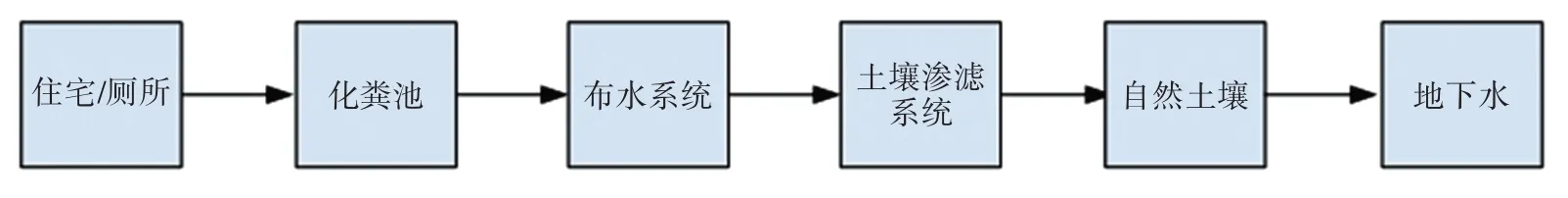
图1 化粪池+土壤渗滤系统技术模式设计Figure 1 Design of septic tank+soil infiltration system technical mode
(1)污水通过排水管道进入三格化粪池。
(2)污水在三格化粪池内停留足够长的时间,使得固体沉降到底部形成污泥[12]。
(3)三格化粪池尾水通过水泵从三格化粪池流出,经布水系统,定时定量排放至土壤渗滤系统。
(4)尾水进入土壤渗滤系统经过一定处理后进入自然土壤系统。
(5)当污水渗透到自然土壤系统后,经过土壤的吸收、沉淀作用以及微生物处理净化,清除污水中的有害细菌和病毒。
(6)净化后的水最终汇入地下水。
1.3 土壤渗滤系统的建设
2020 年7 月13 日在天津市宁河区张老仁庄一农户庭院外建设化粪池+渗滤沟式土壤渗滤系统(施工图如图2 所示)。其中布水区+处理区为一长6.2 m、宽2.5 m、深0.6 m 的长方体土坑,布水系统由4 根直径为32 mm穿孔管组成,穿孔管每个孔之间的距离为100 mm,4 根穿孔管将布水区平均分为3 部分,每部分宽度为700 mm,穿孔管的孔径为5 mm。在穿孔管上添加粗细不同的填料,填料深约300 mm,在填料上方覆盖约300 mm的土壤。布水区距三格化粪池第三格直线距离约3 m,污水通过三格化粪池第三格中吸污泵定时定量地投放到土壤渗滤系统中。吸污泵设置每日工作1 h,工作时间段为每日上午8:00—9:00,吸污泵工作流量为25 L·h-1,每日向土壤渗滤系统中投放污水25 L。最后在土壤渗滤系统上方建造菜园并种植蔬菜,设置4个处理组:空白对照组(CK)、白菜组(BC)、黄瓜组(HG)和水萝卜组(SLB),蔬菜于2020年7月13日种植。

图2 化粪池+土壤渗滤系统施工图Figure 2 The construction drawing of septic tank+soil infiltration system
1.4 测定项目与方法
1.4.1 样品采集
2020 年7 月至2021 年3 月每隔30 d 在土壤渗滤系统上方的4 个处理组菜地采集试验样品,用土钻分别采取表层(深度0~20 cm)和深层(深度20~40 cm)土壤样品共8 个,每个样品3 次重复,共计24 个样品,采样点如图3所示。

图3 采样点平面示意图Figure 3 Schematic diagram graph of sampling points
1.4.2 指标测定
本试验测定的土壤指标(全氮、全磷、粪大肠菌值和蛔虫卵死亡率)和蔬菜指标(亚硝酸盐、维生素C、铁、还原糖、pH、粪大肠菌群数和可溶性糖)检测方法及标准分别如表4、表5所示。

表4 土壤指标检测方法及标准Table 4 Soil sample index detection methods and standards

表5 蔬菜指标检测方法及标准Table 5 Vegetable sample index detection methods and standards
1.4.3 数据分析
理化指标数据采用IBM SPSS Statistics 22.0 进行单因素方差分析(ANOVA),利用最小显著差法(LSD)检验试验数据的差异显著性(P<0.05)[13],并采用Origin 2018进行绘图;土壤微生物高通量测序数据利用Majorbio云平台制图并分析。
2 结果与讨论
2.1 土壤渗滤系统处理农村黑灰水对庭院菜地土壤理化性质的影响
2.1.1 TN
4 个处理组不同土层TN 含量如图4 所示。各处理组表层土与深层土TN含量在试验期间总体上均呈现先上升后下降的趋势,其中空白对照组、黄瓜组和水萝卜组在2020 年11 月TN 含量达到顶峰,并与2020 年7 月和2021 年3 月TN 含量相比差异显著(P<0.05),这可能是由于该村农户在11 月时粪污排泄量增加而导致污水中污染物负荷增大[14],进而导致菜地土壤吸附的氮素量升高。

图4 不同月份不同处理组各土层全氮(TN)含量Figure 4 Total nitrogen content in different soil layers in different treatment groups in different months
对于白菜组、黄瓜组和水萝卜组,从2020 年7 月开始种植蔬菜到2020年11月收割蔬菜,表层土TN含量分别提高了589.77%、356.93%和70.00%,深层土分别提高了266.46%、718.22%和148.70%。表明土壤渗滤系统处理农村黑灰水使庭院菜地表层与深层土壤TN含量提高。有研究表明土壤渗滤系统从建设到运行稳定需要一个稳定周期[15],孔刚等[16]研究发现渗滤沟式土壤渗滤系统运行是否稳定可通过系统对TN 的去除效率来判断,其研究结果表明土壤渗虑系统对TN的去除存在两个阶段。前期TN去除率低,仅为40%~50%,系统不稳定;后期TN 去除率提高,达70%~95%,表明系统已稳定,从不稳定到稳定共经历约60 d。而本研究从2020 年7 月至9 月系统处于不稳定期,系统对TN 去除率低,土壤对TN 的吸附也较少,此外7月至9月蔬菜处于幼苗期,其对土壤氮素的吸收能力较弱。而2020 年10 月至11 月,土壤渗滤系统运行稳定,系统对TN的去除率逐渐提升,菜地土壤对氮素的吸附也逐渐增强,运行后期,土壤优势微生物数量迅速增长且比例协调,生物脱氮能力也得到大幅提升[17],蔬菜对氮素的吸收也随之增强。
进入2020年11月后,温度逐渐降低,但是系统仍然保持稳定运行。从2020 年11 月(收割蔬菜)至12月,除白菜组外,对照组、黄瓜组和水萝卜组两土层TN 含量均出现下降,3 个处理组表层土分别下降了68.70%、64.07% 和2.50%,深层土分别下降了84.07%、74.54%和7.43%,白菜组两土层TN含量则分别提高10.05%、133.61%。这可能是由于收割蔬菜之后蔬菜根系被移出菜地土壤,土壤渗滤系统反硝化反应中被植物根系所吸收的较少,导致大部分在微生物的反硝化反应作用下排至系统外部[18]。此外,李娜[19]的研究表明无论是在冻结温度变化还是冻融循环模式改变的条件下,土壤TN 含量均随土壤深度的增加而降低,这与本研究结论一致。而白菜组两土层TN含量上升可能是由于土壤冻融作用使白菜根系土壤矿化氮含量增加[19]。
如图5 所示,与未经农村黑灰水处理过的土壤TN 含量相比,除了3 月白菜组深层TN 含量无显著差异外(P>0.05),其余处理组各土层TN 含量与之均有显著差异(P<0.05),这表明土壤渗滤系统处理农村黑灰水对菜地土壤两土层TN含量均有显著影响。

图5 处理前后各处理组各土层全氮(TN)含量Figure 5 The total nitrogen content of each soil layer in each treatment group before and after infiltration treatment
2.1.2 TP
4 个处理组不同土层TP 含量如图6 所示,整体上各处理不同时期土壤TP含量波动幅度较小。对于表层土而言,试验期间4 个处理组整体上呈先上升后下降再上升的趋势。其中从2020 年7 月(种植蔬菜)开始至2020 年11 月(收割蔬菜)结束,4 个处理组TP 含量均呈上升趋势,且在11 月时除CK 外其余3 个处理组表层土TP 含量均高于深层土,这可能是由于生活污水中磷经过土壤渗滤系统的吸附、沉淀和微生物同化作用后被植物根系吸收利用,最终以有机物残留体的形式积累于表层土壤[20],使得表层土壤TP 含量高于深层土壤,这与唐文忠[11]等的研究结果一致。而从2020年11月至2021年2月4个处理组表层土TP含量均呈下降趋势,到了3 月均开始出现上升趋势。整体上从2020 年7 月至2021 年3 月,对于表层土而言,除了CK 下降9.66%外,其余3 个处理组TP 含量分别提高了0.14%、4.53%和3.09%。对于深层土,4 个处理组TP 含量均有所下降,分别下降16.63%、8.65%、18.89%和4.35%。
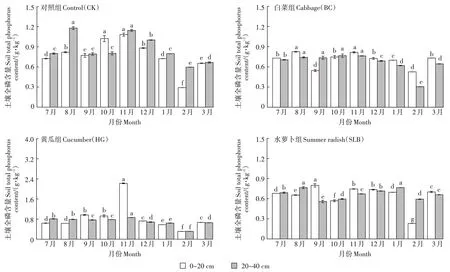
图6 不同月份不同处理组各土层全磷(TP)含量Figure 6 Total phosphorus content in different soil layers in different treatment groups in different months
有研究[21-22]表明土壤中磷的迁移与温度有关,温度升高,土壤吸附磷的作用增强[23]。本研究中从2020年7 月至11 月,蔬菜根系对TP 的吸附使得表层土壤TP 含量高于深层土壤。而从2020 年11 月收割蔬菜结束至2021 年2 月,随着温度的降低,4 个处理组两土层TP 含量均显著下降(P<0.05),而从2021 年2 月至3 月随着温度的提升,4 个处理组两土层TP 含量均显著上升,这与此前研究[21-22]结论一致。
从2020 年7 月(种植蔬菜)至2020 年11 月(收割蔬菜),各处理组表层土TP 含量分别提高了49.24%、11.78%、248.91%和9.71%,深层土TP 含量除了水萝卜组降低了2.61%以外,其余处理组分别提高了43.13%、8.23%和6.54%。对于表层土而言,在7 月种植蔬菜后,相较于CK,白菜组TP 含量提高0.69%,黄瓜组与水萝卜组分别下降11.72%和6.21%;对于深层土而言,黄瓜组TP 含量较CK 提高了1.25%,白菜组和水萝卜组分别下降11.88%和13.75%。
而在2020年11月(收割蔬菜)时,对表层土而言,相较于CK,黄瓜组TP含量下降106.38%,白菜组和水萝卜组分别提高24.58%、31.05%。而对深层土而言,3 个菜地处理组TP 含量均较CK 有所提高,分别提高33.36%、24.63%和41.31%,这表明土壤渗滤系统对庭院菜地表层土与深层土TP含量均有影响。有研究表明,土壤渗滤系统去除TP的途径为土壤吸附、化学沉淀及植物吸收作用[24],其中最重要的是土壤吸附及磷的化学沉淀作用,而该作用主要受土壤的物理化学特性影响,如pH 值、氧化还原状态和土壤中金属离子(Ca2+、Al3+、Fe3+等)含量等[25-26]。李海波等[27]、秦伟等[28]研究发现,土壤渗滤系统对污水中TP 的去除效果很好,去除率始终保持在95%左右,表明土壤渗滤系统对磷具有良好的持留作用,这与本研究结果一致。
此外,如图7 所示,与未经农村黑灰水处理过的土壤TP含量相比,2021年3月各处理组各土层TP含量均有显著差异(P<0.05),这表明土壤渗滤系统处理农村黑灰水对菜地土壤两土层TP含量均有显著影响。

图7 处理前后各处理组各土层全磷(TP)含量Figure 7 The total phosphorus content of each soil layer in each treatment group before and after infiltration treatment
2.2 土壤渗滤系统处理农村黑灰水对庭院菜地土壤细菌群落的影响
2.2.1 生态学指数
对于菜地土壤细菌群落,不同处理抽平后的有效序列数为:30 个土壤样本共获得7 089 个OTUs,物种分类统计包括:48 个门、155 个纲、372 个目、602 个科和1 159 个属。由图8a 可以看出,对于表层土而言,7月菜地背景土壤与3 月菜地各处理组样本共有的OTUs 总数为1 758,7 月菜地背景土壤与3 月菜地各处理组OTUs 总数分别为3 524、3 685、3 371、4 024 和3 719。由图8b 可以看出,对于深层土而言,7 月菜地背景土壤与3 月菜地各处理组样本共有的OTUs 总数为1 693,7 月菜地背景土壤与3 月菜地各处理组OTUs总数分别为2 913、3 772、3 865、3 905和4 009。
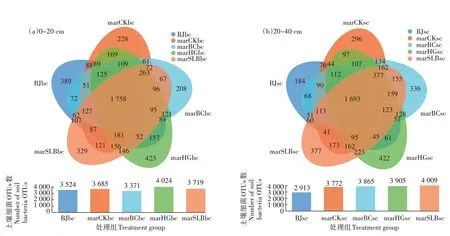
图8 各土层不同处理组土壤细菌群落OTUs数Figure 8 OTUs number of soil bacterial communities in different treatment groups in each soil layers
菜地土壤表层土与深层土不同处理土壤微生物细菌群落α多样性指数分别如表6和表7所示。对于表层土而言,相较于7 月菜地背景土壤,3 月4 个处理组中只有白菜组Shannon、Ace 和Shannoneven 指数均低于7 月菜地背景土壤。3 月其余3 个处理组Shannon 和Shannoneven 指数均高于7 月菜地背景土壤,且差异显著(P<0.05),Ace指数则无显著差异(P>0.05)。对于深层土而言,相较于7 月菜地背景土壤,3 月4 个处理组Shannon、Ace 和Shannoneven 指数均高于7 月菜地背景土壤,且差异显著(P<0.05),其中3 月菜地各处理组Shannon和Ace指数均无显著差异。这表明土壤渗滤系统处理农村黑灰水对菜地深层土壤细菌群落多样性与丰富度均有促进作用,但对表层土壤细菌群落丰富度无显著影响。

表6 处理前后不同处理组表层土细菌群落多样性指数Table 6 Bacterial community diversity index of topsoil in different treatment groups before and after infiltration treatment

表7 处理前后不同处理组深层土细菌群落多样性指数Table 7 Bacterial community diversity index of deep soil in different treatment groups before and after infiltration treatment
2.2.2 土壤细菌群落组成
2020 年7 月菜地背景土壤表层和2021 年3 月菜地各处理表层土壤细菌属水平的群落组成如图9a 所示。各处理在属水平上的细菌群落结构高度相似,主要优势菌群为节杆菌属(Arthrobacter,1.93%~9.16%)、硫杆菌属(Thiobacillus,3.02%~7.68%)、溶杆菌属(Lysobacter,1.40%~3.58%)、Gaiella(1.30%~1.99%)、鞘氨醇单胞菌属(Sphingomonas,0.53%~1.94%)、类诺卡氏属(Nocardioides,0.70%~2.21%)、MND1(0.75%~1.22%)、Galbitalea(0.07%~5.11%)、RB41(0.10%~1.90%)、链霉菌属(Streptomyces,0.65%~1.10%)。相较于7 月背景土壤,3 月4 个处理组节杆菌属相对丰度均有上升,分别上升2.54%、7.23%、3.68% 和4.48%。节杆菌属是一种革兰氏阳性菌,广泛存在于空气、水、受污染的土壤及人的皮肤中。大量研究[29-31]表明节杆菌属菌株对污染水体处理和土壤重金属吸附具有重要作用。
2020 年7 月菜地背景土壤深层和2021 年3 月菜地各处理深层土壤细菌属水平的群落组成如图9b 所示。各处理在属水平上的细菌群落结构相似,主要优势菌群为节杆菌属(Arthrobacter,0.46%~3.43%)、Gaiella(1.30%~2.74%)、MND1(1.06%~2.56%)、鞘氨醇单胞菌属(Sphingomonas,0.57%~1.66%)、RB41(0.69%~1.72%)、硫杆菌属(Thiobacilus,0.07%~2.90%)、溶杆菌属(Lysobacter,0.62%~1.20%)、链霉菌属(Streptomyces,0.6%~1.16%)、类诺卡氏属(Nocardioides,0.61%~1.18%)、红杆菌属(Solirubrobacter,0.5%~1.3%)。相较于7 月背景土壤,3 月4 个处理组硫杆菌属相对丰度均有上升,分别上升0.24%、0.75%、1.17% 和2.83%。这表明土壤渗滤系统使深层土硫杆菌属丰富度提高。硫杆菌属是土壤和水体中最常见的一种无色硫细菌,其氧化作用可以为植物提供可利用的硫酸态硫素营养。有研究表明硫杆菌属中的一些菌种在去除环境中重金属方面发挥重要作用,如氧化亚铁硫杆菌(Thiobacillus ferrooxidans)和氧化硫硫杆菌(Thiobacillus thiooxidans),不仅对重金属具有良好的沥滤效果,还可以用于冶炼金属[32];另外脱氮硫杆菌(Thiobacillus denitrificans)也可以在处理工业废水的反硝化过程中起到重要作用[33]。
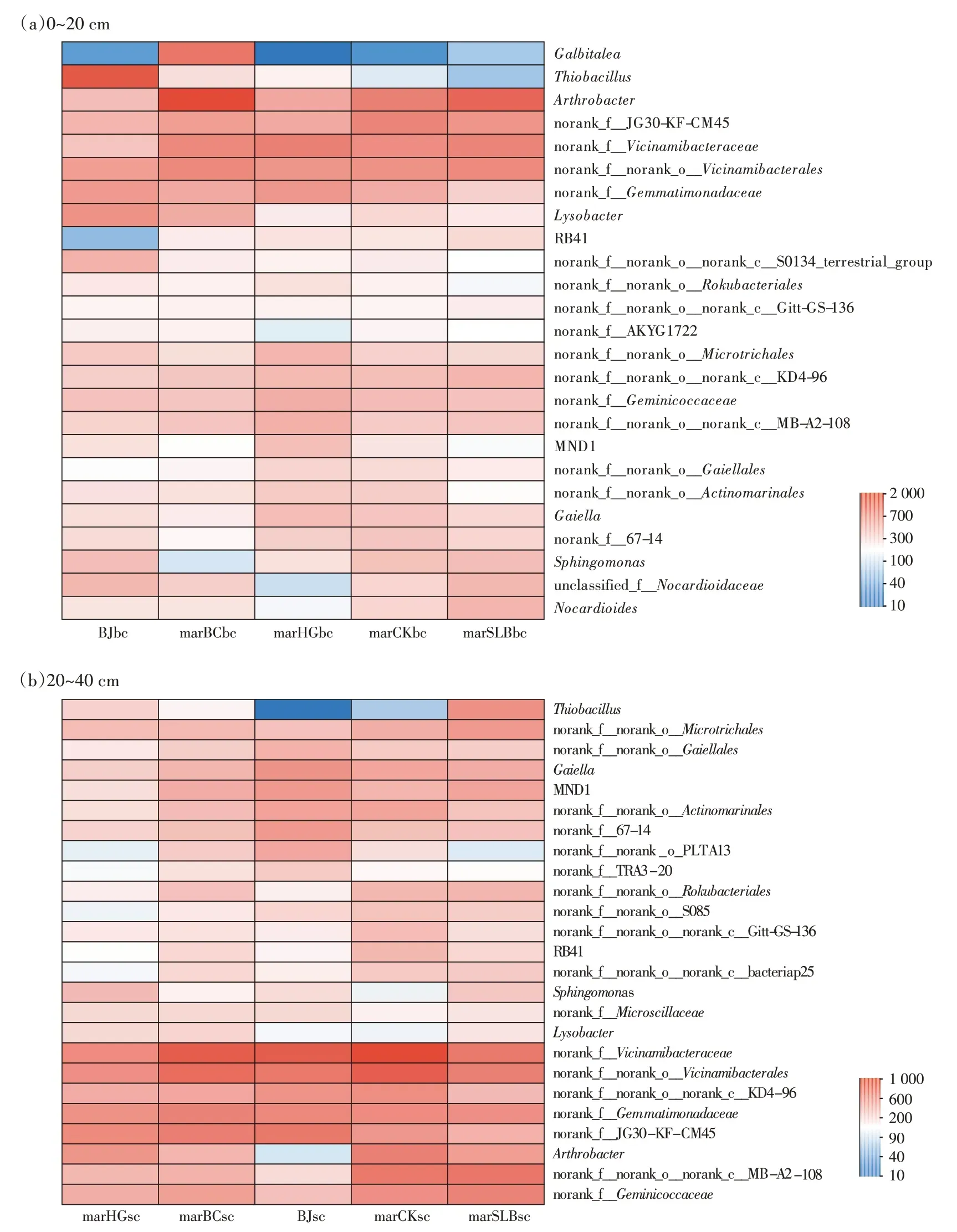
图9 处理前后两土层不同处理组土壤细菌群落属水平上物种相对丰度Figure 9 The relative species richness of soil bacterial communities in different treatment groups in two soil layers before and after infiltration treatment
整体上2020 年7 月和2021 年3 月表层土与深层土Top25 菌属高度相似,相较于表层土,深层土只增加了红杆菌属。链霉菌属是一种潜在的致病微生物,虽然其大部分为非致病性污染菌,但是索马里链霉菌除外,该菌可能引起足菌肿病,偶尔还会引发侵袭性感染。虽然在菜地土壤表层土与深层土中发现具有潜在致病风险的链霉菌属,但是长期利用土壤渗滤系统处理菜地会使链霉菌属丰富度降低。本试验中,与2020 年7 月背景土壤相比,2021 年3 月经过土壤渗滤系统处理后的菜地各处理组链霉菌属丰度均有下降,分别下降0.24%、0.23%、0.41%和0.56%。
因此,利用土壤渗滤系统处理农村黑灰水不仅会提高硫杆菌属和节杆菌属相对丰度,还可以降低土壤致病微生物链霉菌属相对丰度,缓解土壤致病微生物的环境风险。
2.2.3 土壤养分与土壤微生物相关性分析
如图10a 所示,通过相关性热图(Heatmap)分析庭院菜地土壤环境因子对菜地表层土壤细菌属水平群落组成影响。硫杆菌属(Thiobacilus)与TN、TP 均呈显著正相关(P<0.05),溶杆菌属(Lysobacter)与TN呈极显著正相关(P<0.001),与TP 呈显著正相关(P<0.05)。马赛菌属(Massilia)与TN、TP 均呈极显著负相关(P<0.01)。红杆菌属(Solirubrobacter)与TN、TP均呈显著负相关(P<0.05)。RB41 与TN 呈极显著负相关(P<0.01)。如图10b 所示,通过相关性热图分析庭院菜地土壤环境因子对菜地深层土壤细菌属水平群落组成影响。节杆菌属(Arthrobacter)与TN 呈显著负相关(P<0.05),Gaiella与TP 呈显著正相关(P<0.05),MND1与TN呈显著正相关(P<0.05)。
马赛菌属(Massilia)因其菌株分布广泛、适应能力强且具有一定的应用价值而被人们广泛关注,在农业、环境和工业等领域具有较大应用潜力[34]。溶磷功能是马赛菌属所具有功能中的一种[35]。由于磷是植物生长的必需元素,但是过多的磷素被土壤中Ca2+、Fe3+和Al3+固定成植物不可利用的磷形态,而马赛菌属具有溶磷功能,不仅能提高土壤中有效磷含量,还可以改善土壤环境。如图10a所示,马赛菌属在表层土壤中与TN、TP 均呈极显著负相关。这可能是由于从2020 年7 月到2021 年3 月菜地土壤各处理组TP 含量和马赛菌属相对丰度增加,导致TP 中其他形态的磷减少,进而使马赛菌属与TP呈负相关。如图10a所示,溶杆菌属(Lysobacter)与TN 呈极显著正相关,这表明TN 是影响其活性的主要环境因子。溶杆菌属是一种对真菌、革兰氏阴性菌、革兰氏阳性菌和线虫有突出拮抗作用的菌属[36],具有独特的滑动性和溶菌活性,这使其在生物防治方面具有很大优势[37],但是土壤中溶杆菌属对人体的安全性还需要进行严格的风险评估[38]。
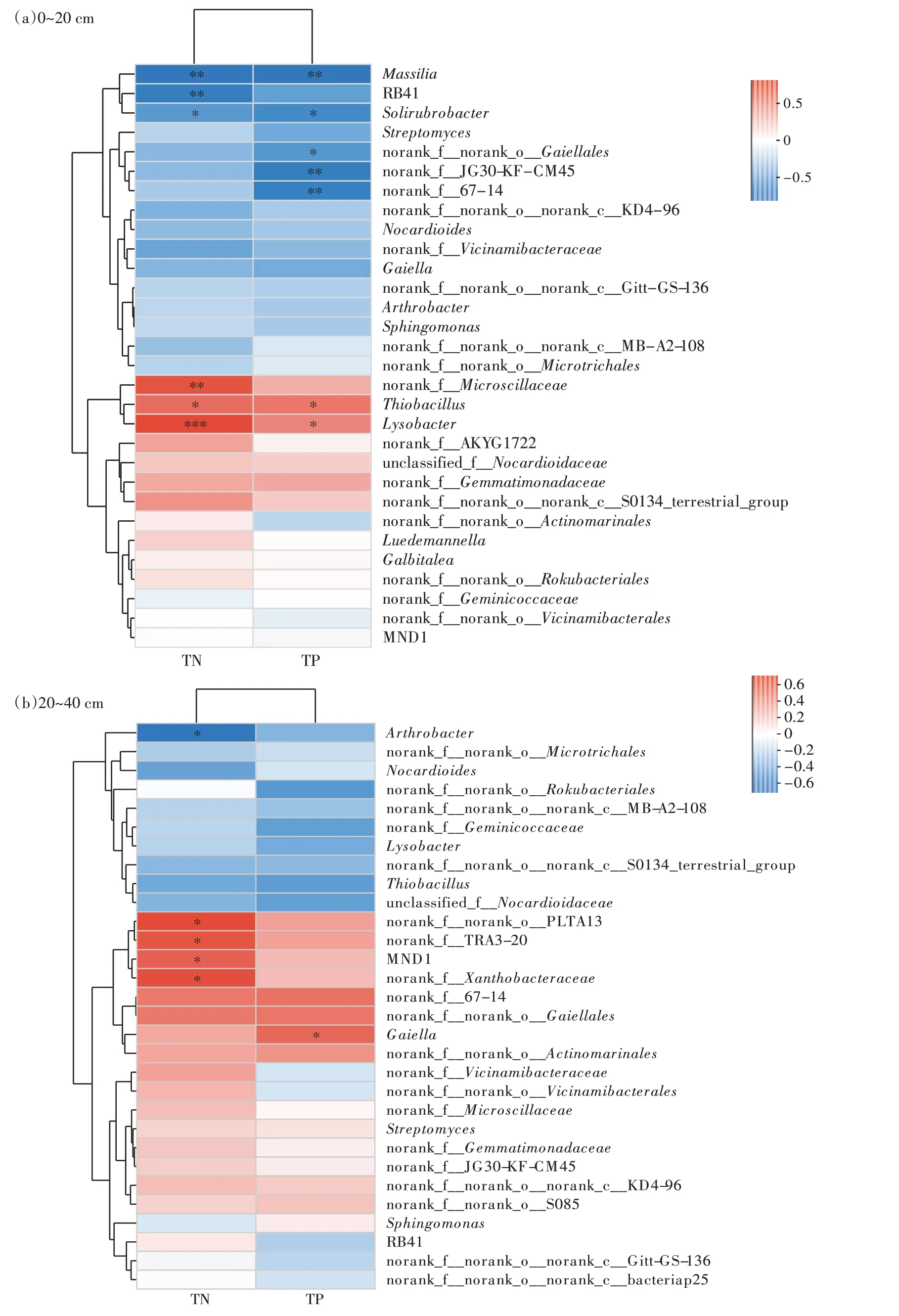
图10 各土层不同处理组土壤环境因子与土壤细菌群落组成热图Figure 10 Heatmap of soil environmental factors and soil bacterial communitiy composition in different treatment groups in each soil layer
土壤微生物作为土壤生态系统中最重要、最活跃和敏感的组成部分,参与其中的养分转化、物质循环等过程,在改善土壤环境、培肥土壤以及促进植物吸收利用营养物质和生长发育等方面发挥着非常重要的作用。所有土壤微生物中,细菌的丰富度最高,是衡量土壤质量和健康程度、反映土壤环境条件的重要标志之一[39-40],其数量、多样性以及群落结构组成特征的变化均会影响土壤肥力和农田的可持续生产力。建设土壤渗滤系统会改变庭院菜地土壤性质,影响庭院菜地土壤环境,进而改变庭院菜地土壤细菌的群落结构,对庭院菜地土壤质量和生态系统的稳定性产生一定的影响[41]。
2.3 土壤渗滤系统处理农村黑灰水对庭院菜地土壤卫生指标的影响
2021 年3 月时各处理组表层土与深层土卫生学指标如表8 所示。各处理组两土层粪大肠菌值均远远大于10-4且蛔虫卵死亡率均达到100%,达到《粪便无害化卫生要求》(GB 7959—2012)中兼性厌氧发酵粪大肠菌值和《农村户厕卫生规范》(GB 19379—2012)户厕卫生状况与粪便处理的卫生要求中湿式设施粪大肠菌值最低要求,并且未处理农村黑灰水的土壤粪大肠菌值(表9)也远高于10-4,蛔虫卵死亡率达到100%,这表明经过土壤渗滤系统处理农村黑灰水前后的庭院菜地土壤卫生学指标无明显变化且均符合卫生安全要求。

表8 处理后各处理组各土层卫生指标Table 8 Hygienic index of soil in each treatment group after infiltration treatment

表9 处理前菜地土壤各土层卫生指标Table 9 Hygienic index of each soil layer of vegetable soil before infiltration treatment
2.4 土壤渗滤系统处理农村黑灰水对蔬菜卫生指标的影响
如表10 所示,通过分析示范户菜园白菜、黄瓜、水萝卜的卫生指标发现,白菜、黄瓜和水萝卜粪大肠菌群数均小于3 MPN·g-1,达到《食品安全国家标准食品微生物学检验 大肠菌群计数》(GB 4789.3—2016)中大肠菌群数最大可能数(MPN)检索表中最低值,蛔虫卵死亡率也均达到100%。此外,通过选择一未利用土壤渗滤系统处理的菜地种植的蔬菜与此示范户种植的蔬菜进行对比,结果表明两种菜地土壤卫生学指标无显著差异(P>0.05),粪大肠菌群数和蛔虫卵死亡率同样均达到《食品安全国家标准食品微生物学检验大肠菌群计数》要求,这表明土壤渗滤系统处理农村黑灰水对蔬菜卫生学指标无显著影响,蔬菜具有食用安全性。

表10 不同庭院类型不同蔬菜卫生指标对比Table 10 Comparison of hygienic index of different types of vegetables in differernt gardens
3 结论
(1)在蔬菜种植期间,土壤渗滤系统处理农村黑灰水会显著提高菜地土壤TN、TP 含量。整体上,菜地各处理组两土层(0~20 cm 表层和20~40 cm 深层)TN 含量呈先上升后下降的趋势,TP 含量呈先上升后下降再上升的趋势。
(2)土壤渗滤系统处理农村黑灰水对菜地深层土壤细菌群落多样性和丰富度有促进作用,对菜地表层土壤细菌群落丰富度无显著影响;土壤渗滤系统处理农村黑灰水会降低菜地土壤致病微生物相对丰度;土壤渗滤系统处理农村黑灰水会提高硫杆菌属和节杆菌属相对丰度。
(3)土壤渗滤系统处理农村黑灰水对蔬菜粪大肠菌值无显著影响,蔬菜卫生学指标符合《食品安全国家标准食品微生物学检验大肠菌群计数》要求,具有食用安全性。
(4)经土壤渗滤系统处理农村黑灰水前后的菜地土壤粪大肠菌值均大于10-4,蛔虫卵死亡率均为100%,处理前后无明显变化。
