人工草场不同饲养模式对羔羊小肠脂肪消化和肝脏脂质代谢相关基因表达的影响
2022-03-30彭思嘉左淑贤王月君罗海玲张英俊王占军
李 贞 彭思嘉 左淑贤 王月君 罗海玲* 张英俊 王占军
(1.中国农业大学动物科技学院,动物营养国家重点实验室,北京100193;2.中国农业大学草业科学与技术学院,北京100193;3.宁夏农林科学院,银川750002)
我国自2000年以来为保护生态植被实行划区轮牧、休牧和禁牧封育的政策,在一定程度上限制了放牧家畜的规模[1]。消费市场规模的扩大以及草原牧区放牧受限,促使肉羊养殖逐渐由传统放牧向规模化舍饲转变。滩羊作为宁夏地方品种,因其肉质鲜嫩、膻味轻且具有独特的风味和口感而多次入选国宴。随着宁夏禁牧决策的实施,滩羊的生产方式由传统的天然草场放牧转为舍饲或者人工草场放牧[2],大量研究表明,饲养模式会影响羊肉品质[3-4]。肌内脂肪沉积是肉品质的影响因素,而脂肪沉积与机体脂类代谢相关。脂类是反刍动物体内重要的能源物质,饲粮脂类摄入后经瘤胃分解氢化,进入小肠消化吸收,产物通过血液循环运输至肝脏代谢转化,再进入循环系统被各组织利用,最后沉积在肌肉、脂肪等组织中。肌内脂肪沉积是动物机体脂质代谢动态平衡的最终结果,一定程度上受脂质代谢相关基因和酶的调控[5]。饲粮脂质约20%在空肠上部被吸收,约60%在空肠中后部吸收,即食糜到达回肠时基本完成吸收过程;脂肪酶在胆盐激活下,主要在空肠发挥作用[6]。而肝脏作为机体脂质代谢的主要场所,对来自脂肪分解产生的游离脂肪酸、瘤胃发酵产生的挥发性脂肪酸以及饲粮来源的长链脂肪酸等代谢产物进行转化和分配[7]。
本试验前期研究已经发现,不同饲养模式下羔羊肌肉脂肪酸含量存在显著差异,放牧和放牧补饲模式均可增加羊肉中n-3多不饱和脂肪酸的含量,降低饱和脂肪酸的含量,改善羊肉脂肪酸组成[8];另外,舍饲滩羊肌内脂肪含量及各部位体脂沉积均显著高于放牧滩羊[9]。现有研究多集中于不同饲养模式对羔羊生产性能和肉品质的影响,但对于羔羊机体内部脂质代谢过程的关注较少。小肠和肝脏作为动物摄入饲粮脂质后消化代谢的重要场所,饲养模式的改变可能会导致小肠脂肪的消化吸收和肝脏脂质代谢的过程产生差异,从而引起不同饲养模式下羊肉脂肪酸沉积的差异。鉴于此,本试验旨在研究不同饲养模式对羔羊小肠脂肪消化吸收和肝脏脂质代谢相关基因表达的影响,为解释肌肉脂肪沉积和脂肪酸含量及组成的差异提供理论依据。
1 材料与方法
1.1 试验动物及饲养管理
饲养试验于2019年7月至10月在宁夏回族自治区固原市原州区头营镇马园村(东经106°26′,北纬36°14′,平均海拔1 600 m)进行。试验所用人工草地分为4个放牧小区,每个小区面积为516 m2,草地为15%苜蓿(alfalfa)、35%草地早熟禾(Poapratensis)和50%草地雀麦(Bromusriparius)的混播组合,亩播量为4.5 kg。
选用体重[(19.69±0.29) kg]相近的3月龄断奶滩羊公羔33只,随机分为舍饲组(H组)、人工草场放牧补饲组(GH组)和人工草场放牧组(G组),每组11只。H组每天07:30和17:30进行饲喂,保证1~2 h活动时间;GH组每天07:00—11:00进行放牧,归牧后进行补饲;G组每天07:00—19:00进行放牧,不单独补饲。每天将羊在4个放牧小区中轮流放牧,放牧结束后,所有羊归圈。试验期间自由饮水,预试期7 d,正试期90 d。其中,H组和GH组滩羊单栏饲养,采用颗粒料、玉米秸秆和苜蓿干草按75%、15%和10%比例充分混合后饲喂。通过预试期调整饲喂量,保证每次饲喂剩料量为总量的5%~15%。试验饲粮参考NRC(2007)肉用绵羊的营养需要,按照试验羊体重30 kg,日增重200 g的营养需要量进行配制,试验饲粮组成及营养水平见表1。人工草场牧草主要营养成分见表2。本试验前期已测得G组平均每天采食牧草干物质0.514 kg,GH组平均每天采食牧草干物质0.530 kg,采食混合饲粮干物质0.657 kg;H组平均每天采食混合饲粮干物质1.189 kg[9]。

表1 试验饲粮组成及营养水平(干物质基础)

表2 人工草场牧草主要营养成分(干物质基础)
1.2 样品采集
试验结束后,测得各组宰前活重(H组34.97 kg,GH组33.33 kg,G组23.53 kg)[9],所有羔羊宰前禁食12 h,自由饮水。采用清真屠宰法,在羔羊颈部放血处死后立即打开腹腔,分离肝脏,记录称重。分离小肠,排尽小肠内容物后用生理盐水冲洗干净,记录称重;其中小肠指数(%)=(小肠重量/宰前活重)×100。收集小肠(十二指肠、空肠、回肠)组织,用4%多聚甲醛固定后常温保存;取肝脏组织样品、小肠食糜保存于-80 ℃冰箱。
1.3 试验方法
1.3.1 小肠组织形态指标测定
剪取十二指肠、空肠和回肠各肠段约2 cm,生理盐水冲洗干净后置于4%多聚甲醛溶液中保存。制作石蜡切片,并经苏木素-伊红(HE)染色后,对染色后的切片进行拍照采集相关图像,使用Pannoramic Viewer软件测量肠道形态指标。
1.3.2 小肠食糜上清液脂肪酶活性测定
取-80 ℃保存的小肠食糜样品,4 ℃自然解冻,用SIGMA 3K15台式高速冷冻离心机(希格玛,德国)在4 ℃条件下26 515×g离心10 min,取上清液与4 ℃ 0.4 mol/mL KCl溶液按体积比1∶4进行稀释,使用南京建成生物工程研究所的脂肪酶测定试剂盒(微板法,货号A054-2-1)测定脂肪酶活性,试验步骤按照说明书进行,采用Thermo MK3酶标仪(赛默飞,美国)进行测定。
1.3.3 总RNA提取及cDNA合成
选用北京艾德莱生物科技有限公司的EASYspin Plus组织/细胞RNA快速提取试剂盒(货号RN2802)提取肝脏总RNA,使用Biospec-nano生命科学紫外可见分光光度计(SHIMADZU,日本)检测样本的RNA浓度和纯度。对提取的总RNA选用北京艾德莱生物科技有限公司的TRUEscript RT Kit(+gDNA Eraser)试剂盒(货号PC5402),建立20 μL 500 ng体系反转录合成第1链cDNA,于-20 ℃保存。
1.3.4 肝脏脂质代谢相关基因的引物设计及实时荧光定量PCR检测
根据NCBI查找绵羊(Ovisaries)的相应基因序列,设计脂质代谢重要调控基因[过氧化物酶体增殖物激活受体α(PPARα)、过氧化物酶体增殖物激活受体γ(PPARγ)、固醇调控元件结合转录因子1(SREBF1)]、脂肪酸氧化过程相关基因[长链酰基辅酶A合酶1(ASCL1)、肉碱棕榈酰转移酶1(CPT1)、肉碱棕榈酰转移酶2(CPT2)]和乙酰辅酶A代谢过程相关基因[β-羟基-β-甲基戊二酸单酰辅酶A合酶1(HMGCS1)、β-羟基-β-甲基戊二酸单酰辅酶A裂解酶(HMGCL)、β-羟基-β-甲基戊二酸单酰辅酶A还原酶(HMGCR)]的特异性PCR引物,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,引物序列信息见表3,委托北京擎科生物科技有限公司进行引物合成。

表3 引物序列
使用LineGene 964 BIOER荧光定量PCR检测系统(杭州博日科技有限公司)进行实时荧光定量PCR试验,选用北京艾德莱生物科技有限公司的2×Sybr Green Qpcr Mix(货号PC3302),建立20 μL反应体系,包括:12.5 μL 2×SuperReal PreMix Plus,0.5 μL正向, 0.5 μL反向引物,1 μL cDNA 模板,RNase free ddH2O补齐至20 μL。采用两步法进行扩增,PCR反应程序为:1)恒温段,95 ℃预变性2 min;2)循环段,95 ℃变性15 s,60 ℃退火34 s,共40个循环,收集荧光信号;3)熔解段,对熔解曲线进行分析,曲线为单一峰则为特异性扩增,无非特异性扩增或引物二聚体。
试验中每个样品的每个基因做3个技术重复,结果取平均值,采用2-△△Ct法计算目的基因在样本中的相对表达量,其中:
△Ct=(Ct目的基因-Ct内参基因);
△△Ct=(△Ct试验组-△Ct对照组)。
1.4 统计分析
采用Excel 2016进行原始数据的统计和整理,导入SPSS 21.0软件进行单因素方差分析,采用Duncan氏法进行多重比较检验,当P<0.05时表示差异显著。
2 结 果
2.1 不同饲养模式对羔羊小肠重量及指数的影响
由表4可知,G组的小肠重量显著高于H组(P<0.05);3组间小肠指数存在显著差异(P<0.05),其中G组最高,H组最低。

表4 不同饲养模式对羔羊小肠重量及指数的影响
2.2 不同饲养模式对羔羊小肠形态的影响
十二指肠、空肠和回肠组织形态分别如图1所示。

标尺代表1 000 μm。H:舍饲组;GH:人工草场放牧补饲组;G:人工草场放牧组。下图同。
由表5可知,H组和GH组十二指肠、回肠的绒毛高度及绒毛高度/隐窝深度均显著高于G组(P<0.05),G组空肠的隐窝深度显著高于H组和GH组(P<0.05),G组和GH组空肠的肌层厚度显著高于H组(P<0.05)。
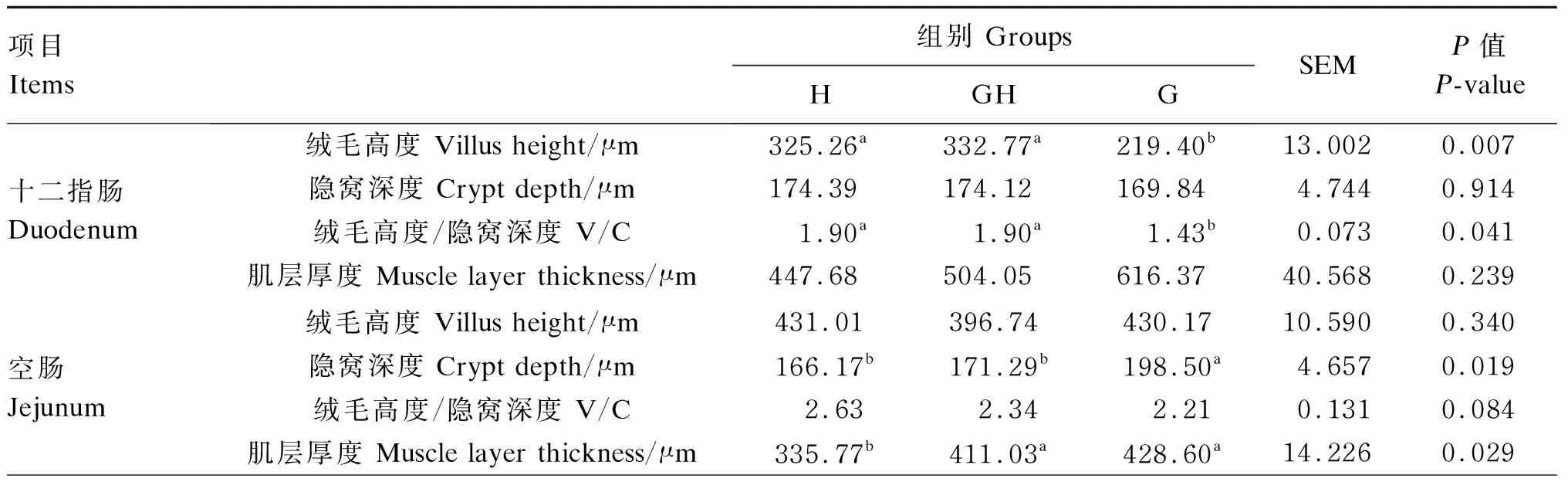
表5 不同饲养模式对羔羊小肠形态差异的影响

续表5项目 Items组别 GroupsHGHGSEMP值P-value回肠Ileum绒毛高度 Villus height/μm514.81a490.61a393.31b10.944<0.001隐窝深度 Crypt depth/μm191.10176.97174.725.5130.440绒毛高度/隐窝深度 V/C2.81a2.84a2.27b0.1010.046肌层厚度 Muscle layer thickness/μm320.31389.89383.0514.3080.112
2.3 不同饲养模式对羔羊小肠脂肪酶活性的影响
由图2可知,不同饲养模式下,H组的羔羊空肠食糜上清脂肪酶活性显著高于G组(P<0.05);各组间羔羊十二指肠和回肠食糜上清脂肪酶活性无显著差异(P>0.05)。

数据柱标注不同字母表示显著差异(P<0.05)。下图同。
2.4 不同饲养模式对羔羊肝脏代谢相关基因表达的影响
2.4.1 不同饲养模式对羔羊肝脏脂质代谢重要调控基因表达的影响
由图3可知,不同饲养模式对羔羊肝脏PPARα、PPARγ、SREBF1基因相对表达量均无显著影响(P>0.05)。

图3 不同饲养模式对羔羊肝脏脂质代谢重要调控基因表达的影响
2.4.2 不同饲养模式对羔羊肝脏脂肪酸氧化过程相关基因表达的影响
由图4可知,H组羔羊的肝脏CPT1基因相对表达量显著高于G组(P<0.05);3组间肝脏ACSL1、CPT2基因相对表达量无显著差异(P>0.05)。

图4 不同饲养模式对羔羊肝脏脂肪酸氧化过程相关基因表达的影响
2.4.3 不同饲养模式对羔羊肝脏乙酰辅酶A代谢过程相关基因表达的影响
由图5可知,H组羔羊的肝脏HMGCL、HMGCR基因相对表达量显著高于G组(P<0.05),3组间肝脏HMGCS1基因相对表达量无显著差异(P>0.05)。
3 讨 论
3.1 不同饲养模式对羔羊小肠重量及指数的影响
在羔羊出生时小肠尚未发育完全,随着年龄增长、饲粮类型的改变逐渐完善其功能直至成熟,因此,饲粮的变化会对小肠发育产生重要影响[10]。研究表明,在断奶阶段,羔羊从采食母乳转为固体饲料,这极大刺激了消化器官形态的发育,小肠重量在120~160日龄快速增长,到200日龄时逐渐趋于成熟[11]。本研究试验动物为3月龄滩羊羔羊,在试验期内正处于120~160日龄快速增长的时间段,G组羔羊小肠重量显著高于H组,这可能是因为放牧模式下羔羊采食的新鲜牧草比舍饲模式下饲喂的饲粮粗纤维比例更高,能刺激肠道促进其发育;同时也可能是在营养水平较低的情况下机体优先保证肠道发育,让小肠有更大表面积发挥消化吸收功能[12]。此外,G组小肠指数最高,其原因是在小肠重量更高的情况下,G组宰前活重更低,从而导致小肠指数提高[9]。
3.2 不同饲养模式对羔羊小肠形态的影响
小肠的消化功能与肠道形态密切相关[13],小肠绒毛的高度增加表明小肠吸收表面积增大,对营养物质的吸收增强;隐窝深度反映细胞生成率,其增加表明成熟细胞比例低,细胞分泌功能较弱,影响吸收功能的发挥。而绒毛高度/隐窝深度可以综合反映小肠的消化吸收功能及健康程度,比值升高时,肠道上皮细胞数量增加,肠道吸收面积增大,提高营养物质的吸收利用率;反之则可能存在肠道病变如黏膜受损,影响肠道功能[14-15]。本试验中,G组十二指肠及回肠的绒毛高度、十二指肠的绒毛高度/隐窝深度显著低于其他2组,而其空肠的隐窝深度显著高于其他2组,这与孙娟[10]的研究结果一致,可能是因为饲粮的营养物质水平不同,GH组和H组饲粮的能量和蛋白质水平更高引起的。但刘学良等[16]的研究结果表明,放牧较舍饲饲粮中粗饲料比例更高,滩羊十二指肠绒毛高度更高,这可能与具体采食牧草种类、饲粮精粗比及品种等有关。另外,肠道肌层可以节律性收缩,其厚度增加利于小肠食糜与消化酶充分接触[17]。空肠是小肠消化吸收营养物质的主要部位,GH组和G组空肠肌层厚度显著高于H组,说明其小肠的蠕动能力增强,更利于食糜与消化酶的充分接触。但也有研究认为,较薄的胃肠道壁是动物提高营养物质通过率的一种适应性机制[18-19],因此H组的空肠肌层厚度低也可能代表其营养物质吸收能力更强。综上所述,舍饲和人工草场放牧补饲模式下的羔羊可能因为饲粮营养水平更高,促进了小肠的形态发育,有利于小肠对营养物质的消化吸收。
3.3 不同饲养模式对羔羊小肠脂肪酶活性的影响
消化酶的分泌和活性可直接影响小肠对营养物质的消化率,消化酶活性主要与品种、日龄、饲粮和环境有关[20]。脂肪酶主要是将甘油三酯水解为甘油和脂肪酸,反刍动物小肠内脂肪酶主要来源于胰腺,生成后随胰液排入小肠[21]。羔羊小肠不同部位的pH不同,会影响消化酶功能的发挥。十二指肠内pH较低会影响脂肪酶活性,空肠脂肪酶活性显著高于十二指肠和回肠,因此脂肪酶主要在空肠中发挥作用[6]。孙娟[10]研究发现,动物摄入饲粮脂肪更多,脂肪酶活性更高,放牧补饲比自然放牧可以显著提高羔羊空肠脂肪酶活性,这与本试验的结果一致,舍饲模式羔羊空肠的脂肪酶活性高于人工草场放牧模式,利于脂肪消化。
3.4 不同饲养模式对羔羊肝脏代谢相关基因表达的影响
3.4.1 不同饲养模式对羔羊肝脏脂质代谢重要调控基因表达的影响
肝脏在脂类的代谢过程中起重要作用,因此研究肝脏脂质代谢相关基因的表达有助于进一步了解不同饲养模式下机体脂质代谢的差异。PPARα在肝脏中高度表达,主要是调控脂肪酸氧化过程涉及的基因表达[22]。PPARγ是动物脂肪生成的关键转录调控因子,能够直接调控脂肪细胞分化和脂类代谢相关基因的表达[23-24]。SREBF1是脂质代谢的重要参与者,能调控脂肪酸合成和摄取过程相关基因的表达[25]。本试验中,不同饲养模式对羔羊肝脏PPARα、PPARγ、SREBF1基因相对表达量有一定影响,但并未达到显著水平,说明饲养模式的改变可能通过调节其他基因表达影响机体脂质代谢。
3.4.2 不同饲养模式对羔羊肝脏脂肪酸氧化过程相关基因表达的影响
ACSL1是PPARα的靶基因,研究发现小鼠注射PPARα激动剂时肝脏ACSL1基因相对表达量显著上调[26]。本试验中3组间ACSL1基因相对表达量无显著差异,这可能与ACSL1基因表达受多途径调控相关,但其中具体机制尚不清楚。CPT1和CPT2是一对移位酶,也是脂肪酸β氧化过程的限速酶。本试验中,舍饲模式下肝脏CPT1基因相对表达量显著高于人工草场放牧模式,CPT1基因表达上调说明脂肪动员作用加强,机体需要脂肪酸供能,可以促进脂肪酸的转运,肝脏线粒体脂肪酸的氧化作用增强。有研究表明,随着乌金猪饲粮能量或者蛋白质水平的变化,CPT1基因相对表达量也受到影响[27-28],这说明H组饲粮的能量或蛋白质水平可能与G组存在显著差异。虽然CPT1和CPT2都是PPARα调控的靶基因,但是在本试验中各组肝脏CPT2基因相对表达量差异不显著,表现出H组高于G组的相对变化趋势,这与PPARα基因相对表达量结果相似,而CPT1基因相对表达量有显著差异可能是由于CPT1基因表达还受其他通路或基因的调控,但还需要进一步研究。
3.4.3 不同饲养模式对羔羊肝脏乙酰辅酶A代谢过程相关基因表达的影响
HMGCL催化乙酰乙酸的生成,是该过程的限速酶[29]。在本试验中,H组肝脏HMGCL基因相对表达量显著高于G组,说明H组羔羊机体肝脏乙酰乙酸合成作用更强。HMGCR是乙酰辅酶A合成胆固醇的限速酶,该酶控制20多个后续的酶反应[30]。研究发现HMGCR的磷酸化会抑制其活性,在肝脏中,HMGCR主要被腺苷酸激活蛋白激酶(AMPK)磷酸化。因此抑制AMPK活性能激活HMGCR,增加胆固醇合成[31]。本试验中,H组肝脏中HMGCR基因相对表达量显著高于G组,说明H组羔羊胆固醇合成更为活跃。
4 结 论
综上所述,在本试验条件下,与放牧模式相比,舍饲和人工草场放牧补饲模式提高了羔羊小肠绒毛高度和绒毛高度/隐窝深度,且降低了隐窝深度,有利于小肠形态发育;在舍饲模式下空肠脂肪酶活性更高,这有利于脂肪在小肠的消化、吸收;在舍饲模式下羔羊肝脏脂质代谢相关基因CPT1、HMGCL、HMGCR的相对表达量显著上调,从而利于体脂沉积。
