家禽重要性状的基因组学研究与应用现状
2022-03-30欧阳清渊胡深强王继文
欧阳清渊,胡深强,王继文
(四川农业大学动物科技学院,成都 611130)
家禽的育种工作始于20世纪初,接近一个世纪的传统育种使得家禽的多项生产性能逼近表型选育极限值。基因组学技术的发展成为进一步综合提升家禽各项生产性能的新途径。基因组学利用现代生物学技术与分析方法获得物种基因组序列并鉴定基因的功能[1],家禽基因组学研究的重点在于那些与重要性状相关的区域,并利用这些区域在遗传图谱和物理图谱中的位置来改良家禽品种。
鉴定与重要性状相关的区域其关键在于要结合表型和基因组上的变异信息。基因组的变异类型主要分为单核苷酸突变(single nucleotide polymorphism, SNP)、插入和缺失(insertion and deletion, Indel)和拷贝数变异(copy number variations, CNVs)3类。检测全基因组范围内变异信息的技术手段是多样的,包括芯片技术、简化基因组测序(reduced-representation genome sequencing, RRGS)[2]和全基因组重测序等技术。全基因组关联分析(genome-wide association studies, GWAS)是重要性状功能基因鉴定常用的分析方法[3],其基于测序和芯片技术在全基因组范围内寻找与重要经济性状相关联的遗传变异。选择消除分析也是挖掘人工驯化过程中和物种适应性进化中受选择基因的普遍策略[4]。多种测序技术和分析手段在家禽基因组上的综合运用,加快了我们对于家禽重要性状的认识和理解,并筛选到一批能够应用于家禽重要性状的基因组选择育种分子标记。这些研究和应用为进一步综合全面提升家禽各项生产性能提供参考,本文对这些信息进行综述。
1 家禽参考基因组序列
基因组学研究依赖于基因组的构建。2004年,鸡的第一个基因组草图构建完成[5],标志着家禽的基因组时代正式来临。家禽参考基因组的大小(1 Gb左右)仅为哺乳动物的一半,但其基因数目仅略少于哺乳动物,其重复元素的收缩、118个大的共素块的缺失以及相关基因的丢失被认为导致了其特有的紧凑基因组大小[6]。伴随着高通量测序技术的更新换代,家禽基因组也得到了飞速的发展,鸡、鸭、鹅等家禽的基因组已更新升级,红色原鸡的基因组已正式进入6.0版本(表1)。鸭基因组序列与鸡基因组序列相比,某些免疫基因家族中检测到特异性复制,如防御素和亲丁酚类基因,这可能有助于其对许多流感毒株的自然抗性[7]。基因组组装和注释的完整性直接决定功能基因和位点筛选的准确性。近年来,家禽的基因组组装也从scaffold逐渐向染色体层面过渡,反映其质量的Contig N50和Scaffold N50得到提高,连续性显著提升,并且性染色体(ZW)也逐渐被组装完整。家禽独特的性染色体特征也得到了广泛关注,研究报道显示,鸡的性染色体具有拟常染色体区域高度分化和W染色体完全退化的特点[8]。然而,在对包括鸡和鸭在内的17种鸟类的性染色体进行比较基因组分析的时候,发现并不是所有鸟类的W染色体都和鸡一样完全退化[9]。由于性染色体的组装难度和程度,家禽内部性染色体的比较主要发生在鸡和鸭之间。与鸡相比,鸭的性染色体分化程度较低,其W染色体保留了比鸡多2.5倍的基因[10]。家禽性染色体参考基因组序列的成功组装使得定位一些与性别连锁的性状基因的遗传位点成为可能。
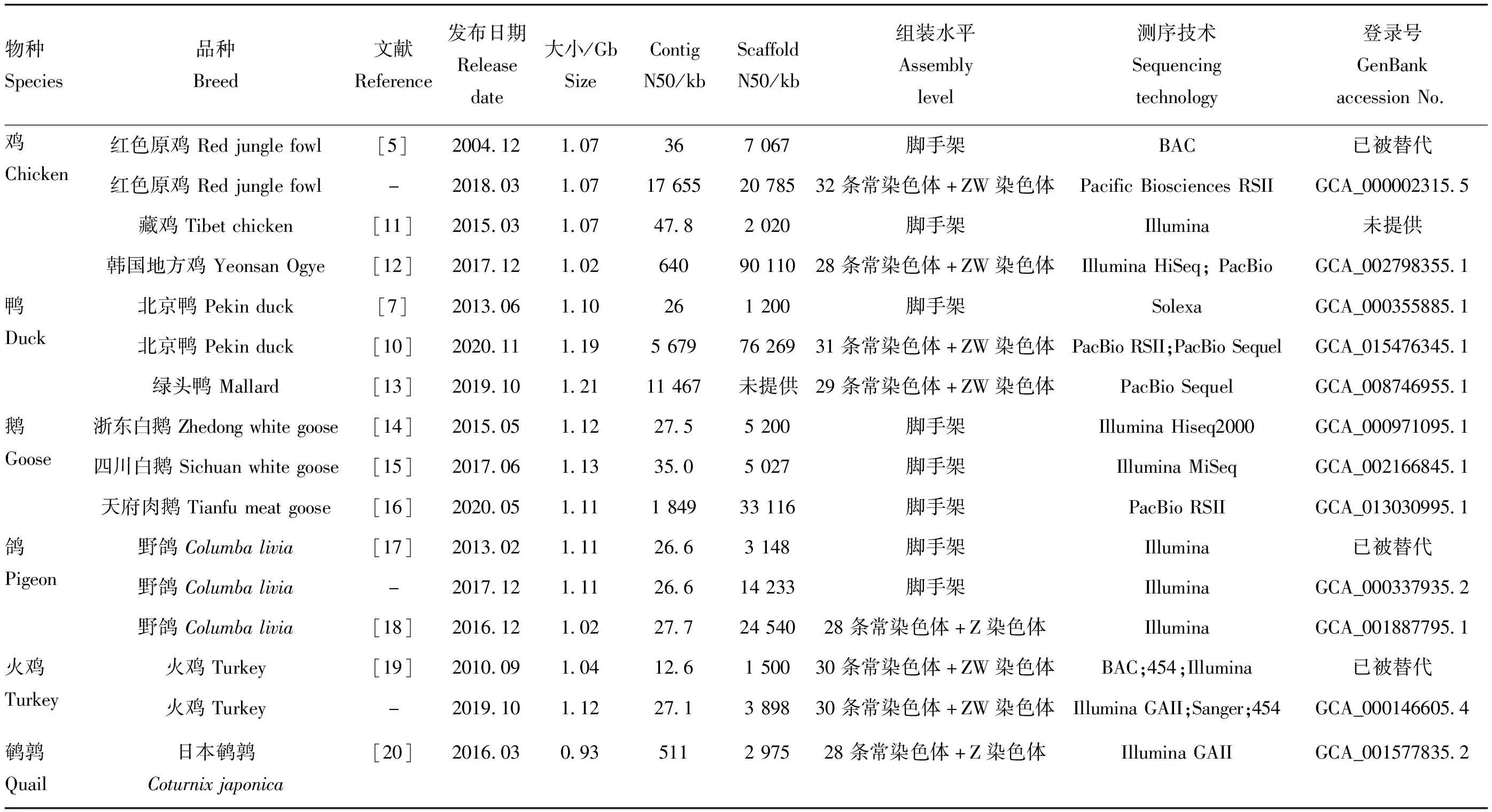
表1 家禽参考基因组基本情况
2 家禽重要性状的功能基因鉴定和定位
2.1 家禽外貌性状的功能基因鉴定和定位
外貌性状作为消费者可以直观辨别的典型特征受到育种学者的广泛关注,对这些性状的遗传机制开展研究,可能会为家禽提供独特的品种特征。应用基因组学技术,研究学者对家禽的颜色、羽毛发育和头部特征等外貌性状均展开了研究。
2.1.1 家禽色素相关功能基因的鉴定和定位 羽毛、皮肤和胫等不同部位多样的色素沉着能够满足消费者对不同颜色家禽的需求。关于羽毛的色素沉积得到了最广泛的关注,Park等[21]利用279只鸡的60K SNP芯片数据结合其表型进行了GWAS分析,估计了鸡毛色的遗传力,表明鸡羽色是一个多基因性状,并且发现了MC1R、TYR、PMEL、MLPH、ASIP、SOX10和SLC34A2与羽毛黑色素沉着相关。Yang等[22]通过构建黑羽与花羽鸡的资源群体定位到与鸡羽毛黑色素沉积相关的NUAK1和SHH基因。不同鸭品种之间,羽色也存在较大的差异,Zhou等[13]构建了白羽的北京鸭和绿头野鸭的参考资源群体,发现鸭基因组中MITF基因内含子的6.6 kb片段插入导致其剪接方式发生变化使鸭产生白羽性状。Wang等[23]通过对不同羽色类型的建昌鸭进行重测序也证实了MITF基因与鸭白羽性状相关,并且MC1R基因与麻羽表型相关。Xi等[24]对灰羽和三点花的钢鹅进行重测序,比较分析发现EDNRB2基因中14 bp的缺失插入与鹅不同的羽色表型相关。鹌鹑通常都表现麻羽性状,其深浅程度存在差异,Wu等[25]通过种群重测序和GWAS,在Z染色体上发现了包含CCDC171和TYRP1基因一个选择性扫描区的单倍型与栗色和黄色羽毛密切相关。鸽子的NDP基因也被证实与4种不同的羽色表型相关[26]。黄羽性状在肉鸡消费市场中往往能够获得较高的收益,Huang等[27]利用黑色和黄色的鸡进行重测序后筛选到可能与黄羽性状相关的RALY、LGR4、SLC23A2和SLC2A14等候选基因。随后,有学者基于阿纳克红鸡的杂交商业品系和惠阳须鸡构建的F2群体,利用全基因关联技术定位到CABLES1、CHST11、BCL2L1和CHD22与三黄鸡的黄羽性状相关[28]。在五花黄鸡与红色原鸡的比较基因组研究结果中也发现PMEL和TYRP1是控制黄羽性状的候选基因[29]。除了羽色以外,家禽的肤色、胫色和眼睑等也呈现出不同颜色的变异。家禽的肤色主要包括白肤、黄肤和乌皮3种类型,研究发现控制家禽黄肤和黑皮的功能基因是BCDO2[30]和EDN3[31-32]。胫色主要包括黄色、黑色、白色和豆绿色等,与鸡和鸭胫色相关的基因和位点最近均进行了定位[33-35]。SLCO4C1和TP63等基因也被证明参与了家禽红/白色耳垂的调控[36-37]。
2.1.2 家禽羽毛发育功能基因的鉴定和定位 在羽毛外貌特征方面,部分家禽具有无毛、丝羽和翻毛等性状,具有这些羽毛特征的家禽可能在一些特定的生产性状方面异于普通品种[38-39],这使得研究这些独特羽毛变异的调控机制显得尤其重要。Wells等[40]通过对有羽鸡和无羽鸡的血液DNA进行SNP芯片扫描,将控制无羽的基因定位到4号染色体上,并进一步精确到FGF20基因。Ng等[41]通过对一只卷曲杂合子基因型的公鸡和5只有正常羽毛母鸡的45只后代进行基因组芯片扫描,确定了KRT75保守区有一个69 bp的序列缺失与家禽的卷曲羽毛性状相关。Dorshorst等[42]使用SNP芯片将与丝羽性状相关的位点定位在3号染色体上的69.7 Mb区域。Feng等[43]通过对F2群体进行60K芯片扫描以及基因分型结合表型记录分析,进一步将控制丝羽性状的位点缩小在3号染色体的18.9 kb区间,并确定了一个位于PDSS2基因上游103 bp的与丝羽性状完全相关的SNP。毛腿性状作为某些品种家禽的特定性状,在对有毛腿和无毛腿性状的鸡进行全基因组重测序后通过比较其Indels变异,筛选到24个可能调控毛腿性状的基因[44]。
2.1.3 家禽头部特征功能基因的鉴定和定位 大多数家禽的头部具有典型特征,不同品种间差异的头部特征也成为识别家禽品种的重要标识。Shapiro等[17]在构建原鸽基因组的同时,对不同凤头性状的鸽子进行基因组重测序发现,EphB2与鸽的凤头性状密切相关。Zhang等[45]利用凤头鸭全基因组重测技术发现,Hoxc8、EphA2、EphA3、EphB2可能是与鸭凤头性状相关的候选基因。针对鸡头部冠型的差异,瑞典乌普萨拉大学研究团队利用基因组学技术展开了系列研究,结果发现SOX5 基因第一个内含子拷贝数的变异形成豆冠[46],7 号染色体一段 7.4 Mb 序列反转引起MNR2 同源结构域蛋白基因异位表达形成玫瑰冠[47],EOMES基因上游200 kb调控区20 kb片段串联重复则形成双冠[48]。喙畸形也是一种在鸡群中比例在3%左右的头部外貌特征,喙畸形家禽的采食量和饮水量均会降低从而导致生产性能的下降。Bai等[49-50]通过全基因组SNP和CNVs扫描,发现LRIG2可能是调控喙畸形的候选功能基因。
2.2 家禽生长性能的功能基因鉴定和定位
生长性能与生产效益直接相关,对于家禽育种十分重要。然而,由于生长性能受到多基因的调控,并且各学者开展试验的技术手段和材料存在差异,使得各项筛选得到的位点有差异(表2)。为核实测序结果的准确性,一些研究对筛选位点的功能做了进一步的验证,Liao等[51]通过GGRS检测了252只白来杭鸡的基因型,发现RBPJ基因与其体重密切相关,并进一步通过表达量检测探究了其参与表型调控的机制。Zhou等[13]利用1 024只鸭的重测序数据发现一种可能的远程调控突变导致IGF2BP1基因在出生后持续表达,这种突变可以使鸭的体尺增加15%,饲料效率提高6%。在表观遗传方面,Hu等[52]采用甲基化DNA免疫沉淀测序(methylated DNA immunoprecipitation sequencing, MeDIP-seq)方法,研究隐性白洛克和新华鸡的全基因组DNA甲基化模式,发现包括与生长发育相关的IGF1R、FGF12、FGF14、FGF18、FGFR2和FGFR3等75个基因的甲基化模式发生了改变。骨发育也是育种学家关注的重点[53-54],兴义矮脚鸡被认为是骨发育异常的品种,将其与正常骨发育个体杂交构建的家系进行全基因组扫描后分析,发现IHH基因是鸡匍匐性状的功能基因[55]。除了直接与生长发育相关的体重、采食量和骨发育以外,也有学者对屠宰性状(表3)控制区域进行了定位,利用简化基因组测序结果证明具有较高经济价值的鹅肥肝性能与ARAP2、GABRE和IL6等基因有关[56]。

表2 利用基因组学技术筛选与家禽生长发育相关候选基因试验
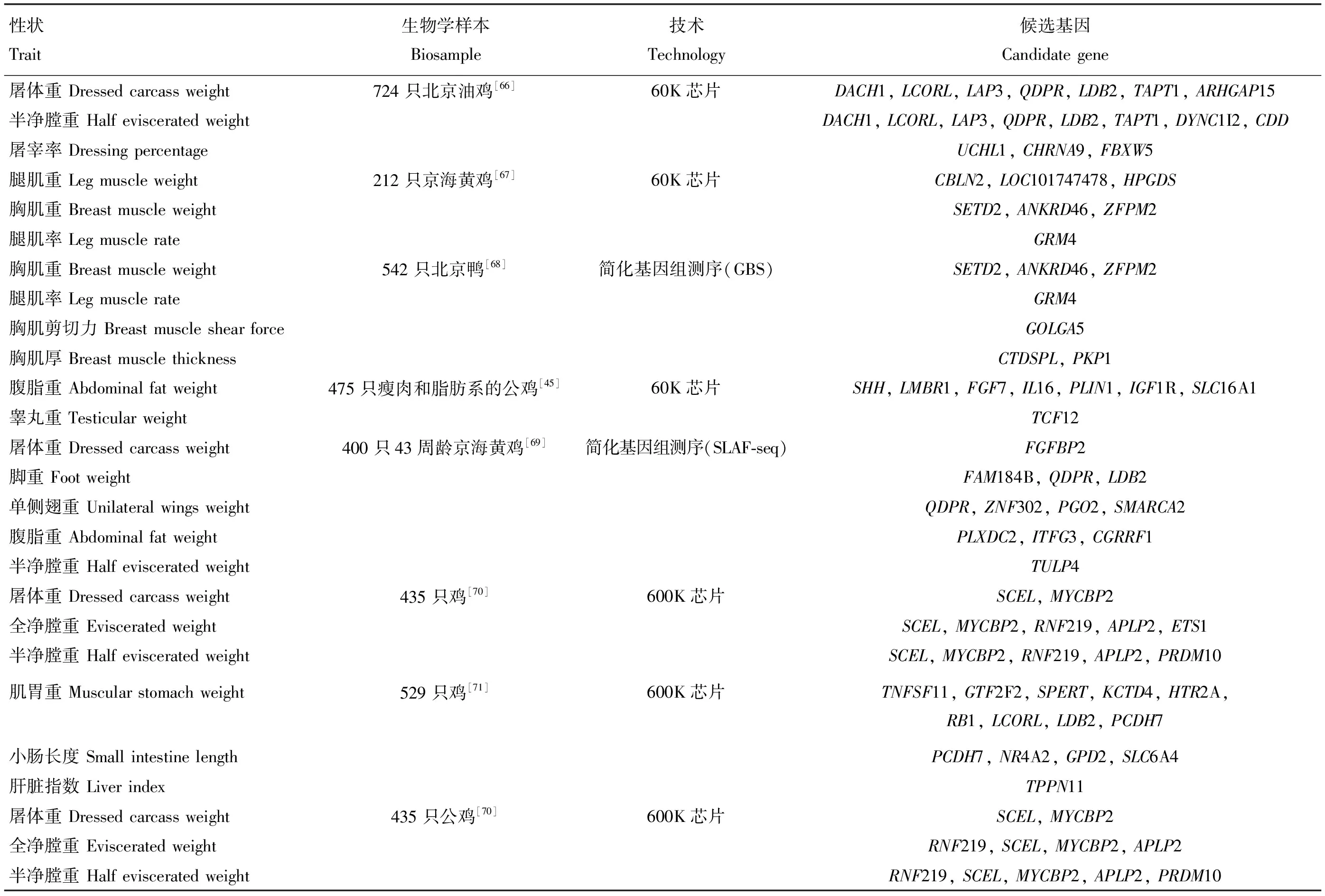
表3 利用基因组学技术筛选与家禽屠宰性状相关候选基因试验
2.3 家禽肉质性状功能基因的鉴定和定位
随着人们对肉质禽类产品需求的增加,家禽的育种目标也逐渐转向提高肉质。然而,以往过分选育肉的产量导致禽类肌肉异常发生率也大大增加,如PSE肉、白条纹肉和木质肉等[72]。白条纹肉作为家禽尤其是鸡中常见的肌肉疾病,对禽肉外观以及消费者的购买产生负面影响。白条纹肉具有0.19~0.34左右的遗传力[73],且含有较高的脂肪和较低的蛋白质[74-75],另外,白条纹肉的持水量和嫩度均转低,它们还表现出较高的烹饪损失[76]。针对这种禽肉的病理现象,育种学家也采用基因组学的方法进行了研究,发现鸡GGA1、GGA17和GGA18号染色体上的部分区域与白条纹肉有关,这些区域的候选基因与肌肉纤维再生和修复相关的肌肉结构和过程(MYH15、MYH1E、MYH1B、MYH1F、MYH13、MYOCD)、脂肪变性和纤维化(PDGFRα)、细胞外基质或肌膜组成(COL6A3、FN1、SGCB)、肌肉代谢(PNPLA7)和人类神经肌肉疾病(FN1、COL6A3、SGCB、LRSAM1)有关[77]。肉色也是影响消费者选择禽肉的主要视觉因素。多项试验针对禽类的肉色进行了GWAS分析[78-81],多个与肉色关联的区域和基因被筛选出来,其中β-胡萝卜素单加氧酶1(BCMO1)作为候选基因也在不同的试验中证明其功能与禽类的肉色有关[82-83]。肌间脂肪(IMF)可以通过提高肉的风味、多汁度和柔嫩度等途径提高肉的质量[84]。Liu等[85]通过59只鸡的55K SNP芯片数据和IMF表型数据发现,ACSL1、PPARα、ACADL、FABP6、FABP7、PLPP3、PNLIPRP1、MBOAT1和ALDH3A2这9个与脂质代谢相关的基因可能与肌肉的IMF有关。对鸡肌内脂肪和脂肪细胞的甲基化程度比较的试验研究结果发现,COL6A1基因启动子的甲基化水平可能与肌内前细胞增殖和分化有关[86]。
2.4 家禽繁殖性状功能基因的鉴定和定位
针对家禽繁殖性状的研究主要集中在产蛋量、蛋重和蛋壳颜色上(表4)。除了禽蛋的产量以外,禽蛋质量在近来也逐渐成为研究的热点。蛋白是消费者判断禽蛋新鲜程度的重要指标,遗传背景可以部分解释个体和品种之间蛋白质量的差异[87]。在众多的关于禽蛋蛋白质量的基因组学研究中,7号[88-90]和Z[91-92]染色体被多次证明与其相关。禽类的蛋黄由于其较高的营养价值在食品工业中被广泛的使用,Sun等[93]利用白来杭和东乡鸡的资源群体结合600K的SNP芯片数据证明蛋黄重量的遗传力为0.25~0.38,并确定了ZAR1、STARD13、ACER1b、ACSBG2和DHRS12可能与蛋黄的重量有关。相比于大量围绕母禽开展的研究,近年学者逐渐意识到公禽的繁殖性能可能也具有一定的遗传能力。Wolc等[94]通过收集白来杭鸡参考家系F9的1 239只和F6的1 575只公鸡的精液质量数据以及F7代的822只公鸡的600K SNP芯片数据,证实了公禽繁殖性能的遗传成分,但未发现有较大影响的QTL。Azmal等[95]也通过190只京红蛋鸡的600K SNP芯片数据结合亲本61~69周龄的受精率表型定位到与受精率相关的遗传位点。公禽精液品质和种蛋的孵化率仍然非常重要,遗憾的是,目前并没有相关的研究针对这两个性状进行基因组的定位。

表4 利用基因组学技术筛选与母禽繁殖性状相关候选基因试验
2.5 家禽抗病性功能基因的鉴定和定位
近年来,家禽高密度的饲养方式和遗传多样性的减少都增强了疾病暴发的可能性。虽然疫苗的出现可以适当缓解一些问题,然而想要更好地解决目前的疾病和阻止可能出现的威胁仍然需要改进控制措施。基因组学领域为解决或改善这些问题提供了途径。育种学家通过识别数量性状基因座和控制抗病性状的基因,利用现有生物多样性的知识对具有优良抗病性状的鸟类进行遗传选择。马立克病毒(MDV)是目前应用全基因组学技术研究最多的病毒,Wolc等[109]首次利用贝叶斯变量选择方法进行GWAS研究,确定与MDV感染蛋鸡死亡率相关的基因组区域位于2、3、4、9、15、18和21号染色体。随后,Li等[110]对57只易感马立克病毒鸡和10只抗性鸡进行全基因组SNP扫描,关联分析和qPCR试验验证发现,SMOC1基因可能与马立克病毒的抗性有关。Yan等[111]对可能涉及MDV抗性的两个鸡品系基因组中的CNVs进行了初步筛选,发现了许多系特异的拷贝数变异,筛选出了一些与该疾病抗性有关的基因,并发现MAPK信号通路可能在宿主对马立克病毒感染的反应中发挥重要作用。同样,利用全基因组范围内的CNVs扫描和分析,Bai等[112]在两个MDV抗性有差异的自交系中发现IRF2基因与鸡的MDV抗性有关。雏鸡患病比例较高的沙门菌同样也得到了关注,在对818只感染沙门菌后表现为死亡和携带者的鸡进行600 K芯片分型后,通过GWAS分析确定FBXW7和LRBA是参与沙门菌抗药性的候选基因[113]。新城疫病毒被证明具有中等遗传力,并通过GWAS分析发现其与ROBO1和ROBO2等基因相关[114-115]。鸭的病毒性肝炎由于传播速度快和致死性高严重危害产业发展,Xu等[116]通过GWAS分析发现,BCHE是一个测定鸭血浆胆碱酯酶(可区分肝病和非肝病)水平的功能基因。
2.6 家禽抗逆性功能基因的鉴定和定位
育种成功的一个关键要素是释放动物的遗传潜力,以使它们在各种环境条件下都能有最佳的表现。通常而言,虽然商品系家禽能够达到较高的生产水平,但其对环境的适应能力远低于地方家禽品种。热应激是影响家禽生产性能和肉类品质的环境因素之一,它可以使热休克因子和热休克蛋白在家禽组织中过度表达从而影响家禽组织的生理机能进而影响生产能力。在过去的几年中,一些全基因组选择的研究也涉及热应激反应的遗传和分子机制[117-118]。对气候的适应情况在不同家禽品种间也具有差异,844只台湾鸡和洛岛红杂交F2代60K SNP芯片数据和表型数据通过GWAS定位到与亚热带气候相关的遗传位点[119]。藏鸡是我国唯一的低氧高海拔环境下的地方家禽品种,Wang等[11]对一只雌性藏鸡进行de novo测序,并对5只红色原鸡和其他27只不同品种的家鸡进行了全基因组重测序,从头组装了一个藏鸡基因组,揭示了藏鸡高海拔低氧适应性进化的遗传机制。Jiang等[120]对54只藏鸡死胚和82只存活藏鸡进行60K芯片测序,发现FOXG1可能是藏鸡缺氧适应的主要候选基因。Zhang等[121]也通过全基因甲基化研究发现,藏鸡和低海拔地区鸡的甲基化模式存在差异,这将有助于未来与适应高海拔条件相关的表观遗传学研究。
3 家禽重要性状基因组学研究的应用
在遗传资源的鉴定和保护方面,通过基因组学技术筛选特定品种的分子标记,可以为家禽遗传资源保护提供有效保障,支持和引导家禽遗传资源监测评估。研究者们利用基因组重测序技术检测分析包括连城白鸭在内的12个鸭遗传资源的基因组特异性,并开发出一种采用SNP分子标记技术鉴别连城白鸭的方法[122]。寿光鸡和太湖鸡特异性鉴定的分子标记也同样得到了开发[123-124]。
对于较多的经济性状来说,育种学家通常整合基因组中与性状相关的突变位点应用到实践中。一般而言,基因组选择需要在参考群体中通过已知的表型和候选标记位点的基因型计算标记的效应;随后,根据估计的效应对已知表型和基因型的候选群体进行基因组育种值的估计;最后,根据基因组估计育种值对个体进行选留实现基因组的选择育种。2012年,美国安伟捷育种公司宣布将基因组选择技术应用于蛋鸡和肉鸡的商业育种流程,2017年开始在火鸡中应用,提高了20%到40% 的准确性。在蛋鸡繁殖性能方面,安伟捷公司同时对褐壳蛋鸡进行为期3年的基因组选择和表型选择,发现基因组选择可以缩小50%的世代间隔,并减少表型测定鸡饲养量的3/4[125]。美国科宝公司在2008年就开始研究胸肌重及腿病选育中基因组选择的应用,并于2015年将基因组选择全面纳入常规育种体系。近年来,中国育种工作者和企业在复杂性状方面也进行了应用。研究者们利用整合全基因组范围内与剩余采食量和产蛋数显著SNP标记效应的一步法全基因组育种值(GEBV)估计方法进行白羽肉鸡的选择,发现与常规一步法GEBV估计结果相比,剩余采食量和产蛋数的选择准确性分别可提高15.44%和8.1%,可缩短新品系育成的时间,节约选育的成本,提高育种效率,加快我国白羽肉鸡自主品系培育进程[126-127]。研究者们结合重测序技术和极端群体表型信息,筛选得到了5个种母鸡贮精能力性状候选位点,从而有效提高了种母鸡遗传改良的效率[128]。而对于更多位点控制的性状或需要同时对一些性状进行选育的时候,育种工作者通常在对中外不同家禽品种进行基因组测序的基础上,整合重要经济性状功能基因的显著位点,研制家禽商业育种芯片进行基因组选择育种。郝晓东等[129]在黄羽肉鸡的育种过程中应用基因组选择技术,发现其准确性相比BLUP更高,并且可以有效缩短世代间隔和表型测定数量,并且在多性状选育时能获得更佳的均衡性。Liu等[130]在724只北京油鸡群体中使用60K芯片对鸡的IMF进行了全基因组选择的应用,发现基因组选择F2代的IMF值比随机交配F2代的IMF含量增加了9.62%。在白羽肉鸡的育种工作中,对2 000只具有表型和全基因组55K芯片基因型的参考群体进行选择,结果显示胸肌率提高2.5%,腿肌率提高0.3%。
在品种培育方面,对于由单位点控制的性状而言,基因组学筛选到的功能基因位点可以在家禽育种工作中得到简单且有效的应用,目前在色素沉积方面的应用较为广泛。育种工作者基于前期基因组学分析确定的功能基因和关键位点,设计操作简单、准确率高的用于鉴别特定外貌基因型的PCR引物组合和分型方法,可加快选育具有特定性状家禽品种的育种进程,缩短育种时间。研究者们利用基因组筛选到的变异位点开发出的分子标记,可快速对特定部位特定颜色个体的基因型进行鉴定,区分开同一表型纯合和杂合个体,通过选留基因型纯合个体,可保证该群体留种的后代表型一致[131-134]。李光奇等[135]采用全基因组重测序技术对白来航品系突变进行研究,成功鉴定到一个位于 11 号染色体的羽色基因突变点,携带该突变的纯合型白来航母鸡与洛岛红公鸡杂交时,后代母鸡表现为红羽,根据该突变位点进行应用,培育出的蛋鸡新配套系实现了商品代母鸡红羽比例在98% 以上。
4 展 望
综上,家禽基因组参考序列组装程度的不断完善,为家禽重要性状基因组区域的挖掘提供了重要保障。随着高通量芯片和测序技术的发展,各国育种学家运用基因组学技术对家禽不同的性状展开的研究筛选到了大量的分子标记。然而,这些研究的应用多集中在家禽的外观、生产和繁殖性状中,对于肉质、抗病和抗逆性的研究还比较缺乏。在消费多元化和生物安全防控升级的时代背景下,加强基因组选择在家禽肉质、抗病和抗逆性等方面的研究和应用是后基因组时代家禽育种工作者应该关注的重点。另一方面,对于已有较多组学数据的性状而言,如果能够综合利用各种信息,如比较基因组的信息、受选择的信息、基因表达信息、调控信息和变异信息,将有助于更加精确地筛选与重要性状相关的变异位点。因此,一个整合、分析和可视化家禽基因组数据库的构建可能会加速这些分子标记应用到育种实践中的进程。
