基于流式细胞术的低值血小板检测方法的性能评价*
2022-03-30朱捷方佩琪潘柏申王蓓丽郭玮复旦大学附属中山医院检验科上海200032复旦大学附属中山医院厦门医院检验科福建厦门3605
朱捷,方佩琪,潘柏申,2,王蓓丽,2,郭玮,2(.复旦大学附属中山医院检验科,上海 200032;2.复旦大学附属中山医院厦门医院检验科,福建厦门 3605)
血小板是人体血液重要的组分,骨髓中的巨核细胞生成血小板后会释放入外周血液中,在循环中存活5~7 d[1]。一旦机体发生损伤或者血管破损,血小板会发生激活,黏附聚集在血管内皮破损处暴露出来的细胞外基质上,形成血栓物质,阻止机体出血并修复损伤[2-3]。临床上最为常见且危害严重的是免疫性血小板减少症(immune thrombocytopenia,ITP),成人发病率已经上升至每10万9.5人[4]。该病发病原因以及相关机制仍不明确,相关研究主要依赖于体外巨核细胞培养实验以及ITP小鼠模型[5-7]。在体外实验中,常使用小鼠幼肝、人骨髓和脐带血分选纯化CD34原始细胞,进一步将其诱导分化为巨核细胞后进行功能学研究[8-9]。在评估巨核细胞分化能力时,其所产生的血小板数量是一项重要的考察指标,但是培养体系中巨核细胞产生的血小板数量远远低于常规血液细胞分析仪的检测下限,而人工计数法耗时长,重复性差。流式细胞术是一种对溶液中单个细胞或者颗粒物质进行多参数分析的技术[10],本研究拟用流式细胞术检测低值血小板并进行性能评价。
1 对象与方法
1.1标本收集 选择2020年10月在复旦大学附属中山医院体检的表观健康人,入组50人,用于血小板分离和后续实验方法评估。入组条件:①无心血管疾病及肿瘤病史;②无血液病;③血小板数量处于参考区间内;④样本无脂血、黄疸、溶血。
1.2主要仪器与试剂 XN-2800血液分析仪(日本Sysmex公司),CantoⅡ流式细胞仪(美国BD公司),Thermo Scientific SL8台式离心机(美国Thermo公司)。
前列环素I2(prostaglandin I2,PGI2)(美国MCE公司),无钙台式液(雷根生物技术公司),绝对计数管(每管小球数量:46 900)及人抗体CD61(美国 BD公司),鼠抗体CD61(美国Biolegend公司),RPMI 1640培养基、胎牛血清(美国 Gibco公司),人重组SCF蛋白、人重组IL-3蛋白、人重组IL-6蛋白、人重组促血小板生成素(TPO)蛋白、人重组FLT-3蛋白(美国R&D公司),BLAB/c小鼠(上海斯莱克实验动物公司)。
1.3血小板前处理 在2 mL EDTA-K2抗凝血中添加PGI2(终浓度为50 ng/L),防止血小板激活发生聚集[11]。200 r/min离心10 min,吸取上层富血小板血浆,再次加入PGI2,3 000 r/min离心10 min,去除上层血浆。加入5 mL无钙台式液,重悬后3 000 r/min离心10 min,重复3次,每次离心前均添加PGI2以防止血小板聚集。最后将血小板重悬于1 mL无钙台式液中。用XN-2800血液分析仪检测血小板浓度5次并取平均值,作为基线值。
使用无钙台式液对血小板悬液进行梯度稀释,将1011/L血小板10倍稀释至10/L,备用。
1.4血小板计数 流式检测:在绝对计数管中加入50 μL血小板悬液,再加入5 μL CD61-PerCP抗体,充分混匀后暗室静置温育30 min。加入250 μL无钙台式液重悬,用CantoⅡ流式细胞仪检测。依照公式:血小板浓度=(检测获取的血小板数量/检测获取的微球数量)×[微球总数(固定值)/样品体积],换算得到血小板浓度。每份样品平行检测10次。具体设门方式见图1,在FITC通道圈门选取微球,在PerCP通道圈门选取血小板。门内设定收集至少50个血小板,图1列出不同血小板浓度下门内血小板收集情况。
手工样品检测:取10 μL血小板悬液进行牛鲍氏计数板充池,室温静置10~15 min,由2名资深检验科工作人员用双盲法进行血小板计数,在高倍镜下依次计数中央大方格内的四角以及正中共5个大方格内的血小板数量,每份样品平行计数5次,取均值。
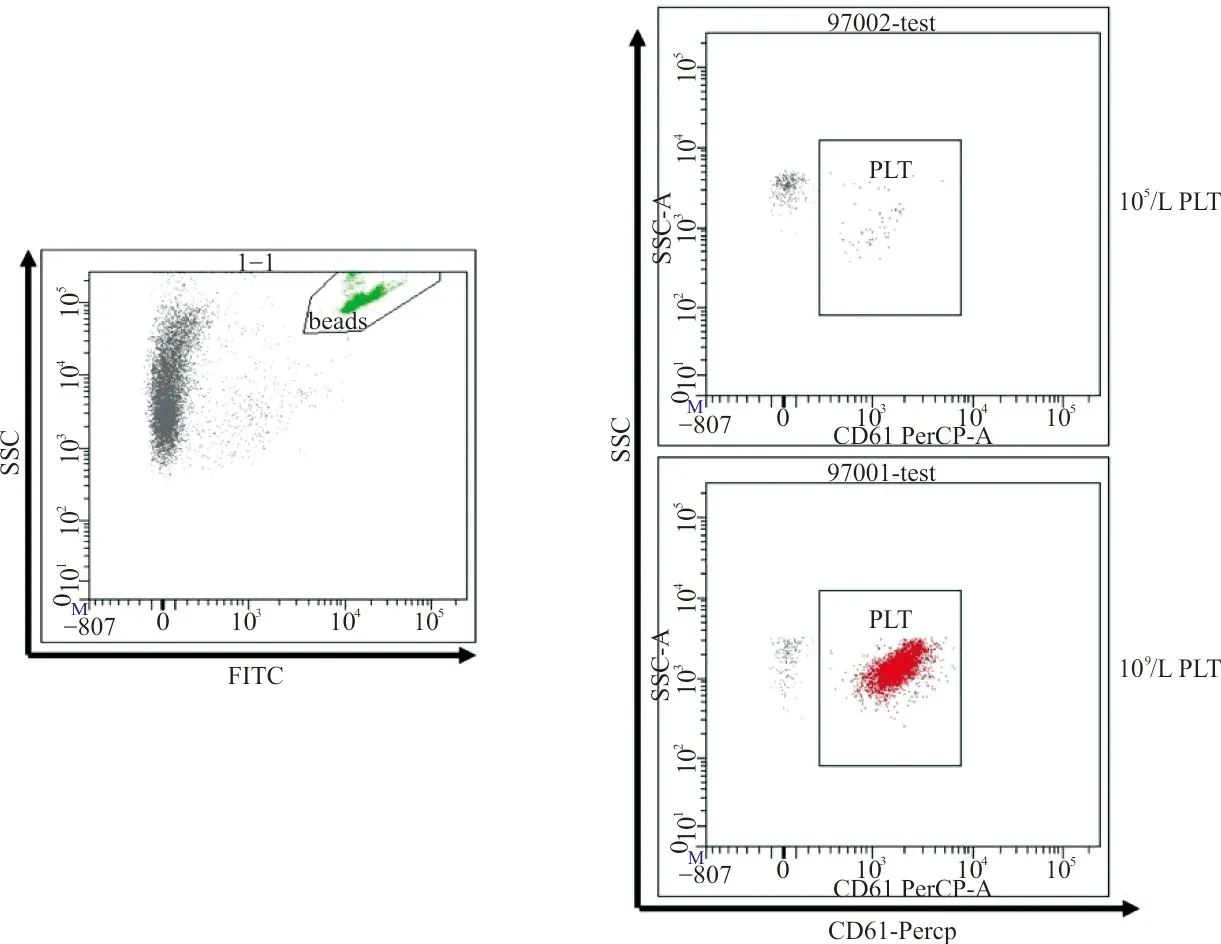
图1 流式方法检测血小板设门方式
1.5巨核细胞分化培养 用13.5 d的BLAB/c小鼠幼肝干细胞诱导巨核细胞的分化培养,实验方法参考文献[12]。将细胞分为6组,每组培养体系内均添加小鼠幼肝干细胞106个,在每组培养体系中分别添加不同浓度的TPO,浓度分别为100、80、60、40、20 ng/mL,添加PBS作为空白对照。培养14 d后分别观察体系中巨核细胞生成数量及血小板数量。
1.6精密度和正确度验证 对稀释后不同浓度的血小板悬液测定10次。计算变异系数(CV)及偏倚。判断标准:(1)CV和偏倚应小于15%;(2)如果CV≥15%或者偏倚≥15%,优先考虑人为操作误差,则对该浓度下的血小板重新检测10次,并将所得数据与之前数据合并计算,以增加实验结果的可靠程度。如果CV<15%,偏倚<15%,则表明该浓度下的血小板检测精密度以及正确度通过验证;如果CV≥15%或者偏倚≥15%,则表明该浓度下的血小板检测精密度或者正确度无法通过验证,达不到后续实验要求。
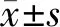
2 结果
2.1精密度验证 将制备好的血小板悬液进行梯度稀释,分别用人工镜检和流式检测的方式对不同浓度的血小板进行检测,结果见表1。随着血小板浓度的降低,人工镜检法和流式检测法的精密度均逐渐下降。当血小板浓度在108/L及以上时,人工镜检法和流式检测法差异无统计学意义(P>0.05)。但当血小板浓度进一步下降后,人工镜检法和流式检测法差异有统计学意义(P<0.05),且相同浓度下流式检测法的CV值小于手工镜检法。表明用流式法检测低值血小板时的精密度优于手工镜检法。当血小板浓度为5.60×105/L时,2名检测人员的镜下检测结果差异巨大,所得结果不在同一个次方水平,故而判定无法检测出血小板结果。而用流式法检测血小板,当浓度为5.60×104/L时,流式圈门的门内所得血小板数量不足50个,也判定结果无法测出。
表1 手工镜检法和流式检测法精密度比对
2.2正确度验证 以手工稀释的血小板理论浓度值为标准,分别计算手工镜检法和流式检测法相对于标准值的偏倚,结果见表2。随着血小板浓度的下降,2种检测方法的偏倚程度也逐渐加大,但流式检测法的偏倚小于手工镜检法。其中,血小板浓度为5.60×106/L时,流式检测法偏倚值也小于15%。表明流式检测法在检测低值血小板时其正确度可靠。

表2 手工镜检法和流式检测法正确度比对
2.3流式方法检测体外巨核细胞生成的血小板计数 用流式法检测不同组别中小鼠幼肝干细胞转化为巨核细胞所生成的血小板数量,其检测方法与检测人源性血小板方法相同,同时在镜下计数巨核细胞的数量(放大倍数为200),结果见图2。实验体系内血小板浓度大致在106/L以上时,用流式方法检测血小板可以有效计算出培养体系中血小板的浓度。加入100 ng/mL TPO的培养体系中所生成的血小板数量最高,随着TPO浓度下降,血小板数量也随之下降。血小板浓度与其体系中巨核细胞数量存在显著正相关(r2=0.879 9,P<0.001,回归方程为Y=0.993 8X-3.221)。见图3。
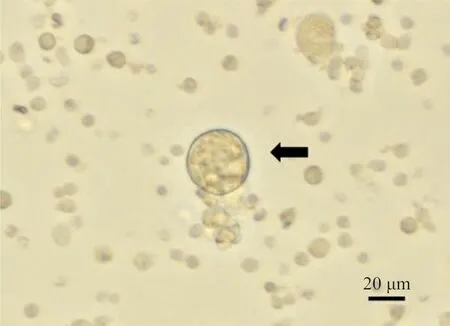
注:黑色箭头为巨核细胞。

注:A、B、C分别为不同浓度TPO培养体系中血小板数量、不同浓度TPO培养体系中巨核细胞数量以及二者的相关性结果。
3 讨论
本研究探索了流式细胞术在低值血小板检测方法学上的可行性。通过检测不同浓度血小板来判定该检测方法的精密度和正确度,我们发现手工法检测低值血小板的偏倚和CV较大。但是使用流式检测方法时,可以通过长时间收集样本来获得足够的血小板,进而通过绝对计数管中的微量小球计算获得血小板浓度。只是当血小板浓度在104/L时或者更小时,门内无法获得足够的血小板,且非特异性荧光干扰较大,故而无法检测。
用流式细胞术定量检测血小板数量已有报道。王建中等[11]用3种流式检测方式测定血小板浓度,用绝对计数管检测血小板效果最优,但是易受红细胞碎片干扰。黎庆梅等[12]通过实验表明,用流式方法检测109/L~1011/L血小板,其检测能力优于电阻抗法。本研究用流式细胞术检测细胞培养上清液中的血小板,同时探索了该检测方法在检测极低血小板浓度时的正确度和精密度,尚无相关研究报道,具有一定的创新性。
本研究通过对幼鼠幼肝内干细胞进行刺激,诱导其分化为巨核细胞,用流式检测法检测添加不同浓度TPO培养体系上清液中的血小板数量,发现其与培养体系内的巨核细胞数量呈正比。该实验从侧面表明,本研究基于流式平台检测低值血小板的方法可行,可用于后续实验工作的开展。
