钙激活中性蛋白酶1与口腔鳞状细胞癌迁移及侵袭的相关性
2022-03-30王忠朝胡妙龄张梦雪毛娅林聂敏海
谭 丹,刘 瑶,王忠朝,胡 芸,胡妙龄,张梦雪,毛娅林,聂敏海
西南医科大学1.口腔颌面修复重建与再生实验室(泸州 646000);2.附属口腔医院牙周黏膜病科(泸州 646000)
口腔鳞状细胞癌(oral squamous cell carcinoma,OS⁃CC)是口腔最常见的恶性肿瘤,据统计约占口腔肿瘤的90%。肿瘤转移是恶性肿瘤患者死亡的主要原因之一,因此对OSCC转移机制的研究,进而阻断其转移,对提高患者预后具有重要的意义[1]。
钙中性蛋白酶(calpain,CAPN)是一类特异性依靠钙激活的中性半胱氨酸蛋白酶,广泛分布于哺乳动物细胞中,被一定浓度的钙离子激活后发生自溶表现出蛋白水解酶活性[2]。现已发现CAPN 至少有14 种亚型,根据其分布特点分为有组织特异性中性钙蛋白酶和无组织特异性中性钙蛋白酶两大类,目前人们研究比较深入的是非组织特异性的同工酶CAPN-Ⅰ与CAPN-Ⅱ,目前CAPN 许多亚型的生理功能及调控蛋白水解的机制尚未完全明确[3-6]。CAPN在病理过程中的研究一直以来主要集中于炎症,神经退行性病变等,近年来在肿瘤中的作用逐渐被人们所重视,越来越多的研究表明CAPN 参与了多种肿瘤的发生发展,且具有肿瘤特异性[7-9]。
CAPN与口腔鳞状细胞癌的关系少有报道,本研究主要从细胞和分子水平探讨CAPN1 对口腔鳞癌细胞黏附、侵袭转移等生物学行为的影响,从而探索CAPN1与口腔鳞癌预后的关系,并为CAPN1作为口腔鳞癌的治疗新靶点提供理论依据。
1 材料和方法
1.1 实验对象
于2017年6月至2018年6月在西南医科大学口颌面修复重建与再生实验室完成实验。选取人类永生化口腔角化上皮细胞系HOK作为对照组(正常组),口腔鳞癌细胞系HSC3、CAL27 作为实验组(肿瘤组),均由实验室保种。
1.2 主要试剂与仪器
主要试剂:①Western blot 相关试剂:SDS-PAGE试剂、匀浆缓冲液;固相载体:PVDF尼龙膜或NC膜(硝酸纤维素薄膜)、转膜缓冲液;膜染色液:考马斯亮蓝0.2 g;甲醇80 mL;乙酸2 mL;ddH2O 118 mL。封闭液(5%脱脂奶粉,现配):脱脂奶粉1.0 g 溶于20 mL 的0.01 mol/L PBS 中。显色液:化学发光剂(ECL)或DAB 6.0 mg,0.01 mol/L PBS 10.0 mL,硫酸镍胺0.1 mL;H2O21.0 mL。②RNA 干扰相关试剂:siRNA 干扰位点序列转染使用Invitrogene 公司生产的脂质体Lipofectamine 2000。主要仪器:电泳仪、摇床、Transwell小室等。
1.3 实验方法
1.3.1 细胞培养 将细胞放入10 % 的胎牛血清的DMEM培养液中培养,添加青霉素,放入37 ℃孵箱中。当细胞长至瓶底70%左右时,用胰消化酶消化细胞,离心,弃上清液,收集细胞,清洗,重悬,传代细胞。细胞长至80%左右,分组,细胞转染,提取RNA或蛋白质。
1.3.2 RNA 干扰阻滞CAPN1 以OSCC 细胞株HSC3、CAL27为研究对象,将这两组细胞随机分为siRNA1-1组、siRNA1-2 组、siRNA-neg 组。siRNA1-1 组:在HSC3、CAL27中分别转染化学合成的针对CAPN1-1设计的小分子干扰RNA,沉默CAPN1-1 基因;siRNA1-2组:在HSC3、CAL27 中分别转染化学合成的针对CAPN1-2 设计的小分子干扰RNA,沉默CAPN1-2 基因:;siRNA-neg组:采用一对经验证对任何人、小鼠基因序列均无特异性干扰作用的siRNA(si NC)为阴性对照。应用PCR 法和Western blot 检测转染后细胞内CAPN亚型CAPN1的mRNA和蛋白水平的变化。
1.3.3 蛋白质印迹法 收集培养的细胞,加蛋白裂解液,离心,取上层液体,SDS-PAGE 电泳,转膜,脱脂奶粉密封1 h,试剂盒测浓度,加一抗,培育24 h后缓冲液洗涤,加二抗,避光培育1 h,显影。
1.3.4 QT-PCR 在肿瘤细胞培养液中加入氯仿,摇荡,离心,加异丙醇,离心,加75 %乙醇离心,干燥,-80 ℃保存。重复40 次反转录体系(94 ℃15 min,94 ℃15 s,60 ℃34 s,72 ℃10 min),计算。
1.3.5 细胞体外侵袭能力及迁移能力测定 细胞侵袭重建基底膜实验在Transwell 小室中进行。Transwell 小室分为上下两层,中间以聚碳酸滤膜(8 μm 孔径)隔开,滤膜上铺以ECMgel,实验组和对照组的HSC3 和CAL27 细胞转染48 h 后用胰酶消化,调整细胞浓度为1×106个/mL。将Transwell 小室的上室浸泡于下室培养液中,上室加入200 μL 细胞悬液(2×105个),细胞在上层常规培养48 h。取出小室,吸去Transwell上下室中的培养液,用无菌棉签快速擦去Transwell上室的ECMgel和未侵袭的细胞,再用DMEM 培养基浸湿的棉签重复擦Transwell 上室2~3 次,将Transwell 下表面浸泡于70%甲醇中固定30 min,再用苏木素-伊红浸染位于Transwell 下表面的细胞,梯度酒精脱水,二甲苯透明,在200 × 光镜下计数位于Transwell 下表面的细胞,计数中间和四周5 个视野,实验重复3 次,取其中平均值代表侵袭力的值。根据穿膜的数值做侵袭条形图。细胞体外迁移能力测定该实验与侵袭的差异在于在滤膜上未铺以ECMgel,其余相同。计数中间和四周5 个视野,实验重复3次,取其平均值代表迁移能力的值。根据穿膜的数值制作条形图。
1.4 统计学分析
所得数据均用SPSS 12.0软件包进行统计分析。计量资料用均数±标准差()表示,多个样本均数比较采用单因素方差分析(one-way ANOVA),各实验组和对照组间均数的两两比较采用Dunnett-t法,P <0.05为差异有统计学意义。
2 结果
2.1 CAPN1在正常细胞及口腔鳞癌细胞中的表达
Western blot 结果显示,CAPN1 在OSCC 肿瘤组(HSC3、CAL27组)中的表达高于正常组(HOK组),P <0.05,差异具有统计学意义。
2.2 RNA干扰抑制口腔鳞癌细胞CAPN1的表达
QT-PCR 检测显示:siRNA1-1、siRNA1-2、及siR⁃NA-neg组中三组皆见actin内参明显均一的表达;三组皆见CAPN1 mRNA 的表达,与siRNA-neg 组相比,siR⁃NA1-1 组及siRNA1-2 组组中CAPN1 mRNA 的表达均明显受到抑制(P <0.05),分别抑制了90%、93%。该结果提示siRNA CAPN1-1、siRNA CAPN1-2 转染能特异地抑制CAPN1 mRNA表达,见图1。
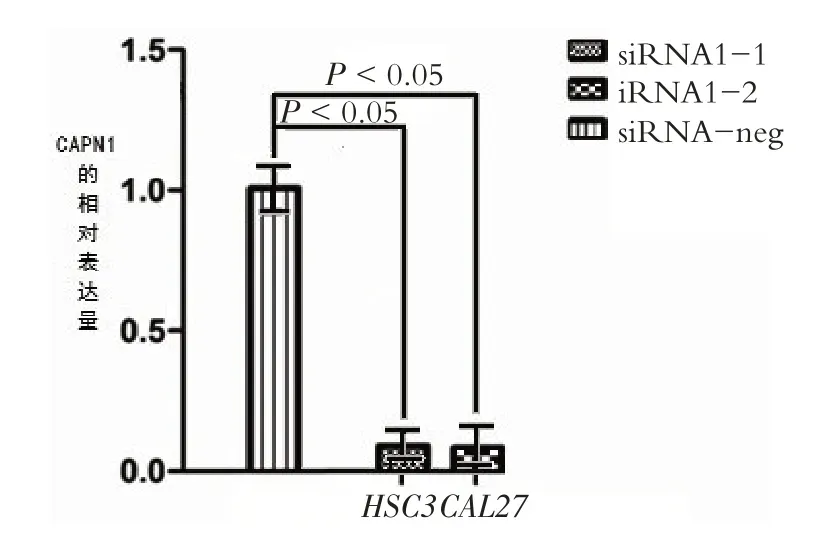
图1 QT-PCR检测转染细胞中CAPN1蛋白表达水平的改变Figure 1 changes of CAPN1 in transfected cells detected by RT-PCR
2.3 Western blot 检测转染细胞中CAPN1 蛋白表达水平的改变
Western blot检测结果显示:CAPN1干扰后体外培养的HSC3 和CAL27 细胞中CAPN1 蛋白的表达变化。结果提示转染48 h 后,在HSC3 和CAL27 细胞中,与siRNA-neg 组相比 siRNA CAPN1-1 组、siRNA CAPN1-2 组的CAPN1 蛋白的表达受到明显抑制(P <0.05),这与mRNA水平的变化基本一致,见图2。
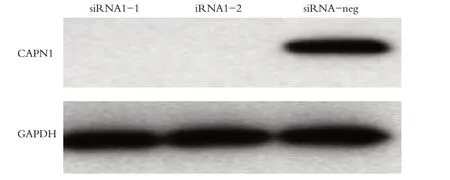
图2 Western blot检测转染细胞中CAPN1蛋白表达水平Figure 2 Western blot was used to detect the expression level of CAPN1 in transfected cells
2.4 小分子干扰RNA转染前后细胞侵袭能力的影响
3 组细胞的侵袭能力,通过计数在趋化诱导48 h后,穿过滤膜的细胞数目来检测的。显微镜下显示siR⁃NA1-2 组穿膜数目最少,siRNA-neg 组数目最多。siR⁃NA1-1 组、siRNA1-2 组较siRNA-neg 组数目均减少,差异均有统计学意义(P <0.01),见图3。

图3 Transwell小室实验测试肿瘤细胞侵袭能力Figure 3 Transwell chamber experiment tested the ability of tumor cells to invade
根据上图穿膜细胞数目做条形图。条形图示:siR⁃NA1-1 组、siRNA1-2 组相比于siRNA-neg 组数目均有减少,且差异具有统计学意义(P <0.01),见图4。
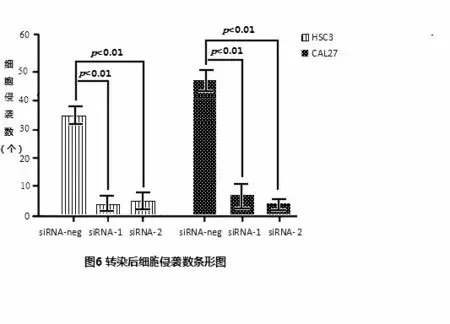
图4 转染后细胞侵袭数条形图Figure 4 Percentage of cell migration after transfection
2.5 小分子干扰RNA转染前后细胞迁移能力的影响
同理,根据以上数据,三组细胞穿过滤膜的数目变化趋势作图,如下图5。可以看到,48 h后三组细胞数目不同,并且siRNA1-2 组数目最少,siRNA-neg 组数目最多。经统计学处理,siRNA1-1组与siRNA1-2组相比于siRNA-neg 组数目均有减少,且差异具有统计学意义(P <0.05)。根据上图做迁移条形图,如下图6。

图5 Transwell小室实验测试肿瘤细胞迁移能力Figure 5 Transwell chamber experiment tested the migration ability of tumor cells

图6 转染后细胞迁移数条形图Figure 6 Percentage of cell migration after transfection
条形图示:siRNA1-1 组、siRNA1-2 组相比于siR⁃NA-neg组数目均有减少,且差异具有统计学意义(P <0.05)。
3 讨论
中性钙蛋白酶系统在人和动物的体内广泛存在,是一个高度复杂,高度调控的体系。中性钙蛋白酶系统不仅包括CAPN 和钙中性蛋白酶抑制蛋白(cal⁃pastatin),而且还包括钙中性蛋白酶激活蛋白(CAPN activator)。三者之间构成一个高度可调的依赖于钙离子的蛋白水解酶系统。其中中性钙蛋白酶(CAPN)是其系统中最核心的成分[10-12]。CAPN 在病理过程中的研究一直以来主要集中于炎症,神经退行性病变等,近年来在肿瘤中的作用逐渐被人们所重视,越来越多的研究表明CAPN 参与了多种肿瘤的发生发展,同时研究也表明CAPN在多种肿瘤中起到的作用不尽相同[13-14],最新研究显示,在许多肿瘤发生发展中存在CAPN的异常表达[2-3,10],但目前国内外关于CAPN家族与口腔鳞状细胞癌的相关性研究较少,本研究首次聚焦于CAPN 家族与口腔鳞状细胞癌的相关性。
CAPN系统在肿瘤生物学中发挥了重要的作用,大量研究表明其在细胞保护、凋亡、自噬通路中的作用较为明确,而在细胞骨架重建、细胞迁移、侵袭方面的研究有限[1,4,13,21],亟待系统建立CAPN 在肿瘤细胞迁移、侵袭及细胞骨架重建方面的作用,本研究也首次尝试探索CAPN1 在口腔鳞状细胞癌细胞迁移、侵袭的关系,为口腔癌患者提供靶向治疗的理论依据。
本研究在细胞及蛋白水平初探索了CAPN与口腔鳞状细胞癌的迁移、侵袭的相关性,研究结果表明CAPN1 在鳞状细胞中高表达,并且可升高口腔鳞癌细胞迁移、侵袭能力,可能在口腔鳞癌的发生发展中发挥了重要作用,这些结果可能为口腔鳞状细胞癌靶向治疗提供了新的视角。
CAPN通过什么通路,具体如何影响肿瘤细胞的侵袭及迁移目前仍然存在多种说法,这些说法目前其实主要倾向于CAPN水解多种调节细胞黏附及肌球蛋白力学相关的底物发挥作用[15-21],这些研究的背景也为我们下一步探索提供系新的方向。
4 结论
本研究主要通过生物学的实验方法探讨CAPN1对口腔鳞癌细胞侵袭转移等生物学行为的影响,从而初步探讨CAPN1与口腔鳞癌的关系。本研究结果发现相较于正常细胞,口腔鳞状细胞癌中存在CAPN1表达上调,同时通过RNA 干扰技术将CAPN1 沉默后对OS⁃CC 细胞学行为的作用进行了初步探索,研究表明CAPN1 基因沉默引起OSCC 细胞侵袭和黏附能力下降,此结果提示CAPN1可能与肿瘤转移或不良预后密切相关。
(利益冲突:无)
