宫颈癌病人切除修复交叉互补基因1基因多态性与铂类超敏反应关系
2022-03-30侯丽娟王文文翟建军孙燕
侯丽娟,王文文,翟建军,孙燕
作者单位:首都医科大学附属北京同仁医院妇产科,北京100176
多数宫颈癌病人确诊时病情已进展至晚期,单纯手术及放疗难以控制,需联合新辅助化疗[1]。铂类是宫颈癌化疗中最基础药物,可结合癌细胞DNA碱基产生交联反应,干扰DNA 复制,抑制肿瘤生长,然而仍有部分病人化疗不敏感,预后较差[2-3]。近年研究发现,DNA 损伤修复能力异常是铂类耐药重要分子基础[4]。在人类细胞中,化疗药物及紫外线所致DNA 损伤主要通过核苷酸剪切修复途径(nucleo‑tide excision repair,NER)修复,而切除修复交叉互补基因1(excision repair cross complement 1,ERCC1)在NER 途径中起着关键作用,如NER 初期发挥DNA 损伤识别功能,后期共同行使损害部位5,端切除功能[5]。因此宫颈癌病人ERCC1 基因多态性与铂类超敏反应关系的研究成为当前研究热点。本研究旨在宫颈癌病人分析ERCC1 基因多态性与铂类超敏反应关系,明确铂类超敏反应危险因素,为临床确定合理化疗方案提供参考信息。
1 资料与方法
1.1 一般资料选取2012 年1 月至2017 年9 月首都医科大学附属北京同仁医院收治的103例宫颈癌病人作为研究对象,均经细胞病理学检查确诊。年龄(42.51±10.68)岁,范围为20~65 岁。病人或其近亲属知晓并签署知情同意书,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 方法所有病人化疗前后均接受肝肾功能、外周血细胞、心电图等常规检查。35 例接受PBF 方案,d1~d5,静脉滴注20 mg/m2顺铂,肌内注射500 mg/m25-氟尿嘧啶,d1、d5,肌内注射博来霉素7 mg/m2;33 例接受PMF 方案:d1~d5,静脉滴注0.75~1.00 g/m25-氟尿嘧啶,d1,静脉滴注6~8 mg/m2丝裂霉素,d1~d3,静脉滴注40 mg 顺铂;38 例接受PVB 方案:d1、d2,静脉滴注40 mg 顺铂,d1,静脉滴注30 mg 长春新碱,d2,静脉滴注博来霉素30 mg;21 d 为1 个化疗周期,连续化疗1~2个周期后评估,化疗有效且分期较晚者,建议放疗;化疗有效且分期较早者行盆腔淋巴结及根治性子宫切除术,若术后病理结果显示切缘阳性、低分化癌、淋巴结转移等高危因素,给予以放疗为主的辅助治疗。
化疗后切除或活检肿瘤组织,−80 ℃超低温冰箱内保存待测。(1)DNA提取:取血液标本200µL置于离心管,滴加蛋白酶K 溶液20µL、缓冲液20µL,充分混合均匀,56 ℃放置15 min,直至溶液清亮;滴加无水乙醇200µL,振荡混匀,倒入硅胶离心柱,离心30 s,倒掉废液,将硅胶离心柱放回收集管;于硅胶离心柱滴加缓冲液500µL,离心30 s,倒掉废液,将硅胶离心柱放回收集管;于硅胶离心柱滴加漂洗液500µL,离心30 s,倒掉废液,将硅胶离心柱放回收集管,离心2 min,倒掉废液,室温下放置数分钟,晾干吸附材料中残余漂洗液;将硅胶离心柱转入干净离心管,滴加洗脱缓冲液100 µL,室温放置15 min,离心2 min,离心管收集溶液。(2)聚合酶链式反应(PCR):反应体系为2×Taq MasterMix 12.5 µL,引物2 µL,DNA 模板2 µL,双蒸水8.5 µL,总体积25µL;引物序列:ERCC1 Asn118Asn(rs11615)正向引物5’-CGGGGACCCTTTAGGAAAG-3’,反向引物5’-GGCTTCTCATAGAACAGTCC-3’;PCR 循环参数:ERCC1 rs11615:94 ℃预变性3 min,94 ℃30 s,62 ℃36 s,72 ℃50 s,共40 个循环,72 ℃延伸5 min,扩增产物4 ℃保存;限制性内切酶消化体系为PCR 产物10 µL,限制性内切酶1 µL,双蒸水7 µL,缓冲液2µL,总体积20 µL,取含ERCC1 s11615 的PCR 产物10 µL 与限制性核酸内切酶BsrDI 1 µL、双蒸水7µL、1×反应缓冲液1.8µL、乙酰胺0.2µL,65 ℃消化16 h,4 ℃保存;(3)琼脂糖凝胶电泳:于烧瓶中加入0.75 g琼脂糖+25 mL 1×Tris 硼酸电泳缓冲液,微波炉中火加热至沸腾,倒入已置好梳子的胶膜中,37 ℃放置1 h;待胶凝固后,于电泳前后槽加入1×Tris 硼酸电泳缓冲液及玻璃板,缓慢拔出梳板,调节缓冲液面,即缓冲液面高于胶面,前槽水面略高于后槽,确保缓冲液进入所有加样孔;吸取酶切产物10 µL,保证吸管垂直加样孔,缓缓注入DNA 样品;加样成功后,设定电压(120 mV)及时间(25 min),正确接通电泳槽及电源;(4)基因分型:酶切产物经3%琼脂糖凝胶电泳分型,野生纯合子型:两个碱基突变,无酶切位点,仅有最长片段,电泳图仅有一条条带;突变纯合子型:两个碱基无突变,有酶切位点,形成两条条带;杂合子型:一个碱基突变,无酶切位点,形成最长片段,另一个碱基无突变,有酶切位点,形成两个小片段,电泳图显示3条条带。
参照世界卫生组织(WHO)抗肿瘤药物客观疗效判定标准评估,包含完全缓解、部分缓解、稳定、进展等4 个等级[6],其中完全缓解与部分缓解属于治疗有效,归入敏感组,稳定和进展属于治疗无效,归入耐药组。
1.3 观察指标(1)两组ERCC1 rs11615 多态位点基因型分布。(2)影响宫颈癌铂类化疗敏感性的单因素分析。(3)影响宫颈癌铂类化疗敏感性的多因素分析。(4)随访24 个月,不同ERCC1 rs11615 多态位点基因型分布中位无进展生存期(PFS)。
1.4 统计学方法通过SPSS 22.0 处理数据,计数资料以百分数表示,行χ2检验;采用logistic 回归模型分析宫颈癌铂类化疗敏感性的影响因素;采用Kaplan-Meier 法计算中位PFS,比较采用log-rank 分析。P<0.05表明差异有统计学意义。
2 结果
2.1 两组ERCC1 rs11615 多态位点基因型分布103 例宫颈癌病人经连续化疗1~2 周期后,20 例为完全缓解,51例部分缓解,23例稳定,9例进展,总有效率为68.93%(71/103),根据化疗效果分为敏感组(n=71)和耐药组(n=32)。敏感组ERCC1 rs11615位点CT 基因型高于耐药组,且携带ERCC1 rs11615 位点CT基因型的宫颈癌病人化疗耐药的风险低于CC基因型(P<0.05)。见表1。

表1 两组宫颈癌病人切除修复交叉互补基因1(ERCC1)rs11615位点基因型分布/例(%)
2.2 影响宫颈癌铂类化疗敏感性的单因素分析临床分期Ⅳ期、ERCC1rs11615 位点CC 基因型、有淋巴结转移、深间质浸润、低分化程度与宫颈癌铂类化疗敏感性密切相关(P<0.05)。见表2。

表2 影响宫颈癌铂类化疗敏感性的单因素分析/例(%)
2.3 影响宫颈癌铂类化疗敏感性的多因素分析以宫颈癌铂类化疗敏感性为因变量,以临床分期Ⅳ期、ERCC1rs11615 位点基因型、淋巴结转移、间质浸润、分化程度为自变量,纳入logistic 回归分析模型,结果显示,临床分期Ⅳ期、ERCC1 rs11615 位点CC基因型、有淋巴结转移、深间质浸润、低分化程度是影响宫颈癌铂类化疗敏感性危险因素(P<0.05)。见表3,4。

表3 宫颈癌铂类化疗敏感性影响因素赋值
2.4 不同ERCC1 rs11615 位点基因分布中位PFS随访24 个月,ERCC1 基因rs11615 位点CC 基因型病人中位PFS 为9.8 个月,CT 基因型病人中位PFS为10.9个月,log-rank分析差异无统计学意义(P=0.76)。见图1。

图1 不同切除修复交叉互补基因1(ERCC1)基因分布中位无进展生存期(PFS)
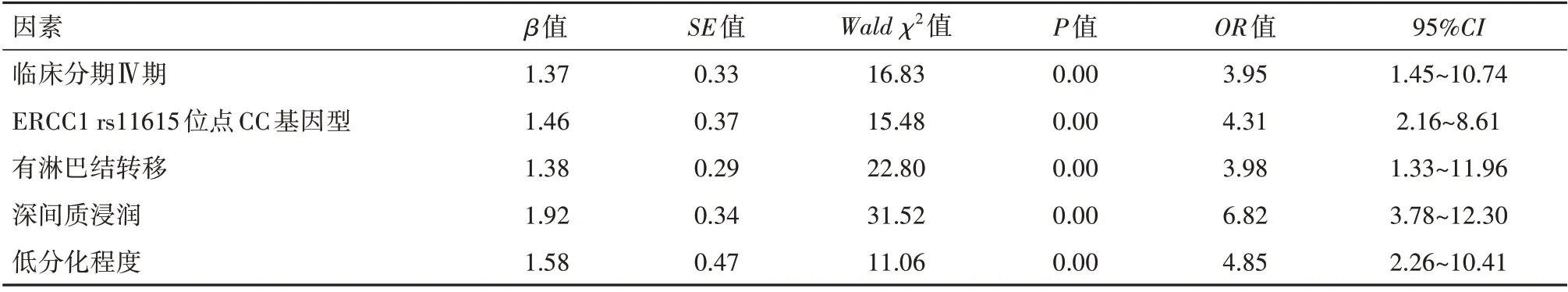
表4 影响宫颈癌铂类化疗敏感性的多因素分析
3 讨论
在中国,宫颈癌每年新发病例14 万,约占全球宫颈癌新发病例28.8%,且呈年轻化趋势进展,因此治疗方面已由经典手术、放疗演变为以放化疗、手术为主的综合治疗[7-9]。新辅助化疗已被证实是行之有效手段,其中铂类药物为广谱抗癌药物,可通过形成DNA 加合物,抑制肿瘤细胞RNA 及蛋白质合成,诱导肿瘤细胞凋亡,减少宫旁浸润,增加手术彻底性机会,然而铂类化疗会引起DNA 损伤,产生化疗耐药[10-11]。
目前临床认为,机体对铂类药物耐受与DNA 损伤修复、药物失活、药物蓄积等多种因素有关,DNA损伤修复可能是其中最重要因素[12-13]。亦有学者指出,DNA 修复基因过表达可改变DNA 修复能力,导致肿瘤发生及化疗药物耐药[14]。ERCC1 基因是DNA 损伤识别及修复重要组成部分,其单核苷酸多态性可能对宫颈癌病人铂类耐药及预后产生影响,虽然当前已有ERCC1 基因rs11615 位点C/T 多态性与宫颈癌病人铂类超敏反应相关研究,但研究结果尚不统一,张龙等[15]认为,ERCC1 基因rs11615 位点TT基因型能增加患宫颈癌患病风险,而CC、CT基因型与宫颈癌发生无明显关系。有研究指出,RCC1基因rs11615位点C/T基因型化疗敏感率高于C/C基因型,且携带C/T基因型化疗敏感性比C/C基因型增加4.48 倍[16]。分析两者产生差异原因可能与遗传背景、地区不同有关。本研究显示,敏感组ERCC1 rs11615 位点CT 基因型高于耐药组,且携带ERCC1 rs11615位点CT 基因型的宫颈癌病人化疗耐药的风险低于CC 基因型(P<0.05),故推测ERCC1 基因可能作为评估宫颈癌病人铂类超敏反应指标,为宫颈癌新辅助化疗提供新思路。同时本研究中并未发现ERCC1 rs11615 位点TT 基因型,考虑为样本量偏少所致,仍需在扩大样本量基础上继续研究。
本研究还发现,临床分期Ⅳ期、ERCC1 rs11615 CC基因型、有淋巴结转移、深间质浸润、低分化程度是影响宫颈癌铂类化疗敏感性危险因素(P<0.05)。既往研究指出,淋巴结转移是影响乳腺癌、宫颈癌等恶性肿瘤预后重要因素,淋巴结转移数目越多,预后相对愈差,转移数目越少,预后相对愈好[17]。分化程度越低,提示淋巴结转移发生率越高,病情越严重,治疗效果越差,越容易产生耐药。而临床分期越低提示病情尚处于较早阶段,接受以铂类为基础的联合化疗方案治疗后效果更加明显,预后越好。同时ERCC1 rs11615 CC 基因型是影响宫颈癌铂类化疗敏感性的又一危险因素,亦从侧面说明鉴别诊断ERCC1 基因型分布是临床评估宫颈癌铂类化疗敏感性的重要指标。此外,梁军等[18]研究发现,ERCC1及XRCC1基因多态性与中国晚期大肠癌病人接受奥沙利铂一线化疗后生存期有关。有学者指出,晚期非小细胞肺癌病人ERCC1基因型与中位PFS 无显著相关性[19-20]。在此基础上,本研究比较宫颈癌病人不同ERCC1 rs11615 位点基因分布中位PFS,结果发现,ERCC1 rs11615 多态位点CC、CT基因型的中位PFS比较,差异无统计学意义,与上述研究结果存在一定差异,分析原因可能与肿瘤类型、ERCC1 基因位点及随访时间有关。同时受研究性质局限,铂类药物出现耐药后处理方案并不统一,且病例数较少,无法进行系统评估,尚需严格长期随访,以便更好了解铂类药物超敏反应对宫颈癌病人预后的影响。
综上,宫颈癌病人铂类超敏反应与ERCC1 rs11615基因型、临床分期、淋巴结转移、分化程度等因素有关,建议临床重点观察上述指标,为宫颈癌铂类化疗超敏反应鉴别诊断提供指导依据。
