基于CADD探究新疆胀果甘草查尔酮A对宫颈癌细胞增殖、凋亡作用及其分子机制
2022-03-29艾孜提艾力艾海提木合布力阿布力孜米热古丽买买提明赛力克阿拉阿里汗玉苏普瓦吉木阿力木江
艾孜提艾力·艾海提,杨 争,木合布力·阿布力孜,米热古丽·买买提明,赛力克阿拉·阿里汗,玉苏普瓦吉木·阿力木江
新疆医科大学药学院,乌鲁木齐 830011
宫颈癌是严重威胁妇女健康的恶性肿瘤之一,近几年其发病率呈现上升态势[1]。研究发现,在我国宫颈癌患者的病死率以每年3.35%的速度在递增,10年增长率为29.9%,且年轻人发病趋势日益明显[2]。根据一项针对近千名女性HPV人乳头瘤病毒(human papilloma viruses,HPV)筛查结果可知,感染率为17.46%[3],可见宫颈癌的预防及治疗面临严峻挑战。目前宫颈癌的常规治疗措施为放化疗及手术治疗,存在毒副作用大、易发生肿瘤耐药及易复发等难题[4]。肿瘤干细胞(cancer stem cells,CSCs)是一类自我更新能力,能够启动和驱动肿瘤细胞生长及转移,在肿瘤的复发、转移过程中具有重要作用的细胞[5]。CSCs是存在于肿瘤微环境中的一小部分群体,有研究报道从宫颈癌细胞中可以鉴定分离出宫颈癌干细胞(cervical cancer stem cells,CCSCs)[6,7]。肿瘤干细胞对多数化疗药物不敏感,是患者在康复阶段导致癌症复发的主要原因,严重影响放化疗以后的患者2~5年生存率[8]。因此,从天然药物活性成分中寻找和筛选结构新颖、高抗癌活性、低毒性且具有抑制肿瘤干细胞活性的抗宫颈癌先导化合物在创新药物研究中具有较好的深入研究意义。
甘草作为药食两用的药材资源,在我国药用历史悠久。虽然甘草存在多种品种,而《中国药典》(2020年版一部)收录其原植物有2种,即胀果甘草(GlycyrrhizainflataBat.)和光果甘草(GlycyrrhizaglabraL.),其中胀果甘草在新疆南部、甘肃等西北地区分布资源比较丰富[9]。不同品种的甘草中所含的查尔酮类成分的化学结构有所差异。研究证实,查尔酮A(licochalcone A,LicoA)具有抗肿瘤[10]、抗菌[11]、抗炎[12]、保肝[13]、免疫调节[14]等作用,而关于其对宫颈癌相关肿瘤干细胞标记物的调控方面鲜见报道。本课题组在前期基础研究的基础上,改良一种用于治疗宫颈糜烂的传统医院制剂,加入了含LicoA的胀果甘草提取物,正在研发具有预防宫颈癌潜力并可用于阴道抑菌消炎及宫颈糜烂的阴道泡腾片。在天然有效成分的抗癌活性筛选中发现,胀果甘草查尔酮成分LicoA对宫颈癌细胞的增殖、凋亡及周期方面具有显著活性外,且对宫颈癌肿瘤干细胞标记物(Bcl-2、ALDH1A1、OCT-4、UHRF1、BIRC7、BIRC5)基因及细胞周期蛋白依赖性激酶4(cyclin-dependent kinase 4,CDK4)基因产生明显的调节有用。经计算机辅助药物设计法(CADD法)等手段预测其可能的作用靶点,研究LicoA对以上基因mRNA表达量的影响,为进一步阐明LicoA对宫颈癌细胞抗癌活性方面的作用及可能的分子机制探索提供更充分的参考依据。
1 材料与方法
1.1 主要试剂与仪器
1.1.1 主要试剂
顺铂注射液(江苏豪森药业集团有限公司);人子宫颈癌细胞SiHa、HeLa均购买于新疆医科大学中心实验室细胞库;DMEM高糖培养基(美国Sigma公司,货号:AF29561079);胎牛血清(美国Sigma公司,货号:1644044);扩增试剂盒(日本TaKaRa公司,货号:RR047A)、逆转录试剂盒(日本TaKaRa公司,货号:RR820A);RNA提取试剂盒(上海生物工程技术有限公司,货号:00170212)。
1.1.2 主要仪器
WRX-4显微熔点仪(宁波科诚仪器有限公司,中国);Unity-Inova600超导核磁共振仪(Varian公司,美国);LTQ-Orbitrap XL赛默飞组合式高分辨质谱仪(赛默飞世尔科技公司,美国);KQ5200DE数控超声波清洗器(昆山市超声仪器有限公司,中国);ZF-7型暗箱三用紫外分析仪(上海嘉鹏科技有限公司,中国);Heracell CO2培养箱(赛默飞世尔科技公司,美国);Multiskan GO酶标分析仪(赛默飞世尔科技公司,美国);BD流式细胞仪(BD公司,美国);QuantStudioTM6Flex实时荧光定量PCR仪(赛默飞世尔科技公司,美国)。
1.2 方法
1.2.1 胀果甘草查尔酮A的制备
取干燥的胀果甘草根粉碎,称取50.0 g,以料液比(W∶V)为1∶15的95%乙醇中浸泡24 h,45 ℃条件下超声15 min,80 ℃加热回流提取2 h,抽滤,得滤液a。滤渣于500 mL的95%乙醇中浸泡过夜,同上述方法处理,得滤液b,合并滤液a、b,45 ℃减压浓缩,50 ℃干燥。将粗提物用适量30%乙醇溶解上样于提前处理好的聚酰胺色谱柱,吸附24 h,先水洗3 BV,然后用10%、20%、30%、40%、50%、60%、70%、80%、90%乙醇梯度洗脱3 BV,分别收集流分,浓缩,合并具有相同特征的流分,于50 ℃减压旋蒸并干燥得到总黄酮粉末[15]。
将上述粉末溶解于适量20%乙醇中,上样于提前备好的AB-8大孔吸附树脂,吸附24 h,先水洗3 BV,然后30%、50%、60%、70%、80%乙醇各洗脱3 BV,分别收集流分,浓缩,具有相同特征的流分合并,于50 ℃减压旋蒸干燥后得到总黄酮粉末。称取总黄酮粉末100 mg,用适量甲醇溶解,于制备薄层板上点样,以LicoA对照品为对照,以石油醚∶乙酸乙酯=1∶1,加1滴甲酸为展开剂展开,于365 nm紫外光下观察斑点,标记与对照品对应的斑点(LicoA具有亮蓝绿色的斑点),干燥后刮去,加甲醇溶解,45 ℃减压浓缩,50 ℃干燥,得到黄色粉末。之后以硅胶柱层析法纯化,石油醚∶乙酸乙酯=2∶1洗脱,收集亮黄色斑点的流分,浓缩,干燥,得到亮黄色粉末,取少量测定其熔点并经过1H NMR、13C NMR及HR-EI-MS进行结构鉴定。
1.2.2 细胞培养
取生长状态良好的SiHa和HeLa细胞,用含10%胎牛血清、链霉素(100 μg/L)、庆大霉素(100 μg/L)的DMEM完全培养液(pH=7.5),在37 ℃,5% CO2氧饱合湿度的恒温培养箱中培养24 h,取对数生长期细胞进行以下各项实验。
1.2.3 宫颈癌细胞活力检测
采用MTT法检测LicoA对宫颈癌细胞SiHa、HeLa的增殖抑制活性。取处于对数生长期的SiHa、HeLa细胞,以5×104个/mL的密度铺在96孔板,培养24 h,待96孔中细胞长至视野的80%左右时,弃去每孔上清液,将浓度为0、10、25、50、75、100 μg/mL的用完全培养基配制的LicoA溶液,按每孔200 μL,每个浓度6个复孔,加入到96孔板中,以同样浓度梯度的含顺铂的完全培养液作为阳性对照,只加完全培养液的细胞悬液为空白对照,分别作用24、48、72 h后加入MTT溶液,用酶标仪于490 nm测定吸光度(A),计算细胞抑制率,进一步用SPSS 26.0软件分别计算出IC50值。细胞抑制率=(A空白-A实验)/A空白×100%。
1.2.4 细胞形态观察
根据LicoA对SiHa、HeLa细胞的IC50值,对其进行形态学研究。取对数生长期细胞,收集,用细胞计数法以每孔细胞数为3×105个接种于6孔板,待细胞贴壁生长至视野80%~90%,用完全培养基配制终浓度为0、10、25、50 μg/mL LicoA溶液,分别作用于SiHa、HeLa细胞24 h后,在倒置显微镜下观察细胞形态学变化并拍照。
1.2.5 SiHa细胞凋亡检测
取对数生长期SiHa细胞,调整细胞密度为1×106个/mL,接种于6孔板中,培养24 h后弃去培养基,每孔加入2 mL用完全培养基配置的20 μg/mL的顺铂溶液及浓度为0、10、20、30 μg/mL的LicoA溶液干预细胞(根据“1.2.3”结果筛选分析得出),作用24 h后,PBS冲洗并离心,完全弃去上清后每一组分别加100 μL Bingding Buffer(Buffer∶PBS=1∶9配制)轻柔吹打均匀,每组分别加入AnnexinV-和PI各5 μL,室温避光染色15 min,再每组分别补加400 μL Bingding Buffer混合均匀,经300目网筛过滤,上机检测。
1.2.6 SiHa细胞周期检测
取生长良好的SiHa细胞,收集、计数、稀释成1×105个/mL的细胞悬液,按每孔2 mL铺于6孔板内,置于恒温培养箱培养24 h。弃去培养液,每孔加入2 mL用完全培养基配置的20 μg/mL的顺铂溶液及浓度为0、10、20、30 μg/mL的LicoA溶液,作用24 h,每孔分别收集上清,加PBS清洗、消化、收集备用。收集好的细胞各加4~5 mL预冷的75%乙醇混合均匀,放置4 ℃冰箱固定24 h。1 000 r/min离心5 min,弃上清,分别加3 mL PBS冲洗3次,弃去上清液,收集细胞,每组分别加400 μL PI/RNase Staining Buffer混合均匀,室温避光染色15 min,经300目网筛过滤,上机检测。
1.2.7 分子对接实验
1.2.7.1 分子对接参数
对接个数(num_modes)是20个,能量范围(energy_range)是5,可能性构象搜寻(exhaustiveness)值为100,除了有特别说明外,其余参数均采取默认值。
1.2.7.2 对接口袋
经可能的结合位点的筛选之后,选择由CDK4基因所编码的CDK4蛋白与目标单体LicoA进行分子对接。由于数据库中未能检索到有特定配体与之结合的构象,故采用全构象对接方式进行分析。CDK4(见图1),活性口袋的坐标为:center_x=-1,center_y=-2,center_z=75;size_x=52,size_y=40,size_z=44。
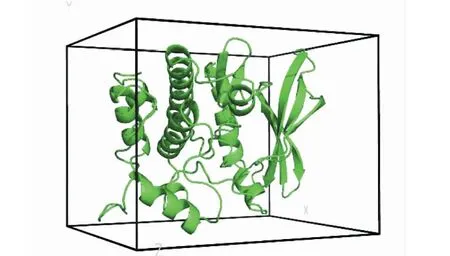
图1 CDK4蛋白的对接口袋Fig.1 Docking pocket of CDK4 protein
1.2.8 对宫颈癌相关肿瘤标记物的影响
通过荧光定量RT-PCR法,以β-actin为内参,对SiHa细胞中Bcl-2、ALDH1A1、OCT-4、UHRF1、BIRC7、BIRC5等肿瘤干细胞标记物的mRNA表达量进行测定。取生长良好的SiHa细胞,收集,计数,稀释成1×105个/mL的细胞悬液,按每孔2 mL铺于6孔板内,置于恒温培养箱培养24 h。每孔加入2 mL用完全培养基配置的浓度为0、10、25、50 μg/mL的LicoA溶液,作用24 h。按照总RNA提取试剂盒(Trizol)的说明书规范操作,提取SiHa细胞总RNA,定量并测定其纯度后逆转录得到不同干预组的cDNA,按说明书加入引物及扩增试剂,上PCR扩增仪进行扩增反应,扩增条件为TaKaRa扩增试剂盒说明书中两步扩增程序,最终得PCR产物并分析结果。PCR引物序列见下表1。
1.2.9 统计学处理

表1 引物序列表Table 1 Sequences of primers
2 结果
2.1 甘草查尔酮A的结构表征
甘草查尔酮A,黄色粉末,得率0.36%;分子式:C21H22O4;mp.136~137 ℃;HR-EI-MS:m/z339.159 2 [M]+(calcd for C21H23O4,339.159 1);1H NMR(600 MHz,DMSO-d6)δ:10.31(1H,s,OH-4′),10.14(1H,s,OH-4),7.98(2H,d,J=9.0 Hz,H-2′,H-6′),7.91(1H,d,J=15.6 Hz,H-β),7.59(1H,d,J=15.6 Hz,H-α),7.54(1H,s,6-H),6.89(2H,d,J=8.4 Hz,H-3′,H-5′),6.53(1H,s,H-3),6.25(1H,s,H-10),4.94(1H,s,H-11),3.83(3H,s,ОCH3),1.46(6H,s,CH3);13C NMR(150 MHz,DMSO-d6)δ:187.8(s,С=О),162.1(s,С-4′),160.2(s,C-2),158.7(s,C-4),147.9(s,C-10),139.2(s,С-β),131.2(s,C-2′,C-6′),130.1(s,C-1′),128.2(s,C-6),127.0(s,C-5),118.3(s,C-α),115.7(s,C-3′,C-5′),114.0(s,C-1),110.5(s,C-11),100.4(s,C-3),55.9(d,CH3),40.1(s,C-7),27.5(d,CH3)。以上1H NMR、13C NMR数据与文献[16]对比基本一致,确定该成分为甘草查尔酮A(LicoA),其结构如图2所示。

图2 LicoA的化学结构Fig.2 The chemical structure of LicoA
2.2 对宫颈癌细胞增殖抑制活性
如表2,SiHa、HeLa细胞分别用0~100 μg/mL浓度范围内的含LicoA和阳性对照药顺铂的完全培养基作用24、48、72 h,根据其抑制率利用SPSS 26.0求相应的IC50。阳性药顺铂分别对两种细胞作用24、48、72 h后,对SiHa细胞的IC50值分别为20.53、7.75、4.49 μg/mL,对HeLa细胞的IC50值分别为20.71、8.92、5.76 μg/mL;LicoA分别对两种细胞作用24、48、72 h后,对SiHa细胞的IC50值分别为68.38、38.48、24.49 μg/mL,对HeLa细胞的IC50值分别为39.31、14.91、6.90 μg/mL。

表2 甘草查尔酮A及顺铂对SiHa、HeLa细胞半数抑制浓度Table 2 LicoA and Cisplatin to SiHa and HeLa cells
2.3 对细胞形态的影响
LicoA对HeLa细胞形态的影响比对SiHa细胞明显,10 μg/mL时开始影响HeLa细胞形态,细胞呈现皱缩现象,而对SiHa形态的影响开始于50 μg/mL,10、25 μg/mL时影响不明显(见图3)。

图3 LicoA对2种细胞的形态学变化(100 μm)Fig.3 Morphological changes of LicoA on two cells (100 μm)
2.4 对宫颈癌细胞凋亡的影响
顺铂在20 μg/mL时对SiHa细胞作用24 h时的凋亡率为47.60%。与空白组对比,LicoA干预SiHa细胞24 h后的促凋亡作用较为显著。在10~30 μg/mL浓度范围内,LicoA对SiHa细胞的凋亡率从12.6%增加到52.0%,结果见表3及图4。
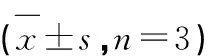
表3 LicoA对SiHa细胞作用24 h的凋亡率Table 3 Apoptosisrate of LicoA on SiHa cells for 24

图4 LicoA和顺铂对SiHa细胞的凋亡实验结果Fig.4 Apoptosis results of LicoA and cisplatin on SiHa cells注:A:空白对照;B:查尔酮A 10 μg/mL;C:查尔酮A 20 μg/mL;D:查尔酮A 30 μg/mL;E:顺铂20 μg/mL;F:图A~E结果的统计分析。与空白对照组比较,*P < 0.05,**P < 0.01。Note:A:Control;B:LicoA 10 μg/mL;C:LicoA 20μg/mL;D:LicoA 30 μg/mL;E:Cisplatin 20 μg/mL;F:Statistical analysis of A-E.Compared with control,*P < 0.05,**P < 0.01.
2.5 对细胞周期的影响
阳性药顺铂在20 μg/mL时对SiHa细胞作用24 h后,细胞周期G0/G1期占比为52.55%,S期为35.91%,G2/M期为11.54%;空白组SiHa细胞在G0/G1期的比值为74.53%,S期为16.19%,G2/M期为8.56%;LicoA在30 μg/mL时,对SiHa细胞在G0/G1期的比值为43.58%,S期分别为35.18%,G2/M期分别为21.25%;与空白组对比,LicoA在30 μg/mL时SiHa细胞G0/G1的比值减少了30.95%,S期和G2/M期分别增加了18.99%和12.69%(见表4、图5)。
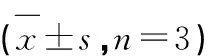
表4 LicoA和顺铂对SiHa细胞周期的影响Table 4 Cell cycle effects of LicoA and cisplatin on
2.6 分子对接实验结果
LicoA与CDK4蛋白最低结合能为-8.6 kcal/mol,选择打分最高的对接构象进行具体的结合模式分析后可知,LicoA能较好地结合在CDK4形成的结合口袋内。结合口袋的作用主要含A、B、C三个关键的结合位点,LicoA两侧苯环一端均插入到CDK4形成的结合口袋内,可以和周围氨基酸残基形成作用力,羰基上的氧可与周围残基形成部分作用力,LicoA一侧苯环上的羟基与ASN-145可形成一个2.7 Å的较强氢键;羰基上的氧与GLY-15可形成一个2.4 Å的较强氢键;A环上的苯环与ASP-158可形成Pi-阴离子作用(见图6)。
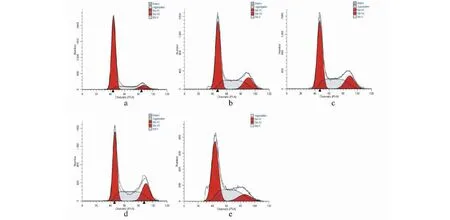
图5 LicoA对SiHa细胞周期的影响Fig.5 Cell cycle effects of LicoA on SiHa注:a:空白对照;b:查尔酮A 10 μg/mL;c:查尔酮A 20 μg/mL;d:查尔酮A 30 μg/mL;e:顺铂20 μg/mL。Note:a:Control;b:LicoA 10 μg/mL;c:LicoA 20μg/mL;d:LicoA 30 μg/mL;e:Cisplatin 20 μg/mL.
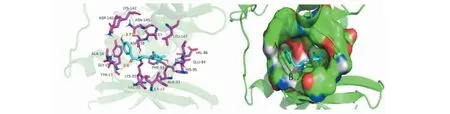
图6 LicoA和CDK4的结合模式Fig.6 Binding mode of LicoA and CDK4
2.7 对宫颈癌肿瘤标记物mRNA相对表达量的影响
如图7所示,LicoA在浓度为50 μg/mL条件下作用于SiHa细胞24 h后,周期相关基因CDK-4的相对表达量下调至0.012;Bcl-2、ALDH1A1、OCT-4、UHRF1、BIRC7、BIRC5等基因的相对表达量随着LicoA干预浓度的提高,分别出现了不同程度的下调。与空白对照组(0 μg/mL)相比,干预组(25、50 μg/mL)SiHa细胞各基因mRNA表达量有显著性差异(P<0.05或P<0.01)。
3 讨论与结论
目前,临床上对于宫颈癌的治疗措施仍以外科手术切除为主,配合化疗和放疗辅助治疗。肿瘤干细胞学说的提出对宫颈肿瘤的发生、发展和治疗做出了新的诠释。研究证实,肿瘤干细胞既是肿瘤细胞放化疗耐受的根源所在,也是引起肿瘤细胞转移和复发的原因之一[17]。因此,利用天然活性成分,安全有效的干预肿瘤干细胞,从而降低宫颈癌的发病可能及预防治疗后宫颈癌的复发是一个新的研究方向。

图7 不同浓度LicoA干预SiHa细胞后各基因相对表达量Fig.7 Relative expression of genes after intervention of different concentrations of LicoA in SiHa 注:与空白对照组比较,*P < 0.05,**P < 0.01。Note:Compared with control,*P < 0.05,**P < 0.01.
目前研究证实,甘草具有抗肿瘤、抗菌、抗炎、保肝、免疫调节等作用。新疆地区胀果甘草资源丰富,甘草查尔酮A成分主要分布于其根茎中。本课题组在前期研究中开发和建立胀果甘草中查尔酮A的检测鉴定系统并申报了一项仪器装备相关的实用新型专利(专利号:ZL201721685479.2),在此基础上提取并制备了LicoA成分。LicoA抗肿瘤的机制可能是通过诱导肿瘤细胞凋亡,但关于其对宫颈癌肿瘤干细胞标记物的调控作用的研究较为少见。本研究结果显示,新疆胀果甘草查尔酮A对宫颈癌细胞的增殖具有明显的抑制作用,并且呈现浓度和时间依赖性,能够诱导SiHa细胞凋亡并且可能阻滞细胞周期于S期和G2/M期,并对宫颈癌肿瘤干细胞标记物具有显著下调作用。
在正常情况下,视网膜母细胞瘤(Rb)与细胞周期的G1期的E2F转录因子形成复合物并被抑制。CDK4能磷酸化Rb复合物导致E2F的释放,以转录细胞周期由G1期进入S期所必需基因,而没有这种磷酸化活性的情况下细胞阻滞在G1期[18],本研究中CDK4基因在甘草查尔酮A浓度为25、50 μg/mL时被显著抑制。干细胞标记物ALDH1A1和OCT4在宫颈癌及其前体病变中表达上调,特别是在外周血中表达上调,提示ALDH1A1和OCT4可作为生物标志物用于早期发现宫颈癌或监测患者的治疗[19]。ALDH1A1参与视黄醇在细胞质中氧化成视黄酸的过程,而视黄酸又被转入细胞核并启动参与早期干细胞分化的基因的转录,促进肿瘤干细胞增殖[20,21]。八聚体结合蛋白4(OCT-4)是一种在胚胎和成体干细胞中表达的转录因子,与细胞增殖、分化、多能性和自我更新有关,在胚胎干细胞中敲除OCT-4会导致其分化及干细胞特性消失[22]。甘草查尔酮A也能使以上2种标记物(ALDH1A1、OCT4)的mRNA表达量显著下调。此外,本研究所筛选的Bcl-2、UHRF1、BIRC7、BIRC5等均为宫颈癌细胞中高表达的肿瘤标记物[23],其mRNA表达量也均被甘草查尔酮A不同程度地下调,提示新疆胀果甘草查尔酮A成分可能具有良好的预防宫颈癌复发的研究潜力。
