长链非编码RNA LINC01410对B细胞非霍奇金淋巴瘤细胞增殖和凋亡的影响▲
2022-03-29卢盛娟邓木英莫国君雷丹青夏爱军钟大妮谭晓虹廖成成
卢盛娟 邓木英 莫国君 雷丹青 夏爱军 孙 洁 钟大妮 谭晓虹 岑 洪 廖成成
(1 前海人寿广西医院药学部,广西南宁市 530200,电子邮箱:424039059@qq.com;2 广西医科大学生命科学研究院,南宁市 530021;3 广西医科大学第二附属医院药学部,南宁市 530007;4 广西医科大学附属肿瘤医院淋巴血液肿瘤内科,南宁市530021)
B细胞非霍奇金淋巴瘤(B-cell non-Hodgkin′s lymphoma,B-NHL)是一类最常见、最具侵袭性的淋巴系统肿瘤,占非霍奇金淋巴瘤确诊病例的30%~58%[1]。它的形态学和遗传学具有较明显的异质性,早期症状不明显,且缺乏有效的治疗策略,患者预后不良[2]。虽然淋巴瘤化疗已经进入靶向药物及免疫特异性治疗时代,但蒽环类肿瘤化疗药物依旧是B-NHL化疗的基石。研究证实,采用单纯药物治疗B-NHL患者的治愈率不到40%[3]。因此,迫切需要寻找新的生物标志物预测B细胞淋巴瘤的侵袭性和预后。
近年来已有研究表明,长链非编码RNA(long noncoding RNA,LncRNA)可通过多种机制对细胞功能进行调控[4-5]。LncRNA HOX转录反义RNA有可能通过磷脂酰肌醇3-激酶/蛋白激酶B/活化B细胞κ轻链增强子的核因子途径促进弥漫性大B淋巴瘤细胞的增殖和抗凋亡能力,并且与淋巴瘤患者的预后较差密切相关[6]。有学者在基因表达综合(Gene Expression Omnibus,GEO)数据库中对1 659例弥漫性大B淋巴瘤患者的基因芯片数据进行分析,发现了多个与患者预后密切相关的LncRNA,并且LncRNA相关的信号通路以细胞凋亡通路为主[7]。本研究利用GEO数据库筛选与B-NHL预后相关的LncRNA,探讨敲低LINC01410的表达对B-NHL细胞增殖和凋亡的影响。
1 材料和方法
1.1 主要试剂及器材 B-NHL Raji、Ramos细胞系(南京翼飞雪生物,批号:YCL-0189、YCL-0483);外周血单个核细胞[peripheral blood mononuclear cell,PBMC;广州雷德倍尔公司LDEBIO,批号:1501-HLA(A0201)];Gibco胎牛血清(美国Life公司,批号:10091130);杜氏改良伊格尔培养基高糖培养基(南京建成科技,批号:P001-3);1640培养基(南京建成科技,批号:P004-3);慢病毒载体SV40(上海吉凯基因,批号:POSE0051);慢病毒包装质粒(上海吉凯基因,批号:POSE2975);多柔比星(深圳万乐药业有限公司,批号:2102E1);细胞计数检测(cell counting kit-8,CCK-8)试剂盒(AAT Bioquest,批号:TJ35000);膜联蛋白V-异硫氰酸荧光素(Annexin V-fluorescein isothiocyanate,Annexin V-FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒(TaKaRa公司,批号:630109);NucleoZOL 试剂(上海GENE公司,批号:740404.200);逆转录试剂盒和SYBR实时荧光定量PCR试剂盒(TaKaRa公司,批号:GSAE0219793、RR420A);兔抗多聚腺苷二磷酸-核糖聚合酶[poly(ADP-ribose) polymerase,PARP]多克隆抗体(美国CST公司,批号:9542S);兔抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体(美国Proteintech公司,批号:10494-1-AP)及荧光标记的山羊抗兔IgG(美国LI-COR公司,批号:926-32211)。倒置相差荧光显微镜(Olympus公司,型号:1600004S);实时荧光定量PCR仪(Applied Biosystems,型号:StepOne);流式细胞仪(BD LSRFortessa,型号:FACSCaibur)。
1.2 生物信息学分析 B-NHL表达谱数据集(GSE10846)下载自GEO数据库(https://www.ncbi.nlm.nih.gov/geo/),数据集中共有420例B-NHL患者的资料,收集以上患者的一般情况、治疗情况和预后信息。所有生物信息学分析均采用R语言。LncRNA注释信息(gencode.v26.long_noncoding_RNAs.gtf)来源于Gencode数据库V26(http://www.gencodegenes.org/releases/current.html)。通过Cox回归模型计算出各个LncRNA的风险比及其95%可信区间,按照风险比降序展示前30个LncRNA(风险比均>1)。
1.3 方法
1.3.1 实时荧光定量PCR 法检测PBMC和B-NHL细胞系中LINC01410的RNA相对表达水平[8]:按照NCBI GeneBank数据库(https://www.ncbi.nlm.nih.gov/nuccore/NR_121647.1)中人LINC01410和GAPDH (内参)的基因全序列设计引物,委托上海生工生物工程有限公司合成引物并完成鉴定,引物序列见表1。采用NucleoZOL法提取PBMC、Raji和Ramos的总RNA。根据逆转录试剂盒说明书,分别取各组细胞总RNA 1 μg进行逆转录,合成cDNA,再按照定量 PCR 试剂盒说明书,分别以cDNA为模板加入反应体系,上机检测。以上操作均在冰上进行。反应体系: cDNA 1 μL,2×SYBR Green PCR Mastermix 8 μL,上下游引物各0.8 μL,加入无酶水至20 μL。反应程序:95℃变性1 min,95℃退火15 s,61℃延伸45 s,扩增40个循环。每个样本重复检测3次,采用2-△△Ct法分析LINC01410的RNA相对表达水平。

表1 实时荧光定量PCR引物设计
1.3.2 LINC01410敲低B-NHL细胞系的建立:将慢病毒空载体SV40和慢病毒sh-LINC01410载体质粒分别插入慢病毒包装质粒中,形成慢病毒空载体和LINC01410敲低包装的慢病毒(sh-NC组和sh-LINC01410组),先于Raji、Ramos细胞中加入1.5 μL感染剂,再加500 μL慢病毒感染Raji、Ramos细胞96 h后,在绿色荧光显微镜下观察转染情况,并用嘌呤霉素筛选感染后的Raji、Ramos细胞,嘌呤霉素的筛选浓度为1/5 000,培养24 h,获得细胞转染率不随时间延长而降低的稳转株。采用PCR法检测各细胞系中LINC01410 RNA的相对表达水平,方法同1.3.1。实验重复3次。
1.3.3 实验分组:将Raji和Ramos细胞分别随机分为慢病毒对照组、LINC01410敲低组、多柔比星组、LINC01410敲低+多柔比星组。(1)慢病毒对照组:sh-NC+二甲基亚砜(dimethyl sulfoxide,DMSO;100 μL);(2)LINC01410敲低组:sh-LINC01410+DMSO(100 μL);(3)多柔比星组:sh-NC+多柔比星(100 ng/mL,100 μL);(4)LINC01410敲低+多柔比星组:sh-LINC01410+多柔比星(100 ng/mL,100 μL)。各组均于37℃细胞培养箱培养36 h。
1.3.4 CCK-8法检测LINC01410对B-NHL细胞活力的影响[8]:取Raji和Ramos细胞系各组细胞,以4×103个/孔的密度接种到96孔板中。每孔加入CCK-8溶液20 μL,恒温37℃孵育2 h后,将96孔板置于酶标仪中,振荡溶解10 min,检测450 nm波长处各孔的吸光度值(A450),实验重复3次。以慢病毒对照组为对照组,其余组为实验组,计算细胞活力。细胞活力=(实验组A450-对照组A450)/对照组A450×100%。
1.3.5 流式细胞术检测LINC01410对B-NHL细胞凋亡的影响[8]:取Raji、Ramos细胞系各组细胞,以1×105个/孔接种到24孔板中,置于5% CO2、37℃、饱和湿度的恒温培养箱中培养24 h,收集细胞培养液加入1.5 mL离心管中,并用PBS洗涤两次,2 min/次,取500 μL结合缓冲液重悬细胞。每管依次加入8 μL Annexin V-FITC和8 μL PI,轻柔充分混匀后,室温避光孵育15 min,利用流式细胞仪检测细胞凋亡率,实验重复3次。
1.3.6 蛋白质免疫印迹法检测B-NHL细胞中PARP蛋白的相对表达水平:取Raji、Ramos细胞系各组细胞,加入 100~200 μL含1%苯甲基磺酰氟的放射免疫沉淀测定蛋白裂解液(Biosharp公司,批号:BL504A,现配现用),冰上充分裂解30 min。吸取150 μL混合液转移至1.5 mL EP管中,4℃、12 000 r/min离心15 min,取上清,即细胞总蛋白。使用二喹啉甲酸法测定蛋白浓度。分别取30 μg蛋白进行电泳、转膜、封闭、扫膜,再加入6 mL PARP抗体(稀释比例1 ∶2 000),4℃孵育过夜。第2天加入荧光标记的山羊抗兔IgG二抗(稀释比例1 ∶10 000)室温避光振摇孵育 1 h。采用双色红外成色系统扫膜。以GAPDH作为内参,使用Image J软件通过分析条带灰度值计算PARP蛋白的相对表达水平,实验重复3次。
1.4 统计学分析 应用SPSS 25.0 软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。采用Kaplan-Meier法计算总生存率,组间比较采用log-rank检验。以P<0.05为差异有统计学意义。采用SynergyFinder软件包分析协同作用,synergy值>10提示有协同作用。
2 结 果
2.1 LncRNA表达和B-NHL患者总生存期之间的风险比分析 通过GEO数据库共鉴定出GSE10846转录本LncRNA 13 208个。运用Cox回归模型对LncRNA的表达量与患者总生存期之间的风险比进行分析,结果显示前30个高风险比的LncRNA的风险比范围为2.41~20.80,其中LINC01410的风险比为2.51。见图1。
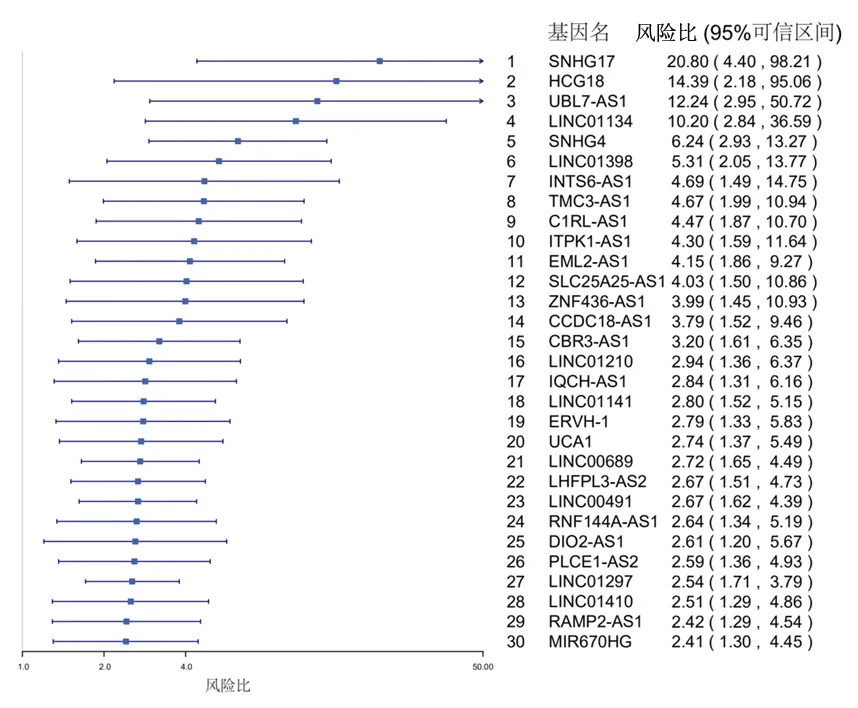
图1 LncRNA表达和B-NHL患者总生存期之间的风险比分析(前30个)
2.2 PBMC和B-NHL细胞系Raji、Ramos中LINC01410 RNA相对表达水平的比较 淋巴瘤细胞系Raji、Ramos中LINC01410 RNA的相对表达水平高于PBMC,差异有统计学意义(均P<0.05)。见表2。

表2 在PBMC和B-NHL细胞系Raji、Ramos中LINC01410 RNA相对表达水平的比较(x±s)
2.3 慢病毒感染B-NHL细胞后LINC01410 RNA的相对表达情况 在Raji、Ramos细胞系中,sh-LINC01410组的LINC01410 RNA表达水平均较sh-NC组降低(均P<0.05),表明成功构建低表达LINC01410的B-NHL细胞。见表3。

表3 慢病毒感染B-NHL细胞后LINC01410 RNA的相对表达情况(x±s)
2.4 多柔比星、sh-LINC01410及二者联合作用对B-NHL细胞活力的影响 在Raji、Ramos细胞系中,慢病毒对照组、LINC01410敲低组、多柔比星组和LINC01410敲低+多柔比星组的细胞活力依次降低(均P<0.05)。见表4。且100 ng/mL多柔比星与sh-LINC01410共同作用对Raji、Ramos细胞活性的抑制作用最大,协同分数分别为14.100、17.376。见图2。

表4 多柔比星、sh-LINC01410及二者联合作用对B-NHL细胞活力的影响(x±s,%)

图2 多柔比星、sh-LINC01410及其联合作用对B-NHL细胞活力的影响
2.5 多柔比星、sh-LINC01410及二者联合作用对B-NHL细胞凋亡的影响 在Raji、Ramos细胞系中,慢病毒对照组、LINC01410敲低组、多柔比星组、LINC01410敲低+多柔比星组的细胞凋亡率依次升高(均P<0.05)。见表5及图3。
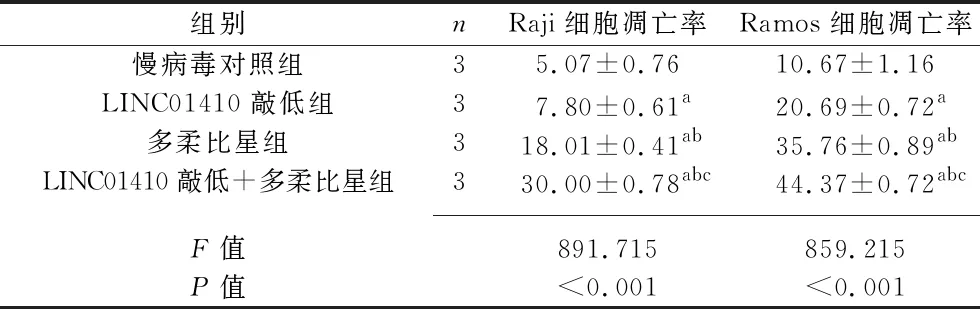
表5 多柔比星、sh-LINC01410及二者联合作用对B-NHL细胞凋亡的影响(x±s,%)

图3 多柔比星、sh-LINC01410及二者联合作用对B-NHL细胞凋亡的影响
2.6 多柔比星、sh-LINC01410及二者联合作用对B-NHL细胞中PARP蛋白表达的影响 Raji细胞系中, LINC01410敲低组和慢病毒对照组的PARP蛋白相对表达水平差异无统计学意义(P>0.05),而Ramos细胞中,LINC01410敲低组的PARP蛋白相对表达水平均较慢病毒对照组升高(P<0.05)。在Raji和Ramos细胞系中,多柔比星组与LINC01410敲低+多柔比星组的PARP蛋白相对表达水平均较慢病毒对照组升高,LINC01410敲低+多柔比星组的PARP蛋白相对表达水平较多柔比星组升高(均P<0.05)。见表6和图4。

表6 多柔比星、sh-LINC01410及二者联合作用对B-NHL细胞中PARP蛋白相对表达水平的影响(x±s)

图4 多柔比星、sh-LINC01410及二者联合作用对B-NHL细胞中PARP蛋白相对表达水平的影响
2.7 LINC01410基因的表达对侵袭性B-NHL患者生存率的影响 根据GEO数据集(GSE108460)中B-NHL患者的LncRNA表达谱,以LINC01410表达量中位数为界,高于中位数者为高表达(或过表达),低于中位数者为低表达,通过Kaplan-Meier生存分析可知,LINC01410过表达的B-NHL患者的中位生存时间为4.7年,而LINC01410低表达者各时间点的生存率均大于50%,尚无法估计中位生存时间,LINC01410过表达者的生存时间短于LINC01410低表达者(P=0.0078)。见图5。
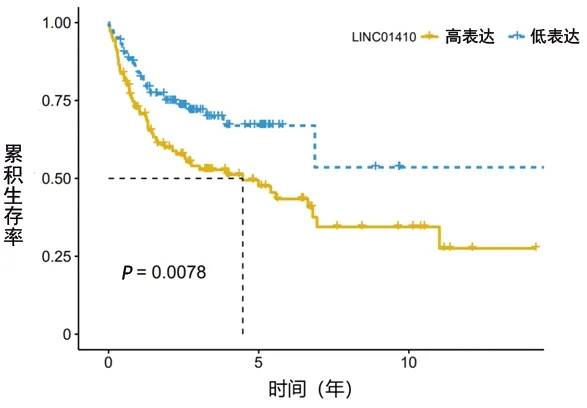
图5 Kaplan-Meier生存分析
3 讨 论
B-NHL可通过化疗或免疫化疗治愈且治愈率相对较高,但仍有部分患者的疗效欠佳或治疗后复发,其主要原因是肿瘤异质性引起耐药[9]。目前尚未发现治疗B-NHL的特定靶基因。LncRNA在多种肿瘤的发生和发展过程中起到关键作用,故受到越来越多的关注。不同于微小RNA,LncRNA的转录本大于200 nt,能够更加稳定地存在于细胞中,但不编码下游蛋白质。哺乳动物中LncRNA转录本数量超过蛋白编码RNA的数十倍[10],这提示LncRNA在疾病,尤其是肿瘤疾病的发生中所起的作用远超出预期,因此对LncRNA的研究是当前肿瘤研究的重要方向[11]。研究证实[12],LncRNA能够通过多种机制对细胞功能进行调控:LncRNA能作为顺式作用元件直接影响下游基因的表达,或者通过形成RNA-RNA、RNA-DNA复合物影响目的基因的表达,还能通过RNA 干扰机制降解mRNA。本研究通过GEO数据库筛选出30个与B-NHL预后高度相关的LncRNA,分析这30个LncRNA与B-NHL患者总生存时间的关系,筛选出高风险比的LINC01410,此外,LINC01410 RNA在B-NHL Raji、Ramos细胞系中的相对表达水平高于PBMC(均P<0.05),这些结果表明LINC01410是淋巴瘤发生和发展的重要生物标志物。
研究发现,LINC01410为消化道肿瘤的促进分子,其可通过靶向微小RNA-532激活核因子κB通路,上调核因子κB的表达,进而上调LINC01410的表达,而核因子κB通路可能在胃癌耐药机制中起着至关重要的作用,其主要原因可能是LINC01410能促进胃癌血管的生成和转移[13]。另一项研究表明,LINC01410可通过促进结肠上皮细胞系HT-29、HCT116细胞的增殖和侵袭进而对结肠产生致癌作用[14]。然而,在淋巴瘤方面尚无LINC01410的相关报道。本研究结果显示,LINC01410敲低后,Raji和Ramos细胞活力明显降低,给予多柔比星干预后细胞活力降低更明显,当多柔比星与sh-LINC01410共同作用时,细胞活力降至最低,表明敲低LINC01410能抑制B-NHL细胞增殖,且LINC01410敲低后的B-NHL细胞经多柔比星干预后,增殖抑制作用更明显。总之,敲低LINC01410能减弱B-NHL细胞系的增殖能力,与多柔比星联用能对多柔比星的化疗杀伤起增效作用。
本研究结果还显示,敲低LINC01410能促进B-NHL细胞系Raji和Ramos细胞的凋亡,多柔比星和sh-LINC01410二者联合作用时促凋亡效果更明显。但是,敲低LINC01410前后Raji细胞的PARP蛋白相对表达水平变化并不明显,而在敲低LINC01410后,或与多柔比星共同作用下,Ramos细胞中PARP蛋白相对表达水平均明显升高。以上结果表明敲低LINC01410能协同多柔比星,通过上调PARP蛋白相对表达水平促进B-NHL细胞凋亡。这可能与LncRNA可通过多种调节机制在细胞的转录、转录后水平及染色体修饰等方面发挥调节作用有关[15]。
本研究结果显示,LINC01410高表达的B-NHL患者的中位生存时间仅有4.7年,而LINC01410低表达者5年生存率大于70%,高于既往临床实验总体的5年生存率(50%)[16],这说明LINC01410或可作为预测B-NHL患者预后的指标,及时区分出难治复发性或多柔比星耐药的患者,为精准治疗及进一步寻找多柔比星耐药的关键靶点提供理论基础。
综上所述,LINC01410过表达提示B-NHL患者预后不良。敲低LINC01410可上调凋亡蛋白PARP的相对表达水平,促进B-NHL细胞凋亡,抑制B-NHL细胞活力,且其与多柔比星联用可产生增效协同作用。
